La conjuntivitis aguda es una enfermedad que puede ser debida principalmente a causas alérgicas o infecciosas, y en este último caso están implicados varios microorganismos distintos. Los virus, especialmente los diferentes serotipos de adenovirus, constituyen una de las causas más comunes, aunque no deberían descartarse los enterovirus (conjuntivitis hemorrágica) y los virus gripales1. Las conjuntivitis por adenovirus pueden ocurrir de manera esporádica o en forma de brotes, afectando tanto a niños como adultos y predominando en los meses de primavera1.
El diagnóstico de conjuntivitis por adenovirus puede ser realizado directamente mediante la detección de los antígenos virales específicos (inmunofluorescencia [IF] o inmunocromatografía), el cultivo celular (clásico o shell-vial) o por las técnicas de amplificación genómica (reacción en cadena de la polimerasa [PCR])2,3. El cultivo shell-vial presenta, frente al cultivo convencional, la ventaja de su mayor rapidez y especificidad diagnóstica3.
La IF es una técnica rápida y específica que se puede hacer en un corto espacio de tiempo, y generalmente es más sensible que el cultivo celular, incluyendo el shell-vial3,4. La PCR ha sido descrita como la técnica más sensible y específica para este tipo de diagnóstico viral, pero tiene la posible desventaja de presentar un tiempo de procesamiento más largo, mayor complejidad técnica y superior coste que la IF2,5.
Presentamos un estudio prospectivo sobre la utilidad de la inmunofluorescencia directa (DFA) frente al cultivo celular shell-vial en el diagnóstico de sospecha de conjuntivitis por adenovirus.
Se estudiaron 68 muestras clínicas de pacientes con sospecha clínica de conjuntivitis viral. Las muestras no correspondían a ningún brote y eras casos individuales, y se han incluido en el estudio 2 muestras de un mismo paciente (ojos distintos). Todas las muestras (frotis conjuntivales) fueron recogidas con un escobillón estéril sin anestesia local y por el oftalmólogo. Las muestras se enviaron al laboratorio en un medio líquido de transporte para virus (MTV, Vircell, Granada, España). Las muestras fueron homogeneizadas (vortex) para obtener un mayor rendimiento de la DFA. De cada una de ellas se tomaron 200μl y se citocentrifugaron en un porta a 700rpm durante 10min (Cytospin 3, Shandon Científico, Inglaterra). Después de su secado al aire, las preparaciones fueron fijadas con acetona a –20°C durante 10min y a continuación se revelaron mediante una técnica de IF indirecta utilizando anticuerpos monoclonales de ratón marcados con fluoresceína específicos para los adenovirus (clones H-60 y H-72) (Adenovirus Monofluokit, BioRad, Irlanda).
A partir de la suspensión celular inicial de las muestras se inocularon 0,5ml en un shell-vial de la línea de células Hep-2 (Vircell, Granada, España). Los viales se centrifugaron a 3.500rpm durante 15min; posteriormente se incubaron a 36°C durante 48h. Transcurrido este tiempo, las monocapas se tiñeron con los mismos anticuerpos monoclonales utilizados en el DFA.
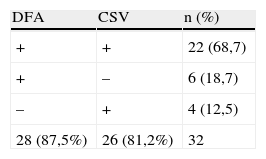
De las 68 muestras estudiadas, 32 (47%) fueron consideradas como positivas para adenovirus. La DFA fue positiva en 28 (87,5%) muestras y el cultivo shell-vial, en 26 (81,2%). En el 68,7% de los casos el diagnóstico se realizó de forma simultánea por ambas técnicas; en 6 casos (18,7%) la muestra fue positiva solo en la DFA y en 4 casos (12,5%) fue positiva solo en el cultivo shell-vial (tabla 1).
En este estudio la DFA ha presentado una sensibilidad ligeramente mayor que la del cultivo shell-vial, aunque la primera tiene la ventaja de la mayor rapidez diagnóstica. La técnica de DFA se ha podido realizar con una media de 1,5h desde la recepción de la muestra y el cultivo shell-vial requiere un periodo mínimo de 2días de incubación para dar el resultado definitivo3,4.
En las muestras positivas solo por la DFA es posible que el retraso en el envío o recogida de las muestras o la baja presencia de células en las mismas haya determinado la pérdida de la capacidad replicativa de los adenovirus presentes en ellas2,6.
En los 4 casos solo positivos por el cultivo shell-vial se observó una escasa presencia de células conjuntivales en las muestras, quizá no suficientes para detectar la presencia de los antígenos virales; en algunos trabajos sobre detección de infecciones herpéticas, no adenovirus, se establece la presencia mínima de 20 células/campo para aceptar la muestra como viable para esta técnica7; sin embargo, no existen estudios sobre este valor en la detección de conjuntivitis por adenovirus. La baja carga viral de las muestras en estos casos solo permitiría su detección mediante el cultivo prolongado en el shell-vial3.
Los resultados de este estudio sugieren la mayor eficacia de DFA frente al cultivo celular shell-vial en el diagnóstico rápido y específico de la conjuntivitis por adenovirus, obteniéndose resultados dentro de las 2h posteriores a la recepción de las muestras, período de tiempo incluso menor al necesario para la aplicación de algunas técnicas moleculares. Sin embargo, presenta la desventaja de la necesidad de disponer de un microscopio de fluorescencia de forma continua y estar sometida a la subjetividad del observador, de modo que precisa de personal con experiencia en este tipo de técnicas. La DFA podría ser útil para el diagnóstico rápido de los brotes de conjuntivitis que se presentan en comunidades cerradas.