Los microbiólogos clínicos deben asegurar, al máximo nivel permitido por el desarrollo científico y técnico, la fiabilidad de los resultados. Esto implica que, además de reunir los criterios técnicos que aseguren su validez, deben ser realizados con una serie de garantías, que permitan obtener resultados comparables, con independencia del laboratorio que los ejecute. En este sentido, el empleo de métodos de referencia, reconocidos y aceptados, es la herramienta más eficaz para obtener estas garantías.
Las actividades relacionadas con la verificación y validación de métodos analíticos ha cobrado gran importancia, debido por un lado al continuo desarrollo y actualización de técnicas y equipos analíticos cada vez más complejos, y por otro lado, al interés de los profesionales en garantizar la calidad de sus procesos y resultados.
Se describen las definiciones de validación y verificación, las diferentes modalidades de validación/verificación, así como los tipos de métodos y el nivel de validación necesario según sea el grado de normalización. Se comentan las situaciones en las que es obligatoria y/o recomendable la validación/verificación, así como las particularidades que la validación tiene en microbiología.
Se incide en la importancia de potenciar el uso de las cepas de referencia como control en microbiología y del uso de controles normalizados, así como en la importancia de la participación en programas de evaluación externa de la calidad para poder demostrar competencia técnica. Se hace hincapié en la forma de calcular algunos de los parámetros imprescindibles para la validación/verificación, como son la exactitud y la precisión.
El desarrollo completo de estos conceptos se puede consultar en el procedimiento microbiológico SEIMC número 48: «Validación y verificación de métodos microbiológicos» disponible en: www.seimc.org/protocolos/microbiologia.
Clinical microbiologists should ensure, to the maximum level allowed by the scientific and technical development, the reliability of the results. This implies that, in addition to meeting the technical criteria to ensure their validity, they must be performed with a number of conditions that allows comparable results to be obtained, regardless of the laboratory that performs the test. In this sense, the use of recognized and accepted reference methodsis the most effective tool for these guarantees.
The activities related to verification and validation of analytical methods has become very important, as there is continuous development, as well as updating techniques and increasingly complex analytical equipment, and an interest of professionals to ensure quality processes and results.
The definitions of validation and verification are described, along with the different types of validation/verification, and the types of methods, and the level of validation necessary depending on the degree of standardization. The situations in which validation/verification is mandatory and/or recommended is discussed, including those particularly related to validation in Microbiology.
It stresses the importance of promoting the use of reference strains as controls in Microbiology and the use of standard controls, as well as the importance of participation in External Quality Assessment programs to demonstrate technical competence. The emphasis is on how to calculate some of the parameters required for validation/verification, such as the accuracy and precision.
The development of these concepts can be found in the microbiological process SEIMC number 48: «Validation and verification of microbiological methods» www.seimc.org/protocols/microbiology.
El desarrollo y realización de análisis de control microbiológico es una herramienta que tiene una repercusión decisiva en el ámbito del diagnóstico clínico, de la salud pública, de la tecnología alimentaria y del medio ambiente. En los últimos años las actividades relacionadas con la verificación y validación de métodos analíticos ha cobrado gran importancia debido por un lado al continuo desarrollo y actualización de técnicas y equipos analíticos cada vez más complejos, y por otro lado al interés de los profesionales en garantizar la calidad de sus procesos y resultados.
La validación puede definirse como el conjunto de procesos desarrollados para la «confirmación mediante examen y la aportación de evidencias objetivas que demuestren el cumplimiento de ciertos requisitos para el uso específico previsto de los procedimientos analíticos»1.
De esta definición se pueden destacar algunos puntos fundamentales:
- 1)
La validación se aplica exclusivamente a procedimientos. Aunque se ha utilizado esta palabra para equipos, en general se está sustituyendo esta palabra por la de cualificación o calificación.
- 2)
Las palabras fundamentales desde el ámbito de la documentación son:
- a)
Se refiere a un procedimiento de medida.
- b)
Exige que existan unos requisitos preestablecidos y un uso previsto.
- c)
Produce evidencias que deben quedar documentadas.
- a)
De la definición dada queda claramente establecido que el objetivo es confirmar la adecuación del proceso de medida para el uso previsto.
En general, la validación de procedimientos se realiza cuando se pone en marcha una técnica analítica. Su objetivo es garantizar que los métodos cumplen determinados criterios, en términos de precisión, exactitud, etc. El proceso de validación es variable en función de diferentes criterios, como si se trata de un método normalizado o no y el tipo de método según sea un método cualitativo o cuantitativo.
La validación es un proceso basado en estudios sistemáticos de laboratorio, mediante la cual se pone de manifiesto que un procedimiento analítico determinado posee unas características de funcionamiento adecuadas a la aplicación que se le quiere dar. Por tanto, una validación de un método de análisis incluye 2 aspectos fundamentales: por una parte, la evaluación de los parámetros de calidad del método y del proceso, y por otra la adecuación de los mismos a unos requerimientos analíticos concretos determinados de antemano.
En función del método que se emplee el laboratorio deberá elegir un tipo de validación. Por ello es necesario las modalidades de validación y los diferentes tipos de métodos existentes, según sean normalizados o no.
Modalidades o tipos de validaciónExisten 2 modalidades o tipos de validación en función de que se realice sobre un tipo de método u otro. En función del método que se emplee los requisitos de validación varían. Así, se definen la validación primaria y la secundaria o verificación.
La validación primaria es un proceso exploratorio que tiene como meta establecer los límites operacionales y las características de desempeño de un método nuevo, modificado o caracterizado en forma inadecuada. Debe dar origen a especificaciones numéricas y descriptivas para el desempeño e incluir una descripción detallada y precisa del objeto de interés. La validación primaria va precedida de la elaboración de un esquema de ensayo especialmente diseñado. Corresponde con la validación inicial que deben llevar a cabo los laboratorios y casas comerciales que diseñan un equipo diagnóstico, una prueba nueva o la unión en un solo protocolo de varios métodos normalizados o no. También corresponde con la caracterización que debe realizarse a una técnica que se desarrolla en un laboratorio para su propio uso (in house).
La validación secundaria, revalidación, validación parcial o verificación se realiza cuando un laboratorio procede a implementar un método desarrollado en otra parte. Esta validación se centra en la reunión de evidencias acerca de que el laboratorio está capacitado para cumplir las especificaciones establecidas en la validación primaria. Algunos organismos lo denominan verificación y es la confirmación, mediante el aporte de pruebas objetivas, de que se cumplen los requisitos establecidos en las condiciones de uso de ese laboratorio. Se trata de la validación que hay que llevar a cabo cuando se introduce un equipo diagnóstico, método o prueba en un laboratorio clínico y que ya está validada primariamente por organizaciones internacionales.
Normalmente la validación secundaria emplea formas seleccionadas y simplificadas de los procedimientos empleados en la validación primaria, aunque posiblemente extendidas por un tiempo mayor. Las muestras naturales constituyen el material de ensayo óptimo, y el trabajo solo requiere tratar el procedimiento dentro de los límites operacionales establecidos por la validación primaria. En EE. UU. la FDA y el Clinical Laboratory Improvement Ammendments (CLIA 88) considera este proceso como la verificación y lo define como la «demostración y documentación realizada una sola vez de que las características de una prueba son comparables a las establecidas por el fabricante antes de ser usado en el diagnóstico». Las características incluyen: precisión, exactitud, sensibilidad, especificidad y rango de resultados, límite de detección y/o cuantificación y cuando sea apropiado, valor predictivo. La validación parcial o verificación también puede denominarse como «prueba inicial de desempeño», «comprobación del método»2.
Tipos de métodos y grado de validación según el grado de normalizaciónEn el caso de los laboratorios clínicos los profesionales están muy acostumbrados a tener muy clara la diferenciación entre método comercial con marcado CE, aplicado exactamente como indica el fabricante, con alguna modificación (por ejemplo, cambio del método de extracción de los ácidos nucleicos en el caso de una técnica de PCR o aplicados a muestras que no aparecen validadas en el insert) y métodos desarrollados por el propio laboratorio usando reactivos comerciales que sí están bien caracterizados, pero que no está validado el proceso completo para el que el laboratorio clínico lo va a utilizar.
Es importante comentar la definición de tipos de métodos según las directrices definidas por la Entidad Nacional de Acreditación (ENAC), y que los clasifica en métodos tipo i, ii, iii y iv, con exigencias de validación distintas3:
Métodos normalizados (tipo i)Son métodos desarrollados por un organismo de normalización o por otras organizaciones bien establecidas, cuyos métodos son generalmente aceptados por el sector técnico en cuestión. Estos métodos normalizados son considerados como de referencia, ya que pueden ser utilizados para evaluar otros métodos desarrollados para la misma determinación. No requieren una validación completa, pero sí la confirmación de su correcta aplicación. Se trata de métodos que el laboratorio aplica como ya está descrito en las normas.
Métodos alternativos al método de referencia (tipo ii)Son métodos que han sido validados por comparación con el método de referencia que corresponda, de acuerdo a un estándar aceptado y que sean reconocidos formalmente como equivalentes al método de referencia por una organización técnica competente e independiente de acuerdo a unos datos experimentales obtenidos por ejemplo en ejercicios de intercomparación. En esta categoría suelen incluirse los métodos desarrollados por los fabricantes de equipos. El laboratorio deberá poseer evidencias de la validación del método. Se tratarán a efectos de validación como los métodos de referencia.
Métodos normalizados con modificaciones o basados en métodos de referencia (tipo iii)Son métodos descritos en procedimientos internos del laboratorio, que están basados claramente en métodos de referencia, y que no suponen una modificación técnica respecto del método de referencia, entendiendo como «modificación técnica» aquella que ponga en cuestión la validez técnica del método (por ejemplo, cambios relevantes en los controles utilizados, cambios en las condiciones instrumentales, otras muestras, otros medios de cultivo, diferentes tiempos/temperaturas de incubación, equipos con distintas tolerancias a las especificadas, combinación de partes del método normalizado con partes de una referencia bibliográfica, etc.). Estos métodos deben mantenerse actualizados en relación con el método de referencia en que se fundamentan. No precisan de una validación completa, pero sí la comprobación de su correcto funcionamiento.
Otros métodos (tipo iv)Son aquellos métodos desarrollados por el propio laboratorio o por cualquier otra parte, por ejemplo un fabricante o proveedor, y que no disponen del reconocimiento de los métodos de referencia o alternativos. La validación de estos métodos deberá ser tan amplia como sea necesario para satisfacer las necesidades del tipo de aplicación o del campo de aplicación dados.
Las características de funcionamiento que al menos se deben confirmar en el caso de métodos de referencia, alternativos y basados en métodos de referencia (tipos i, ii y iii), son la exactitud y la precisión.
En el caso de los métodos (tipo iv) la validación deberá completarse estudiando las diferentes variables que pudieran verse afectadas por las modificaciones propuestas de entre los parámetros: especificidad, sensibilidad, exactitud relativa, desviación positiva, desviación negativa, repetibilidad, reproducibilidad, linealidad, incertidumbre y el límite de cuantificación dentro de una variabilidad establecida y, en caso necesario, determinar cuantitativamente estos parámetros. Las diferencias debidas a las matrices (tipos de muestra) deben tenerse en cuenta al analizar diferentes tipos de muestras, y los resultados deben evaluarse utilizando métodos estadísticos apropiados.
Situaciones y obligaciones en la validación/verificaciónAntes de incorporar una nueva técnica a la rutina del laboratorio, los métodos y procedimientos analíticos seleccionados se deben evaluar y demostrar que aportan resultados satisfactorios antes de comenzar a utilizarlos. Estas situaciones son:
- 1)
Cuando se incorpora un cambio en una técnica analítica que se encuentra en uso en el laboratorio, como por ejemplo cambio de un equipo para extracción, modificación de los controles utilizados, cambios en las condiciones instrumentales del método (tiempos, temperaturas, etc.).
- 2)
Cuando se desea comparar el desempeño entre diferentes técnicas analíticas.
Cuando se valida un procedimiento analítico es necesario cumplir 3 normas básicas:
- a)
Debe validarse todo el procedimiento analítico; en algunos tipos de procedimientos puede entenderse que únicamente es necesario validar la etapa de medida instrumental (por ejemplo, secuenciación); esto es un error, ya que esta suele ser la que introduce un error menor. Se ha de tener en consideración que el componente humano es el que incorpora una mayor contribución a la incertidumbre de la medida.
- b)
Debe validarse todo el intervalo de aplicación del procedimiento analítico (niveles máximo, mínimo y medio del rango de trabajo).
- c)
Debe validarse teniendo en cuenta la variedad de muestras (por ejemplo, sangre, plasma, orina, etc.).
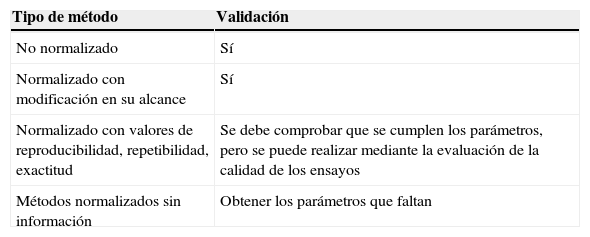
Asimismo, debe quedar constancia de los registros del proceso de validación, generalmente en los propios registros de análisis del laboratorio, así como también de las conclusiones de la validación, contrastando si se cumplen los criterios de aceptación/rechazo definidos a priori; estas conclusiones pueden registrarse en el informe de validación. La extensión y amplitud de la validación dependerá pues del método y de su aplicación. En la tabla 1 se resumen estos aspectos.
Validación según el tipo de método
| Tipo de método | Validación |
|---|---|
| No normalizado | Sí |
| Normalizado con modificación en su alcance | Sí |
| Normalizado con valores de reproducibilidad, repetibilidad, exactitud | Se debe comprobar que se cumplen los parámetros, pero se puede realizar mediante la evaluación de la calidad de los ensayos |
| Métodos normalizados sin información | Obtener los parámetros que faltan |
El proceso analítico microbiológico obliga a tener en cuenta una serie de características propias de los métodos microbiológicos que van a influir en su forma de validación, así como en el resultado final obtenido.
A diferencia de las ciencias físicas y químicas, en microbiología se trabaja con microorganismos que se multiplican por división binaria y crecen exponencialmente.
Además, el número de colonias observadas es solamente una aproximación del número de partículas vivas, y la viabilidad se define como crecimiento por el propio método, que dependerá del medio de cultivo empelado, tiempo y temperatura de incubación. Hay una falta de referencias comunes internacionales, y en consecuencia la tasa de recuperación absoluta no puede ser definida y la trazabilidad es imposible, presentándose los recuentos obtenidos como recuperaciones relativas. Dado que se trabaja con seres vivos, en muchas ocasiones impredecibles, los procesos de estabilización de las muestras para disponer de un valor de referencia o para poder realizar ensayos de reproducibilidad son complicados, siendo difícil, en muchos casos, asegurar completamente la estabilidad.
Siguiendo las recomendaciones de la guía de validación G-04 de ENAC3, la validación de los métodos de ensayo debe reflejar las condiciones reales de ensayo. Esto puede conseguirse utilizando muestras contaminadas naturalmente o inoculadas con un nivel conocido de microorganismos contaminantes. El microbiólogo debe ser consciente de que la inoculación de una matriz (muestra) con microorganismos contaminantes imita tan solo de una manera superficial la presencia de contaminantes naturales. No obstante, a menudo es la mejor y la única solución disponible.
En general, en el campo de la medida microbiológica no se dispone de patrones como ocurre en el campo físico. Sin embargo, como consecuencia del avance de las necesidades de comparabilidad entre laboratorios ha sido necesario desarrollar herramientas similares. A estas muestras que tienen como objetivo ser una base común y fiable para todos los laboratorios se les ha denominado materiales de referencia.
Se define como material de referencia al «material o sustancia de la que uno o más de los valores cuyas propiedades son suficientemente homogéneas y claramente establecidas como para poder ser utilizadas en la calibración de un aparato, la valoración de un método de medición o la asignación de valores a materiales»4,5.
Para obtener los valores de la propiedad se ha empleado un método de referencia, que se define como un «método investigado a fondo que describe, con claridad y exactitud, las condiciones y los procedimientos para la medición de los valores de una o más propiedades, cuando se ha demostrado que tiene una exactitud y una precisión adecuadas para la finalidad pretendida y, por consiguiente, puede utilizarse para evaluar la precisión de otros métodos para la misma medición, permitiendo especialmente la caracterización de un material de referencia».
Sin embargo, en el campo microbiológico se producen hechos diferenciadores importantes respecto de otros campos:
- 1)
Pueden producirse mutaciones.
- 2)
Los métodos no son definitivos y diferentes microorganismos pueden actuar de la misma manera.
Por ello, además, en microbiología existen otro tipo de materiales que se utilizan tanto para comprobar la validez de los métodos como para controlar los medios de cultivo utilizados en los análisis microbiológicos. Son las denominadas cepas de referencia. Se entiende coloquialmente por cepa de referencia «un cultivo procedente de una colección reconocida». Evidentemente esta definición coincide con la existente para material de referencia, y por tanto deberían ser consideradas también materiales de referencia. Sin embargo, también se entiende por material de referencia aquellas muestras suministradas por certificadores que tienen un valor conocido y certificado de un número concreto de microorganismos de un determinado tipo, obtenido mediante la aplicación de un determinado método6,7. Este caso incluiría también las cepas que se han usado en ensayos de intercomparación.
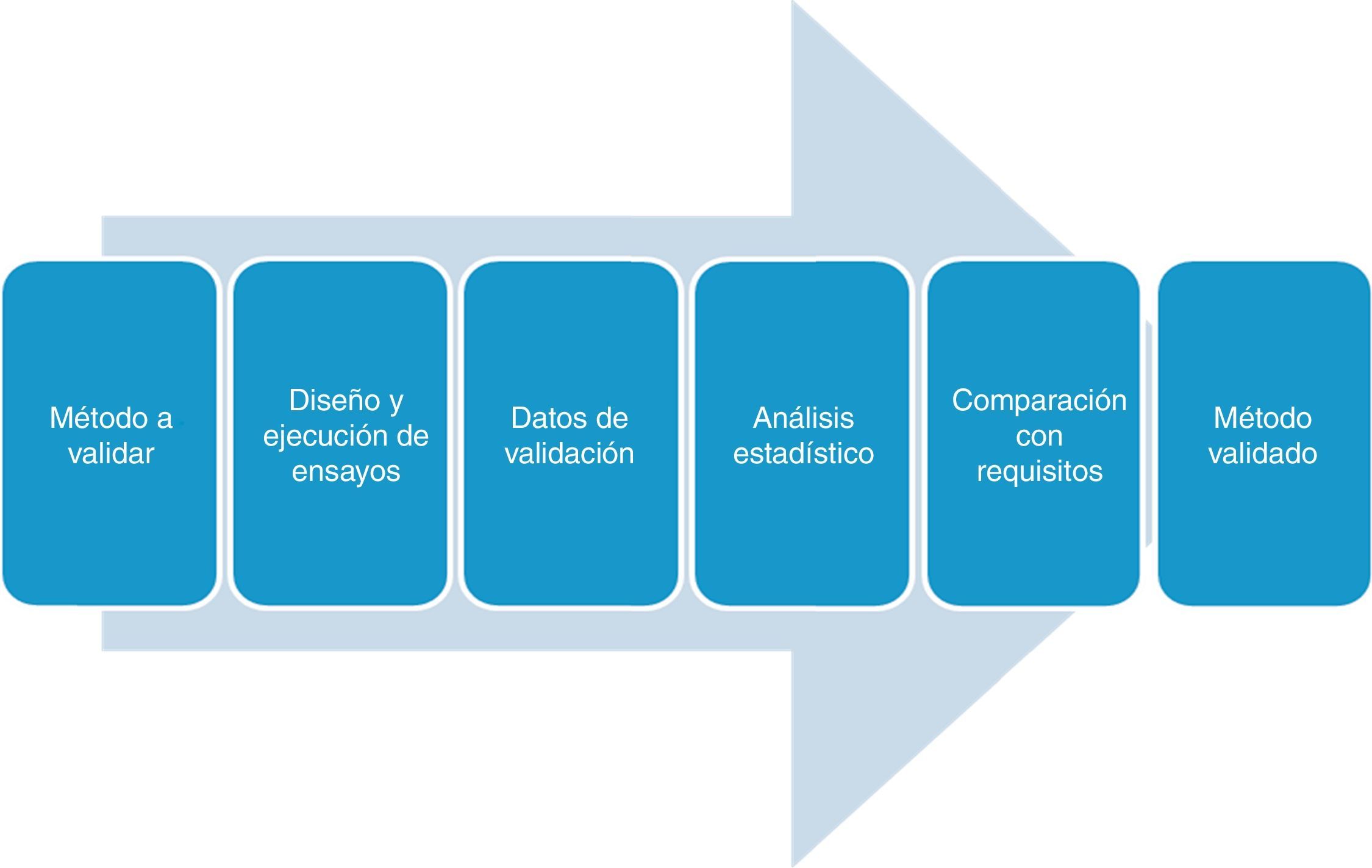
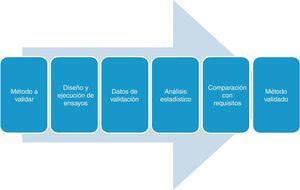
Etapas del proceso de validación/verificaciónEl proceso de validación/verificación de un método debe estar cuidadosamente planificado, por ello deben contemplarse los siguientes pasos:
- 1)
Conocer el problema analítico a resolver. Los procedimientos y el alcance de la validación no son siempre los mismos. Deben ser establecidos de acuerdo a las características del método de ensayo utilizado por el laboratorio y tener en cuenta las necesidades del solicitante de la prueba.
- 2)
Planificar las acciones a seguir. Esto implica especificar los requisitos y condiciones a cumplir, determinar los parámetros de desempeño del método, establecer el diseño experimental y el método de análisis de resultados. El diseño experimental y el análisis de resultado tienen que ser estadísticamente válidos. En esta etapa es fundamental definir el alcance de la validación de acuerdo al método a emplear, especificar la muestra en la que se va a aplicar; establecer condiciones tales como temperatura y tiempo de incubación, límites de operación; realizar una clara descripción del/los microorganismos de interés; y establecer otras limitaciones y especificaciones. Si los parámetros de realización no están ya especificados, el laboratorio debe decidir cuáles deben ser caracterizados con el fin de validar el método, lo cual deberá estar fundamentado de manera fiable y científica. Se planificará todo en función del protocolo de validación.
- 3)
Llevar a cabo la validación y evaluar los resultados obtenidos, por comparación con los parámetros establecidos. Confirmar la validez del procedimiento utilizado de acuerdo al propósito establecido, y si se han satisfecho los requisitos.
- 4)
Realizar el informe de validación.
Así pues, se puede definir que los criterios generales de validación consisten en el proceso de evaluación de las características de un procedimiento de medida y la comprobación de que dichas características cumplen una serie de requisitos preestablecidos.
Una validación requiere una serie de actividades o criterios generales de validación1:
- 1)
Definición de requisitos: será en función del tipo de método y definirá rangos para los parámetros.
- 2)
Definición del método.
- 3)
Obtención de muestras o cepas con valor de referencia para poder realizar comparaciones.
- 4)
Aplicación del método a las muestras en las condiciones establecidas.
- 5)
Obtención de valores de los parámetros.
- 6)
Comprobación del cumplimiento de requisitos y declaración de validez del método.
En la figura 1 se muestran las fases del proceso de validación.
Parámetros de validación/verificación de un método. DefinicionesLos parámetros de un método son las características del mismo, que le hacen apto para un uso previsto. La Guía de Validación ENAC ya indica una serie de parámetros a tener en cuenta.
Los parámetros de validación de un determinado método deben estudiarse para cada microorganismo diana y para cada muestra.
La selección de las muestras a validar se realizará en función del alcance de acreditación y del uso clínico del método a validar.
Algunos de estos parámetros son:
Límite de detección del métodoEs la menor magnitud que puede examinarse de un analito (por ejemplo, microorganismo, etc.), que puede determinarse con un nivel aceptable de exactitud y precisión. Es la concentración real más baja de analito en una muestra que puede ser detectado consistentemente (por ejemplo, en el 95% de los especímenes probados) con una precisión aceptable, pero no necesariamente cuantificado, en condiciones de laboratorio de rutina y en un tipo de muestra definida. En el caso de los cultivos microbiológicos es el número mínimo de organismos que pueden ser detectados en una cantidad de muestra con una probabilidad dada, pero en cantidades que no pueden ser claramente cuantificadas. Se establece determinando o una muestra o material de referencia apropiado. Se aplica generalmente a métodos cualitativos.
Límite de cuantificaciónEs la concentración mínima de un analito (por ejemplo, microorganismo, etc.) que puede determinarse con un nivel aceptable de exactitud y precisión. Se aplica a métodos cuantitativos.
Selectividad/especificidadGrado en que un método puede determinar un analito particular en una muestra, sin ser interferido por otros componentes. La especificidad analítica (proporción de muestras que no contienen el microorganismo investigado y responden negativamente al método). Es la fracción total del número de resultados negativos asignados correctamente con el método utilizado. La especificidad analítica se refiere a la capacidad de un ensayo para detectar solo el objetivo pretendido y que la cuantificación de la diana no se debe ver afectada por la reactividad cruzada de otros analitos relacionados o potencialmente interferentes. Los 2 aspectos de especificidad analítica son pues la reactividad cruzada y la interferencia. Ambos se determinan mediante la realización de estudios de interferencia.
Los parámetros de validación de métodos cualitativos (sensibilidad, especificidad, falsos positivos, falsos negativos, eficiencia) pretenden demostrar la no influencia de microbiota acompañante en el resultado del ensayo, por lo que se deberán preparar muestras que contengan el microorganismo objetivo y otros similares al objeto del estudio.
Desviación positiva o falso positivo: una desviación positiva ocurre cuando un método da un resultado positivo sin confirmación y el método de referencia da un resultado negativo. Esta desviación se convierte en un resultado falso positivo cuando puede demostrarse que el resultado verdadero es negativo.
Desviación negativa o falso negativo: una desviación negativa ocurre cuando un método da un resultado negativo sin confirmación y el método de referencia da un resultado positivo. Esta desviación se convierte en un resultado falso negativo cuando puede demostrarse que el resultado verdadero es positivo.
Sensibilidad analítica: es la fracción del total de positivos correctamente asignados en los recuentos presuntivos.
Especificidad analítica: es la fracción del total de negativos correctamente asignados en los recuentos presuntivos.
ExactitudEs el grado de concordancia entre el resultado de una medición y el valor de referencia aceptado. Su estudio implica disponer de un material de referencia frente al que comprobar si existen diferencias estadísticamente significativas entre los valores obtenidos por aplicación del método del laboratorio y el valor de referencia.
PrecisiónEs el grado de concordancia entre los resultados obtenidos al aplicar el procedimiento analítico repetidas veces bajo condiciones establecidas. La precisión depende solo de la distribución de errores aleatorios y no tiene ninguna relación con el valor verdadero o el valor especificado. Se expresa como coeficiente de variación.
En el caso de que las condiciones establecidas sean mismo operador, laboratorio, aparato, en corto intervalo de tiempo y sobre la misma muestra y la diferencia entre 2 resultados de ensayo pueda esperarse dentro de una determinada probabilidad (95%) a este valor se le llama repetibilidad.
En el caso de que las condiciones establecidas permitan cambiar (operador, laboratorio, aparato, etc.) y la diferencia entre 2 resultados de ensayo pueda esperarse dentro de una determinada probabilidad (95%), a este valor se le llama reproducibilidad8,9.
Técnicas para la validaciónPara la validación es conveniente utilizar una o varias de las técnicas siguientes para la determinación del desempeño de un método:
- 1)
Contaminación de muestras artificialmente. La validación de métodos microbiológicos debe ser reflejo de las condiciones de ensayo reales. Esto se puede conseguir utilizando muestras contaminadas naturalmente o muestras contaminadas o fortificadas a un determinado nivel. En general, el proceso consiste en la preparación de una muestra agregando el material interferente a una muestra real que contenga el material a ensayar. Una segunda alícuota de la muestra original se diluye con un solvente, y ambas se analizan determinándose la diferencia entre ambas.
- 2)
Uso de materiales de referencia o materiales de referencia certificados. Esta alternativa tiene algunos inconvenientes como el elevado coste económico, la posibilidad y facilidad de encontrar un material de referencia suficientemente representativo de la muestra a validar.
- 3)
Comparación de resultados obtenidos con otros métodos alternativos. Se analizan muestras de pacientes por el método en estudio y otro método de comparación, luego se estima el error sistemático basándose en las diferencias observadas entre ambos métodos. El método de comparación debería ser, en la medida de lo posible, el de referencia (gold standard).
- 4)
Comparaciones interlaboratorios10 (validación por pares de valores). La validación por pares de valores es aplicable cuando no es posible utilizar ninguno de los métodos anteriores, es decir, no es posible realizar contaminación artificial de las muestras, no se puede disponer de muestras de valor de referencia estable, o cuando siéndolo no se disponga de cantidad suficiente. Esta sistemática se basa en la utilización de resultados de intercomparaciones en las que haya participado el laboratorio, y utilizar estos datos como valores de referencia.
La participación en intercomparaciones permite una evaluación del sesgo de forma que el laboratorio pueda demostrar que se mantiene dentro de los criterios de aceptación definidos por normas, reglamentos, por el cliente o por el laboratorio.
El desarrollo de estos conceptos se puede consultar en el procedimiento microbiológico SEIMC número 48: «Validación y verificación de métodos microbiológicos» disponible en: www.seimc.org/protocolos/microbiologia11.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.