Introducción
A lo largo de las últimas 2 décadas ha tenido lugar un incremento progresivo en la incidencia de las infecciones ocasionadas por patógenos multirresistentes. Entre los microorganismos grampositivos cabe destacar la resistencia a antibióticos considerados hasta hace poco como de primera elección, como el caso de la resistencia de Streptococcus pneumoniae a penicilina, de los estafilococos a la meticilina o de los enterococos a la ampicilina y a los glucopéptidos. También entre las bacterias gramnegativas se ha registrado un incremento de resistencias. Podríamos citar como ejemplo el aumento de resistencias a quinolonas en Escherichia coli, o la aparición cada vez más frecuente de aislamientos de E. coli productor de betalactamasas de espectro extendido (BLEE), los cuales son, además, resistentes a otros antibióticos no betalactámicos. Por otra parte, importantes patógenos nosocomiales como Pseudomonas aeruginosa o Acinetobacter baumannii han incrementado su resistencia a las carbapenemas y a otros agentes. La emergencia y diseminación de estos microorganismos multirresistentes en el medio hospitalario representa, en la actualidad, un importante problema terapéutico y epidemiológico. Una de las estrategias encaminadas al establecimiento de las medidas adecuadas para controlar la resistencia a los antibióticos son los estudios de seguimiento epidemiológico y microbiológico.
El proyecto denominado estudio Vigilancia de la Resistencia a los Antimicrobianos (VIRA) consiste en la realización de estudios periódicos de seguimiento epidemiológico de la resistencia a antimicrobianos en nuestro país. En él participan 40 hospitales distribuidos por toda la geografía nacional. Este proyecto se inició en el año 2001 durante el cual se llevó a cabo el primer estudio 1, el segundo estudio VIRA se realizó en el año 2004 2 y los resultados que aquí presentamos corresponden al tercer estudio. En el estudio VIRA se evalúan los siguientes microorganismos multirresistentes: S. pneumoniae no sensibles a penicilina, Staphylococcus aureus resistentes a meticilina (SARM), estafilococos coagulasa negativa, enterococos (Enterococcus faecalis y Enterococcus faecium) resistentes a ampicilina, Haemophilus influenzae resistentes a ampicilina, E. coli resistentes a ciprofloxacino, P. aeruginosa y A. baumannii.
El estudio VIRA tiene los dos objetivos siguientes: a) conocer el patrón actual de la resistencia a los antimicrobianos de aquellos microorganismos más prevalentes en el medio hospitalario y que presentan una mayor problemática desde el punto de vista terapéutico, y b) analizar las tendencias de dichas resistencias.
Material y métodos
Un total de 40 hospitales pertenecientes a 15 comunidades autónomas de España han participado en este estudio. A través de una encuesta, los diferentes centros proporcionaron información correspondiente al mes de febrero de 2006, acerca del número obtenido en sus respectivos laboratorios de los aislamientos siguientes: S. pneumoniae sensibles y resistentes a penicilina, S. aureus sensibles y resistentes a meticilina, enterococos (E. faecalis y E. faecium) sensibles y resistentes a ampicilina, H. influenzae sensibles y resistentes a ampicilina, y E. coli sensibles y resistentes a ciprofloxacino. Para cada uno de estos microorganismos solamente se contabilizó un aislamiento por paciente.
Por otra parte, cada uno de los centros participantes envió al laboratorio coordinador del estudio (Servicio de Microbiología del Hospital Clínico San Carlos, Madrid) un máximo de 55 aislamientos distribuidos de la siguiente forma: S. pneumoniae con sensibilidad intermedia y resistentes a la penicilina (10), SARM (10), estafilococos coagulasa negativa procedentes de hemocultivos clínicamente significativos (5), E. faecium y E. faecalis resistentes a la ampicilina (5), H. influenzae resistente a la ampicilina (5), E. coli resistente a ciprofloxacino (10), P. aeruginosa (5) y A. baumannii (5). Debido a problemas surgidos en el envío de las cepas de uno de los hospitales, éstas no pudieron incluirse en el estudio. Las cepas correspondían a aislamientos consecutivos realizados a lo largo del mes de febrero de 2006 y solamente se envió una cepa por paciente para evitar duplicidad. Todos los aislamientos fueron identificados en los laboratorios participantes según el método utilizado habitualmente.
Una vez recibidas las cepas, en el laboratorio coordinador se realizó un subcultivo en el medio apropiado (agar sangre o agar chocolate), con el fin de asegurar la viabilidad y pureza de los microorganismos. La identificación de las cepas remitidas se confirmó mediante los siguientes sistemas comercializados: Slidex-Staph, Slidex-pneumo, sistema Vitek 2 ID-GPC e ID-GNB y API NH. (BioMérieux, Marcy l'Etoile, Francia). En los aislamientos de H. influenzae y enterococos se ensayó la producción de betalactamasas mediante los discos de nitrocefina (Becton Dickinson, Cockeysville, MD, EE.UU.)
En el laboratorio coordinador se llevó a cabo la determinación de la sensibilidad a los antimicrobianos mediante un método de microdilución en caldo según las normas recientemente descritas por el Clinical Laboratory Standards Institute (CLSI) 3, utilizando un sistema comercializado (Sensititre; Trek Diagnostic Systems Ltd, East Grinstead, Reino Unido). Los antimicrobianos incluidos en el estudio, vienen indicados en las tablas 1 y 2, y se seleccionaron según el microorganismo a estudiar. El criterio interpretativo para cada uno de los antibióticos es el publicado en las normas del CLSI 4. En el caso de S. pneumoniae, se consideraron como puntos de corte para cefotaxima y cefepima los correspondientes a aislamientos causantes de meningitis, con el fin de poder comparar los resultados de este estudio con los del estudio efectuado en el año 2001. Las siguientes cepas control se incluyeron en el estudio: S. aureus ATCC 29213, S. aureus ATCC 43300, S. aureus ATCC 700698, S. pneumoniae ATCC 49619, S. pneumoniae 51916, E. faecalis ATCC 29212, E. faecalis ATCC 51299; H. influenzae ATCC 49247, H. influenzae ATCC 49766, E. coli ATCC 35218, E. coli ATCC 25922, Klebsiella pneumoniae ATCC 700603 y P. aeruginosa ATCC 27853. La incubación se realizó a 35 °C en atmósfera ambiental y la lectura de la concentración inhibitoria mínima (CIM) se efectuó a las 20 h de incubación, exceptuando las de vancomicina para estafilococos y enterococos y oxacilina para los estafilococos (24 h), así como también las de resistencia de alto nivel a los aminoglucósidos en los enterococos (24-48 h).
En el laboratorio coordinador se llevó a cabo la determinación de los fenotipos de resistencia de S. pneumoniae a macrólidos según el test de doble difusión en disco, descrito por Seppälä et al 5. Se utilizaron discos de eritromicina (15 μg) y clindamicina (2 μg) situados a 15-20 mm de distancia en placas de agar Mueller-Hinton suplementado con 5% de sangre de carnero. La detección fenotípica de las bacterias productoras de betalactamasas plasmídicas (BLEE), se realizó mediante tiras de Etestì de cefotaxima/cefotaxima + ácido clavulánico, ceftazidima/ ceftazidima + ácido clavulánico y cefepima/cefepima + ácido clavulánico (AB Biodisk, Solna, Suecia). Los resultados se interpretaron según los criterios del CLSI 4. En las cepas de estafilococos o enterococos que no fueron sensibles a vancomicina y/o teicoplanina y/o linezolid se confirmaron los valores de las CIM mediante la utilización de tiras de Etestì siguiendo las instrucciones proporcionadas por el fabricante (AB Biodisk, Solna, Suecia). Así mismo se estudió la posibilidad de la presencia de metalobetalactamasas (MBL) en las cepas de P. aeruginosa y de A. baumannii no sensibles a imipenem mediante la utilización de tiras de Etestì de imipenem e imipenem más ácido etilendiaminotetraacético (EDTA) (AB Biodisk, Solna, Suecia).
Los datos obtenidos en este estudio se compararon con los correspondientes a los estudios anteriores llevados a cabo en los años 2001 y 2004 1,2. Para el análisis estadístico de los resultados se utilizó el programa informático Epi Info 2005 versión 3.3.2 (CDC, Atlanta, GA, EE.UU.). La significación estadística se realizó mediante el análisis de la chi cuadrado (χ2). Valores de p < 0,05 se consideraron significativos.
Resultados
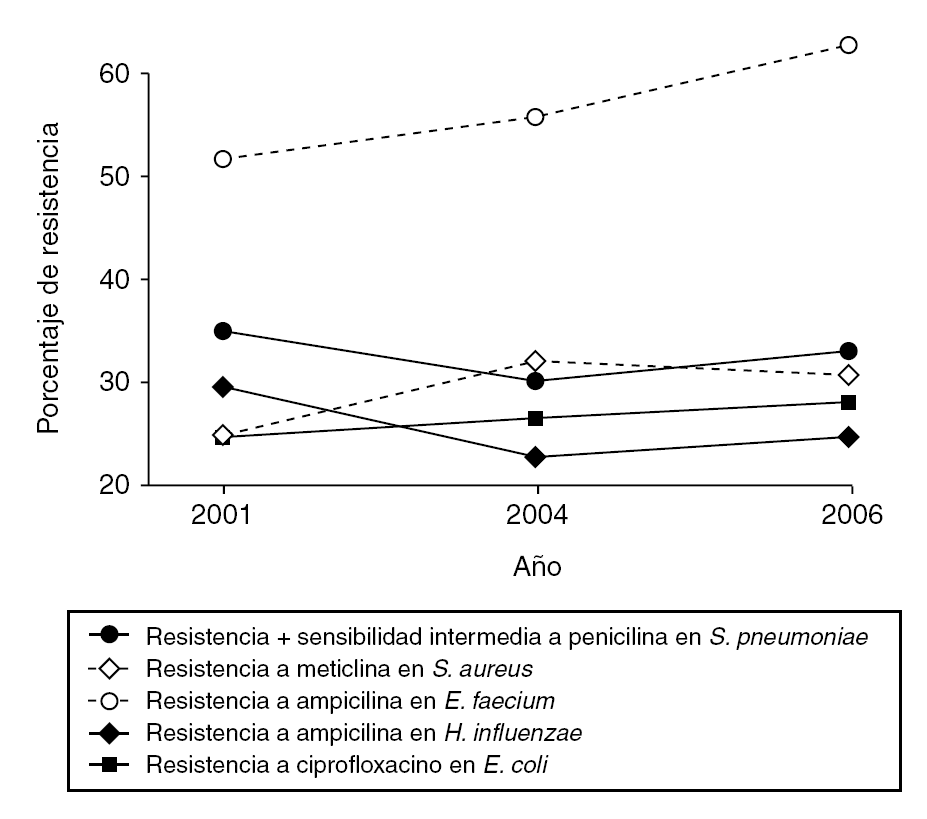
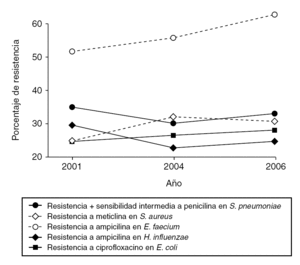
De acuerdo con la información proporcionada por cada uno de los hospitales participantes, correspondiente al mes de febrero de 2006, la incidencia global de los microorganismos evaluados ha sido la siguiente: S. pneumoniae no sensible a penicilina (30,6%), S. aureus resistente a meticilina (29,0%), E. faecalis resistente a ampicilina (0,8%), E. faecium resistente a ampicilina (62,9%), E. coli resistente a ciprofloxacino (26,4%) y H. influenzae resistente a ampicilina (23,6%). Las variaciones observadas en estas incidencias a lo largo del período 2001-2006 vienen representadas en la figura 1.
Figura 1. Porcentajes globales de resistencia aportados por los centros participantes. Estudio VIRA 2001-2006.
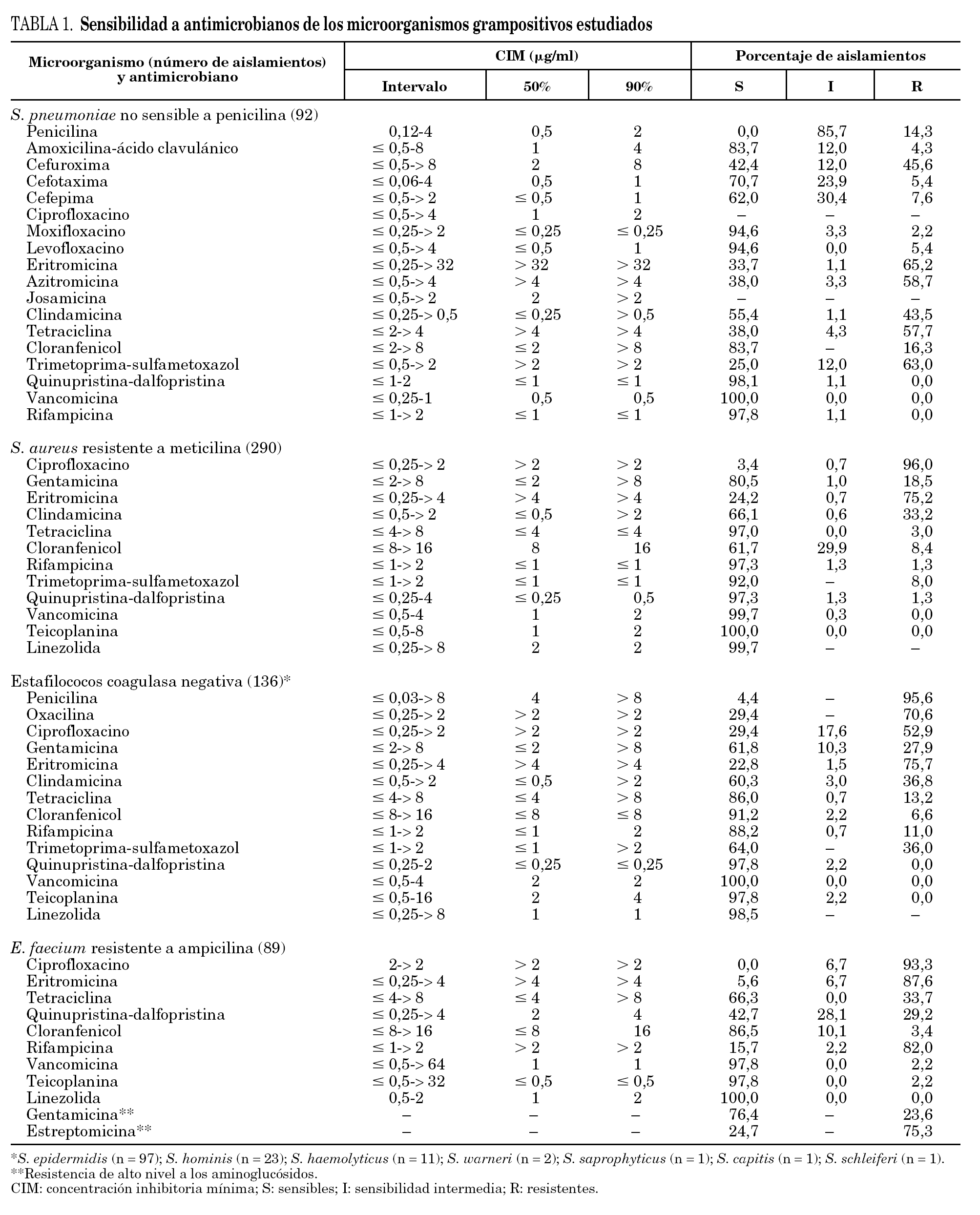
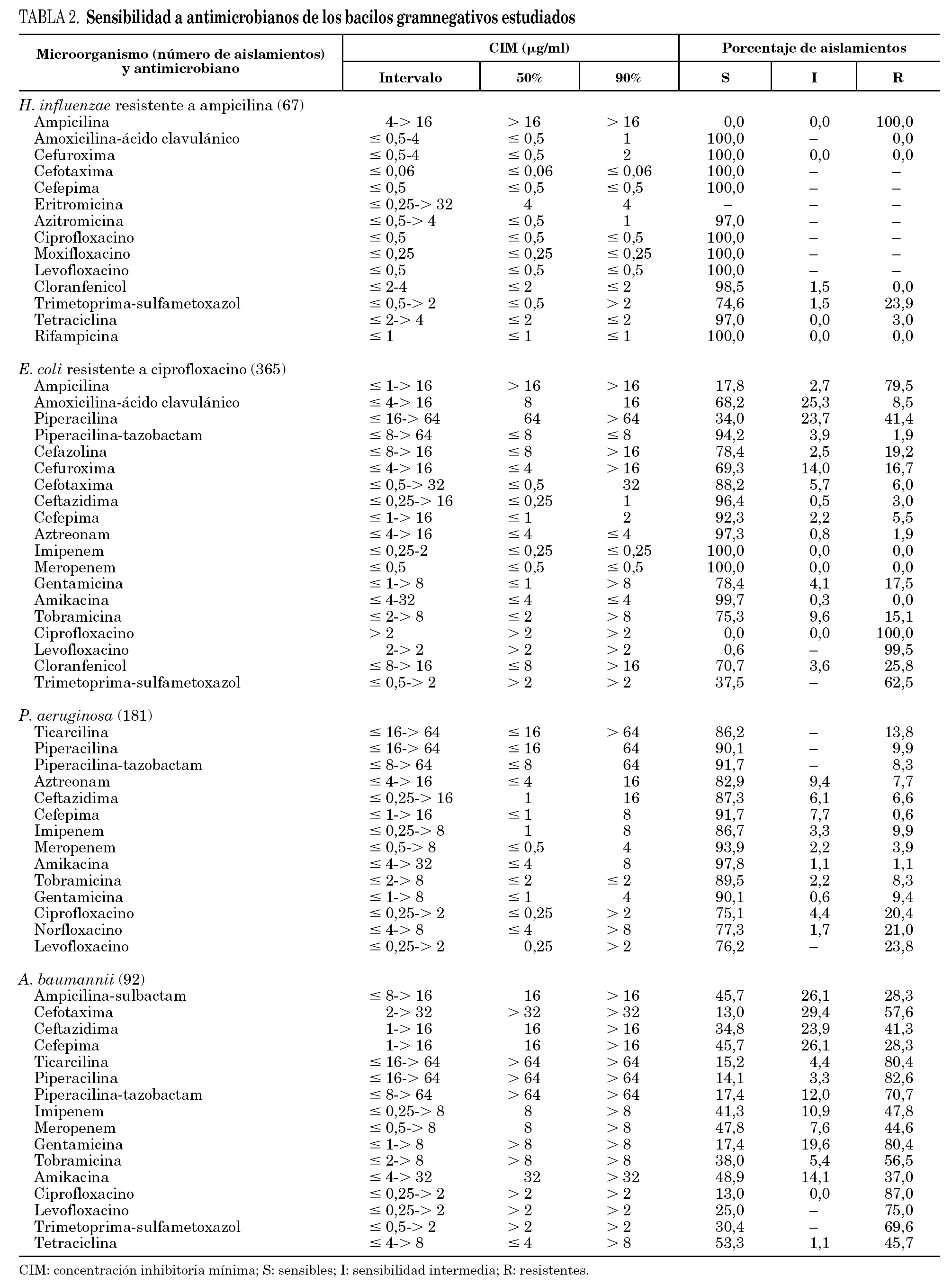
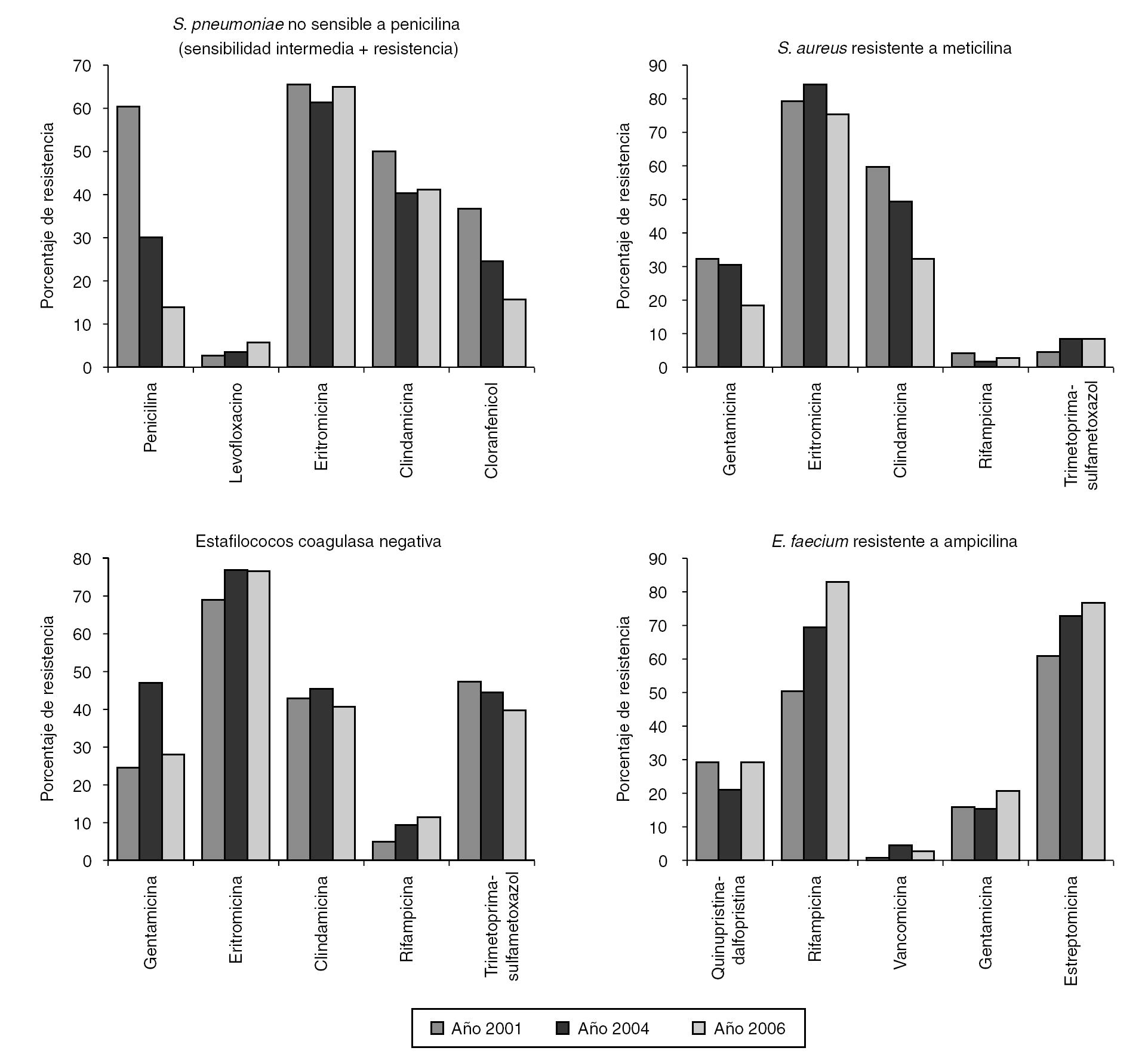
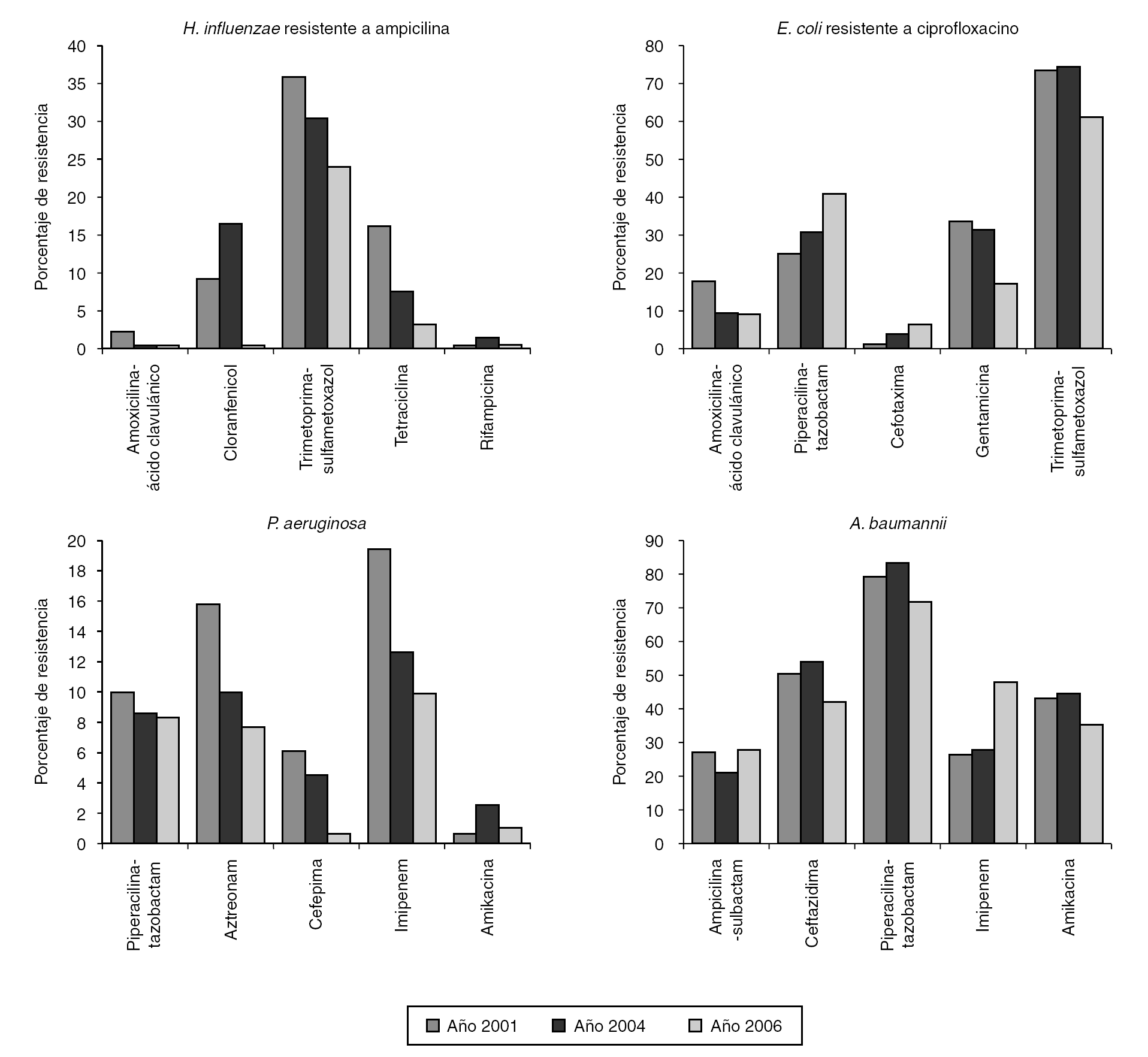
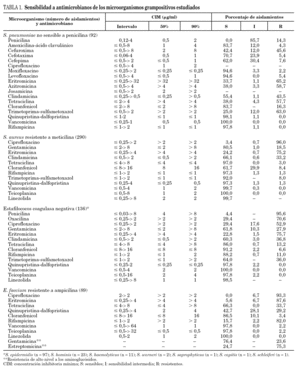
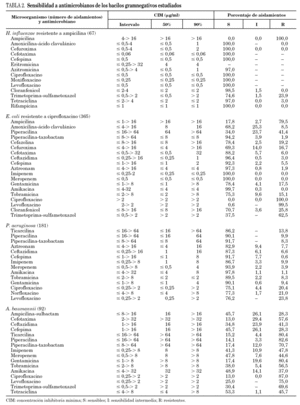
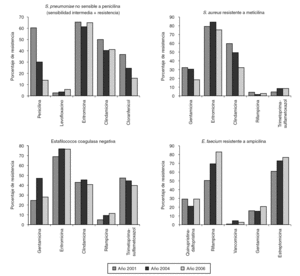
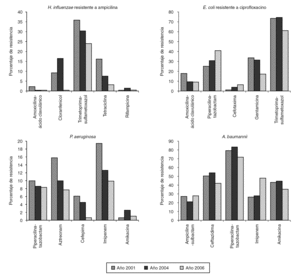
En el estudio se incluyó un total de 1.312 aislamientos. La distribución en los diferentes géneros y especies aparece indicada en las tablas 1 y 2. Los resultados de los estudios de sensibilidad a los diferentes antibióticos se resumen en la tabla 1 para los microorganismos grampositivos y en la tabla 2 para los gramnegativos. La evolución de la resistencia a diversos antibióticos durante el período 2001-2006 aparece representada en las figuras 2 y 3.
Figura 2. Evolución de la resistencia a diversos antimicrobianos de los microorganismos grampositivos estudiados.
Figura 3. Evolución de la resistencia a diversos antimicrobianos de los microorganismos gramnegativos estudiados.
Streptococcus pneumoniae no sensible a penicilina
La procedencia de los neumococos estudiados fue la siguiente: tracto respiratorio inferior, 48,9%; sangre, 20,7%; ocular, 13,0%; oído medio, 12,0%; nasofaríngeo, 2,2%; piel y tejidos blandos, 2,2%, y líquido cefalorraquídeo, 1,1%. El número de neumococos no sensibles a la penicilina incluidos en el presente estudio ha sido de 92, cifra considerablemente inferior a las correspondientes a los 2 estudios VIRA llevados a cabo en los años 2001 y 2004 (204 y 139, respectivamente), a pesar de que la mayoría (37) de los hospitales participantes siguen siendo los mismos desde que se inició el proyecto VIRA. El 85,7% de las cepas enviadas presentó sensibilidad intermedia a penicilina (CIM 0,12-1 μg/ml) y el 14,3% restante fue resistente (CIM ≥2 mg/ml) a este antibiótico.
Solamente 32 cepas (33,7%) han mostrado sensibilidad a eritromicina. El fenotipo más común de resistencia a macrólidos ha sido el constitutivo MLSB (66,1%), mientras que los porcentajes del fenotipo inducible MLSB y del fenotipo M han sido 22,1 y 11,8%, respectivamente. Casi el 95% de los neumococos estudiados fue sensible a levofloxacino y moxifloxacino. Se aisló una cepa con sensibilidad intermedia a quinupristina-dalfopristina. Al igual que en los estudios anteriores, cefotaxima y amoxicilina-ácido clavulánico se han comportado como los agentes betalactámicos más activos de todos los ensayados.
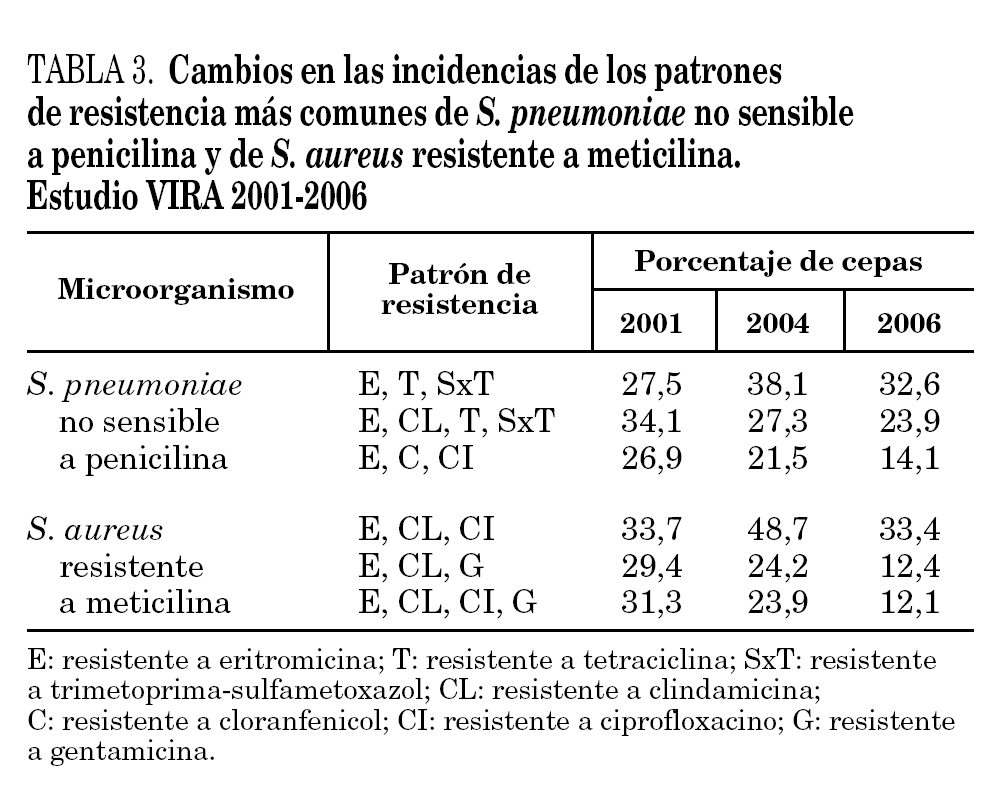
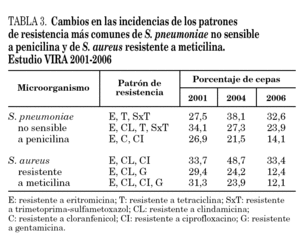
Los patrones de resistencia más comunes han sido similares a los descritos en el estudio VIRA del año 2004 2 (tabla 3): eritromicina, tetraciclina y trimetoprima-sulfametoxazol (en el 32,6% de las cepas); eritromicina, clindamicina, tetraciclina y trimetoprima-sulfametoxazol (23,9% de las cepas), y eritromicina, cloranfenicol, tetraciclina y trimetoprima-sulfametoxazol (14,1%).
Staphylococcus aureus resistente a meticilina
El 96% de las cepas de SARM ha sido resistente a ciprofloxacino y más del 75% a eritromicina. Los porcentajes de resistencia a tetraciclina, cloranfenicol, trimetoprima-sulfametoxazol y rifampicina han oscilado entre el 3 y el 8%. Los patrones de resistencia más comunes fueron: eritromicina, clindamicina y ciprofloxacino (en el 33,4% de los aislamientos); eritromicina, clindamicina y gentamicina (12,4%), y eritromicina, clindamicina, ciprofloxacino y gentamicina (12,1%). Tal como se observa en la tabla 3, las incidencias de estos 3 patrones han experimentado una disminución significativa (p < 0,004) con respecto a las correspondientes del estudio VIRA del año 2004 2.
Hemos detectado una cepa resistente a linezolida, con una CIM de 64 mg/ml, 4 cepas con sensibilidad intermedia a quinupristina-dalfopristina (CIM 2 μg/ml) y 4 cepas resistentes a dicho antibiótico (CIM 4 mg/ml). Todos los aislados han sido sensibles a teicoplanina. Cabe destacar la presencia en este estudio de una cepa de SARM con un valor de CIM para vancomicina de 4 μg/ml. Dicho valor se confirmó mediante la utilización de tiras de Etestì según las instrucciones proporcionadas por el fabricante (AB Biodisk, Solna, Suecia).
Estafilococos coagulasa negativa
Más del 70% de las cepas ha sido resistente a oxacilina. El 25% de las cepas presentó el siguiente patrón de resistencia: eritromicina, clindamicina y ciprofloxacino y el 12,5% fueron resistentes a eritromicina, clindamicina, ciprofloxacino y trimetoprima-sulfametoxazol. Vancomicina ha sido el único antibiótico activo frente al 100% de las cepas. Se han detectado 3 aislamientos (dos Staphylococcus epidermidis y un Staphylococcus hominis) con sensibilidad intermedia a quinupristina-dalfopristina y otros tres (2 S. hominis y un Staphylococcus haemolyticus) que presentaron sensibilidad intermedia a teicoplanina. Dos cepas fueron resistentes a linezolida con unos valores de CIM de 64 y 256 μg/ml, respectivamente, obtenidos mediante la utilización de tiras de Etestì.
Enterococcus faecium resistente a ampicilina
Todos los enterococos resistentes a ampicilina enviados por los hospitales participantes fueron identificados posteriormente por el laboratorio coordinador del estudio como E. faecium. Ninguno fue productor de betalactamasa y dos (2,2%) presentaron alto nivel de resistencia a la ampicilina (CIM > 100 mg/ml). Las tasas de resistencia a ciprofloxacino, eritromicina y rifampicina oscilaron entre el 82 y el 93%. Casi el 25% de las cepas mostró alto nivel de resistencia a gentamicina y más del 75% a estreptomicina. El 29,2% de los enterococos estudiados fue resistente a quinupristina-dalfopristina y el 28,1% presentó sensibilidad intermedia a este antibiótico. Linezolida inhibió todas las cepas a la concentración de ≤2 μg/ml. Se encontraron 2 aislamientos resistentes a vancomicina y teicoplanina, presentando ambos el fenotipo vanA. Procedían de 2 hospitales diferentes y sólo fueron sensibles a linezolida, tetraciclina y cloranfenicol.
Haemophilus influenzae resistente a ampicilina
La procedencia de los aislamientos de H. influenzae enviados por los hospitales participantes ha sido la siguiente: tracto respiratorio, 62,7%; exudado ocular, 26,9%, y exudado ótico, 10,4%. Todos fueron resistentes a ampicilina por producción de betalactamasas. Tal como se observa en la tabla 2, la tasa de sensibilidad a los restantes agentes betalactámicos ensayados, a rifampicina y a las 3 quinolonas fue en todos los casos del 100%. Hemos encontrado 2 cepas con una CIM para azitromicina superior a 4 mg/ml. El 23,9% de las cepas fue resistente a trimetoprima-sulfametoxazol; una de las cuales presentó, además, resistencia a tetraciclina y sensibilidad intermedia a cloranfenicol.
Escherichia coli resistente a ciprofloxacino
La tasa global de resistencia a ciprofloxacino en E. coli durante el mes de febrero de 2006 en los hospitales consultados ha sido del 26,4% cifra ligeramente superior a la comunicada en el año 2004 (25,5%). La mayor parte (81,1%) de los aislamientos de E. coli incluidos en el estudio, era causante de infecciones urinarias, el 10,7% de infecciones en piel y tejidos blandos, el 2,5% de bacteriemias y el 5,7% restante correspondía a etiologías variadas. De los 3 aminoglucósidos ensayados, amikacina ha sido el más activo; solamente se detectó una cepa con sensibilidad intermedia y las restantes fueron todas sensibles. Gentamicina y tobramicina han mostrado un comportamiento similar (17,5 y 15,1% de cepas resistentes, respectivamente). El 100% de los aislamientos ha sido sensible a imipenem y meropenem. De los 365 aislados de E. coli, el 12,1% fue resistente a ampicilina, gentamicina y trimetoprima-sulfametoxazol.
Un total de 54 cepas de E. coli presentaban valores de CIM ≥ 2 μg/ml para cefotaxima y/o ceftazidima y/o cefepima, de las cuales 44 se identificaron fenotípicamente como productoras de BLEE.
Pseudomonas aeruginosa
Los hospitales participantes enviaron un total de 181 cepas de P. aeruginosa, cuya procedencia fue la siguiente: tracto respiratorio (28,2%); piel y tejidos blandos (24,9%); orina (24,9%); sangre (8,8%); exudado ótico (7,2%); intraabdominal (4,4%), y otras (1,6%). Entre el 82 y el 91% de las cepas ha sido sensible a piperacilina y su combinación con tazobactam, aztreonam, ceftazidima y cefepima. Los porcentajes de sensibilidad a las 3 quinolonas incluidas en el estudio han oscilado entre el 75 y el 77%. De los 3 aminoglucósidos, amikacina ha sido el más activo; solamente hemos encontrado 2 cepas resistentes a este antibiótico y 2 cepas con sensibilidad intermedia. Tobramicina y gentamicina presentaron una actividad similar (alrededor del 90% de sensibilidad). Una de las 24 cepas no sensibles a imipenem dio positivo el test de sinergia de imipenem-EDTA, siendo los valores de la CIM de imipenem y de imipenem + EDTA de > 256 y 8 mg/ml, respectivamente.
Al comparar los resultados de este estudio con los efectuados anteriormente 1,2 (fig. 3), se aprecia un descenso significativo (p < 0,02) en la tasa de resistencias a cefepima (del 6,2% en el año 2001 al 4,8% en el 2004 y al 0,6% en este estudio). También la resistencia a aztreonam ha registrado una disminución significativa (del 15,6% en el 2001 al 7,7% en el 2006; p < 0,04). La actividad de ciprofloxacino, levofloxacino y norfloxacino se mantiene estable a lo largo del período estudiado, al igual que los 3 aminoglucósidos ensayados y la piperacilina-tazobactam.
Acinetobacter baumannii
El 30,5% de las cepas de A. baumannii estudiadas procedía de tracto respiratorio, el 29,3% de piel y tejidos blandos, el 19,6% de orinas, el 8,7% de sangre y el 11,9% restante correspondía a diversas procedencias. Los antimicrobianos que han mostrado mayor actividad han sido ampicilina-sulbactam y cefepima, ambos con un porcentaje de resistencia del 28,3%. La mayoría de los aislamientos de A. baumannii fue resistente a ticarcilina, piperacilina, piperacilina-tazobactam, trimetoprima-sulfametoxazol, ciprofloxacino, levofloxacino y gentamicina (entre el 70 y el 87% de cepas resistentes). La tasa de resistencia a imipenem, que en los años 2001-2004 se había mantenido en torno al 27%, ha aumentado hasta el 47,8% en este estudio (p < 0,005). La actividad de los restantes antimicrobianos evaluados no ha experimentado variaciones significativas a lo largo del período 2001-2006 (fig. 3).
Las 44 cepas resistentes a imipenem procedían de 20 centros hospitalarios diferentes. Hubo 3 hospitales en los que las 5 cepas enviadas eran resistentes a imipenem, en un hospital enviaron cuatro, en otros 3 hospitales enviaron, cada uno de ellos, 3 cepas de estas características, y los 13 hospitales restantes enviaron 1 o 2 cepas resistentes a imipenem. Ninguno de los aislamientos resistentes o con sensibilidad intermedia a imipenem dio positivo el Etestì para la detección de MBL.
Discusión
Streptococcus pneumoniae no sensible a penicilina
Al igual que se observa una disminución significativa a lo largo de los tres estudios VIRA en el número de aislamientos de neumococo enviados por los centros participantes, también entre las cepas enviadas la proporción de las resistentes a penicilina ha disminuido significativamente: del 59,8% en el año 2001 al 30,2% en el 2004 (p < 0,0001) y al 14,3% en el último estudio (p < 0,001), con el consiguiente incremento de las cepas con sensibilidad intermedia (40,2, 69,8 y 85,7%, respectivamente). Este fenómeno ha sido ya constatado en la bibliografía reciente 6-8. En los últimos 5 años, en España se ha registrado un descenso progresivo de la resistencia de S. pneumoniae a los antibióticos betalactámicos, lo cual se asocia a diferentes factores como la introducción de la vacuna conjugada heptavalente en la población infantil, la disminución del consumo de antibióticos y la sustitución de los clones internacionales multirresistentes por otros clones de S. pneumoniae sensibles 6. Uno de los efectos observados en Estados Unidos tras la implantación de la vacuna conjugada del neumococo en niños desde el año 2000, ha sido la disminución, tanto en niños como en adultos, de la tasa de infecciones neumocócicas invasivas por cepas resistentes 8.
En el neumococo es común la resistencia cruzada entre la penicilina y los macrólidos, siendo dichas resistencias más elevadas en España que en otros países 9-11. La resistencia a eritromicina ha sido del 65,2%, cifra similar a la comunicada en otros estudios multicéntricos llevados a cabo en nuestro país 7,12. Por otra parte, en concordancia con lo descrito por García-Rey et al 13 entre los neumococos no sensibles a penicilina, esta resistencia no ha experimentado variaciones con respecto a los 2 estudios VIRA anteriores 1,2 (fig. 2).
En los últimos años, la aparición e incremento de aislamientos de neumococos multirresistentes ha dado lugar a una mayor utilización de las fluoroquinolonas con actividad frente al neumococo, como levofloxacino y moxifloxacino. Aunque, generalmente, con incidencias relativamente bajas, se han comunicado resistencias del neumococo a estas fluoroquinolonas, tanto en España 9 como en otros países 10,14,15, así como también fracasos terapéuticos asociados a dichas resistencias 16. En el presente estudio, las tasas de resistencia a levofloxacino y a moxifloxacino han sido del 5,4 y del 2,2%, respectivamente. Estas cifras son ligeramente superiores (2,9 y 0,7%, respectivamente) a las correspondientes al estudio VIRA efectuado en 2004 2, siendo esta diferencia no significativa. Tampoco el porcentaje de cepas que mostraron valores de la CIM de ciprofloxacino de 4 mg/ml o más ha experimentado variaciones significativas en el período 2001-2006, manteniéndose en torno al 6%, cifra similar a la comunicada por otro grupo de trabajo en nuestro país 7.
Staphylococcus aureus resistente a meticilina
La resistencia a meticilina en S. aureus continúa siendo un problema importante. Recientemente se ha comunicado en un centro hospitalario español, entre los años 2002 y 2005, un incremento de esta resistencia del 39,9 al 46,4% 17. Tal como se observa en la figura 1, la incidencia global de resistencia a meticilina en S. aureus (29,0%) del presente estudio no difiere significativamente a la obtenida en el estudio VIRA efectuado en 2004 2. Entre los aislamientos de SARM es frecuente la resistencia a clindamicina, eritromicina y ciprofloxacino, siendo en nuestro estudio del 33, 65 y 96%, respectivamente. Al comparar los resultados obtenidos en el año 2006 con los correspondientes a los estudios VIRA anteriores 1,2, observamos que las tasas de resistencia a eritromicina y clindamicina permanecen estables a lo largo de todo el período 2001-2006. Tampoco las tasas de resistencia a cloranfenicol, rifampicina, tetraciclina y trimetoprima-sulfametoxazol han experimentado variaciones significativas a lo largo de los años. Por el contrario, el porcentaje de resistencia a gentamicina correspondiente a los primeros 2 estudios (30-33%) disminuye significativamente (p < 005) al 18,5% en último período. La disminución de la resistencia a gentamicina en SARM ha sido comunicada recientemente en nuestro país 18.
Un dato que queremos señalar, es la detección por primera vez, de un aislamiento no sensible a linezolida que presentaba una CIM de 64 mg/ml. La resistencia de SARM a linezolida es poco frecuente 19. La mayoría de los estudios publicados no refieren resistencias a este antibiótico entre los aislamientos de SARM 20,21. Se han descrito algunos casos en pacientes sometidos a tratamientos de duración prolongada con linezolida, habiéndose asociado dicha resistencia a mutaciones genéticas en el dominio V del gen 23S rRNA 22,23. En las cepas del año 2006 aparecen resistencias a quinupristina-dalfopristina, no detectadas en estudios anteriores. Las 8 cepas de SARM no sensibles a este antibiótico proceden de 3 hospitales diferentes. La detección de aislamientos de SARM resistentes a quinupristina-dalfopristina aparece raramente descrita en la literaura especializada 19,20,24, a excepción de la elevada tasa de resistencias en grampositivos comunicada por Luh et al 25 en Taiwán donde encontraron un 31% de SARM y un 16% de estafilococos coagulasa negativa no sensibles a este antibiótico. Teicoplanina se mantiene uniformemente activa a lo largo del período 2001-2006. Sin embargo, con respecto a vancomicina, es importante destacar el aislamiento en este estudio de una cepa que presenta, según los criterios del último documento del CLSI 4, sensibilidad disminuida a este antibiótico (CIM 4 mg/ml). En los 2 estudios anteriores todos los aislamientos de SARM fueron inhibidos por concentraciones de vancomicina de 2 mg/ml o menos. Otro hecho que hemos observado es el incremento gradual que han experimentado los valores de las CIM de vancomicina a lo largo del período 2001-2006. A la concentración de 1 mg/ml la vancomicina inhibe el 93,5% de las cepas de SARM en el año 2001, el 79,2% en el año 2004 y el 69,1% en el año 2006. Estos datos nos parecen preocupantes, y aunque, por el momento, en España no se han comunicado aislamientos de SARM resistentes a vancomicina o con valores de CIM de 8 mg/ml, debemos estar alerta ante la posibilidad de tales aislamientos, utilizando para ello el medio selectivo adecuado que nos permita su detección en el laboratorio.
Estafilococos coagulasa negativa
Los resultados de este estudio ponen de manifiesto que la multirresistencia entre los aislamientos de estafilococos coagulasa negativa es frecuente. Al comparar con los resultados de los 2 estudios efectuados previamente 1,2, observamos que los porcentajes de resistencias a la mayoría de los antibióticos ensayados no han experimentado cambios significativos, exceptuando la gentamicina, cuya tasa de resistencia disminuye significativamente (p < 0,002) con respecto al estudio anterior (del 46,2 al 27,9%). Al igual que ocurre con las cepas de SARM, queremos destacar la aparición de resistencias a linezolida y a quinupristina-dalfopristina, no detectadas en los estudios anteriores 1,2. En el estudio nacional de resistencias a estafilococos llevado a cabo en nuestro país en el año 2002 no se encontró ningún aislamiento resistente a estos antibióticos 21. La presencia de este tipo de resistencias aparece reflejada en la literatura médica muy raramente 19. Luh et al25, describieron en el año 2000 el aislamiento de 10 cepas de S. haemolyticus con una CIM a linezolida superior a 32 mg/ml. Más recientemente, Draghi et al 24 han notificado el aislamiento de una cepa de S. epidermidis con una CIM a linezolida de 32 mg/ml. Nuestros aislamientos correspondieron a S. epidermidis y a S. hominis, procedían de 2 hospitales diferentes y presentaron unos valores de CIM para la linezolida de 64 y 256 mg/ml, respectivamente.
La resistencia a teicoplanina se mantiene en cifras muy bajas, mientras que en otros países europeos la incidencia de aislamientos de S. epidermidis con sensibilidad disminuida a teicoplanina se ha incrementado notablemente 26,27.
Enterococcus faecium resistente a ampicilina
La tendencia creciente de la resistencia a la ampicilina en E. faecium, ya observada entre los años 2001 y 2004 2, se manifiesta también en el último período, aumentando del 52,1% en el año 2001 al 62,9% en el año 2006 (p < 0,04). En el presente estudio, se confirma que la multirresistencia entre los aislamientos de E. faecium resistentes a ampicilina es común y cada vez mayor. Al comparar con los resultados del estudio anterior 2, se aprecia un incremento significativo (p < 0,05) de la resistencia a rifampicina (del 68,5% en el año 2004 al 82,0% en el 2006). También las tasas de resistencia a otros antibióticos como, quinupristina-dalfopristina, alto nivel de resistencia a gentamicina y estreptomicina, han experimentado incrementos entre los años 2004 y 2006, aunque no significativos (del 21,3 al 29,2%, del 16,9 al 23,6% y del 70,8 al 75,3%, respectivamente).
La actividad de los glucopéptidos y de linezolida se mantiene prácticamente igual a lo largo del período 2001- 2006. El 2,2% de los enterococos correspondientes al año 2006 muestran resistencia a vancomicina y teicoplanina. La prevalencia de enterococos resistentes a glucopéptidos es generalmente baja, tanto en España como en otros países europeos 28. El elevado porcentaje (57,3%) de cepas no sensibles a quinupristina-dalfopristina, ya comunicado en los 2 estudios VIRA anteriores 1,2, es superior al notificado recientemente por Oh et al 29 en Corea y similar al encontrado en un hospital de Madrid entre los aislamientos de E. faecium resistentes a ampicilina y causantes de bacteriemia 30. Por lo cual, consideramos que en nuestro medio, la quinupristina-dalfopristina no constituye una alternativa válida para el tratamiento de las infecciones causadas por E. faecium multirresistente.
Haemophilus influenzae resistente a ampicilina
La vacunación sistemática contra H. influenzae serotipo B desde octubre de 1998 en nuestro país, ha dado lugar a una disminución significativa de la enfermedad invasiva por este microorganismo entre la población infantil 31. Sin embargo, H. influenzae continúa siendo uno de los patógenos más comunes causantes de infecciones respiratorias de origen comunitario como neumonía y exacerbaciones agudas de bronquitis crónica. También aparece implicado frecuentemente en cuadros de sinusitis y otitis media aguda.
La prevalencia global de resistencia a ampicilina en H. influenzae, obtenida de acuerdo con los datos proporcionados por los diferentes centros participantes, es del 23,6%, similar a la correspondiente al último estudio VIRA 2 (22,05%). La bibliografía reciente consultada refleja cifras comprendidas entre el 22 y el 26% 32-34. Al igual que en el estudio VIRA del año 2004 2, no hemos encontrado ningún aislamiento que fuera resistente a ampicilina y no productor de betalactamasa. Tales aislamientos han sido comunicados por otros autores españoles 32,33 aunque en incidencias bajas. También la prevalencia en nuestro país de cepas de H. influenzae productoras de betalactamasa y resistentes a amoxicilina-ácido clavulánico es muy baja 32,35. En el primer estudio 1 encontramos 2 aislamientos con estas características, que no se han detectado posteriormente. Gómez-Garcés et al 35 han comunicado un 3% de estos aislamientos en un estudio multicéntrico reciente.
La resistencia de H. influenzae a fluoroquinolonas es muy poco frecuente 36. En los 3 estudios VIRA no se ha detectado este tipo de resistencia. La resistencia a azitromicina (3%) es similar a la descrita por Jones et al 12 en un estudio multicéntrico europeo.
Al comparar las tasas de resistencia a trimetoprima-sulfametoxazol, cloranfenicol y tetraciclina de este estudio con las correspondientes de los 2 estudios VIRA anteriores 1,2, se observa una tendencia a la disminución de las mismas, aunque en el caso de trimetoprima-sulfametoxazol las diferencias no son significativas. La resistencia a cloranfenicol fue del 9,0% en el año 2001 y del 0,0% en el presente estudio (p < 0,005) y los porcentajes de resistencia a tetraciclina han disminuido del 16,0% en el año 2001 al 3,0% en el año 2006 (p < 0,005).
Escherichia coli resistente a ciprofloxacino
En diversas publicaciones españolas de los últimos años, se refleja la progresiva disminución de la sensibilidad de E. coli a las quinolonas 37-39. Esta tendencia se evidencia también en nuestro estudio. La incidencia global de resistencia a ciprofloxacino comunicada por los hospitales participantes fue del 24,1% en el año 2001, del 25,5% en el 2004 y del 26,4% en el 2006.
El 12,1% de las cepas de E. coli resistentes a ciprofloxacino estudiadas fue productora de BLEE y procedía de 26 hospitales diferentes. Se observa, con respecto al estudio anterior, donde se experimentó un incremento significativo (del 1,1% en el año 2001 al 11,3% en el 2004), que sigue la tendencia al aumento de la prevalencia de E. coli productor de BLEE. En España, este incremento se ha descrito por diversos autores en los últimos años, tanto en aislamientos causantes de infecciones nosocomiales como comunitarias 40-42. La presencia de enterobacterias productoras de BLEE constituye un grave problema terapéutico, ya que estas bacterias son, además, resistentes a otros antibióticos, por lo que hay pocas opciones para el tratamiento de las infecciones que estas bacterias ocasionan. Entre los 44 aislados productores de BLEE, los porcentajes de resistencia a gentamicina, cloranfenicol y trimetoprima-sulfametoxazol han sido del 11,4, 27,3 y 59,1%, respectivamente.
Más del 40% de los aislados de E. coli ha sido resistente a piperacilina, siendo este porcentaje significativamente superior al 24,9% detectado en el año 2001 (p < 0,00001) y al 29,8% del año 2004 (p < 0,002). Por el contrario, la tasa de resistencia a gentamicina presenta una disminución significativa (p < 0,00001) con respecto a los valores correspondientes a los años 2001 y 2004, los cuales estaban comprendidos entre el 31 y el 33%. También se detecta una disminución significativa en la resistencia a trimetoprima-sulfametoxazol; en los primeros 2 estudios se mantuvo en torno al 74% y desciende al 62,5% en este estudio (p < 0,001).
Las resistencias a amoxicilina-ácido clavulánico y a cloranfenicol, que en el año 2004 habían experimentado una disminución significativa, se mantienen estables en el último período estudiado.
Pseudomonas aeruginosa
En nuestro estudio encontramos unos porcentajes de resistencia a la mayoría de los antimicrobianos evaluados inferiores a los descritos por otros grupos de trabajo, tanto en España 43,44 como en otros países 45,46. El 3,3% de nuestras cepas muestra multirresistencia (resistencia a tres o más de los siguientes antibióticos: ceftazidima, ciprofloxacino, tobramicina e imipenem).
Al igual que en el estudio VIRA del año 2004 2, solamente una cepa dio positiva la prueba de Etestì MBL, tratándose probablemente de una cepa productora de MBL. En los últimos años, se han descrito brotes nosocomiales por P. aeruginosa productora de MBL en diversos países 47,48, lo cual puede constituir un problema terapéutico importante. Nuestros datos, en consonancia con los comunicados recientemente por Gutiérrez et al 49, confirman que en nuestro país, por el momento, la resistencia de P. aeruginosa mediada por MBL no constituye un problema creciente.
Acinetobacter baumannii
A. baumannii multirresistente se ha convertido en estos últimos años en un importante patógeno causante de brotes epidémicos hospitalarios, especialmente en pacientes ingresados en las unidades de cuidados intensivos. Los patrones de resistencia de este microorganismo varían mucho de un hospital a otro 50 y entre los diferentes países 51. Las tasas de resistencia a los antimicrobianos que nosotros hemos encontrado, difieren de las de otros países europeos, donde, en general, no son tan elevadas 51. La mayoría de nuestros resultados coinciden con los de otros autores españoles 50,52,53. Sin embargo, se aprecian algunas diferencias, así los porcentajes de resistencia a cefotaxima, ceftazidima, cefepima y carbapenemas son ligeramente inferiores a los comunicados por Gallego et al 52 en el País Vasco. En el estudio multicéntrico 53 llevado a cabo por la Red Española de Investigación en Patología Infecciosa (REIPI), la resistencia a ceftazidima es superior a la de nuestro estudio (76,8% frente a 41,3%) mientras que la de tobramicina es más baja (35% frente a 56,5%).
En este estudio se constata, de acuerdo con la bibliografía revisada 50,52, la multirresistencia de A. baumannii, así como la prevalencia cada vez mayor de la resistencia a imipenem. Como ya se ha comentado, la tasa de resistencia a imipenem en el año 2006 ha sido significativamente superior con respecto a la obtenida en años anteriores. Las cepas resistentes a imipenem que, en el 41% de los casos procedían de infecciones de tracto respiratorio, presentan resistencia cruzada con la mayoría de los antibióticos disponibles. Más del 90% de estas cepas son además resistentes a piperacilina-tazobactam, gentamicina y ciprofloxacino; entre el 75 y el 84% de las mismas son resistentes a trimetoprima-sulfametoxazol, tobramicina y cefotaxima y alrededor del 50% presenta resistencia a tetraciclina, amikacina, ampicilina-sulbactam y ceftazidima. El antibiótico más activo frente a las cepas de A. baumannii resistentes a imipenem es cefepima con 22,7% de sensibilidad. En un centro hospitalario de nuestro país se demuestra que la elevada resistencia a imipenem es debida a la diseminación de un clon mayoritario que produce carbapenemasas tipo OXA, en el que también se ha detectado, aunque en menor proporción metalobetalactamasas 52. En otros países la resistencia a carbapenemas mediada por la producción de MBL presenta una mayor prevalencia. Así, en Corea, Yong et al 54, describen hasta un 26,5% de aislados de Acinetobacter spp. resistentes a imipenem productores de MBL. Ninguna de nuestras cepas resistentes a imipenem ha dado positivo el test de la producción de MBL mediante tiras de Etestì. Gallego et al 52, de un total de 76 cepas de A. baumannii, resistentes a imipenem, encontraron siete que daban positivo este test. En 20 (51,3%) de los 39 hospitales participantes se aíslan cepas resistentes a imipenem y en tres de ellos todas las cepas enviadas son resistentes, lo que indica la diseminación de clones de A. baumannii multirresistentes en el medio hospitalario.
Al analizar los resultados obtenidos en los 3 estudios VIRA se observa, para la mayoría de los antibióticos evaluados, un incremento de las tasas de resistencia o una estabilización de las mismas, exceptuando algunos casos, como el descenso de la resistencia a betalactámicos en S. pneumoniae. En la actualidad, el tratamiento de las infecciones que las diferentes bacterias multirresistentes anteriormente comentadas ocasionan, constituye un grave problema debido a las escasas opciones terapéuticas de que disponemos. De todo lo anteriormente comentado, se deduce la necesidad de establecer mecanismos adecuados de vigilancia epidemiológica para evitar la diseminación de las bacterias multirresistentes y lograr un mejor control de la infección nosocomial. También queremos subrayar la importancia de la utilización racional y prudente de los antibióticos, así como la necesidad de fomentar la investigación de nuevos fármacos que sean capaces de evadir los mecanismos de resistencia.
Agradecimientos
Deseamos agradecer la colaboración de Sanofi Aventis en la realización de este trabajo.
Relación de miembros del Grupo VIRA
Hospital General Universitario de Alicante (Alicante), Hospital Infanta Cristina (Badajoz), Ciutat Sanitària de la Vall d'Hebron (Barcelona), Hospital Clínic i Provincial de Barcelona (Barcelona), Hospital de Basurto (Bilbao), Complejo Hospitalario de Cáceres (Cáceres), Hospital Universitario Puerta del Mar (Cádiz), Hospital Carmen y Severo Ochoa (Cangas del Narcea), Complejo Hospitalario Reina Sofía (Córdoba), Hospital Comarcal Don Benito-Villanueva de la Serena (Don Benito), Hospital General Universitario de Elche (Elche), Hospital Universitario de Getafe (Getafe), Complejo Hospitalario Virgen de las Nieves (Granada), Hospital General y Universitario de Guadalajara (Guadalajara), Hospital Severo Ochoa (Leganés), Hospital 12 de Octubre (Madrid), Hospital Santa Cristina (Madrid), Hospital Universitario La Paz (Madrid), Hospital Clínico San Carlos (Madrid), Hospital General Universitario Gregorio Marañón (Madrid), Complejo Hospitalario Móstoles-Alcorcón (Móstoles), Hospital Central de la Defensa (Madrid), Hospital de Mérida (Mérida), Hospital Universitario Virgen de la Arrixaca (Murcia), Hospital General Universitario J.M. Morales Meseguer (Murcia), Hospital Son Llàtzer (Palma de Mallorca), Hospital Insular de Gran Canaria (Las Palmas de Gran Canaria), Hospital General de las Palmas de Gran Canaria Dr. Negrín (Las Palmas de Gran Canaria), Hospital de Navarra (Pamplona/Iruña), Hospital Clínico (Salamanca), Hospital Clínico Universitario de Santiago (Santiago de Compostela), Hospital General (Segovia), Hospital Virgen del Rocío (Sevilla), Complejo Hospitalario Virgen de la Macarena (Sevilla), Complejo Hospitalario Nuestra Señora de Valme (Sevilla), Instituto Valenciano de Oncología (Valencia), Hospital de Sagunto (Valencia), Hospital Universitario La Fe (Valencia), Hospital Universitario de Valladolid (Valladolid), Hospital Clínico Universitario Lozano Blesa (Zaragoza).
Correspondencia: Dr. J.J. Picazo.
Servicio de Microbiología Clínica. Hospital Clínico San Carlos.
Pl. Cristo Rey, s/n. 28040 Madrid. España.
Correo electrónico: jpicazo@microb.net
Manuscrito recibido el 1-6-2006; aceptado el 28-8-2006.