Introducción
En los últimos años se ha producido un incremento de los aislamientos de cepas de Escherichia coli y Klebsiella pneumoniae productoras de betalactamasas de espectro extendido (BLEE), posiblemente en relación con el uso generalizado de cefalosporinas de amplio espectro 1,2. Además de la presión selectiva ejercida por las cefalosporinas, se ha sugerido que la presión antibiótica global o la que ejercen determinados grupos de antibióticos, por ejemplo, las quinolonas, podrían justificar la diseminación de estas cepas 3. Desde su aparición en 1983, las cepas productoras de BLEE se han considerado fundamentalmente como patógenos nosocomiales 3-5, sin embargo, actualmente, las infecciones por enterobacterias productoras de BLEE son un problema emergente en la comunidad. En España, datos del estudio multicéntrico GEIH-BLEE 2000 señalan que el 51% de las cepas de E. coli y el 7% de K. pneumoniae productoras de BLEE, son de origen comunitario 6. Actualmente, en nuestro hospital, el 64% de las cepas de E. coli y el 36% de K. pneumoniae productoras de BLEE proceden de muestras no hospitalarias y un alto porcentaje de estas cepas se aíslan a partir de muestras de orina de mujeres con infección del tracto urinario (ITU) no complicada.
Además de conferir resistencia a todos los betalactámicos, excepto cefamicinas y carbapenemas, los plásmidos que codifican las BLEE contienen, con frecuencia, otros genes de resistencia para distintos antimicrobianos, como aminoglucósidos, tetraciclinas y cotrimoxazol y, especialmente en cepas de K. pneumoniae, es también frecuente la resistencia a quinolonas 7,8. Excluyendo estos antimicrobianos, las alternativas terapéuticas para el adecuado tratamiento de las ITU comunitarias causadas por cepas productoras de BLEE son muy limitadas.
Entre los antimicrobianos recomendados para el tratamiento de la ITU no complicada de la comunidad, fosfomicina trometamol se considera una alternativa de primera línea por su elevada actividad frente a los uropatógenos más frecuentes 9-11. Sin embargo, su actividad frente a cepas productoras de BLEE no es bien conocida 12.
Este estudio compara la actividad de fosfomicina, frente a cepas de E. coli y K. pneumoniae productoras de BLEE, con la de los antimicrobianos más frecuentemente utilizados en el tratamiento de las ITU no complicadas, con el objetivo de determinar si fosfomicina puede representar una alternativa válida en el tratamiento las ITU comunitarias causadas por estos patógenos.
Material y métodos
Cepas bacterianas
Se han estudiado 428 cepas productoras de BLEE, 290 (68%) E. coli y 138 (32%) K. pneumoniae. Entre las cepas estudiadas, 170 E. coli y 70 K. pneumoniae procedían del estudio multicéntrico GEIH-BLEE 2000 y las restantes, 120 E. coli y 68 K. pneumoniae, correspondían a aislamientos realizados en el Hospital Universitario Virgen Macarena de Sevilla (HUVM) entre los años 1995-2001. El 65% de las cepas de E. coli y el 39% de las cepas de K. pneumoniae fueron aisladas a partir de muestras de orina.
Los aislamientos procedentes del estudio multicéntrico incluían 137 cepas de E. coli (81%) y 26 de K. pneumoniae (37%) no relacionadas genéticamente, mientras que los aislamientos realizados en el HUVM incluían 84 cepas de E. coli (70%) y cinco de K. pneumoniae (7%) no relacionadas genéticamente, con un grupo genéticamente relacionado que comprendía más del 80% de los aislamientos de K. pneumoniae 6,13.
En ambos estudios, se confirmó la identificación de los aislamientos con el sistema API 20E (BioMérieux) y la producción de BLEE mediante técnica de microdilución siguiendo los criterios del CLSI 14. Las BLEE fueron caracterizadas mediante isoelectroenfoque (IEF), reacción en cadena de la polimerasa (PCR) con cebadores específicos para TEM, SHV y CTX-M y secuenciación de los genes codificantes 6,13. La relación genética de los aislamientos fue determinada mediante secuencias extragénicas palindrómicas repetidas (REP)-PCR 6,13.
Estudio de sensibilidad
Se determinó la actividad in vitro de amoxicilina-ácido clavulánico (AMC) (Sigma), ciprofloxacino (CIP) (Sigma) y cotrimoxazol (SxT) (Laboratorios Galloso, Madrid), mediante técnica de microdilución en caldo Mueller-Hinton. La actividad de fosfomicina (Grupo Zambon) frente a las cepas estudiadas se determinó por técnica de dilución en agar Mueller-Hinton suplementado con 25 mg/l de glucosa-6-fosfato (inóculo 5 10 4 UFC/spot) 14.
La interpretación de resultados se ha realizado siguiendo los criterios del Clinical and Laboratory Standards Institutte (CLSI). Al no existir puntos de corte establecidos para determinar la actividad de fosfomicina frente a cepas de K. pneumoniae, para la interpretación de estos resultados, se han seguido los criterios establecidos para E. coli 14.
Las tasas de resistencia a los antibióticos estudiados, se han calculado considerando como resistentes las cepas con sensibilidad intermedia a cada uno de los antimicrobianos ensayados.
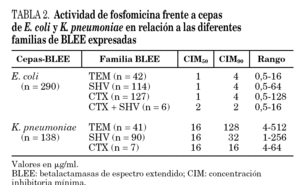
Para evaluar la actividad de fosfomicina frente a aislamientos que producían diferentes tipos de BLEE se han considerado sólo las BLEE presentes en al menos 10 aislamientos, no relacionados genéticamente, y siguiendo este criterio se seleccionaron 38 cepas de E. coli que producían SHV-12, 25 cepas CTX-M-9 y 35 con CTX-M-14. Entre las cepas de K. pneumoniae se seleccionaron 12 que expresaban TEM-4 y 13 SHV-12.
Resultados
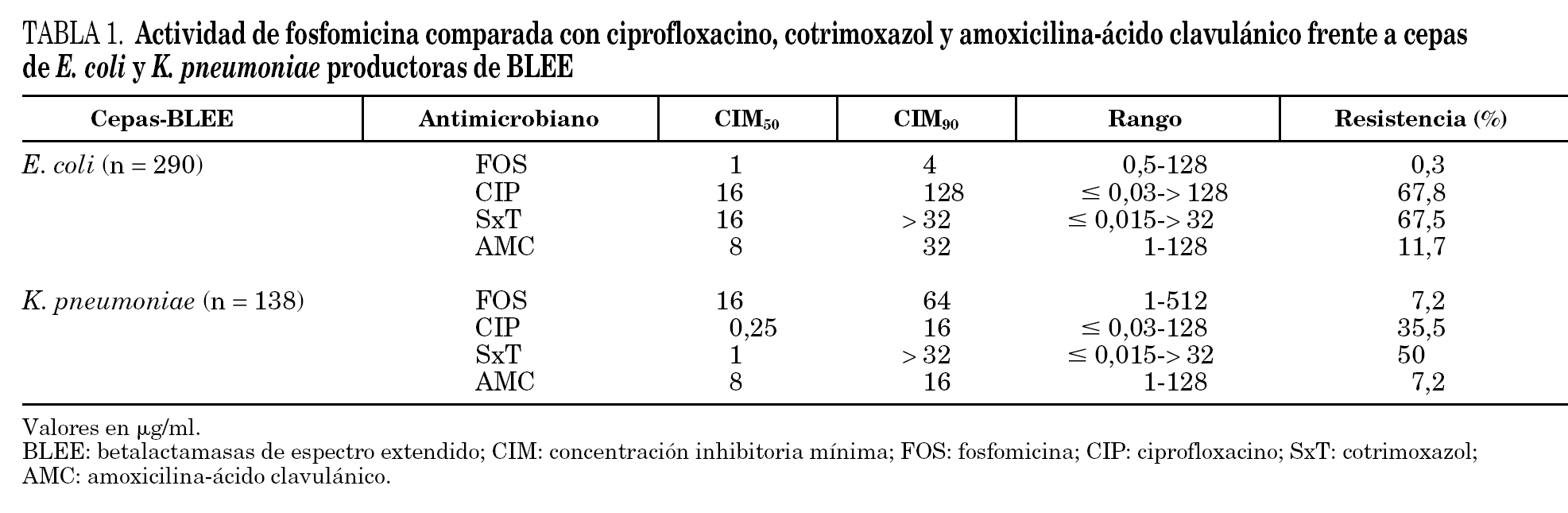
La actividad in vitro de los antibióticos estudiados frente a las cepas de E. coli y K. pneumoniae productoras de BLEE se presenta en la tabla 1. Entre las 428 cepas estudiadas, 417 (97,4%) resultaron sensibles a fosfomicina con CIM ≤64 μg/ml. La CIM50 fue de 2 μg/ml y la CIM90 de 32 μg/ml (rango: 0,5-512 μg/ml). La mayoría de los aislamientos con sensibilidad intermedia y todos los resistentes a fosfomicina fueron cepas de K. pneumoniae, 4 cepas resistentes (CIM≥256 μg/ml) y seis intermedias (CIM = 128 μg/ml). Estas 10 cepas de K. pneumoniae, con sensibilidad intermedia o resistentes a fosfomicina fueron aislamientos no relacionados genéticamente.
Sólo una cepa de E. coli, entre las 290 estudiadas, resultó con sensibilidad intermedia a fosfomicina (CIM = 128 mg/ml). Para K. pneumoniae las CIM50 y CIM90 de fosfomicina fueron más elevadas que para E. coli (CIM50-CIM90 de 16-64 mg/ml frente a 1-4 mg/ml) aunque, el 90% de las cepas se encontraban dentro del rango de sensibilidad.
Los antimicrobianos con menor actividad frente a las cepas estudiadas fueron cotrimoxazol y ciprofloxacino. Las tasas de resistencia de E. coli fueron similares para ambos antimicrobianos, alrededor del 67%, mientras que entre las cepas de K. pneumoniae, las tasas de resistencia obtenidas fueron del 50 y 35,5%, respectivamente. E. coli presentó una tasa de resistencia muy baja frente a fosfomicina (0,3%), muy inferior a la observada para amoxicilina-ácido clavulánico (11,7%); mientras que K. pneumoniae demostró mayor nivel de resistencia a fosfomicina (7,2%), igual que a amoxicilina-ácido clavulánico.
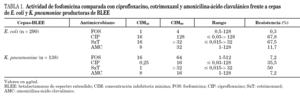
Las CIM50 y CIM90 de fosfomicina para las cepas de E. coli y K. pneumoniae que expresaban diferentes BLEE se presentan en las tablas 2 y 3. No se han observado diferencias en la actividad de fosfomicina frente a aislamientos que producían diferentes familias o tipos de BLEE. Aunque, entre los 10 aislamientos de K. pneumoniae con sensibilidad intermedia o resistentes a fosfomicina ocho eran productores de una BLEE tipo TEM, sólo se identificaron 2 clones que incluían a siete de estas cepas.
Discusión
El aislamiento de enterobacterias, especialmente cepas de E. coli y K. pneumoniae, productoras de BLEE se ha incrementado significativamente en los últimos años y una alta proporción de estos aislamientos son de origen comunitario.
Datos del estudio multicéntrico GEIH-BLEE 2000, abarcando 40 hospitales distribuidos en la geografía española, ponen de manifiesto que más del 50% de las cepas de E. coli productoras de BLEE tienen su origen en la comunidad 6. En otro estudio, Bou et al 15 han comunicado que 7 de 30 pacientes en los que se aislaron cepas productoras de BLEE nunca habían tenido un contacto previo con el hospital. En la serie de Rodríguez-Baño et al 16, el 40% de las cepas de E. coli productor de BLEE fueron de origen comunitario, identificándose entre otros factores de riesgo de infección por estas cepas, el uso previo de fluorquinolonas, la diabetes, hospitalización previa y la ITU recurrente.
Aunque no se conocen con exactitud las razones, las cepas de E. coli productoras de BLEE se encuentra con mayor frecuencia en pacientes no hospitalizados mientras que las cepas de K. pneumoniae productoras de BLEE son más prevalentes en hospitales, causando brotes epidémicos o situaciones de endemia en determinadas áreas hospitalarias 17,18.
El perfil de multirresistencia a antibióticos que expresan estas cepas ocasiona un problema terapéutico importante, tanto en el ámbito hospitalario como en la comunidad.
En el caso de las ITU comunitarias, las tasas de resistencia encontradas para ciprofloxacino y SxT, muy superiores al 20% (tabla 1), desaconsejan el empleo de estos antibióticos como tratamiento empírico en los casos en que por las características del paciente, pueda sospecharse una infección de esta etiología 19. No hay datos concluyentes sobre el empleo de amoxicilina-ácido clavulánico en el tratamiento de las infecciones producidas por cepas productoras de BLEE, sensibles in vitro a esta combinación 20,21 y aunque en el caso de las ITU, es muy probable que consiga la curación clínica y bacteriológica, las tasas de resistencia en E. coli, superiores al 10%, limitan también su uso como tratamiento empírico.
Fosfomicina trometamol se considera un antibiótico de primera línea para el tratamiento de la ITU no complicada ya que mantiene una excelente actividad frente a E. coli que representa el principal agente causal de estas infecciones. En diferentes estudios nacionales, la tasa de resistencia de E. coli a fosfomicina se sitúa alrededor del 2%, muy inferior a la de otros antibióticos tradicionalmente recomendados en el tratamiento de las ITU comunitarias, como cotrimoxazol y quinolonas 9,22.
En este estudio, ninguna cepa de E. coli productor de BLEE resultó resistente a fosfomicina y sólo una cepa entre las 290 estudiadas se catalogó como intermedia (CIM de 128 mg/ml). Entre las cepas de K. pneumoniae 128 de las 138 estudiadas (92,8%) resultaron sensibles a fosfomicina (CIM ≤64 μg/ml). Estos resultados son similares a los descritos para cepas no productoras de BLEE 9-11,22,23.
La baja tasa de resistencia a fosfomicina podría explicarse por su uso exclusivo en humanos y su única indicación como tratamiento en monodosis de la ITU no complicada, que dificulta la aparición de mutantes resistentes o la diseminación de resistencia mediada por plásmidos 10,24.
Se ha descrito la diseminación clonal de cepas de E. coli resistente a cotrimoxazol en la comunidad 25, sin embargo, en nuestro medio, al igual que sucede entre los aislamientos de E. coli productores de BLEE estudiados, no parece existir relación clonal entre las cepas de E. coli resistentes a cotrimoxazol 26. Posiblemente, la diseminación de estos mecanismos de resistencia está en relación con la transmisión vehiculizada por plásmidos en lugar de la diseminación de clones. Por el contrario, las cepas de K. pneumoniae productoras de BLEE, aisladas en el mismo ámbito, son cepas genéticamente relacionadas con un grupo mayoritario que incluye más del 80% de los aislamientos.
Nuestro estudio demuestra que fosfomicina mantiene su actividad frente a cepas productoras de diferentes familias y tipos de BLEE y, de momento, no existe resistencia cruzada con otros grupos de antimicrobianos, lo que convierte a este antimicrobiano en una buena alternativa para el tratamiento de la ITU comunitaria causada por estos patógenos multirresistentes.
Agradecimientos
Este estudio se ha realizado bajo los auspicios científicos de La Red Española de Patología Infecciosa (REIPI, Instituto de Salud Carlos III, Madrid).
Los autores expresan su agradecimiento al GEIH por su colaboración en la colección de las cepas y al Grupo Zambon por su colaboración en la financiación del estudio.
Correspondencia:
Dra. M. de Cueto.
Servicio de Microbiología. Hospital Universitario Virgen Macarena.
Avda. Dr. Fedriani, s/n. 41008 Sevilla. España.
Correo electrónico: m@marinadecueto.e.telefonica.net
Manuscrito recibido el 25-1-2006; aceptado el 24-5-2006.