Los niños que son sometidos a quimioterapia en el contexto de un cáncer presentan necesidades especiales de vacunación una vez finalizado el tratamiento. El objetivo de este trabajo es evaluar la adaptación de los calendarios de vacunación posquimioterapia en una población pediátrica.
MétodoEstudio observacional de una cohorte retrospectiva. Se incluyeron todos los niños entre 0 y 14 años que recibieron quimioterapia en un hospital de tercer nivel entre 2009 y 2015. Se aplicaron criterios de inclusión/exclusión. Se siguieron las indicaciones oficiales del Comité Asesor de Vacunas de la Asociación Española de Pediatría para estas situaciones. Se consultó el registro de vacunación de Atención Primaria y el de la Unidad de Vacunas del Servicio de Medicina Preventiva y Salud Pública del centro sanitario.
ResultadosDe los 99 niños que recibieron quimioterapia, se incluyeron en el estudio 51. El 70,6% fueron varones. El 54,9% padecían un tumor de órgano sólido y el 45,1% un tumor hematológico. El 70,6% tenía registrada alguna vacuna tras el tratamiento. Las vacunas administradas con mayor frecuencia fueron: difteria-tétanos-tosferina o difteria-tétanos (54,9%), meningococo C (41,2%) y la gripe estacional (39,2%). La tasa de adaptación de calendario posquimioterapia fue del 9,8%. La vacuna frente a neumococo conjugada 7v o 13v fue administrada en el 21,6% de los niños evaluados, sin embargo, solo se completó con polisacárida 23v en el 17,6% de los casos. Ninguno recibió vacunación frente a hepatitis A. No se encontraron diferencias estadísticamente significativas entre el cumplimiento del calendario y el tipo de tumor (p=0,066), el sexo (p=0,304) o la edad (p=0,342).
ConclusiónExiste un importante margen de mejora en la adaptación de la vacunación posquimioterapia en niños con cáncer. La participación de los profesionales en programas de formación y la derivación de estos pacientes a las Unidades de Vacunas podría mejorar la tasa de adaptación garantizando una correcta inmunización en estos niños.
Children undergoing chemotherapy for cancer have special vaccination needs after completion of the treatment. The aim of this study was to evaluate the adaptation of post-chemotherapy vaccination schedules.
MethodAn observational study was performed on a retrospective cohort that included all children aged from 0 to 14 years, who completed chemotherapy in a tertiary hospital between 2009 and 2015. Inclusion and exclusion criteria were applied. Immunisation was administered in accordance with the guidelines of the Vaccine Advisory Committee of the Spanish Association of Paediatrics. Primary Care immunisation and clinical records of the Preventive Medicine and Public Health Department were reviewed.
ResultsOf the 99 children who had received chemotherapy, 51 (70.6% males) were included in the study. As regards the type of tumour, 54.9% had a solid organ tumour, and 45.1% had a haematological tumour. Post-chemotherapy immunisation was administered to 70.6%. The most common vaccines received were: diphtheria-tetanus-pertussis or diphtheria-tetanus (54.9%), meningococcus C (41.2%), and seasonal influenza (39.2%). The rate of adaptation of the immunisation schedule after chemotherapy was 9.8%. The pneumococcal conjugate vaccine against 7v or 13v was administered to 21.6% of study subjects. However, only 17.6% received polysaccharide 23v. None received vaccination against hepatitis A. No statistically significant differences were observed between adherence to immunisation schedules and type of tumour (P=.066), gender (P=.304), or age (P=.342).
ConclusionPost-chemotherapy immunisation of children with cancer is poor. The participation of health professionals in training programs and referral of paediatric cancer patients to Vaccine Units could improve the rate of schedule adaptation and proper immunisation of this population.
A día de hoy, las vacunas son la principal estrategia preventiva contra las enfermedades infectocontagiosas1. Los programas sistemáticos de vacunación infantil han supuesto la erradicación de enfermedades como la viruela y el control de la polio a nivel mundial2.
Cada vez son mayores las necesidades de vacunación en situaciones especiales de la población tanto pediátrica como adulta debido al incremento en los últimos años de personas con alteraciones del sistema inmunitario3. De esta forma, el paciente inmunocomprometido precisa la elaboración de un calendario de inmunización individualizado que variará fundamentalmente según la enfermedad de base, los tratamientos aplicados y el estado inmunológico4.
A nivel mundial se calcula que más de 250.000 niños son diagnosticados de cáncer cada año, de los cuales, se estima que 90.000 morirán de la enfermedad5. En España, según el Registro Español de Tumores Infantiles la incidencia de cáncer infantil es de 155,5 casos nuevos anuales por millón de niños/as entre 0 y 14 años6. Actualmente, la mortalidad por cáncer en la edad pediátrica ha disminuido más del 50% desde los años sesenta7. La quimioterapia suele ser el tratamiento de elección en este tipo de enfermedades. Sus efectos secundarios dependen del tipo de fármaco, la dosis y la duración, pero en general, estos tratamientos provocan una situación importante de inmunodepresión8–10. En los últimos años los tratamientos con quimioterapia se han intensificado, produciendo una gran inmunodepresión en los pacientes y aumentando el riesgo de perder la inmunidad frente a vacunas administradas previas11. Así pues, una vez finalizado el tratamiento estos pacientes presentarán necesidades especiales de vacunación pudiendo responder adecuadamente gracias a la recuperación completa de la inmunidad humoral, así como de la memoria inmunitaria12.
Por todo lo anterior, es pertinente el objetivo principal de la presente investigación que consiste en evaluar la adaptación del calendario de vacunación de los niños que recibieron quimioterapia entre 2009 y 2015 en un hospital autonómico de referencia. El objetivo secundario es conocer si existen diferencias en la vacunación según el tipo de tumor.
MétodosÁmbito de estudioLa investigación se ha realizado en un hospital de tercer nivel cuyo porcentaje de ocupación es superior al 80% a lo largo de todo el año. En la atención de niños oncológicos intervienen los Servicios de Oncología Pediátrica y Hematología. El primero se encarga de los pacientes con tumores de órgano sólido (TOS) mientras que el segundo lo hace de los que presentan tumores hematológicos (TH). De manera ambulatoria, los niños oncológicos reciben quimioterapia en el Hospital de Día.
Tipo de estudioSe ha realizado un estudio observacional de una cohorte retrospectiva.
Criterios de inclusión/exclusiónSe incluyeron todos los niños entre 0 y 14 años de edad que recibieron quimioterapia en el hospital entre el 1 de enero de 2009 y el 30 de septiembre de 2015 diagnosticados de TOS o TH.
Los criterios de exclusión fueron:
- a)
haber recibido un trasplante de progenitores hematopoyéticos;
- b)
recibir quimioterapia de forma activa en el momento de la evaluación;
- c)
haber finalizado la quimioterapia en los 3 últimos meses del período de evaluación;
- d)
estar recibiendo tratamiento paliativo;
- e)
pertenecer a otra comunidad autónoma;
- f)
exitus antes de la finalización de la quimioterapia o en los primeros 3 meses desde la finalización;
- g)
recaer en los 3 primeros meses desde la finalización de la quimioterapia con nuevo inicio de tratamiento.
Por un lado, se utilizó el Manual de vacunas on-line del Comité Asesor de Vacunas de la Asociación Española de Pediatría como principal documento de referencia8. Este documento señala que:
- -
En el caso de niños con cáncer que hayan completado la primoinmunización con anterioridad a la administración de la quimioterapia, se recomienda administrar una dosis de refuerzo de todas las vacunas del calendario (a partir de los 3 meses en el caso de las vacunas inactivadas y a partir de los 6 meses en el caso de las atenuadas). Posteriormente, se deberá continuar con el calendario vacunal según la edad del niño.
- -
En el caso de los niños que, por el contrario, no hayan completado la primoinmunización antes de iniciar el tratamiento con quimioterapia, la recomendación será llevar a cabo la revacunación completa en función de la edad del niño.
La tabla 1 muestra un esquema de las pautas de vacunación en niños con cáncer siguiendo las instrucciones anteriores.
Pautas de vacunación en niños con cáncer, según el momento de diagnóstico del mismo
| Vacunas | Primoinmunización NO completada prequimioterapia | Primoinmunización completada prequimioterapia |
|---|---|---|
| Vacunas vivas-atenuadas | ||
| Triple vírica (puede ser administrada tras 6 meses sin QT) | 2 dosis separadas por 3 meses entre sí | Una dosis de refuerzo |
| Varicela (puede ser administrada tras 6 meses sin QT. En caso de niños con leucemia podría ser administrada tras 12 meses de remisión, con linfocitos>700 y plaquetas>100.000. En este caso la QT deberá suspenderse una semana antes de la vacuna y no retomarla hasta 1 semana después) | ||
| Vacunas muertas-inactivadas (tras 3 meses sin QT) | ||
| Difteria-tétanos | Revacunación completa según la edad del niño | Una dosis de refuerzo . |
| Tos ferina | ||
| Polio inactivada | ||
| H. influenzae b | ||
| Hepatitis B | ||
| Meningococo | ||
| Neumococo | ||
| Gripe estacional (si hay brote de gripe en la comunidad puede llevarse a cabo tan pronto como un mes después de la finalización de la quimioterapia). | Se recomienda la vacunación anual frente a la gripe si el niño es mayor de 6 meses de edad. | |
| Hepatitis A | 2 dosis separadas por un mínimo de 6 meses entre sí | |
Adaptada a partir de: (1) Moreno Pérez D, Nuñez Cuadros E. Vacunación en niños inmunodeprimidos o con tratamiento inmunosupresor. En: Asociación Española de Pediatría. Manual de la AEP 2012 de bolsillo. Madrid. Exlibris ediciones; 2012. 75-82. (2) Comité Asesor de Vacunas. Vacunación en niños inmunodeprimidos o con tratamiento inmunosupresor. Manual de vacunas en línea de la AEP [internet]. Madrid: AEP; 2015 [actualizado en agosto 2015; acceso 15 de febrero de 2016]. Disponible en: http://vacunasaep.org/documentos/manual/cap-14
Se entiende por primoinmunización o primovacunación «serie de dosis de un mismo producto biológico natural que se ha de administrar a una persona susceptible para que consiga una inmunidad adecuada frente a la infección que se quiere prevenir». También puede denominarse inmunización primaria13.
Por otro lado, se solicitaron a la Consejería de Salud y Servicios Sanitarios los calendarios de vacunación sistemática infantil históricos de la comunidad autónoma de estudio.
Por último, se consultó el registro de vacunación de Atención Primaria a través de la historia clínica electrónica así como el registro de vacunación de la Unidad de Vacunas del servicio de Medicina Preventiva y Salud Pública del centro.
b)Estrategia de evaluaciónLa evaluación se llevó a cabo siguiendo los pasos que se describen a continuación:
- 1)
Cada niño fue evaluado según el calendario de vacunación sistemático infantil correspondiente a su fecha de nacimiento.
- 2)
Se valoró la necesidad de administración de dosis de refuerzo o revacunación completa según la edad y la fecha de inicio de quimioterapia.
- 3)
Se estableció una relación entre las vacunas requeridas según los criterios anteriores y las vacunas registradas en la historia clínica electrónica de Atención Primaria o la Unidad de Vacunas del centro y que hubieran sido administradas a partir de los 3 meses de la finalización del tratamiento quimioterápico en el caso de las vacunas inactivadas y 6 meses para las vivas.
- 4)
Para la evaluación de la vacunación frente a varicela se tuvo en cuenta si existía algún registro médico de haber padecido esta enfermedad en la infancia o si tras la finalización de quimioterapia había pruebas de laboratorio que confirmaran títulos protectores de anticuerpos (Inmunoglobulina G varicela>150UA/ml).
- 5)
Para la evaluación de la vacunación frente a virus del papiloma humano en niñas se tuvo en cuenta la fecha de nacimiento y la edad en la que se finalizó la quimioterapia ya que esta vacuna fue introducida en el calendario sistemático infantil autonómico en el año 2009 correspondiendo a las niñas que habían nacido en 1995.
Se calculó la tasa de adaptación de calendario tras quimioterapia medido en términos de «% de calendarios adaptados=(N.o calendarios correctos entre 2009 y 2015/N.o total de niños evaluados entre 2009 y 2015)×100». Se entiende por calendario correcto aquel que refleje la administración del 100% de las vacunas indicadas según el año de nacimiento y la necesidad de refuerzo o revacunación.
Se calculó la tasa de cumplimiento según el tipo de vacuna en términos de «% de adaptación vacuna X=(N. o de niños que recibieron la vacuna X entre 2009 y 2015/N.o total de niños en los que estaba indicada la administración de la vacuna X entre 2009 y 2015)×100».
A pesar de que la vacuna conjugada 13v frente a neumococo se incorporó al calendario de vacunación sistemático infantil autonómico en el año 2015 se consideró relevante tenerla en cuenta en el cálculo de la tasa de cumplimiento según el tipo de vacuna ya que está indicada en niños o adultos de cualquier edad que reciban tratamiento quimioterápico o inmunosupresor8,14. Igualmente se evaluó la vacuna polisacárida 23v frente a neumococo en estos pacientes debido a que se recomienda su administración en niños a partir de los 2 años de edad en situaciones especiales15.
Por último, la vacuna frente a hepatitis A deberá ser administrada en estos niños debido a que muchos de los tratamientos inmunosupresores muestran diverso grado de hepatotoxicidad por lo que la infección durante el tratamiento podría ser grave8.
Aspectos éticosEl estudio fue aprobado por el Comité Ético de la Investigación autonómico (N.o 130/15) y se puso en conocimiento de la Fiscalía de Menores.
Análisis estadísticoSe realizó estadística descriptiva de cada variable (análisis univariante), expresando las frecuencias absolutas y relativas de las variables cualitativas investigadas. Se calculó la media como medida de tendencia central así como la desviación típica. Se realizó análisis bivariante para conocer si las variables de estudio seleccionadas tenían o no asociación. Para las variables cualitativas se aplicó el test exacto de Fisher y la prueba Xi-cuadrado. Se utilizó la prueba no paramétrica U de Mann-Whitney debido a que las variables cuantitativas analizadas no seguían una distribución normal según la prueba de Shapiro-Wilks (p<0,001 en los 4 criterios de evaluación y en la evaluación total) y el tamaño muestral era inferior a 30 sujetos en uno de los grupos. Se consideró estadísticamente significativo si p<0,05. Se utilizó el programa Statistical Package for the Social Sciences versión 18.0.
ResultadosDescripción general de la muestraSe han identificado un total de 99 niños que recibieron quimioterapia entre enero de 2009 y septiembre de 2015. De ellos, 48 fueron excluidos tras la aplicación de los criterios de exclusión, siendo las principales causas: exitus antes de la finalización del tratamiento o en los primeros 3 meses tras el mismo (35,41%), trasplante de progenitores hematopoyéticos (29,16%), quimioterapia activa o en los últimos 3 meses (27,08%), pertenencia a otra comunidad autónoma (6,25%) y tratamiento paliativo (2,08%). La muestra final de estudio se compuso de 51 niños de los cuales, en el momento del diagnóstico, el 33,3% estaba en edades comprendidas entre 0 y 4 años, el 39,4% entre 5 y 9 años y el 27,3% entre 10 y 14 años de edad.
La descripción general fue la siguiente: el 70,6% (36) eran hombres y el 29,4% (15) mujeres; el 54,9% (28) representaban TOS y el 45,1% (23) TH. La media y desviación típica de edad de diagnóstico y de inicio de quimioterapia fue 7,5 años (±4,3) y 7,6 años (±4,3), respectivamente. No se encontraron diferencias significativas entre ambas edades y el tipo de tumor (p=0,080; p=0,127).
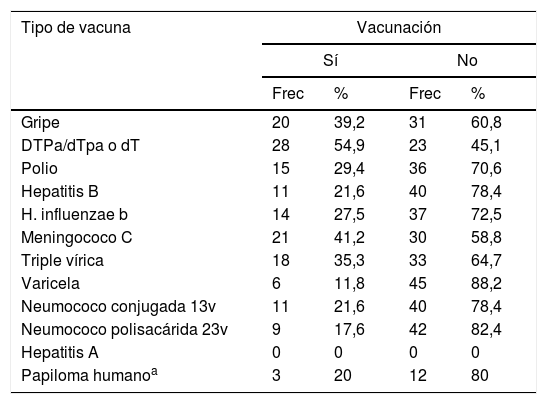
Descripción general de las vacunas registradasEn cuanto a la vacunación posquimioterapia, el 70,6% (36) tenían registrada la administración de alguna vacuna una vez finalizado el tratamiento mientras que el 29,4% (15) no disponían de ningún tipo de registro de vacunación tras la inmunosupresión. En ninguno de estos casos se encontró documentado en la historia clínica el motivo de no vacunación. La tabla 2 muestra que, en función de la edad, la vacuna difteria-tétanos-tosferina (DTPa/dTpa) o difteria-tétanos (dT) fue la más administrada (54,9%), seguida de la vacuna frente a meningococo C (41,2%) y la gripe estacional (39,2%).
Frecuencia y porcentaje de vacunación según el tipo de vacuna
| Tipo de vacuna | Vacunación | |||
|---|---|---|---|---|
| Sí | No | |||
| Frec | % | Frec | % | |
| Gripe | 20 | 39,2 | 31 | 60,8 |
| DTPa/dTpa o dT | 28 | 54,9 | 23 | 45,1 |
| Polio | 15 | 29,4 | 36 | 70,6 |
| Hepatitis B | 11 | 21,6 | 40 | 78,4 |
| H. influenzae b | 14 | 27,5 | 37 | 72,5 |
| Meningococo C | 21 | 41,2 | 30 | 58,8 |
| Triple vírica | 18 | 35,3 | 33 | 64,7 |
| Varicela | 6 | 11,8 | 45 | 88,2 |
| Neumococo conjugada 13v | 11 | 21,6 | 40 | 78,4 |
| Neumococo polisacárida 23v | 9 | 17,6 | 42 | 82,4 |
| Hepatitis A | 0 | 0 | 0 | 0 |
| Papiloma humanoa | 3 | 20 | 12 | 80 |
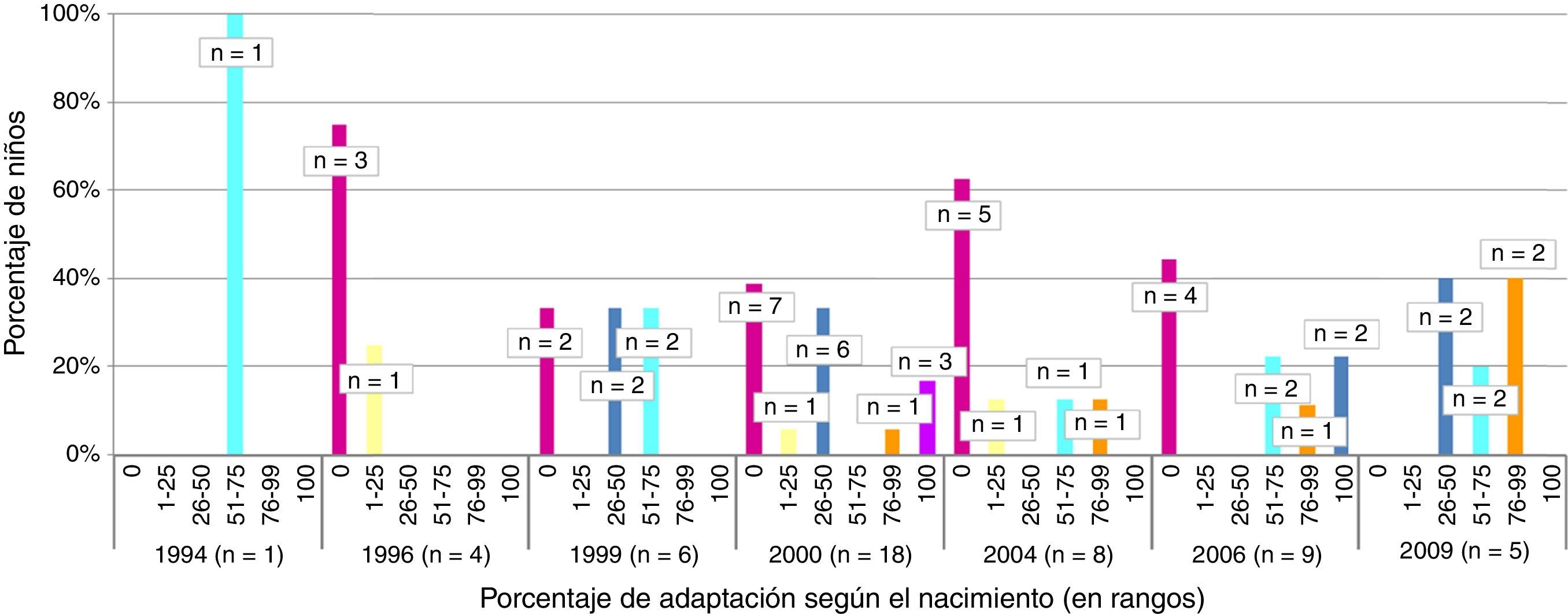
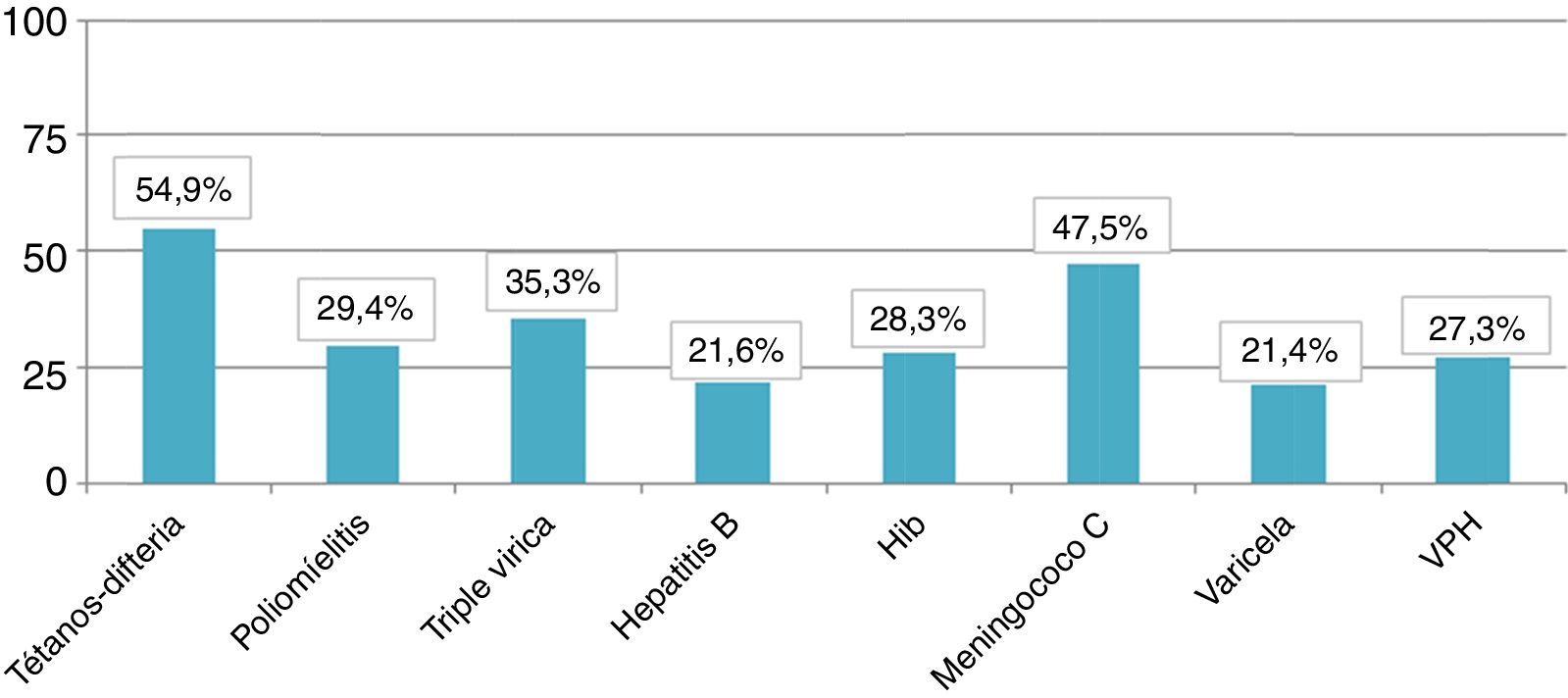
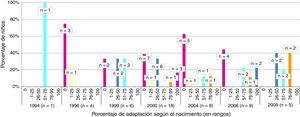
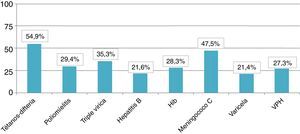
El número total de niños que presentaron una correcta adaptación del calendario sistemático de vacunación tras la quimioterapia fue 5, lo que supuso una tasa de adaptación del calendario posquimioterapia del 9,8%. En la figura 1 se observa el porcentaje de adaptación de vacunación sistemática tras quimioterapia (en rangos de 25) según el calendario de vacunación correspondiente por año de nacimiento así como el número absoluto de niños en cada grupo. La figura 2 muestra la tasa de cumplimiento según el tipo de vacuna y la indicación por año de nacimiento. Solo la vacuna frente a DTPa/dTpa o dT superó el 50% de cumplimiento según la indicación, seguida de meningococo C (47,5%) y triple vírica (35,3%).
En 3 de los 51 niños evaluados el diagnóstico de cáncer se realizó antes del año de edad por lo que la primovacunación no fue completada y la indicación fue la revacunación de acuerdo con su edad en el momento de finalización de la quimioterapia. De ellos, ninguno registraba una correcta adaptación del calendario de vacunación.
No se encontraron diferencias significativas entre la adaptación del calendario y el tipo de tumor (p=0,066), el sexo del paciente (p=0,304) o la edad en rangos (p=0,342).
Vacunación frente a varicelaEsta vacuna fue incluida en el calendario de vacunación sistemático infantil de la comunidad autónoma de estudio en el año 2006. El número de niños evaluados con indicación de vacunación fue 14, sin embargo, solo 3 (21,4%) recibieron la vacuna. De los 11 restantes, solo 2 (18,1%) presentaban Inmunoglobulina G (+) tras la finalización de la quimioterapia; el resto no mostraban pruebas de laboratorio y tampoco documentación médica de haber padecido la enfermedad.
Vacunación frente a papiloma humanoEsta vacuna fue introducida en el calendario sistemático infantil autonómico en el año 2009 correspondiendo a las niñas que habían nacido en 1995. De las 15 niñas evaluadas, 11 (73,3%) presentaban indicación de vacunación frente al virus del papiloma humano teniendo en cuenta el año de nacimiento y la edad en el momento de la finalización de la quimioterapia. Sin embargo, se observó que solo 3 (26,6%) recibieron dicha vacuna.
Vacunación frente a neumococoLa vacunación sistemática frente a neumococo fue incluida en el calendario infantil para los nacidos a partir del 1 de enero de 2015 en la comunidad autónoma del estudio, por tanto, la indicación de vacunación en estos pacientes no se vinculó al calendario sino a la condición de inmunodeprimido. De esta forma, la vacuna frente a neumococo conjugada 7v o 13v fue administrada en el 21,6% de los niños, sin embargo, solo se completó con la vacuna polisacárida 23v en el 17,6% de los casos.
Vacunación frente a hepatitis ANingún niño recibió vacunación frente a hepatitis A tras la finalización del tratamiento.
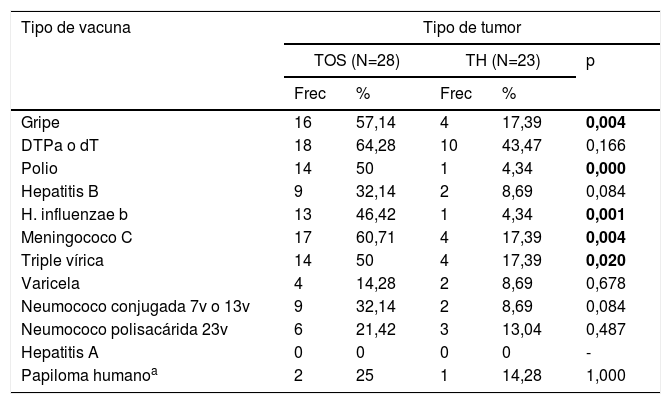
Vacunas recibidas según el tipo de tumorSe encontraron diferencias estadísticamente significativas entre la vacunación posquimioterapia de los niños con TOS y TH para algunas vacunas, siendo más favorable para los niños con TOS (tabla 3).
Frecuencia, porcentaje y p-valor de vacunación según el tipo de vacuna y tipo de tumor. 1=calculado sólo para el grupo de mujeres (TOS N=8; TH N=7)
| Tipo de vacuna | Tipo de tumor | ||||
|---|---|---|---|---|---|
| TOS (N=28) | TH (N=23) | p | |||
| Frec | % | Frec | % | ||
| Gripe | 16 | 57,14 | 4 | 17,39 | 0,004 |
| DTPa o dT | 18 | 64,28 | 10 | 43,47 | 0,166 |
| Polio | 14 | 50 | 1 | 4,34 | 0,000 |
| Hepatitis B | 9 | 32,14 | 2 | 8,69 | 0,084 |
| H. influenzae b | 13 | 46,42 | 1 | 4,34 | 0,001 |
| Meningococo C | 17 | 60,71 | 4 | 17,39 | 0,004 |
| Triple vírica | 14 | 50 | 4 | 17,39 | 0,020 |
| Varicela | 4 | 14,28 | 2 | 8,69 | 0,678 |
| Neumococo conjugada 7v o 13v | 9 | 32,14 | 2 | 8,69 | 0,084 |
| Neumococo polisacárida 23v | 6 | 21,42 | 3 | 13,04 | 0,487 |
| Hepatitis A | 0 | 0 | 0 | 0 | - |
| Papiloma humanoa | 2 | 25 | 1 | 14,28 | 1,000 |
La necesidad de adaptar los calendarios de vacunación a poblaciones de riesgo es cada vez mayor. Esto incluye a niños y adultos en situaciones especiales y/o enfermedades crónicas con o sin inmunodepresión3,4. En general, se ha establecido que el momento del diagnóstico de la enfermedad es el más idóneo para la realización de dicha actualización, ya que la respuesta inmunológica a las vacunas es mayor16.
En concreto, los pacientes de edad pediátrica que han sido sometidos a tratamiento quimioterápico constituyen una población de riesgo17. La adaptación del calendario de vacunación infantil siguiendo las recomendaciones oficiales se convierte en una herramienta preventiva importante ya que puede determinar en gran medida su morbimortalidad4,17,18. Debe tenerse en cuenta, además, que nuestro país registra una población inmigrante y refugiada cada vez mayor y, por tanto, también lo son las bolsas de personas no inmunizadas frente a varicela y sarampión, por ejemplo. Esto supone una dilución de la inmunidad de rebaño lo que aumenta el riesgo de enfermar en personas inmunodeprimidas19.
En la presente investigación se observa que el porcentaje de calendarios correctamente adaptados tras la quimioterapia no alcanzó el 10%. A pesar de ser numerosos los trabajos que versan sobre esta población de riesgo y las necesidades de adaptación vacunal4,8 son escasos los trabajos publicados que abordan las coberturas vacunales en población pediátrica en situaciones especiales20 y menos aún los que evalúan la adaptación de estos calendarios en niños que han recibido quimioterapia.
En cuanto al cumplimiento según el tipo de vacuna, las 3 más frecuentemente administradas fueron la vacuna frente a meningococo C, la DTPa/dTpa o dT y la antigripal estacional. Por un lado, en el caso de la antimeningocócica C podría explicarse en relación con la introducción de esta vacuna en el calendario sistemático infantil de la comunidad autónoma en el año 2000 en relación con un brote epidémico en el año anterior21; así pues, esta vacuna se encuentra altamente arraigada entre los sanitarios. Igualmente, la DTPa/dTpa o dT es habitual que se administre con motivo de accidentes domésticos22. Por último, debido a las importantes consecuencias que puede tener la infección por el virus de la gripe en estos pacientes, la vacuna inactivada antigripal estacional ha sido una de las más estudiadas23. Esta se ha considerado segura e inmunógena en este grupo24,25 a pesar de que algunos autores han encontrado coberturas inferiores al 25% en niños con condiciones de riesgo20.
Las vacunas sistemáticas frente a varicela y virus del papiloma humano fueron las que registraron la menor tasa de cumplimiento. En el momento de la investigación se consideraba que la primera debería administrarse a los 10 años de edad siempre y cuando el niño no la haya recibido previamente o no haya pasado la enfermedad. Cabe pensar que el hecho de que solamente el 11,5% de los niños evaluados hayan recibido esta vacuna podría deberse a que existe un importante infrarregistro en la historia clínica de haber cursado la enfermedad o una escasa preocupación por parte de los profesionales hacia la verificación serológica de títulos protectores de anticuerpos tras la quimioterapia. En el caso de la vacuna frente a virus del papiloma humano y su indicación de administración a los 13 años de edad según el calendario autonómico, el bajo cumplimiento podría deberse a que las niñas que han terminado la quimioterapia después de los 14 años dejan de ser atendidas por el pediatra en el ámbito de la Atención Primaria pasando al médico de familia quien probablemente se encuentre menos sensibilizado hacia esta vacuna en la edad infantil. La vacuna frente a hepatitis A no fue administrada en ninguno de los pacientes debido quizá al desconocimiento por parte de los profesionales del riesgo de complicaciones en caso de infección durante y posquimioterapia.
Son numerosos los autores que en los últimos años han demostrado los beneficios de la vacunación antineumocócica en pacientes de riesgo26–28. Tanto es así que se conoce que en niños con cáncer la administración de 2 dosis frente a neumococo conjugada de 7 serotipos ofrece entre el 86% y el 100% de anticuerpos protectores29. A pesar de lo anterior, en la presente investigación se ha observado una cobertura del 21,6% para la vacuna neumococo conjugada de 7 o 13 serotipos y del 17,6% para la polisacárida de 23 serotipos.
Los resultados del presente estudio indican mayor frecuencia de administración de alguna de las vacunas en los niños con TOS en comparación con los niños con TH. A día de hoy, se desconoce el motivo principal de esta variabilidad, sin embargo, podría deberse al tipo de especialista que realiza el seguimiento. Esto es, los niños con TOS tienen seguimiento por parte de pediatras mientras que los niños con TH son seguidos por hematólogos, lo que podría dar lugar a que estos últimos confíen en que posteriormente será el equipo de pediatría quien se encargue de la adaptación de la vacunación de estos pacientes. No obstante, ninguno de los grupos destaca por tener una mejor tasa de adaptación de calendario.
Para terminar, cabe decir que este trabajo no se encuentra exento de limitaciones. Por un lado, tras la aplicación de los criterios de exclusión se han evaluado un total de 51 niños de los 99 que fueron inicialmente seleccionados. No cabe duda de que la muestra podría haber sido mayor si se hubiera ampliado el rango temporal, sin embargo, no se disponen de registros hospitalarios rigurosos previos a esas fechas. Por otro lado, podría ser que hubiera un infrarregistro en la historia clínica electrónica de Atención Primaria o en la Unidad de Vacunas hospitalaria, sin embargo, y teniendo en cuenta los registros de vacunación sistemática infantil pensamos que no ha sido el caso.
En conclusión, existe un escaso cumplimiento en la adecuación del calendario de vacunación de niños que han recibido quimioterapia. La implicación del responsable médico hospitalario y de Atención Primaria en la actualización de la inmunización posquimioterapia es fundamental para el aumento de las coberturas vacunales postratamiento en este grupo de riesgo. La comunicación entre ambos así como con el médico de familia cuando el paciente se encuentra en edades limítrofes facilitaría la cumplimentación de la vacunación pendiente, en caso de ser necesario. Además, la derivación de estos niños a la Unidad de Vacunas de los Servicios de Medicina Preventiva y Salud Pública garantizaría una correcta continuidad de los cuidados médicos y de enfermería en estos aspectos al proporcionar un seguimiento estrecho de la inmunización del niño a lo largo del proceso tumoral (programación de la vacunación en términos de momento ideal, número de dosis, verificación serológica posterior, registro documental, etc.). La formación continuada en vacunas debe tener una presencia constante en el ámbito sanitario.
FinanciaciónEste trabajo no ha sido financiado por ninguna entidad pública o privada.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.