El cáncer de ano (CA) es uno de los tumores no definitorios de sida más frecuentes, principalmente en hombres que tienen sexo con hombres y mujeres infectadas por VIH.
ObjetivosEvaluar la prevalencia e incidencia de lesiones precursoras (HSIL) y CA en nuestra cohorte de mujeres, y compararlas con las de cérvix; analizar el porcentaje de pacientes que adquieren y aclaran genotipos oncogénicos (VPH-AR) del canal anal; y los factores predictores para dicha infección en ano.
Paciente y métodosEstudio prospectivo-longitudinal (mayo de 2012-diciembre de 2016). En visita basal (V1) y posteriores se tomaban muestras de mucosa anal en medio líquido para citología, y PCR del VPH. En caso de citología anal patológica y/o PCR del VPH-AR positiva se realizaba anoscopia de alta resolución. Además, se enviaban al ginecólogo.
ResultadosNoventa y cinco mujeres de 43,7años fueron incluidas. En V1, el 11,6% tenían patología cervical (4,1% CIN1; 2,2% CIN2/3; 1,1% cáncer de cérvix [CC]); el 64,3% presentaban patología anal (50% LSIL/AIN1, 9,5% HSIL/AIN2/3 y 2,4% CA) y el 49,4%, infección por VPH-AR. Durante 36meses de seguimiento la incidencia de HSIL anal fue de 16×1.000 persona-año; el 14,8% adquirieron VPH-AR y el 51,2% los aclararon, p=0,007; ninguna presentó CIN1/2/3 o CC. En el análisis multivariante encontramos como factores predictores de infección por VPH-AR: tabaquismo (RR: 1,55; IC95%: 0,99-2,42), número de parejas sexuales >3 (RR: 1,69; IC95%: 1,09-2,62), displasia cervical (RR: 1,83; IC95%: 1,26-2,67) y anal (RR: 1,55; IC95%: 1,021-2,35).
ConclusionesA pesar de que el aclaramiento de genotipos oncogénicos en ano era mayor que la adquisición, la prevalencia e incidencia de HSIL era elevada, y superior a la de cérvix, por lo que quizá debería ofertarse el cribado de dichas lesiones a todas las mujeres seropositivas.
Anal cancer is one of the most common non-AIDS defining malignancies, especially in men who have sex with men and women living with HIV (WLHIV).
ObjectivesTo evaluate the prevalence and incidence of precursor lesions (high-grade squamous intraepithelial lesions [HSIL]) and anal cancer in our cohort of women and to compare them to cervical lesions; to calculate the percentage of patients that acquire and clear oncogenic genotypes (HR-HPV) in the anal canal; and to determine predictive factors for anal HPV infection.
Patients and methodsProspective-longitudinal study (May 2012-December 2016). At baseline (V1) and follow up visits, anal mucosa samples were taken in liquid medium for cytology and HPV PCR. In cases of abnormal anal cytology and/or positive HR-HPV PCR results, a high resolution anoscopy was performed. Patients were also referred to the gynaecologist.
ResultsNinety five women with an average age of 43.7years were included. At baseline, 11.6% had cervical abnormalities (4.1% CIN1, 2.2% CIN2/3, 1.1% cervical cancer), 64.3% anal abnormalities (50% LSIL/AIN1, 9.5% HSIL/AIN2/3 and 2.4% anal cancer) and 49.4% had HR-HPV genotypes. During 36months of follow up, the incidence of anal HSIL was 16×1,000 person-years; 14.8% acquired HR-HPV genotypes and 51.2% cleared them, P=.007. No patients presented CIN1/2/3/ or cervical cancer. In the multivariate analysis we found the following predictive factors for HR-HPV infection: smoking (RR: 1.55, 95%CI: 0.99-2.42), number of sexual partners >3 (RR: 1.69; 95%CI: 1.09-2.62), cervical and anal dysplasia (RR: 1.83; 95%CI: 1.26-2.67) and (RR: 1.55; 95%CI: 1.021-2.35), respectively.
ConclusionsDespite clearance rates of anal oncogenic genotypes being higher than acquisition rates, prevalence and incidence of HSIL were still high and greater than cervical HSIL. Therefore, screening for these lesions should perhaps be offered to all WLHIV.
El cáncer de ano (CA) en la actualidad es uno de los tumores no definitorios de sida más frecuente en los pacientes con infección por el VIH1, sobre todo en hombres que tienen sexo con hombres (HSH) y mujeres, teniendo estas últimas una incidencia muy superior a la de mujeres seronegativas2. El CA, así como el cáncer de cuello uterino (CC), han sido estrechamente relacionados con la infección por el virus del papiloma humano (VPH)3. El CC es una neoplasia definitoria de sida, y era la más frecuente en mujeres seropositivas antes de la introducción del tratamiento antirretroviral de alta eficacia (TAR); tras el TAR y la instauración de programas de cribado de CC se produjo una importante reducción en su incidencia4. En cuanto al efecto que el TAR podría ocasionar sobre la aparición de CA, ha sido considerado controvertido; en trabajos realizados durante el período previo a su administración o cercanos a su introducción se encontró un incremento en la incidencia, posiblemente en relación con el aumento de la supervivencia de los pacientes5-8. Sin embargo, en estudios más recientes realizados en HSH seropositivos se ha encontrado que el tratamiento antirretroviral podría ejercer cierto efecto protector frente a la presencia de lesión intraepitelial de alto grado o lesión precursora (HSIL) y CA9-11.
Por el momento, entre las diferentes sociedades científicas de VIH no existe consenso ni homogeneidad en las recomendaciones sobre el cribado de HSIL y CA, no solo en relación al procedimiento y técnica, sino en lo referente al tipo de paciente en el que se debe implementar12,13. En España, GESIDA, en su Documento de consenso sobre diagnóstico y tratamiento de las infecciones de transmisión sexual en adultos, niños y adolescentes de 2017, contempla la realización de citología anal en pacientes VIH positivos con condilomas, HSH y mujeres con displasia cervical12. La citología es la técnica más empleada en el cribado de HSIL y CA, pero esta herramienta tiene una sensibilidad variable y limitada, lo que se traduce en un porcentaje no despreciable de pacientes infradiagnosticados con dichas lesiones, como se demuestra en algunos estudios14-16.
Con este trabajo queremos evaluar la prevalencia e incidencia de HSIL y CA en nuestra cohorte de mujeres seropositivas (MVIH+), y compararlas con las de cérvix; así como analizar el porcentaje de mujeres que adquieren y aclaran la infección por genotipos oncogénicos del VPH en el canal anal y los factores predictores de la aparición de dichos genotipos en ano.
Pacientes y métodosDiseño: estudio prospectivo, longitudinal, unicéntrico, compuesto por MVIH+ incluidas de forma consecutiva, tras la firma del consentimiento informado, en un programa de cribado, diagnóstico, tratamiento y seguimiento de lesiones displásicas de mucosa anal (mayo de 2012-diciembre de 2016). Las pacientes procedían de la consulta de enfermedades infecciosas de un hospital español de tercer nivel. El estudio fue evaluado y aprobado por el comité ético del centro donde se obtuvieron las participantes. Criterios de inclusión: >18años, MVIH+. Criterios de exclusión: hombres con infección por el VIH y antecedentes de neoplasia de canal anal.
En la visita se explicaba a las pacientes las condiciones y los objetivos de la investigación, se les facilitaba un documento de consentimiento informado para su firma y se recogían datos epidemiológicos, clínicos y analíticos que fueron tratados siguiendo la ley de protección de datos vigente (Ley Orgánica 15/1999, de 13 de diciembre, de Protección de Datos de Carácter Personal).
En la visita basal (V1) y posteriores (Vx) se recogieron:
- -
Las variables clínico/epidemiológicas: edad, antecedentes de condilomas perianal-genital y patología cervical (CIN1/2/3, CC); sexo y número de parejas sexuales en los últimos 12meses y en toda su vida, sexo anal, uso de condón, tabaquismo, consumo de alcohol (unidades de bebida estándar [UBE]), adicción a drogas por vía parenteral (ADVP), nacionalidad, nivel de estudios, meses de diagnóstico de VIH, estadio del VIH según la clasificación CDC; meses en tratamiento antirretroviral (TAR), fracaso virológico (se consideró cuando había ARN-viral >50copias/ml en al menos dos determinaciones en 6 meses previos), uso de tratamiento concomitante. Otras infecciones: hepatopatía crónica por virus de la hepatitisB (VHB) o virus de la hepatitisC (VHC), serología luética positiva y otras enfermedades de transmisión sexual, e infección tuberculosa latente, tratada o activa.
- -
Las variables analíticas incluidas fueron linfocitos CD4 nadir, CD4 y carga viral al diagnóstico del VIH; CD4, CD8 y carga viral en el momento de inclusión en el estudio.
En V1 y Vx se procedía a la toma de 2 muestras de la mucosa del canal anal con un par de torundas de algodón impregnadas en suero fisiológico: una para la detección y genotipado del VPH mediante una reacción en cadena de la polimerasa (PCR) cualitativa (Linear Array HPV Genotyping Test), realizada con el termociclador GeneAmp PCR System 9700 (Applied Biosystems, Roche, Suiza), y la segunda para realización de citología; ambas muestras eran incluidas en medio líquido (liquid médium, Thin Layer Liquid); para el estudio citológico se empleó la técnica thin-layer (Procesador Thin Prep 2000, Hologic). Ambas muestras se enviaban al laboratorio de anatomía patológica, donde un mismo patólogo (JE) llevaba a cabo el dictamen de las citologías y la validación de resultados de la PCR del VPH. Los genotipos 16, 18, 26, 31, 33, 35, 39, 45, 51-53, 56, 58, 59, 66, 68, 73 y 82 fueron considerados de alto riesgo (VPH-AR). Los genotipos 6, 11, 34, 40, 42-44, 54, 55, 57, 61, 70-72, 81, 83, 84 y 89, de bajo riesgo (VPH-Br). Se clasificaron como subespecies del genotipo VPH18 los virus 39, 45, 59, 68, y del VPH16, los genotipos 31, 33, 35, 52, 58, 6717.
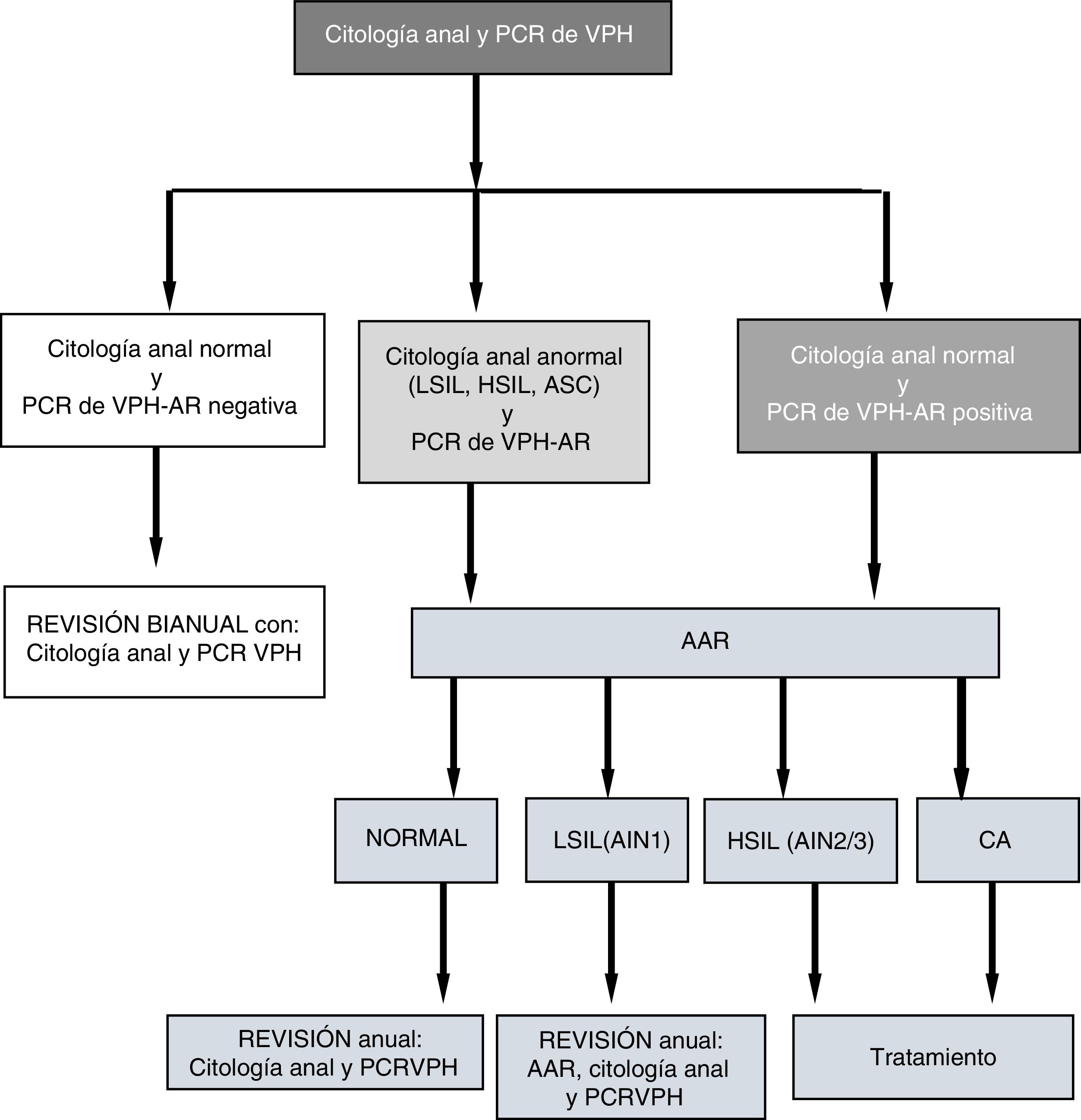
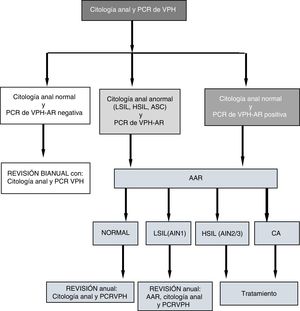
En las visitas (V1 y Vx) a las pacientes con citología anormal y/o PCR de VPH de alto riesgo (AR) positiva se les hacía anoscopia de alta resolución (AAR). Las pacientes con AAR normal y PCR VPH-AR negativa eran evaluadas bianualmente con nueva citología y PCR; aquellas con PCR del VPH positiva y/o AAR con LSIL (AIN1) se evaluaban anualmente; las diagnosticadas de HSIL o CA eran tratadas (fig. 1). El algoritmo de seguimiento (fig. 1) lo desarrollamos a partir de datos propios sobre sobre sensibilidad, especificidad, valores predictivos positivo y negativo de la citología anal y de la PCR del VPH de alto riesgo para predecir HSIL14.
Algoritmo de seguimiento.
AAR: anoscopia de alta resolución; AIN: neoplasia intraepitelial anal; ASC: células atípicas; CA: cáncer de ano; HSIL: lesión intraepitelial de alto grado; LSIL: lesión intraepitelial de bajo grado; PCR-VPH: Protein Chain Reaction del virus del papiloma humano.
La AAR se efectuaba con el colposcopio Carl Zeiss 150 fc© (Carl Zeiss, Oberkochen, Alemania) en un intervalo de 4 a 12 semanas a la realización de la citología anal. Previa a la AAR se hacía inspección y tacto rectal, tras lo cual se introducía un anoscopio desechable transparente a través del cual se instilaban 5ml de ácido acético que se dejaban durante unos 3min, se retiraba y se inspeccionaba la mucosa; posteriormente se instilaba lugol al 5% un minuto y se volvía a inspeccionar. Se tomaban muestras, tanto de mucosa aparentemente normal de los 4 cuadrantes, como de aquellas zonas sugerentes de displasia (aceto-blanco/lugol negativas). Las biopsias se hacían con un catéter de colangiopancreatografía retrógrada endoscópica (CPRE).
La clasificación que empleamos para la citología anal y cervical fue la de Bethesda18, que clasifica las lesiones en 4 tipos: células escamosas atípicas (atypical squamous cells [ASC]), células escamosas atípicas en las que no se puede descartar células de alto grado (atypical squamous cells-high [ASC-H]), lesión intraepitelial de bajo grado (low-grade squamous intraepithelial lesions [LSIL]) y lesiones intraepiteliales de alto grado (high-grade squamous intraepithelial lesions [HSIL]).
La clasificación histológica empleada fue la del consenso «Squamous Terminology (LAST) Standardization Project for HPV», tanto para ano como para cérvix. Esta clasifica a las lesiones anales en LSIL (AIN1/condiloma), HSIL (AIN2/AIN3) y carcinoma de canal anal invasivo (CA), y a las cervicales como CIN1, CIN2, CIN3, CC. La P16 se empleó según las recomendaciones del consenso LAST19.
El estudio citológico e histológico fue realizado siempre por el mismo patólogo (JE).
En V1 y Vx las mujeres fueron enviadas al ginecólogo para citología cervical (se empleaba el mismo medio líquido que para la anal); en caso de ser anormal, se les realizaba colposcopia con tinción de acético y lugol, tras lo cual tomaban biopsia solo de las zonas aceto-blanco lugol-negativas. Las muestras eran enviadas al mismo servicio de anatomía-patológica.
Definición de variables:
Citología anormal: la que incluye desde ASCUS, ASCUS-H, LSIL a HSIL.
Histología con lesión anal HSIL+: incluía desde HSIL (AIN2, AIN3) a cáncer invasivo.
Histología con lesión anal LSIL+: incluía desde LSIL (condiloma/AIN1) a cáncer invasivo.
Aclaramiento de la infección por VPH-AR: cuando en una paciente que tenía en visita basal (V1) infección en mucosa anal por cualquier genotipo del VPH-AR, no se detectaba ningún genotipo del VPH-AR en su última visita.
Adquisición de infección por VPH-AR: cuando en la última visita el paciente presentaba un nuevo genotipo del VPH-AR en mucosa anal que no tenía en visita basal (V1).
Análisis estadísticoTamaño muestral. Se incluyeron 95 mujeres de un total de 149 atendidas en la consulta externa de un servicio de enfermedades infecciosas perteneciente a un hospital de tercer nivel español y que accedieron voluntariamente a formar parte del programa.
Análisis descriptivo. Realizamos una descripción de las principales variables recogidas en el estudio, se calcularon medidas de tendencia central y dispersión (media, desviación típica, mediana, percentiles) para las variables cuantitativas, y frecuencias absolutas con intervalo de confianza del 95% para las cualitativas. Se calculó la prevalencia de VPH y los hallazgos de citología e histología de mucosa anal con intervalo de confianza del 95%.
Análisis bivariante. Se empleó para estudiar la relación entre los posibles factores de riesgo y la infección por VPH-AR. Para las variables cuantitativas que seguían una distribución normal se aplicó el test de la t de Student para muestras independientes; para aquellas que no seguían una distribución normal, el test de Mann-Whitney. Para las variables cualitativas se empleó el test de chi-cuadrado de Pearson, o Fisher si no se cumplían los criterios de aplicación. Para comprobar si las diferentes variables cumplían la hipótesis de normalidad, se utilizó el test de Kolmogorov-Smirnov. Para todos los test se consideró un nivel de significación de 0,05. El software estadístico utilizado fue el SPSS 20.0.
Análisis multivariante. Se realizó mediante regresión de Poisson, empleando el Stata Statistical Software: Release 12, con varianza robusta del error, calculando el riesgo relativo (RR), así como su intervalo de confianza del 95%. Realizamos este tipo de regresión basándonos en la elevada prevalencia de la infección anal por VPH-AR de nuestra cohorte de mujeres infectadas por VIH, por lo que resultaba más adecuado calcular el RR que la odds ratio. El método de selección de variables fue por pasos sucesivos hacia atrás, considerando como criterio de entrada p<0,05 y de salida p>0,10. En el modelo se incluyeron tanto las variables que habían resultado estadísticamente significativas en el análisis bivariante, como las clínicamente relevantes, quedando finalmente compuesto por las siguientes: número de parejas sexuales en toda su vida mayor de3, tabaquismo, citología anal y cervical anormales.
ResultadosCaracterísticas basales de las pacientes incluidasSe incluyeron 95 mujeres de 43,7años de edad media (el 75,8% se encontraban entre los 30 y los 50años). La mediana de tiempo de evolución del VIH era de 13,6años (P25-P75: 6,8-21,2); CD4 nadir 213,7células/μl, el 93,6% en tratamiento antirretroviral, durante 10años (P25-P75: 5-16,8), con una media de CD4 648,7células/μl (Cd4/CD8: 0,95), y el 7,8% en fracaso virológico; el resto de variables se encuentran en la tabla 1.
Características basales de la cohorte
| Variables | MVIH+ (n=95) |
|---|---|
| Edad (± DS) | 43,7 (± 8,3) |
| <30 años, n (%) | 5 (5,3) |
| 30-50 años, n (%) | 72 (75,8) |
| >50 años n (%) | 17 (17,9) |
| Infección crónica por VHC, n (%) | 24 (25,3) |
| Infección crónica por VHB, n (%) | 1 (1,1) |
| Antecedentes de condiloma anal/genital n (%) | 23 (34) |
| Condiloma anal/genital en visita basal | 11 (11,6) |
| Historia de ITS, n (%) | 15 (15,8) |
| Antecedentes de patología cervical, n(%) | |
| CIN 1 | 9 (9,4) |
| CIN 2 | 6 (6,3) |
| CIN 3 | 1 (1,05) |
| Cáncer de cérvix | 2 (2,1) |
| Tabaquismo, n (%) | 61 (64,2) |
| EXADVP, n (%) | 21 (22,1) |
| Consumo de alcohol, n (%) | 15 (14) |
| Alcohol (UBE) (P25-P95) | 0 (0-1,1) |
| Forma de adquisición del VIH, n (%) | |
| Heterosexual | 72 (75,8) |
| ADVP | 21 (22,1) |
| Vertical | 1 (1,1) |
| Desconocida | 1 (1,1) |
| Tiempo de evolución del VIH (años) (P25-P75) | 13,6 (6,8-21,2) |
| CD4 diagnóstico de VIH (cél/μl) (± DS) | 362,6 (± 315) |
| CD4 nadir (cél/ul) (± DS) | 213,7 (± 172) |
| CD4 nadir <200 cél/μl, n (%) | 46 (48,9) |
| CD4 en visita basal (cél/μl) (± DS) | 645,6 (± 372) |
| CD8 en vista basal (cél/μl) (± DS) | 797,6 (± 361) |
| CV del VIH en visita basal (log) (± DS) | 4,8 (± 4,9) |
| Historia previa de sida, n (%) | 49 (51,6) |
| Toma TAR, n (%) | 89 (93,7) |
| Fracaso virológico, n (%) | 7 (7,8) |
| Mediana de meses de TAR (P25-P75) | 95,5 (18-172) |
CV: carga viral del VIH; EXADVP: ex-adicta a drogas vía parenteral; ITS: infección de transmisión sexual; MVIH+: mujeres VIH positivas; VHB: infección crónica por el virus de la hepatitis B; VHC: infección crónica por el virus de la hepatitis C; UBE: unidad de bebida estándar.
El 29,5% no habían cursado ningún tipo de estudio, el 46,3% habían tenido más de 3 parejas sexuales en toda su vida y el 28,4% sexo anal. El 64,2% eran fumadoras, el 11,6% tenían verrugas genitales/perianales y el 18,9%, antecedentes de patología de cérvix (9,5% CIN1, 6,3% CIN2, 1,05% CIN3, 2,1% CC); el resto de variables se presentan en la tabla 2.
Características demográficas y relacionadas con hábitos sexuales
| Variables | MVIH+ n=95 |
|---|---|
| Nivel de estudios | |
| Sin estudios primarios | 28 (29,5) |
| Primaria | 40 (42,1) |
| Secundaria | 20 (21,1) |
| Universitario | 7 (7,4) |
| Jubilado, n (%) | 25 (26,3) |
| Procedencia, n (%) | |
| Europa | 81 (85,3) |
| África | 11 (11,6) |
| Otros | 3 (3,2) |
| Edad de inicio sexo (± DS) | 17,2 (± 3,6) |
| Sexo en 12 meses previos, n (%) | 66 (69,5) |
| Mediana de parejas sexuales en su vida (P25-P75) | 3 (2-10) |
| % de pacientes con parejas sexuales en su vida > 3, n(%) | 44 (46,3) |
| Mediana de parejas sexuales 12 meses previos (P25-P75) | 1 (0-1) |
| Sexo anal, n (%) | 27 (28,4) |
| Uso de condón habitualmente, n (%) | 35 (53,8) |
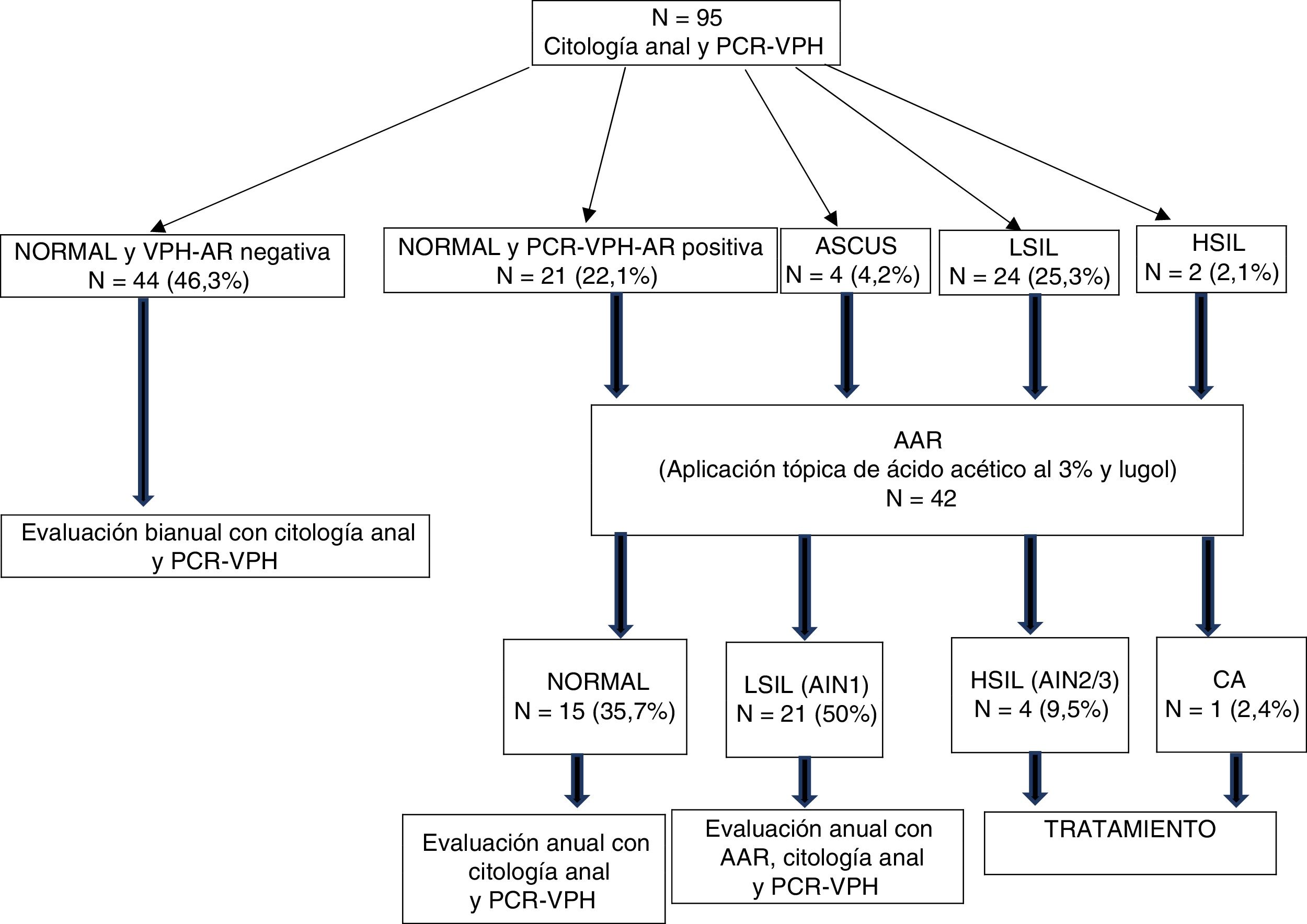
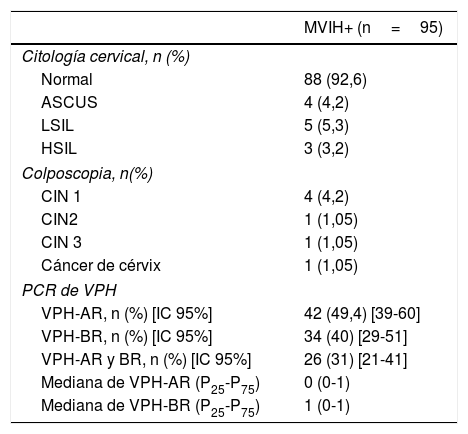
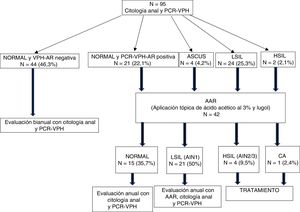
El 92,6% de las MVIH+ tenían una citología cervical normal, el 4,2% ASCUS, el 5,2% LSIL y el 3,2% HSIL (tabla 3). En cuanto a los resultados de la citología anal, encontramos que el 68,4% de las pacientes tenían una citología normal, el 25,3% LSIL, el 2,1% HSIL y el 4,2% ASCUS (fig. 2), con diferencias estadísticamente significativas entre ambos tipos de citologías (p=0,0001).
Resultados de la citología cervical, colposcopia y PCR de VPH de mucosa anal
| MVIH+ (n=95) | |
|---|---|
| Citología cervical, n (%) | |
| Normal | 88 (92,6) |
| ASCUS | 4 (4,2) |
| LSIL | 5 (5,3) |
| HSIL | 3 (3,2) |
| Colposcopia, n(%) | |
| CIN 1 | 4 (4,2) |
| CIN2 | 1 (1,05) |
| CIN 3 | 1 (1,05) |
| Cáncer de cérvix | 1 (1,05) |
| PCR de VPH | |
| VPH-AR, n (%) [IC 95%] | 42 (49,4) [39-60] |
| VPH-BR, n (%) [IC 95%] | 34 (40) [29-51] |
| VPH-AR y BR, n (%) [IC 95%] | 26 (31) [21-41] |
| Mediana de VPH-AR (P25-P75) | 0 (0-1) |
| Mediana de VPH-BR (P25-P75) | 1 (0-1) |
CIN: neoplasia intraepitelial de cérvix; VPH: virus papiloma humano; VPH-AR: VPH de alto riesgo, VPH-BR: VPH de bajo riesgo.
Flujo de pacientes desde la citología anal y PCR del VPH-AR a la AAR.
AAR: anoscopia de alta resolución; AIN: neoplasia intraepitelial anal; ASCUS: células atípicas; CA: cáncer de ano; HSIL: lesión intraepitelial de alto grado; LSIL: lesión intraepitelial de bajo grado; PCR-VPH: Protein Chain Reaction del virus del papiloma humano.
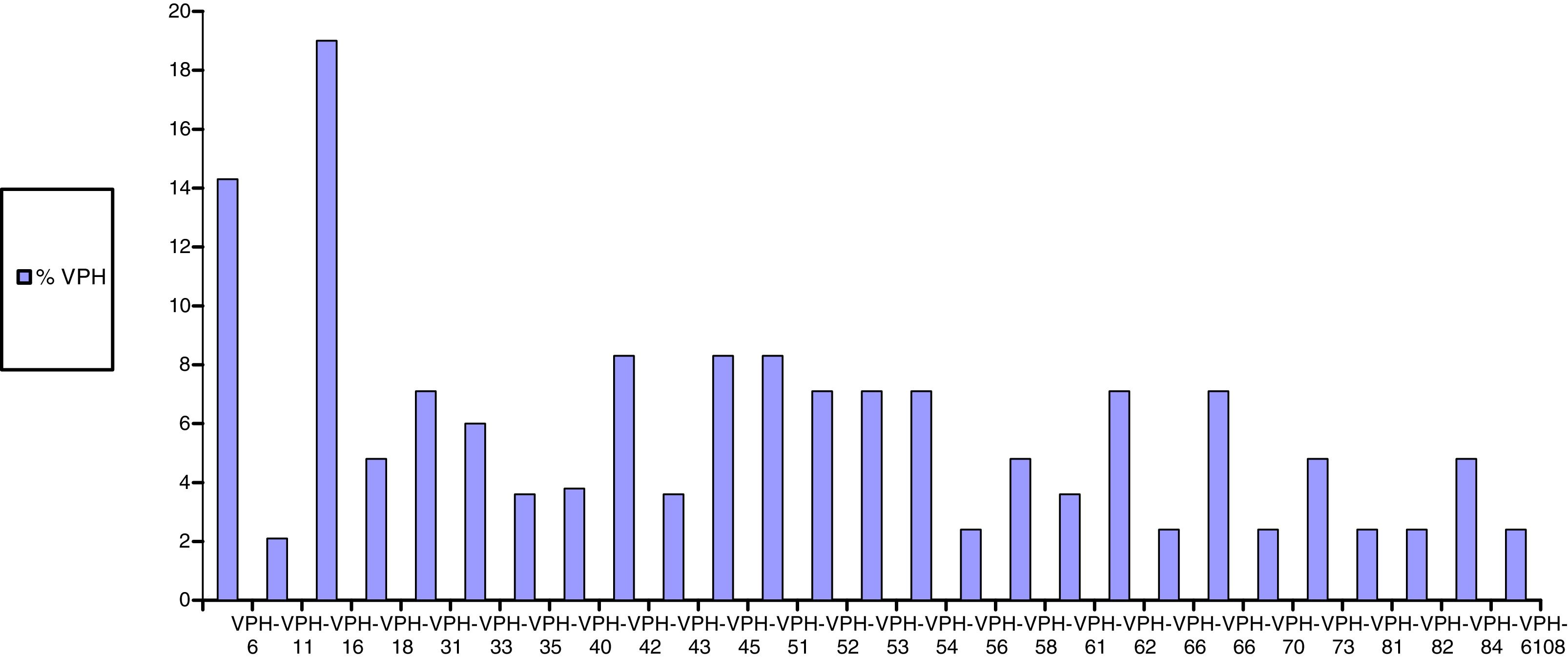
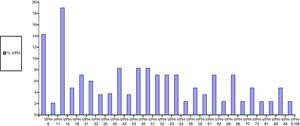
Por otra parte, en cuanto a los resultados de la PCR del VPH en ano, el 49,4% de las mujeres (IC95%: 39-60) tenían infección por genotipos de alto riesgo, con una mediana de genotipos oncogénicos por paciente de 0 (P25-P75: 0-1); el 40%, de bajo riesgo (IC95%: 29-51), con una mediana de 0 (P25-P75: 0-1), y el 31% tenían infección simultánea por genotipos de bajo y alto riesgo (IC95%: 21-41) (tabla 3). Los genotipos de VPH más frecuentemente aislados en la mucosa anal fueron: de bajo riesgo el 6 (14,3%), el 42 (8,3%), el 62 (7,1%), el 73 (4,8%) y el 84 (4,8%), y de alto riesgo el 16 (19%), el 45 (8,3%), el 51 (8,3%) y el 55 (8,3%) (fig. 3).
De las 42 AAR realizadas, el 38,1% eran normales, el 50% LSIL (AIN 1), el 9,5% HSIL (AIN2/3) y el 2,4% CA (fig. 2). De las 12 colposcopias realizadas, el 5,2% fueron normales, el 4,2% CIN1, el 1,05% CIN2, el 1,05% CIN3 y el 1,05% CC.
Resultados del seguimientoDurante los 36 meses (P25-75: 24,8-47,3) de mediana de seguimiento, tres mujeres desarrollaron nuevos casos de HSIL anal, cuya incidencia era de 16×1.000 personas-año. El 14,8% adquirieron VPH-AR y el 51,2% los aclararon, con diferencias estadísticamente significativas (p=0,007).
Dos mujeres fueron exitus letalis, una por un cáncer anal a los 24 meses del diagnóstico, que se realizó en la visita basal, a la que se le administró radioterapia, quimioterapia y amputación abdominopélvica, y otra por recidiva de un linfoma de Hodgkin.
De las 8 mujeres que tuvieron lesiones precursoras de CA (HSIL) en la cohorte, una de ellas rehusó recibir tratamiento y en la revisión a los 12meses la lesión (AIN2) había desaparecido, tenía LSIL (AIN1). Otra recibió imiquimod intra-anal 3 veces por semana durante 16 semanas sin respuesta e incluso progresión, con mayor afectación de los cuadrantes de 1 a 3, por lo que requirió electrocauterización/fulguración de las lesiones con bisturí; las otras 6 restantes, recibieron electrocauterización/fulguración. El 100% de las pacientes tratadas no volvieron a presentar lesiones precursoras ni CA durante una mediana de seguimiento de 30,5meses (P25-P75: 17,5-36,5).
Ninguna de las mujeres presentó durante el seguimiento CIN1, CIN2, CIN3 o CC. El 1,05% presentó neoplasia intraepitelail de vulva grado1 (VIN1) y el 1,05%, VIN3.
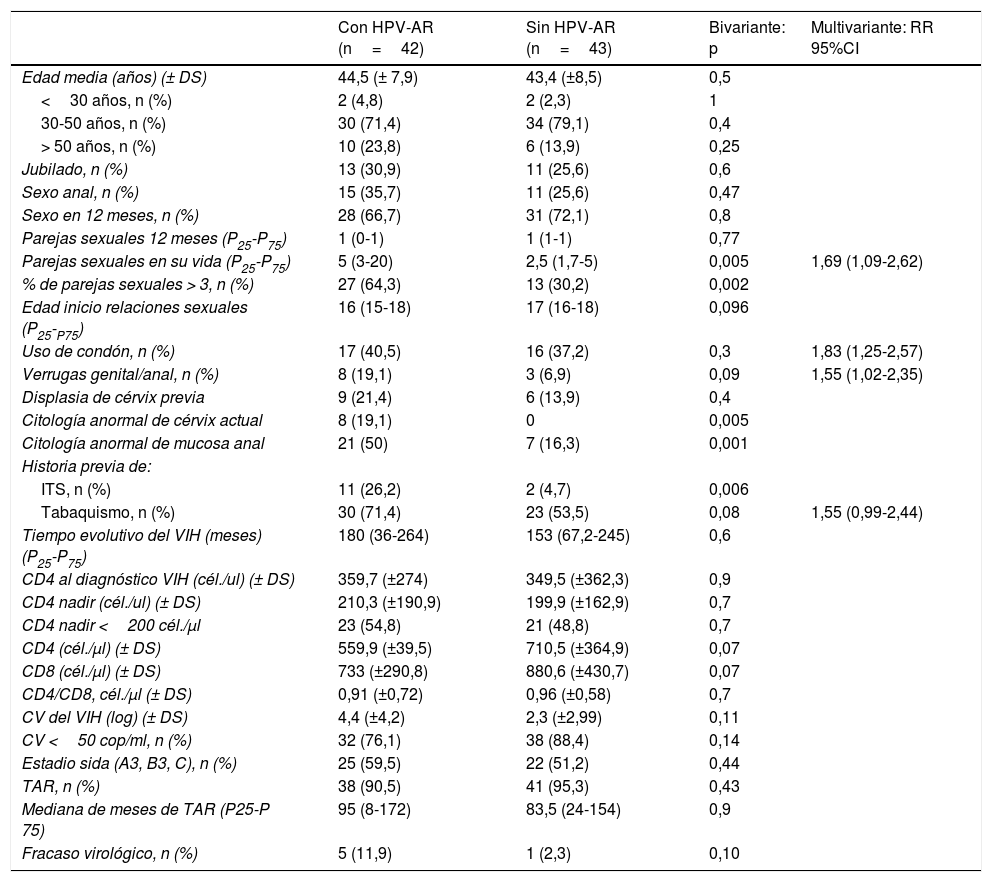
Factores predictores de infección por VPH-AREn el análisis bivariante encontramos como factores de riesgo para la infección anal por el VPH-AR el antecedente de infección de transmisión sexual (ITS) (26,2% vs. 4,7%; p=0,006); displasia de cérvix (19,1% vs. 0%; p=0,005); citología anal anómala (50% vs. 16,3%; p=0,001), y número de parejas sexuales en toda su vida superior a 3 (64,3% vs. 30,2%; p=0,002). El resto de variables pueden consultarse en la tabla 4.
Factores de riesgo de infección VPH-AR en mucosa anal de MVIH+. Análisis bivariante y multivariante
| Con HPV-AR (n=42) | Sin HPV-AR (n=43) | Bivariante: p | Multivariante: RR 95%CI | |
|---|---|---|---|---|
| Edad media (años) (± DS) | 44,5 (± 7,9) | 43,4 (±8,5) | 0,5 | |
| <30 años, n (%) | 2 (4,8) | 2 (2,3) | 1 | |
| 30-50 años, n (%) | 30 (71,4) | 34 (79,1) | 0,4 | |
| > 50 años, n (%) | 10 (23,8) | 6 (13,9) | 0,25 | |
| Jubilado, n (%) | 13 (30,9) | 11 (25,6) | 0,6 | |
| Sexo anal, n (%) | 15 (35,7) | 11 (25,6) | 0,47 | |
| Sexo en 12 meses, n (%) | 28 (66,7) | 31 (72,1) | 0,8 | |
| Parejas sexuales 12 meses (P25-P75) | 1 (0-1) | 1 (1-1) | 0,77 | |
| Parejas sexuales en su vida (P25-P75) | 5 (3-20) | 2,5 (1,7-5) | 0,005 | 1,69 (1,09-2,62) |
| % de parejas sexuales > 3, n (%) | 27 (64,3) | 13 (30,2) | 0,002 | |
| Edad inicio relaciones sexuales (P25-P75) | 16 (15-18) | 17 (16-18) | 0,096 | |
| Uso de condón, n (%) | 17 (40,5) | 16 (37,2) | 0,3 | 1,83 (1,25-2,57) |
| Verrugas genital/anal, n (%) | 8 (19,1) | 3 (6,9) | 0,09 | 1,55 (1,02-2,35) |
| Displasia de cérvix previa | 9 (21,4) | 6 (13,9) | 0,4 | |
| Citología anormal de cérvix actual | 8 (19,1) | 0 | 0,005 | |
| Citología anormal de mucosa anal | 21 (50) | 7 (16,3) | 0,001 | |
| Historia previa de: | ||||
| ITS, n (%) | 11 (26,2) | 2 (4,7) | 0,006 | |
| Tabaquismo, n (%) | 30 (71,4) | 23 (53,5) | 0,08 | 1,55 (0,99-2,44) |
| Tiempo evolutivo del VIH (meses) (P25-P75) | 180 (36-264) | 153 (67,2-245) | 0,6 | |
| CD4 al diagnóstico VIH (cél./ul) (± DS) | 359,7 (±274) | 349,5 (±362,3) | 0,9 | |
| CD4 nadir (cél./ul) (± DS) | 210,3 (±190,9) | 199,9 (±162,9) | 0,7 | |
| CD4 nadir <200 cél./μl | 23 (54,8) | 21 (48,8) | 0,7 | |
| CD4 (cél./μl) (± DS) | 559,9 (±39,5) | 710,5 (±364,9) | 0,07 | |
| CD8 (cél./μl) (± DS) | 733 (±290,8) | 880,6 (±430,7) | 0,07 | |
| CD4/CD8, cél./μl (± DS) | 0,91 (±0,72) | 0,96 (±0,58) | 0,7 | |
| CV del VIH (log) (± DS) | 4,4 (±4,2) | 2,3 (±2,99) | 0,11 | |
| CV <50 cop/ml, n (%) | 32 (76,1) | 38 (88,4) | 0,14 | |
| Estadio sida (A3, B3, C), n (%) | 25 (59,5) | 22 (51,2) | 0,44 | |
| TAR, n (%) | 38 (90,5) | 41 (95,3) | 0,43 | |
| Mediana de meses de TAR (P25-P 75) | 95 (8-172) | 83,5 (24-154) | 0,9 | |
| Fracaso virológico, n (%) | 5 (11,9) | 1 (2,3) | 0,10 |
CV: carga viral; ITS: infección de transmisión sexual; RR: riesgo relativo; VPH: virus del papiloma humano.
Finalmente, en el análisis multivariante encontramos como factores de riesgo para infección anal por genotipos oncogénicos el tabaquismo (RR: 1,55; IC95%: 0,99-2,42), número de parejas sexuales superior a 3 (RR: 1,69; IC95%: 1,09-2,62), displasia cervical (RR: 1,83; IC95%: 1,26-2,67) y anal (RR: 1,55; IC95%: 1,021-2,35) (tabla 4).
DiscusiónUna de cada 10 mujeres VIH positiva de nuestra cohorte tenía una lesión anal precursora de cáncer asociada al VPH, con una incidencia de 16×1.000 personas-año, y hasta el 50% presentaron lesión de bajo grado (LSIL/AIN1). En un estudio comparativo entre mujeres seropositivas vs. seronegativas encontraron una tasa de HSIL en mujeres infectadas por el VIH similar a la nuestra, del 9%20; sin embargo, la prevalencia de LSIL que hallaron fue muy inferior, tan solo del 12%. La diferencia con nuestros resultados podría atribuirse a que en ese estudio la anoscopia solo era realizada en caso de citología anómala; en nuestro caso, y basándonos en datos propios sobre la sensibilidad de la citología y de la PCR del VPH en el cribado de HSIL14, se hacía tanto en mujeres con citología displásica como con PCR positiva de cualquier genotipo oncogénico del VPH. En otro trabajo realizado solo en MVIH+ la tasa de HSIL+ fue del 12%, y como principales factores de riesgo para este tipo de lesión encontraron patología cervical e infección anal por el genotipo1621. Sin embargo, en un estudio retrospectivo, compuesto por 745 MVIH+, la prevalencia de HSIL fue muy superior, hasta del 26%, lo que se asociaba a tabaquismo y citología cervical anormal22. Por último, una revisión sistemática sobre las lesiones precursoras de cáncer de ano asociado al VPH en MVIH+ mostraba variabilidad en las cifras de prevalencias en dichas lesiones al comparar las diferentes cohortes, de forma que oscilaban entre el 3 y y el 26%. Al comparar en nuestra cohorte la prevalencia de HSIL+ anal frente a la de cérvix descubrimos una mayor tasa de displasia en ano, con diferencias estadísticamente significativas. Por otra parte, durante los 3años de mediana de seguimiento no hallamos ningún caso de lesión precursora cervical, ni de cáncer de cérvix. Estos resultados eran congruentes con los comunicados hasta el momento en la literatura, en los que la incidencia de CC se ha ido reduciendo de forma paulatina en las cohortes de mujeres infectadas por el VIH gracias, entre otros factores, a la introducción del tratamiento antirretroviral23.
En cuanto al cáncer de ano, la prevalencia que descubrimos en nuestra cohorte fue superponible a la de CC, inferior al 3% en ambos casos; en los 36meses de mediana de seguimiento ninguna mujer volvió a presentar cáncer anogenital, y las que fueron diagnosticadas y tratadas de lesión precursora asociada al VPH tampoco experimentaron progresión a CA; incluso una de ellas, con HSIL anal, regresó espontáneamente. Esto podría deberse, entre otras causas, a que más del 90% estaban en tratamiento antirretroviral y tenían un excelente estado viro-inmunológico. En un metaanálisis realizado en pacientes seropositivos sobre la infección anal por VPH y lesiones neoplásicas asociadas a dicha infección, hallaron que la progresión de neoplasia intraepitelial anal a cáncer de ano era más baja que la de CIN3 a cáncer de cérvix (1 en 600×año en hombres que tienen sexo con hombres seropositivos vs. 1 en 80×año en mujeres)24.
El CA es una enfermedad no definitoria de sida, muy prevalente en población VIH positiva vs. población general25; en mujeres infectadas por el VIH se ha comunicado una incidencia variable entre 3,9 a 30×100.000 personas-año, cifras que se llegan a incrementan hasta 63,8 casos por 100.000 persona-año en aquellas con CC o CIN3. Publicaciones recientes realizadas sobre cohortes de pacientes infectados por el VIH hombres que tienes sexo con hombres recogen el efecto protector del TAR frente a la aparición de lesiones precursoras y CA asociadas al VPH9-11,26,27, hecho que podría explicar nuestros hallazgos.
En cuanto a la prevalencia de la infección por VPH en la mucosa anal de nuestras mujeres, encontramos que hasta la mitad de ellas estaban infectadas por genotipos de alto riesgo, 2/5 por bajo riesgo y 1/3 por ambos genotipos. El genotipo VPH16 fue el más frecuentemente aislado en mucosa anal, casi en una de cada cinco pacientes, y de los de bajo riesgo, fue el genotipo6. Un estudio publicado recientemente sobre prevalencia del VPH en MVIH+ mostraba que aproximadamente la mitad de las pacientes estaban infectadas por genotipos oncogénicos, siendo el más frecuente el 16, datos muy similares a los de nuestro estudio28. En la cohorte prospectiva Sun Study, compuesta por 120 MVIH+, hallaron una prevalencia del 85% de dichos genotipos en ano; la diferencia con nuestros datos y los previos28 puede deberse, en parte, a que dicha cohorte, en comparación con la nuestra, tenía un menor porcentaje de pacientes en tratamiento antirretroviral (TAR), en supresión virológica y con CD4>500células/ml (solo el 77, el 73 y el 36%, respectivamente)29.
Por otra parte, encontramos que la adquisición de genotipos de alto riesgo ocurría en una de cada 7 mujeres, y aunque más de la mitad los aclaraba durante el seguimiento, la incidencia de HSIL anal en nuestra cohorte era elevada. Un estudio retrospectivo del AIDS Clinical Trials Group (ACTG) A5029 mostró que MVIH+ en tratamiento antirretroviral con CD4>350células/μl tenían mayor tasa de aclaramiento, y en el caso de carga viral del VIH>400copias/ml, superior tasa de adquisición30; estos datos podrían explicar nuestros resultados, ya que el 93,6% de nuestras pacientes recibían TAR, tenían una media de CD4 648,7células/μl, y solo el 7,8% se encontraban en fracaso virológico.
Al analizar los posibles factores predictores de infección por genotipos oncogénicos de la mucosa anal descubrimos que los que se relacionaban de forma estadísticamente significativa fueron el tabaquismo, el número de parejas sexuales en toda su vida mayor a tres, la displasia cervical y la anal, datos en consonancia con los comunicados en 2016 por el grupo de estudio ANRS-C017 VIHGY, que descubrieron en MVIH+ como factores asociados a la infección anal por virus oncogénicos: presencia de citología cervical displásica, infección cervical por VPH de alto riesgo y CD4<350cél/ml. Esta cohorte tenía una tasa de TAR y CD4>500cél/ml, cercanas al 100%, y se encontraban en supresión virológica más del 80% de las pacientes28. El consumo de tabaco en pacientes VIH positivos también ha sido relacionado previamente con la presencia de displasia de canal anal31, así como con la infección por virus de alto riesgo en cérvix y lesiones CIN2+ en MVIH+32. En cuanto a los hábitos sexuales, tanto el tipo de relación como el mayor número de parejas sexuales han sido considerados factores clásicos de la infección por VPH oncogénicos en mucosa anal33.
Una de las principales limitaciones de nuestro estudio deriva del diseño unicéntrico y, por otra parte, del hecho de que no dispusiéramos de la PCR del VPH procedente del cérvix (por problemas ajenos a los investigadores y en relación con los presupuestos), así como de las derivadas de los criterios de exclusión. En cuanto a las fortalezas, se encuentran el diseño del estudio, longitudinal-prospectivo; el que las pacientes eran llevadas siempre por el mismo clínico que se encargaba de la toma de muestras, así como de la AAR, y finalmente, que la citología y la histología eran interpretadas por el mismo patólogo.
En conclusión, en este período tardío del tratamiento antirretroviral la prevalencia y la incidencia de lesiones precursoras de cáncer anal asociadas al VPH en nuestra cohorte de MVIH+ era superior a las de cérvix, a pesar de que el aclaramiento de genotipos oncogénicos en mucosa anal fuese mayor al de adquisición; por ello, creemos que se debería ofertar el cribado de dichas lesiones a todas las mujeres infectadas por el VIH, haciendo especial hincapié en las fumadoras, con mayor número de parejas sexuales o displasia anogenital indistintamente.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.