La cromoblastomicosis es una infección crónica granulomatosa de la piel y del tejido subcutáneo causada por la inoculación traumática de hongos dematiáceos (pigmentados) presentes en el suelo, las plantas y la madera en descomposición1. Es más frecuente en climas tropicales y subtropicales, aunque se han descrito casos autóctonos en regiones de clima templado2. La mayor incidencia se registra en hombres de entre 20 y 60 años, probablemente por la mayor exposición ocupacional, responsable del 90% de los casos1. Su diagnóstico se basa fundamentalmente en la identificación en el tejido de estructuras celulares pigmentadas de pared gruesa conocidas como cuerpos de Medlar, cuerpos escleróticos o células muriformes, que suponen la forma invasiva del hongo y son patognomónicos de esta entidad3. Además, se recomienda el cultivo y, para la identificación de la especie, la secuenciación de regiones espaciador transcrito interno (internal transcribed spacer [ITS]) del ADN ribosómico fúngico (ADNr) es la más apropiada3. Presentamos un caso de cromoblastomicosis por Cladophialophora immunda, una especie recientemente identificada en suelos contaminados con hidrocarburos4,5, en un paciente trasplantado renal.
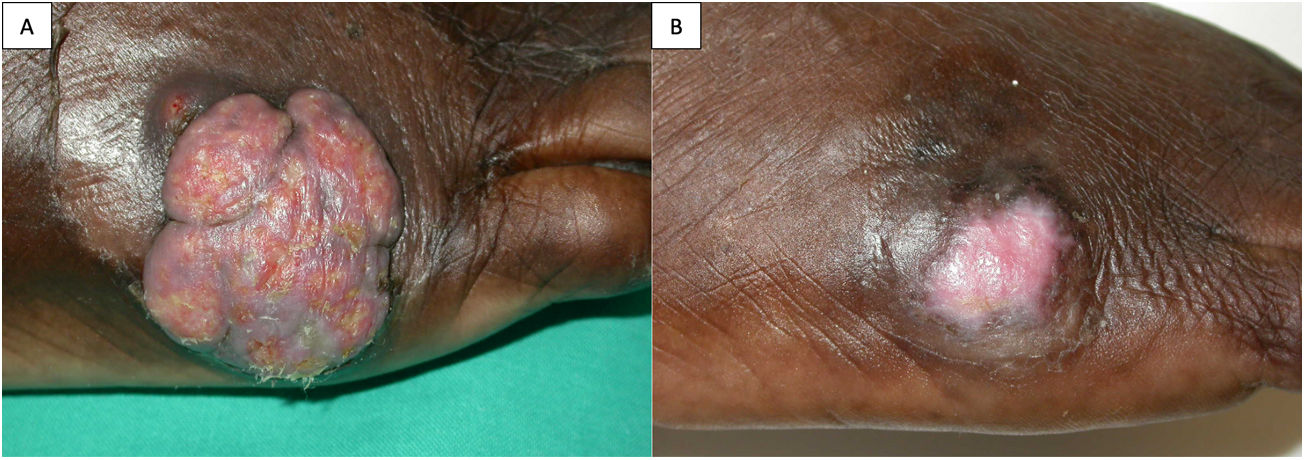
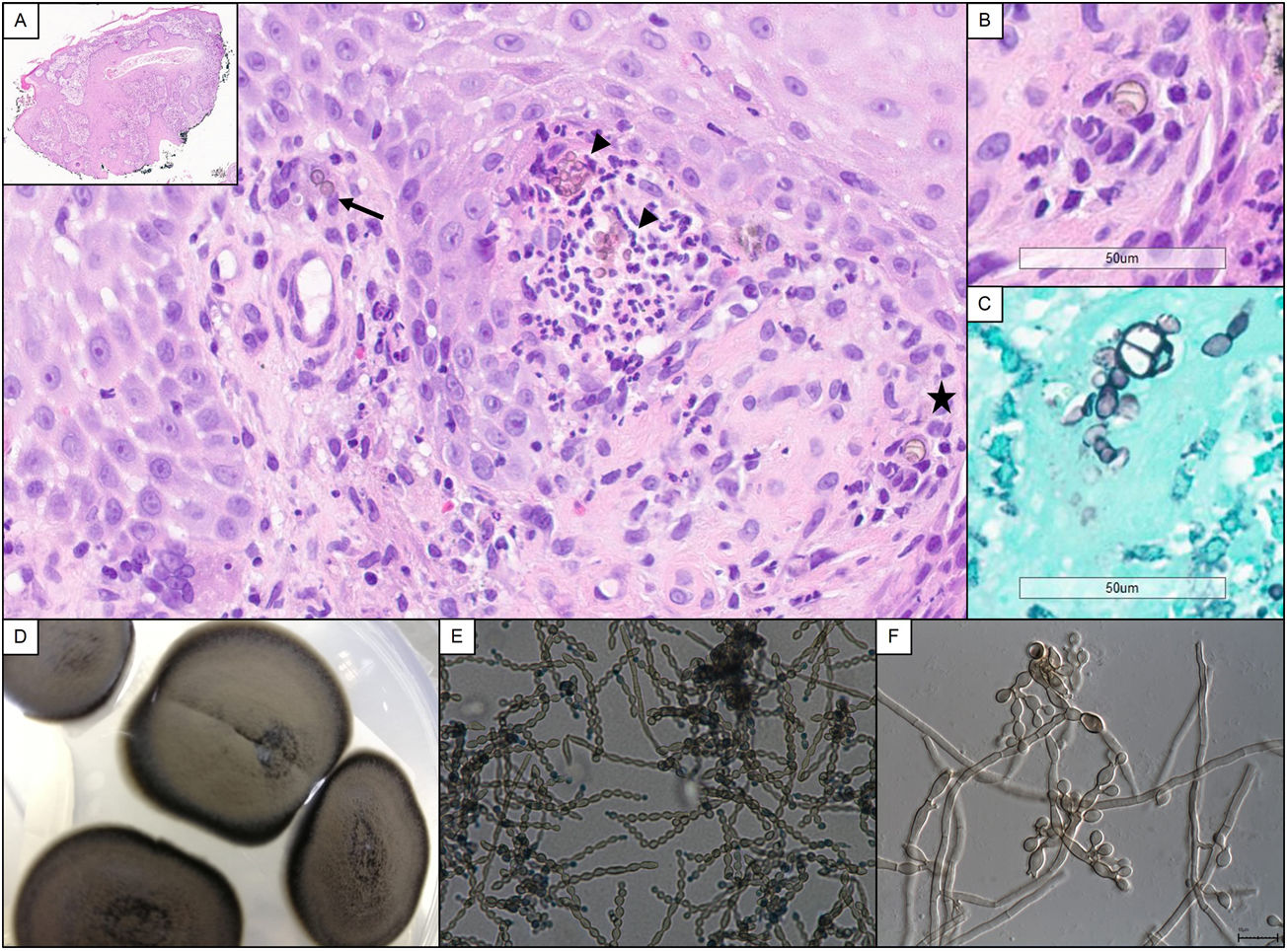
Un varón de 56 años, natural de Guinea Bissau, residente en España desde hacía 30 años, con antecedentes de enfermedad renal terminal secundaria a nefropatía intersticial por ácido úrico, trasplantado renal de donante cadáver en tratamiento inmunosupresor con tacrolimus 4,75mg/día, ácido micofenólico 180mg/8h y prednisona 5mg/día. Diez meses tras el trasplante acude a la consulta de dermatología por una lesión tumoral exofítica multinodular de rápido crecimiento en la zona metatarsiana externa del pie derecho (fig. 1A). El paciente negaba traumatismo previo y no había viajado a su país de origen en el último año. No refería fiebre ni otra sintomatología acompañante, ni presentaba adenopatías locorregionales. Las serologías eran negativas y el hemograma y la bioquímica sanguínea no mostraban hallazgos significativos. Se realizó biopsia cutánea para estudio histológico y microbiológico. En la histología se observaba una hiperplasia epidérmica pseudoepiteliomatosa, asociada a un intenso proceso inflamatorio dérmico, compuesto por granulomas supurativos y células gigantes multinucleadas. Tanto en el citoplasma de estas células como entre los neutrófilos se apreciaban numerosas estructuras fúngicas, redondeadas, de coloración parduzca, a veces agrupadas en cadenetas y tanto en la hematoxilina y eosina (H&E) como en la tinción de Grocott se evidenciaba la presencia de tabiques (células muriformes) (fig. 2A-C). La visión directa con blanco de calcoflúor fue negativa para levaduras, hifas o pseudohifas. Tras 3 días de incubación se observó crecimiento de hongos a 30°C en agar Sabouraud-gentamicina-cloranfenicol y patata-dextrosa-cloranfenicol, pero no en medios con cicloheximida. Macroscópicamente las colonias eran aterciopeladas, de color gris oliváceo oscuro y negro en el reverso (fig. 2D), con una temperatura máxima de crecimiento de 37°C. Microscópicamente se observaban hifas tabicadas, ramificadas, de color marrón pálido, con conidióforos pobremente diferenciados produciendo conidios elipsoidales formando largas cadenas coherentes, sin cicatrices oscuras (figs. 2E y F). Estas características permitieron la identificación del género Cladophialophora. La identificación de especie se realizó mediante secuenciación de regiones ITS del ADNr. La secuencia alineada se correspondía al 99% con C. immunda, CBS 126867, número de acceso de GenBank MH864254.1. Reinterrogando al paciente refería haber estado trabajando en una fábrica de pinturas. Con el diagnóstico de cromoblastomicosis por Cladophialophora immunda se inició tratamiento con terbinafina 250mg/24h durante 4 semanas, con posterior realización de curetaje y electrocoagulación de la lesión residual, con nuevo estudio histológico y microbiológico que confirmó la curación microbiológica (fig. 1B). No fue necesario reducir el tratamiento inmunosupresor. Tras 2 años de seguimiento no se ha objetivado recidiva.
A. Imagen histológica en la que se pueden apreciar estructuras fúngicas de color marrón en las crestas de la dermis papilar, tanto en el citoplasma de una célula gigante multinucleada (flecha), como en un foco de supuración (cabeza de flecha). También se destaca la presencia de una estructura fúngica tabicada o cuerpo muriforme (estrella). En la esquina superior izquierda, vista panorámica donde se muestra la hiperplasia pseudoepiteliomatosa (H&E, ×400). B. Detalle de la célula muriforme de la imagen A con aumento digital (H&E, ×400). C. Microorganismos fúngicos resaltados con tinción de plata de Grocott que muestran también cuerpos tabicados de paredes gruesas, aumentado digitalmente (H&E, ×400). D. Crecimiento fúngico macroscópico, el día 25 a 30°C en agar Sabouraud dextrosa. E. Observación microscópica de preparación en fresco de agar patata-cloranfenicol (×400). F. Detalle de conidióforos, de agar extracto de malta (×1.000).
La relación huésped-patógeno en esta enfermedad es muy específica, ya que las especies involucradas están casi totalmente restringidas a un solo orden del reino fúngico, los Chaetothyriales, y en concreto, la familia Herpotrichiellaceae. Las especies responsables de la gran mayoría de los casos de cromoblastomicosis pertenecen a los géneros Fonsecaea y Cladophialophora, principalmente las especies Fonsecaea pedrosoi y Cladophialophora carrionii, seguidas de los géneros Rhinocladiella, Phialophora y Exophiala en menor medida1,6–8. A partir de cepas de Cladophialophora aisladas se han podido identificar 4 nuevas especies en dicho género, Cladophialophora saturnica y Cladophialophora immunda que causan infecciones cutáneas, Cladophialophora mycetomatis relacionada con infección subcutánea y Cladophialophora samoënsis, un agente endémico de cromoblastomicosis9. Cladophialophora immunda pertenece al clado filogenético «bantiana» (clado ii) del género, que contiene las principales especies neurotrópicas. Está más relacionada con especies ambientales como C. saturnica, que es causa de infecciones cutáneas, o C. devriesii, que ha sido descrita como causa de infecciones diseminadas, que con C. carrionii, el agente etiológico de cromoblastomicosis más prominente del género, que pertenece al clado «carrionii» (clado i)4. C. immunda tiene una pared celular gruesa y melanizada y otras adaptaciones fisiológicas que le permiten hacer frente a condiciones físicas y químicas extremas, y más concretamente muestra una especial asociación con ambientes contaminados por hidrocarburos5,10. De hecho, se ha postulado su uso en biorremediación, dada su capacidad para degradar los hidrocarburos5,10, aunque poco se sabe sobre su potencial patogenicidad. En nuestro caso el paciente refirió exposición ocupacional a pinturas acrílicas, siendo el probable nicho ecológico del hongo por su afinidad con ambientes enriquecidos con hidrocarburos monoaromáticos, presentes por ejemplo en disolventes.
En los pacientes trasplantados renales la cromoblastomicosis es poco frecuente, y en general en los pacientes inmunodeprimidos, la feohifomicosis es la principal manifestación de la enfermedad causada por hongos pigmentados11,12. La feohifomicosis se define por la presencia de células levaduriformes, hifas o pseudohifas pigmentadas en el tejido del huésped. Se puede producir un amplio espectro de síndromes clínicos, incluyendo fungemia, afectación pulmonar y cerebral, aunque las formas cutáneas y subcutáneas son las principales manifestaciones13. La cromoblastomicosis, en cambio, no se extiende más allá del tejido subcutáneo, aunque algunos géneros implicados como Fonsecaea y Exophiala muestran un marcado neurotropismo9. La serie más extensa de infecciones por hongos pigmentados en pacientes trasplantados renales se describió en Brasil, donde de 58 casos solo 4 fueron cromoblastomicosis11. Otra serie brasileña de 6 casos observaba formas de transición entre feohifomicosis y cromoblastomicosis con presencia simultánea de pseudohifas melanizadas y células muriformes en las preparaciones histológicas12. Nuestro caso tenía características similares a las de los pacientes descritos en estas series, como el sexo masculino (82%), la edad (40-60 años), la presentación tardía postrasplante (>90 días) y el tratamiento con corticoides (100%) e inhibidores de la calcineurina (95%)11,12. En cambio, la presentación clínica tumoral fue infrecuente (2%), siendo las formas verrucosas y en placa las más frecuentes. El fármaco antifúngico más utilizado fue el itraconazol, combinado con desbridamiento quirúrgico parcial en aproximadamente el 50% de los casos. En nuestro paciente elegimos la terbinafina para evitar la interacción medicamentosa grave del itraconazol con el tacrolimus, demostrando igualmente su eficacia en combinación con la eliminación quirúrgica de la lesión residual14.
El aislamiento en un paciente inmunosuprimido de un hongo con las características microscópicas propias del género Cladophialophora requiere descartar la especie C. bantiana, un agente productor de feohifomicosis con capacidad de diseminación y neurotropismo15. Por otro lado, dado que la diferenciación fenotípica de las especies de los géneros Exophiala, Cladophialophora y Fonsecaea es difícil, el análisis de las secuencias de la región ITS ha demostrado ser muy útil para su identificación1 y se recomienda especialmente para patógenos infrecuentes o recientemente descritos3. En nuestro caso, la falta de crecimiento a 40°C descartó C. bantiana, y la presencia de células muriformes en la biopsia, así como la identificación molecular, permitió concluir que se trataba de una cromoblastomicosis por C. immunda, especie descrita previamente en una única ocasión como causa de feohifomicosis5. Finalmente, en relación con el tratamiento, varios estudios sugieren que el tratamiento estándar debe incluir itraconazol más cirugía (recomendación AII)3, no obstante, otras alternativas como la terbinafina o el ioduro potásico también se han utilizado con éxito (recomendación BIII)3,14. Para casos refractarios el posaconazol es una alternativa prometedora basándonos en estudios experimentales e in vitro3.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
A la Dra. Rosa Baldellou, por su indispensable participación en el manejo clínico del paciente y su aportación de las fotografías clínicas; a la Dra. Carmen Yus, por su inestimable colaboración en el diagnóstico histopatológico; y a la Dra. Yolanda Gilaberte, por su apoyo decisivo en la coordinación y revisión del artículo.