Nuestro objetivo principal fue revisar los aspectos clínicos, microbiológicos y epidemiológicos de la infección asociada a Clostridium difficile en pediatría (2010-2015), comparando los diagnósticos realizados por detección de toxinas en heces y por PCR a tiempo real del gen de la toxina B.
MétodosEste estudio retrospectivo incluyó a 82 pacientes pediátricos. La detección de C. difficile toxigénico se realizó de manera secuencial, en heces diarreicas y bajo solicitud expresa.
ResultadosEl 39% de los pacientes procedían de Hemato-Oncología y >50% recibió previamente cefalosporinas. La presencia de fiebre asociada a diarrea fue más frecuente en el grupo de detección positiva de toxinas y no recibir antibioterapia específica fue más frecuente en el grupo con PCR positiva, sin diferencias estadísticamente significativas.
ConclusiónDestacamos la presencia de infecciones en niños menores de 2 años. Sería recomendable realizar un diagnóstico de infección asociada a C. difficile en pacientes pediátricos, siempre que la sospecha clínica lo requiera.
Our main objective was a revision of clinical, microbiological and epidemiological results of Clostridium difficile-associated infection in paediatric patients (2010-2015). We compared the diagnoses performed by detection of toxins in feces and those performed by real-time PCR.
MethodsThis retrospective study included 82 paediatric patients. Detection of toxigenic C. difficile was performed sequentially, in diarrheal feces and under clinical request.
ResultsA total of 39% of the patients were attended at Haematology-oncology Unit and >50% of them had previously received cephalosporins. Fever associated with diarrhea was more frequent in the group of toxin detection, whereas not receiving specific antibiotic treatment was more frequent in the group of positive PCR, without statistically significant differences.
ConclusionsWe highlight the presence of C. difficile infection in children under 2years old. A diagnostic testing in selected paediatric patients would be advisable when there is clinical suspicion of infection.
Clostridium difficile es un bacilo grampositivo, anaerobio estricto, formador de esporas y productor de toxinas A y B, que le confieren su virulencia1. Actualmente es uno de los principales microorganismos responsables de infección nosocomial y colitis asociada a antibioterapia de amplio espectro. En la población infantil, la epidemiología ha cambiado en la última década, con un aumento de casos nosocomiales y comunitarios2. Zilberberg et al. comunicaron que la tasa anual de hospitalización pediátrica por infección asociada a C. difficile (ICD) en EE. UU. aumentó entre 7,24 y 12,8/10.000 hospitalizaciones (1997-2006), según datos de más de 3.700 hospitales3, especialmente en niños entre 1 y 4 años. Otros autores han asociado la ICD en niños con una prolongada hospitalización y riesgo de muerte4. Por otro lado, se mantiene la problemática de la significación clínica del aislamiento de C. difficile toxigénico, sobre todo en menores de 2 años, por la elevada presencia de portadores asintomáticos y de infecciones víricas causantes de diarrea. Ha sido publicada una tasa de colonización del 14% entre los 6 y los 12 meses, que desciende a 0-3% en niños de 3 años5. En España existen pocos estudios acerca del diagnóstico de la infección por C. difficile en pacientes pediátricos. Nuestro objetivo principal es revisar los aspectos clínicos, microbiológicos y epidemiológicos de los casos de ICD en pediatría. Además, analizaremos las posibles diferencias entre los diagnósticos realizados mediante detección de toxinas en heces y detección del gen de la toxina B por PCR a tiempo real.
Material y métodosSe realizó un estudio descriptivo y retrospectivo de detección de C. difficile toxigénico en muestras de heces de pacientes pediátricos recibidas en el Servicio de Microbiología (mayo de 2010-mayo de 2015). Nuestro centro hospitalario de tercer nivel asiste a una población total de 519.300 habitantes y dispone de 1.153 camas funcionantes, de las cuales 216 son pediátricas.
La detección de C. difficile toxigénico se realizó en heces diarreicas de manera secuencial6 de la misma manera a lo largo de todo el periodo de estudio y solo bajo solicitud expresa. La presencia de heces sólidas fue criterio de rechazo. Se realizó un cribado con detección simultánea del antígeno glutamato deshidrogenasa (GDH) y de las toxinas A/B mediante enzimoinmunoanálisis (TechlabC. diff Quik Chek Complete). Con antígeno positivo pero detección de toxinas negativa, se realizó PCR del gen de la toxina B (Cepheid Xpert C. difficile) que incluyó la detección de cepas hipervirulentas ribotipo 027. La interpretación y emisión de los resultados al clínico y la división de los grupos de estudio se especifica a continuación: GDH-/Tox-: negativo, GDH+/Tox+: positivo (grupo 1) y GDH+/Tox-/PCRXpert+: positivo (grupo 2). La búsqueda de enteropatógenos bacterianos (Salmonella enterica spp., Campylobacter spp., Shigella spp., Yersinia enterocolitica, Aeromonas spp., Plesiomonas shigelloides) se realizó en 71 muestras mediante cultivo en medios selectivos y diferenciales. La detección de rotavirus y adenovirus se realizó en 72 muestras y el estudio de parásitos en 12 muestras. Se realizó cribado de Cryptosporidium/Giardia en todas las heces (<14 años) o en pacientes inmunodeprimidos por prueba rápida inmunocromatográfica, según rutina asistencial.
Definiciones:
- I.
Episodio de diarrea: presencia de al menos 3 deposiciones blandas/líquidas en 24h.
- II.
ICD asociada a cuidados sanitarios: diarrea en las 48 h posteriores al ingreso hasta el alta o en la readmisión dentro de las 4 semanas posteriores al alta.
- III.
ICD comunitaria: diarrea que ocurre en la comunidad o en las primeras 48 h de hospitalización, sin hospitalización previa en un periodo mayor a las 12 semanas.
- IV.
ICD indeterminada: diarrea que ocurre en la comunidad entre 4 y 12 semanas desde una hospitalización previa.
El procedimiento de obtención de datos clínicos fue la revisión de historias clínicas en formato físico y electrónico. El análisis estadístico de datos se realizó mediante SPSS v. 22. Las variables cualitativas se analizaron mediante chi cuadrado o test exacto de Fisher y las cuantitativas mediante U de Mann-Whitney, utilizando medianas (Me) y rangos intercuartílicos (RIC, percentil 75-percentil 25) como medidas de dispersión. El nivel de significación estadística fue p<0,05.
Este estudio ha obtenido la aprobación del Comité Ético de Investigación Clínica del Hospital Universitario La Paz, con el código PI-2682.
ResultadosSe incluyó en el estudio a 82 pacientes: se descartó a 7 de ellos por presentar datos incompletos. La distribución fue de 2 casos en 2010 (mayo-diciembre), 10 casos en 2011, 12 casos en 2012, 19 casos en 2013, 26 casos en 2014 y 13 casos en 2015 (enero-mayo).
Sobre el total de 75 pacientes, la ICD asociada a cuidados sanitarios fue la más frecuente con 62 casos (82,7%) repartidos equitativamente entre los 2grupos. La incidencia anual de este tipo de infección fue de 5,75 episodios/10.000 estancias pediátricas (2011), 10,50 episodios/10.000 estancias pediátricas (2012), 21,75 episodios/10.000 estancias pediátricas (2013) y 20,19 episodios/10.000 estancias pediátricas (2014). Hubo 10 casos (13,3% del total) de ICD comunitaria distribuidos entre los 2grupos y 3 casos (4%) de ICD indeterminada.
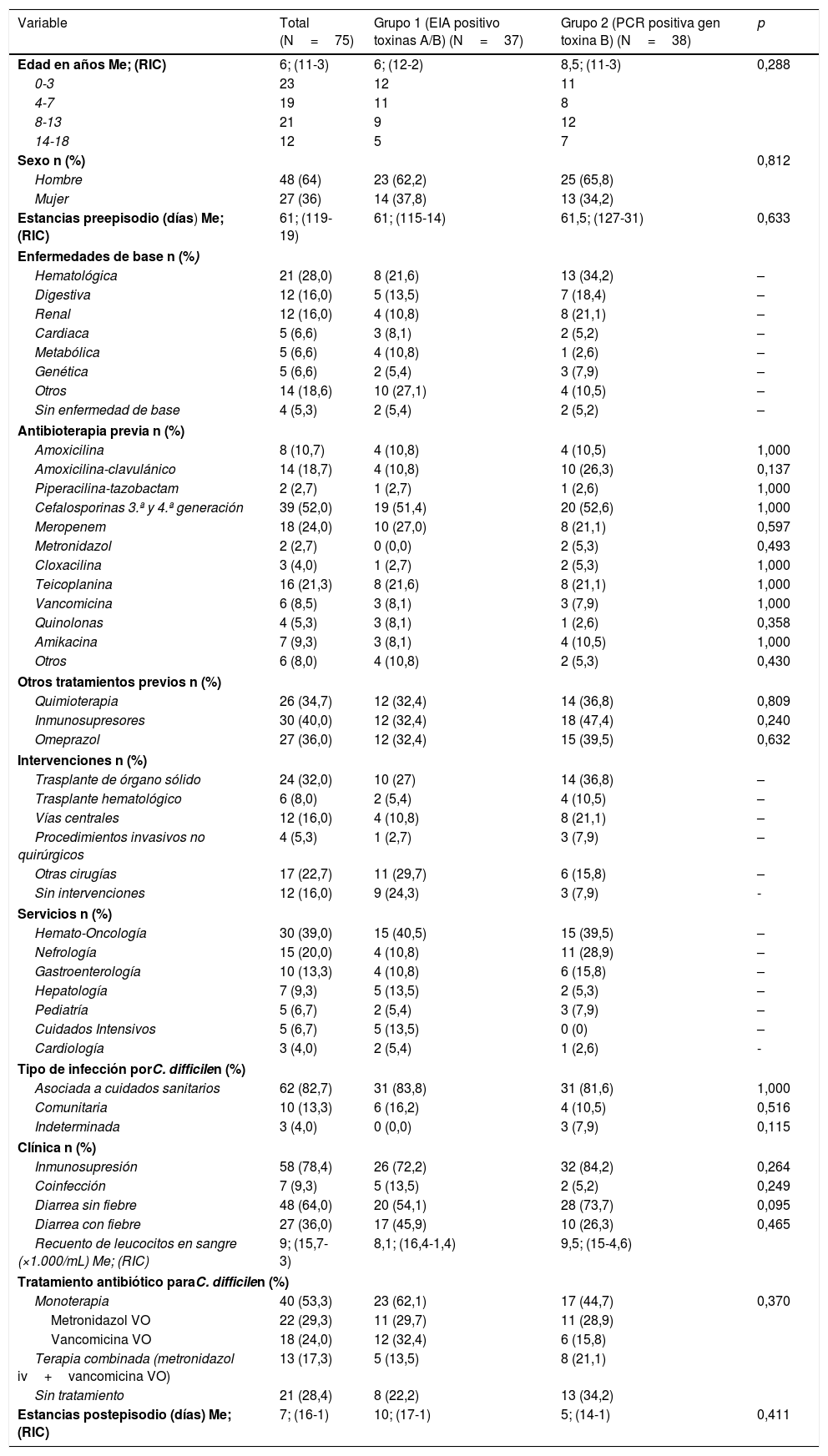
Las variables analizadas se muestran en la tabla 1. En cuanto a variables de evolución, se presentaron 9 recurrencias, 2 admisiones en UCI, 9 fallecimientos (uno en los 30 días posteriores al diagnóstico), pero ninguno atribuible a la ICD, ningún íleo paralítico ni ningún caso de colitis pseudomembranosa.
Variables cualitativas y cuantitativas de los pacientes incluidos en el estudio
| Variable | Total (N=75) | Grupo 1 (EIA positivo toxinas A/B) (N=37) | Grupo 2 (PCR positiva gen toxina B) (N=38) | p |
|---|---|---|---|---|
| Edad en años Me; (RIC) | 6; (11-3) | 6; (12-2) | 8,5; (11-3) | 0,288 |
| 0-3 | 23 | 12 | 11 | |
| 4-7 | 19 | 11 | 8 | |
| 8-13 | 21 | 9 | 12 | |
| 14-18 | 12 | 5 | 7 | |
| Sexo n (%) | 0,812 | |||
| Hombre | 48 (64) | 23 (62,2) | 25 (65,8) | |
| Mujer | 27 (36) | 14 (37,8) | 13 (34,2) | |
| Estancias preepisodio (días) Me; (RIC) | 61; (119-19) | 61; (115-14) | 61,5; (127-31) | 0,633 |
| Enfermedades de base n (%) | ||||
| Hematológica | 21 (28,0) | 8 (21,6) | 13 (34,2) | – |
| Digestiva | 12 (16,0) | 5 (13,5) | 7 (18,4) | – |
| Renal | 12 (16,0) | 4 (10,8) | 8 (21,1) | – |
| Cardiaca | 5 (6,6) | 3 (8,1) | 2 (5,2) | – |
| Metabólica | 5 (6,6) | 4 (10,8) | 1 (2,6) | – |
| Genética | 5 (6,6) | 2 (5,4) | 3 (7,9) | – |
| Otros | 14 (18,6) | 10 (27,1) | 4 (10,5) | – |
| Sin enfermedad de base | 4 (5,3) | 2 (5,4) | 2 (5,2) | – |
| Antibioterapia previa n (%) | ||||
| Amoxicilina | 8 (10,7) | 4 (10,8) | 4 (10,5) | 1,000 |
| Amoxicilina-clavulánico | 14 (18,7) | 4 (10,8) | 10 (26,3) | 0,137 |
| Piperacilina-tazobactam | 2 (2,7) | 1 (2,7) | 1 (2,6) | 1,000 |
| Cefalosporinas 3.ª y 4.ª generación | 39 (52,0) | 19 (51,4) | 20 (52,6) | 1,000 |
| Meropenem | 18 (24,0) | 10 (27,0) | 8 (21,1) | 0,597 |
| Metronidazol | 2 (2,7) | 0 (0,0) | 2 (5,3) | 0,493 |
| Cloxacilina | 3 (4,0) | 1 (2,7) | 2 (5,3) | 1,000 |
| Teicoplanina | 16 (21,3) | 8 (21,6) | 8 (21,1) | 1,000 |
| Vancomicina | 6 (8,5) | 3 (8,1) | 3 (7,9) | 1,000 |
| Quinolonas | 4 (5,3) | 3 (8,1) | 1 (2,6) | 0,358 |
| Amikacina | 7 (9,3) | 3 (8,1) | 4 (10,5) | 1,000 |
| Otros | 6 (8,0) | 4 (10,8) | 2 (5,3) | 0,430 |
| Otros tratamientos previos n (%) | ||||
| Quimioterapia | 26 (34,7) | 12 (32,4) | 14 (36,8) | 0,809 |
| Inmunosupresores | 30 (40,0) | 12 (32,4) | 18 (47,4) | 0,240 |
| Omeprazol | 27 (36,0) | 12 (32,4) | 15 (39,5) | 0,632 |
| Intervenciones n (%) | ||||
| Trasplante de órgano sólido | 24 (32,0) | 10 (27) | 14 (36,8) | – |
| Trasplante hematológico | 6 (8,0) | 2 (5,4) | 4 (10,5) | – |
| Vías centrales | 12 (16,0) | 4 (10,8) | 8 (21,1) | – |
| Procedimientos invasivos no quirúrgicos | 4 (5,3) | 1 (2,7) | 3 (7,9) | – |
| Otras cirugías | 17 (22,7) | 11 (29,7) | 6 (15,8) | – |
| Sin intervenciones | 12 (16,0) | 9 (24,3) | 3 (7,9) | - |
| Servicios n (%) | ||||
| Hemato-Oncología | 30 (39,0) | 15 (40,5) | 15 (39,5) | – |
| Nefrología | 15 (20,0) | 4 (10,8) | 11 (28,9) | – |
| Gastroenterología | 10 (13,3) | 4 (10,8) | 6 (15,8) | – |
| Hepatología | 7 (9,3) | 5 (13,5) | 2 (5,3) | – |
| Pediatría | 5 (6,7) | 2 (5,4) | 3 (7,9) | – |
| Cuidados Intensivos | 5 (6,7) | 5 (13,5) | 0 (0) | – |
| Cardiología | 3 (4,0) | 2 (5,4) | 1 (2,6) | - |
| Tipo de infección porC. difficilen (%) | ||||
| Asociada a cuidados sanitarios | 62 (82,7) | 31 (83,8) | 31 (81,6) | 1,000 |
| Comunitaria | 10 (13,3) | 6 (16,2) | 4 (10,5) | 0,516 |
| Indeterminada | 3 (4,0) | 0 (0,0) | 3 (7,9) | 0,115 |
| Clínica n (%) | ||||
| Inmunosupresión | 58 (78,4) | 26 (72,2) | 32 (84,2) | 0,264 |
| Coinfección | 7 (9,3) | 5 (13,5) | 2 (5,2) | 0,249 |
| Diarrea sin fiebre | 48 (64,0) | 20 (54,1) | 28 (73,7) | 0,095 |
| Diarrea con fiebre | 27 (36,0) | 17 (45,9) | 10 (26,3) | 0,465 |
| Recuento de leucocitos en sangre (×1.000/mL) Me; (RIC) | 9; (15,7-3) | 8,1; (16,4-1,4) | 9,5; (15-4,6) | |
| Tratamiento antibiótico paraC. difficilen (%) | ||||
| Monoterapia | 40 (53,3) | 23 (62,1) | 17 (44,7) | 0,370 |
| Metronidazol VO | 22 (29,3) | 11 (29,7) | 11 (28,9) | |
| Vancomicina VO | 18 (24,0) | 12 (32,4) | 6 (15,8) | |
| Terapia combinada (metronidazol iv+vancomicina VO) | 13 (17,3) | 5 (13,5) | 8 (21,1) | |
| Sin tratamiento | 21 (28,4) | 8 (22,2) | 13 (34,2) | |
| Estancias postepisodio (días) Me; (RIC) | 7; (16-1) | 10; (17-1) | 5; (14-1) | 0,411 |
EIA: enzimoinmunoanálisis; Me: mediana; RIC: rango intercuartílico (p75-p25).
Por grupos diagnósticos, no hubo diferencias estadísticamente significativas entre las variables analizadas. Los pacientes del grupo 1 presentaron fiebre asociada a diarrea con más frecuencia que los del grupo 2 (45,9 vs. 26,3%), aunque sin diferencias estadísticamente significativas. El RIC para el recuento de leucocitos en sangre (×1.000/mL) fue de 15,7-3, con leucocitopenia (<4.000/mL) en 20 pacientes (13 vs. 7), fundamentalmente hematológicos y trasplantados. En cuanto al tratamiento con metronidazol o vancomicina oral en monoterapia o combinada con metronidazol i.v., 8 pacientes del grupo 1 y 13 del grupo 2 no fueron tratados. Atendiendo a los grupos diagnósticos por años, hubo 37 casos para el grupo 1 distribuidos así: 2 (mayo-diciembre 2010), 4 (2011), 5 (2012), 9 (2013), 10 (2014), 7 (enero-mayo de 2015) y 38 casos para el grupo 2 distribuidos así: 2 (2011), 5 (2012), 10 (2013), 16 (2014), 5 (enero-mayo de 2015). Con estos datos encontramos que no se han diagnosticado más casos por PCR que por detección de toxinas en los 5 años.
Hubo 7coinfecciones, 5 en el grupo 1 (rotavirus, Aeromonas hydrophila, Cryptosporidium parvum y 2 Campylobacter jejuni) y 2en el grupo 2 (rotavirus y Aeromonas caviae). No se detectaron cepas hipervirulentas ribotipo 027 en el grupo 2 tras su análisis por PCR.
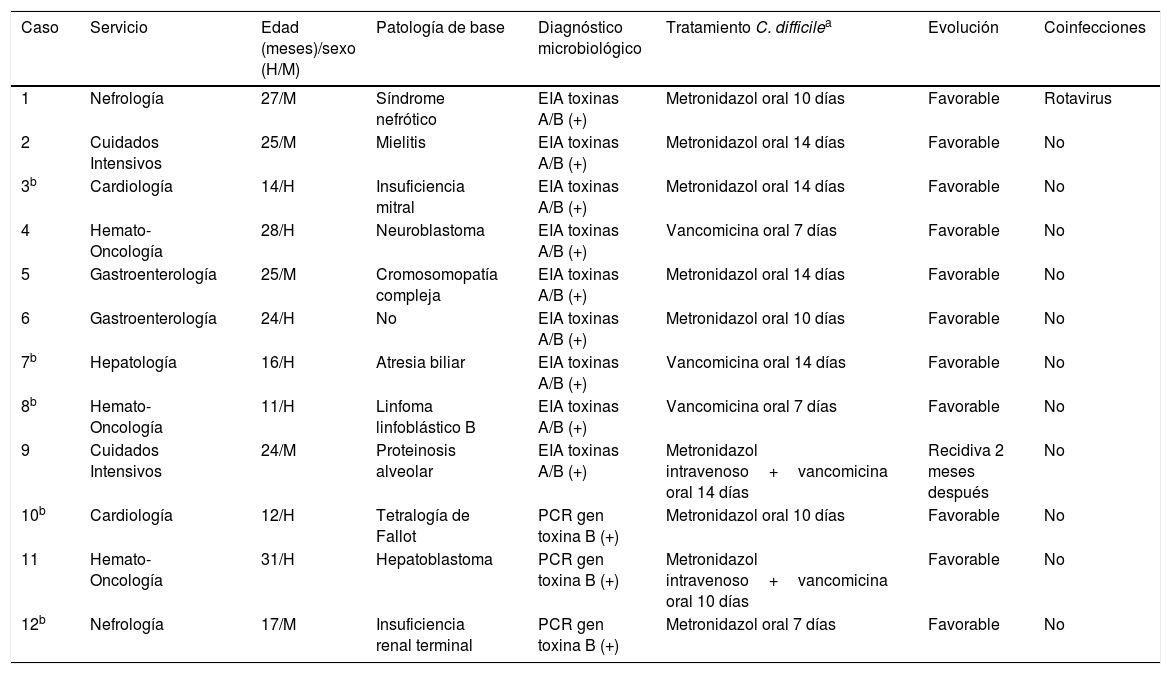
La tabla 2 muestra los 12 casos (de los 17 pacientes con detección de C. difficile toxigénico) en niños menores de 3 años con clínica y tratamiento con metronidazol o vancomicina.
Pacientes menores de 3 años con infección asociada a C. difficile
| Caso | Servicio | Edad (meses)/sexo (H/M) | Patología de base | Diagnóstico microbiológico | Tratamiento C. difficilea | Evolución | Coinfecciones |
|---|---|---|---|---|---|---|---|
| 1 | Nefrología | 27/M | Síndrome nefrótico | EIA toxinas A/B (+) | Metronidazol oral 10 días | Favorable | Rotavirus |
| 2 | Cuidados Intensivos | 25/M | Mielitis | EIA toxinas A/B (+) | Metronidazol oral 14 días | Favorable | No |
| 3b | Cardiología | 14/H | Insuficiencia mitral | EIA toxinas A/B (+) | Metronidazol oral 14 días | Favorable | No |
| 4 | Hemato-Oncología | 28/H | Neuroblastoma | EIA toxinas A/B (+) | Vancomicina oral 7 días | Favorable | No |
| 5 | Gastroenterología | 25/M | Cromosomopatía compleja | EIA toxinas A/B (+) | Metronidazol oral 14 días | Favorable | No |
| 6 | Gastroenterología | 24/H | No | EIA toxinas A/B (+) | Metronidazol oral 10 días | Favorable | No |
| 7b | Hepatología | 16/H | Atresia biliar | EIA toxinas A/B (+) | Vancomicina oral 14 días | Favorable | No |
| 8b | Hemato-Oncología | 11/H | Linfoma linfoblástico B | EIA toxinas A/B (+) | Vancomicina oral 7 días | Favorable | No |
| 9 | Cuidados Intensivos | 24/M | Proteinosis alveolar | EIA toxinas A/B (+) | Metronidazol intravenoso+vancomicina oral 14 días | Recidiva 2 meses después | No |
| 10b | Cardiología | 12/H | Tetralogía de Fallot | PCR gen toxina B (+) | Metronidazol oral 10 días | Favorable | No |
| 11 | Hemato-Oncología | 31/H | Hepatoblastoma | PCR gen toxina B (+) | Metronidazol intravenoso+vancomicina oral 10 días | Favorable | No |
| 12b | Nefrología | 17/M | Insuficiencia renal terminal | PCR gen toxina B (+) | Metronidazol oral 7 días | Favorable | No |
EIA: enzimoinmunoanálisis.
A pesar de que sigue creciendo tanto el número de casos como la gravedad de la ICD7, es una causa infraestimada de diarrea en pacientes pediátricos. Una de las razones es la alta tasa de colonizaciones asintomáticas en lactantes menores de un año y la percepción de la falta de susceptibilidad a esta infección8, bien por inmadurez de los enterocitos o de sus receptores para las toxinas. En nuestra serie de casos, la incidencia anual ha ido en ascenso a lo largo del periodo estudiado, que podría ser debido a mejoras en el método diagnóstico y a una mayor sospecha clínica.
Entre los factores de riesgo analizados, resaltamos una prolongada hospitalización previa con un alto porcentaje de ICD asociada a cuidados sanitarios. Cabe destacar el elevado número de estancias previas (Me=6, RIC=119-19) y enfermedad de base mayoritariamente hematológica. Boyle et al. demostraron un alto riesgo de ICD en los 100 días posteriores al trasplante de médula ósea pediátrico9. La antibioterapia de amplio espectro, sobre todo cefalosporinas de 3.ª-4.ª generación (>50%), quimioterápicos, inmunosupresores y omeprazol fueron los fármacos más utilizados debido a las múltiples enfermedades asociadas. Las intervenciones previas principales fueron los trasplantes de órgano sólido, seguidas de trasplantes de médula ósea y cirugías abdominales, cardiacas, renales y de la canalización de vías centrales. Los pacientes estaban adscritos principalmente al Servicio de Hemato-Oncología (39%), Hepatología, Gastroenterología y Nefrología. Prácticamente todos nuestros pacientes presentaron los factores de riesgo descritos en la literatura. Comorbilidades, fundamentalmente hematológicas, inmunosupresión, enfermedad de Hirschprung y enfermedad intestinal de base son frecuentemente asociadas a ICD en pediatría10.
La presencia de fiebre asociada a diarrea fue más frecuente en el grupo 1 y no recibir tratamiento específico fue más frecuente en el grupo 2, pero sin diferencias significativas. Un uso elevado de vancomicina en ambos grupos podría explicarse por las graves enfermedades de base en estos pacientes.
Las distintas series describen menor gravedad y mortalidad en niños que en adultos, con un 88% de pacientes pediátricos sin complicaciones asociadas y un curso clínico benigno11. De los 17 pacientes menores de 3 años, 5 no fueron tratados. Por tanto, nuestro estudio presentó 12 casos de ICD en menores de 3 años tratados y todos con una respuesta favorable; el menor de ellos tenía 11 meses. Solo hubo una coinfección con rotavirus y una recidiva 2meses después, en una paciente de Cuidados Intensivos con proteinosis alveolar y tratada con terapia combinada.
Existen estudios que no recomiendan la realización sistemática de pruebas diagnósticas en menores de 2 años. A pesar de la interpretación incierta de los resultados debido a las altas tasas de colonización12,13, consideramos que sería recomendable realizar el diagnóstico de la infección por C. difficile siempre que la sospecha clínica lo requiera, independientemente de la edad10,14,15. Guías anteriores13 valoran que, aunque es prudente evitar los test diagnósticos para ICD en menores de un año, recientes datos han mostrado que el 26% de los niños hospitalizados con ICD fueron menores de un año y el 5% fueron neonatos, aunque sin posibilidad de determinar si eran verdaderas infecciones o portadores asintomáticos: se deben buscar etiologías alternativas. Se propone que un resultado positivo en niños de 2-3 años indica una posible ICD.
Son limitaciones del estudio su naturaleza retrospectiva y la difícil valoración del resultado microbiológico por PCR para diferenciar colonización de infección en esta población. Como ventajas destacamos un tamaño muestral elevado y 2grupos de diagnóstico representativos y homogéneos.
En conclusión, en nuestro medio observamos un ligero incremento de casos de ICD a lo largo del periodo analizado, lo que coincide con la literatura, que lo describe como una enfermedad emergente y en aumento en este tipo de población. En nuestra casuística, destacamos la presencia de infecciones en niños menores de 2 años y la ausencia de diferencias clínicas y epidemiológicas estadísticamente significativas entre los pacientes diagnosticados mediante enzimoinmunoanálisis de las toxinas A/B y los diagnosticados mediante PCR del gen de la toxina B.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.