La endocarditis infecciosa (EI) pediátrica es un cuadro grave con mortalidad significativa. La información en España es limitada y procede de series de casos de centros únicos. El objetivo fue describir la epidemiología, la clínica, la microbiología y los resultados de la EI pediátrica en Andalucía.
Pacientes y métodosEstudio descriptivo observacional retrospectivo multicéntrico de pacientes <18años con diagnóstico de EI en 6 hospitales andaluces durante el periodo 2008-2020.
ResultadosSe identificaron 44 episodios de EI (41 pacientes) con mediana de edad de 103 meses (RIQ 37-150 meses). Las cardiopatías congénitas (CC) fueron el principal factor predisponente, presente en 34 casos (77%). Un total de 21 (48%) episodios de EI ocurrieron en pacientes con material protésico. Estos tuvieron una mayor tasa de CC (p=0,002) y disfunción orgánica (p=0,04) que aquellos con válvula nativa.
La fiebre fue un síntoma prácticamente universal asociada con insuficiencia cardíaca en el 23% de los episodios. Staphylococcus aureus (25%), estafilococos coagulasa negativos (18%) y Streptococcus viridans (14%) fueron los microorganismos aislados con mayor frecuencia y tres (7%) pacientes portadores de catéter venoso central tuvieron una infección fúngica.
Se observaron complicaciones tromboembólicas en el 30% de los episodios, y tuvieron requerimientos quirúrgicos el 48% de casos. La mortalidad fue del 9%. El material protésico y la PCR >140mg/l fueron predictores independientes de EI complicada.
ConclusionesLos hallazgos del estudio subrayan la elevada morbilidad de la EI pediátrica. La información generada podría favorecer la identificación de los perfiles epidemiológicos y clínicos de los niños con EI y formas complicadas.
Paediatric infective endocarditis (IE) is a serious condition associated with significant mortality. Information in Spain is limited and comes from case series from single centres. The aim was to describe the epidemiology, clinical features, microbiology and outcome of paediatric IE in Andalusia.
Patients and methodsMulti-centre descriptive observational retrospective study of patients <18years old with a diagnosis of IE who were admitted to six Andalusian hospitals during 2008-2020.
Results44 episodes of IE (41 patients) with a median age of 103months (IQR 37-150 months) were identified. Congenital heart disease (CHD) was the main predisposing factor, identified in 34 cases (77%). A total of 21 (48%) episodes of IE occurred in patients with prosthetic material. These had higher rate of CHD (P=.002) and increased end organ dysfunction (P=.04) compared to those with native valve.
Fever was an almost universal symptom, associated in 23% of the episodes with heart failure. Staphylococcus aureus (25%) followed by coagulase-negative staphylococci (18%) and Streptococcus viridans (14%) were the most frequently isolated microorganisms, and three (7%) patients with central venous catheters had a fungal infection.
Thromboembolic events were observed in 30% of the episodes, surgical intervention was required in 48% of cases. Mortality rate was 9%. Prosthetic material and CRP >140mg/L were independent predictors of complicated IE.
ConclusionsOur findings emphasise the high morbidity of paediatric IE. The information provided could be useful for the identification of epidemiological and clinical profiles of children with IE and complicated forms.
La endocarditis infecciosa (EI) en la edad pediátrica es un importante problema clínico1,2. Aunque la incidencia de la EI en niños es baja, este cuadro se asocia con una importante morbilidad y una significativa mortalidad1-5 Además, su manejo es complejo y difícil, por lo que se recomienda sea realizado en centros especializados por un equipo multidisciplinario y con una amplia experiencia en este proceso infeccioso6. Por estos motivos es importante tener un conocimiento profundo y actualizado de la epidemiologia, la microbiología, la clínica, los factores pronósticos, la prevención y el tratamiento de la EI, características que pueden haber cambiado en los años recientes.
La información publicada en la literatura sobre la EI pediátrica es limitada y de baja calidad metodológica al proceder, casi exclusivamente, de estudios descriptivos observacionales realizados con mayor frecuencia en centros únicos; en ella se incluyen tres series de casos comunicadas previamente en nuestro país, de las que dos de ellas son del mismo centro1,5,7-11. El objetivo de este primer estudio multicéntrico realizado en España de EI en la edad pediátrica fue describir la epidemiología, la clínica, la microbiología y los resultados en los pacientes pediátricos diagnosticados de EI en seis hospitales andaluces de tercer nivel.
Pacientes y métodosCasosLa Red de Endocarditis Pediátrica Andaluza (REPA) es un grupo colaborativo multicéntrico que recoge de forma retrospectiva y prospectiva episodios de EI en hospitales de Andalucía, España. Se realizó un estudio descriptivo observacional retrospectivo de pacientes con EI pediátrica atendidos en seis hospitales de tercer nivel en Andalucía, España: Hospital Universitario Virgen del Rocío (HUVR), Hospital Regional Universitario de Málaga (HURM), Hospital Universitario Reina Sofía (HURS), Hospital Juan Ramón Jiménez (HJRJ), Hospital Universitario Virgen de las Nieves (HVN) y Hospital Universitario Puerta del Mar (HUPM). El periodo de estudio se extendió desde enero de 2008 a diciembre de 2020.
Criterios de inclusiónSe seleccionaron de la base de datos electrónica de atención hospitalaria del Sistema Sanitario Público de Andalucía las historias clínicas que contenían en el juicio diagnóstico el término endocarditis en pacientes <18años. Esta estrategia se complementó con la búsqueda de posibles casos adicionales en las bases de datos internas de las secciones de Infectología y Cardiología pediátrica de los seis hospitales participantes. Las historias clínicas seleccionadas fueron revisadas por los investigadores del estudio. Finalmente, se seleccionaron todos aquellos casos que cumplían los criterios de EI definida o posible según los Criterios de Duke modificados por la Sociedad Europea de Cardiología (ESC)6.
Variables incluidas en el estudio y definicionesSe describieron y analizaron variables demográficas, factores predisponentes, manifestaciones clínicas, hallazgos microbiológicos y de laboratorio, tratamiento y resultado clínico. Las variables demográficas y los factores predisponentes incluidos fueron: edad, género, antecedentes personales, cardiopatía de base, intervención quirúrgica previa, dispositivos al momento de diagnóstico y hallazgos ecocardiográficos. Se incluyeron como hallazgos de laboratorio los valores de hemoglobina y PCR y los recuentos de leucocitos, neutrófilos y plaquetas. Finalmente, se recogió la información sobre la duración del tratamiento antibiótico empírico, dirigido y total, la necesidad, el tipo de tratamiento quirúrgico y el tiempo desde el diagnóstico a la intervención quirúrgica, y el resultado final.
Se definió un episodio de EI como asociado a los cuidados sanitarios cuando el episodio ocurrió ≥48horas después del ingreso hospitalario, o era portador de un catéter venoso central (CVC) o con antecedentes de cateterismo o cirugía cardiaca en los 30días previos al diagnóstico de EI.
Se incluyeron dentro del grupo de material protésico los pacientes con material protésico cardíaco: shunts o conductos, válvulas protésicas y dispositivos cardiacos implantables (p.ej., desfibrilador).
Se consideró como causal un organismo cuando se identificó en al menos dos hemocultivos o en un cultivo de una muestra quirúrgica.
Se categorizó un episodio de EI como complicado cuando durante su evolución presentó alguno de los siguientes resultados: muerte, necesidad de cirugía, evidencia de manifestaciones tromboembólicas o de disfunción orgánica.
Se incluyeron dentro del grupo de patógenos con mayor virulencia los patógenos identificados en los casos de EI distintos a estafilococos coagulasa negativos (ECN), Streptococcus viridans, Corynebacterium pseudodiphtericum y Kingella kingae.
Análisis estadísticoEl procesamiento estadístico se realizó utilizando el paquete SSPS 26.0. Se realizó estadística descriptiva mediante frecuencias absolutas y relativas y análisis univariante de la asociación entre las características de los casos y ser o no portador de material protésico. Las variables categóricas se compararon mediante la χ2 y el test exacto de Fisher, según fuera apropiado. Para la comparación de las variables continuas se utilizó el test de la U de Mann-Whitney y se realizó un análisis multivariante de predictores independientes asociados al desarrollo de EI complicada. Inicialmente se realizó un análisis bivariante de potenciales predictores de EI complicada: edad <3años, duración de síntomas previos al diagnóstico <9días, material protésico, PCR >140mg/l e infecciones por gérmenes con virulencia incrementada. Las variables con un valor p<0,10 en este análisis bivariante se introdujeron posteriormente en un modelo de regresión logística binaria. Se consideró en todos los modelos una prueba significativa cuando el valor de p fue <0,05.
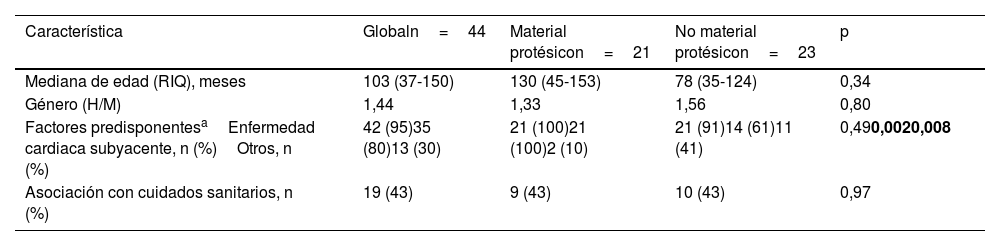
ResultadosCaracterísticas demográficasDurante el periodo de estudio se identificaron 44 episodios de EI en 41 pacientes pediátricos Una paciente con material protésico tuvo tres episodios de reinfecciones de EI con un intervalo temporal >6meses tras un episodio previo y etiologías diferentes. Los 41 pacientes fueron tratados en los siguientes hospitales: HUVR (n=18), HURM (n=10), HURS (n=5), HUPM (n=3), HVN (n=3) y HJRJ (n=2). La mediana de edad fue de 103meses (RIQ 37-150meses) y la enfermedad fue más frecuente en varones (V/M: 1,44) (tabla 1).
Características demográficas de los 44 episodios de endocarditis infecciosa (EI) en seis hospitales terciarios andaluces en el periodo 2008-2020
| Característica | Globaln=44 | Material protésicon=21 | No material protésicon=23 | p |
|---|---|---|---|---|
| Mediana de edad (RIQ), meses | 103 (37-150) | 130 (45-153) | 78 (35-124) | 0,34 |
| Género (H/M) | 1,44 | 1,33 | 1,56 | 0,80 |
| Factores predisponentesaEnfermedad cardiaca subyacente, n (%)Otros, n (%) | 42 (95)35 (80)13 (30) | 21 (100)21 (100)2 (10) | 21 (91)14 (61)11 (41) | 0,490,0020,008 |
| Asociación con cuidados sanitarios, n (%) | 19 (43) | 9 (43) | 10 (43) | 0,97 |
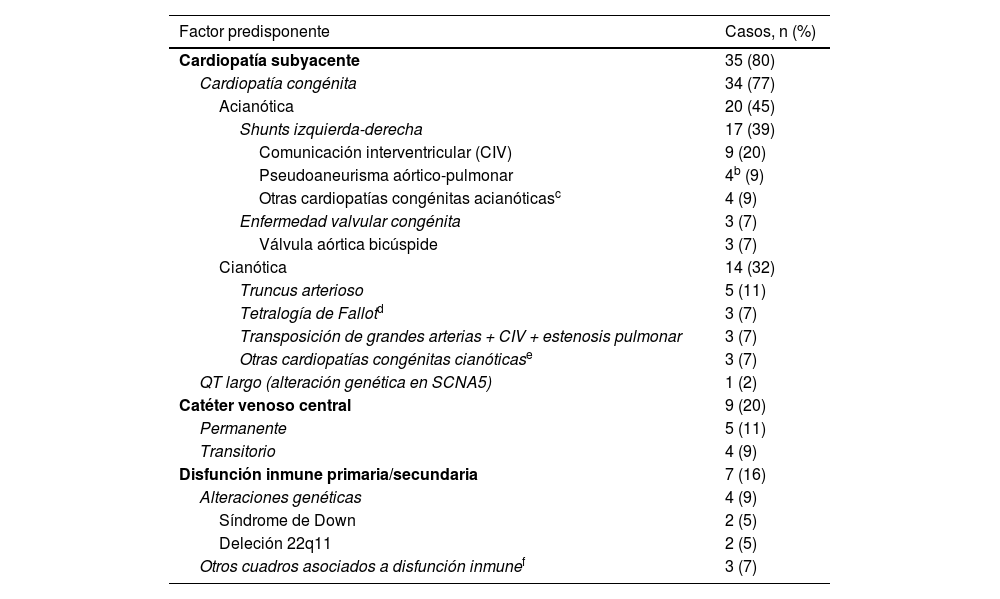
Un total de 42 (95%) episodios tuvieron factores predisponentes asociados, de ellos 35 episodios con antecedentes de cardiopatía subyacente (80%) y 13 episodios con otros factores predisponentes (30%) (algunos episodios se asociaron con más de un factor predisponente) (tabla 2). A nivel más específico se identificaron los siguientes factores predisponentes: 34 (77%) episodios con CC, 9 (20%) episodios en portadores de catéter venoso central (CVC), 7 (15%) episodios con disfunción inmune, y un (2%) episodio asociado a QT largo en un paciente portador de desfibrilador automático implantable (DAI) bicameral. Los 34 episodios con CC se distribuyeron respectivamente en 20 (45%) y 14 (32%) casos con cardiopatía acianótica y cianótica, respectivamente (tabla 2). Las CC acianóticas más prevalentes fueron (n, %): comunicación interventricular (CIV) (9; 20%), pseudoaneurismas aórtico-pulmonares (4; 9%) (descritos en un único paciente) y válvula aórtica bicúspide (3; 7%). Por otra parte, las cardiopatías cianóticas identificadas con mayor frecuencia fueron (n; %): truncus arterioso (TA) (5; 11%) y tetralogía de Fallot (TF) (3; 7%). Las patologías asociadas con disfunción inmune fueron 2 (5%) casos de síndrome de Down y de síndrome de DiGeorge (del 22q11) y un único caso (2%) de tumor de Wilms, trasplante renal y prematuridad extrema.
Factores predisponentes en los 42 episodios de endocarditis infecciosa (EI) en el periodo 2008-2020a
| Factor predisponente | Casos, n (%) |
|---|---|
| Cardiopatía subyacente | 35 (80) |
| Cardiopatía congénita | 34 (77) |
| Acianótica | 20 (45) |
| Shunts izquierda-derecha | 17 (39) |
| Comunicación interventricular (CIV) | 9 (20) |
| Pseudoaneurisma aórtico-pulmonar | 4b (9) |
| Otras cardiopatías congénitas acianóticasc | 4 (9) |
| Enfermedad valvular congénita | 3 (7) |
| Válvula aórtica bicúspide | 3 (7) |
| Cianótica | 14 (32) |
| Truncus arterioso | 5 (11) |
| Tetralogía de Fallotd | 3 (7) |
| Transposición de grandes arterias + CIV + estenosis pulmonar | 3 (7) |
| Otras cardiopatías congénitas cianóticase | 3 (7) |
| QT largo (alteración genética en SCNA5) | 1 (2) |
| Catéter venoso central | 9 (20) |
| Permanente | 5 (11) |
| Transitorio | 4 (9) |
| Disfunción inmune primaria/secundaria | 7 (16) |
| Alteraciones genéticas | 4 (9) |
| Síndrome de Down | 2 (5) |
| Deleción 22q11 | 2 (5) |
| Otros cuadros asociados a disfunción inmunef | 3 (7) |
Se documentaron antecedentes de cirugía cardiaca previa en 22 (63%) de los 35 episodios con cardiopatía, y la cirugía se realizó con una mediana de 84días (RIQ 21-1.368días) antes del comienzo de la EI. Menos de la mitad (43%) de los episodios de EI se asociaron con cuidados sanitarios.
De acuerdo a las características clínicas y los hallazgos ecocardiográficos, 21 (48%) de los 44 episodios de EI ocurrieron en pacientes portadores de material protésico cardiaco: válvula protésica biológica (n=11), parche transanular (n=6), válvula protésica metálica (n=3) y DAI bicameral (n=1). La comparación de los episodios de EI entre estos pacientes y aquellos sin material protésico mostró una mayor proporción de cardiopatía subyacente en el primer grupo (p=0,002) y de otros factores predisponentes en el segundo grupo (p=0,008). No se encontraron diferencias significativas entre ambos grupos para el resto de las variables demográficas analizadas.
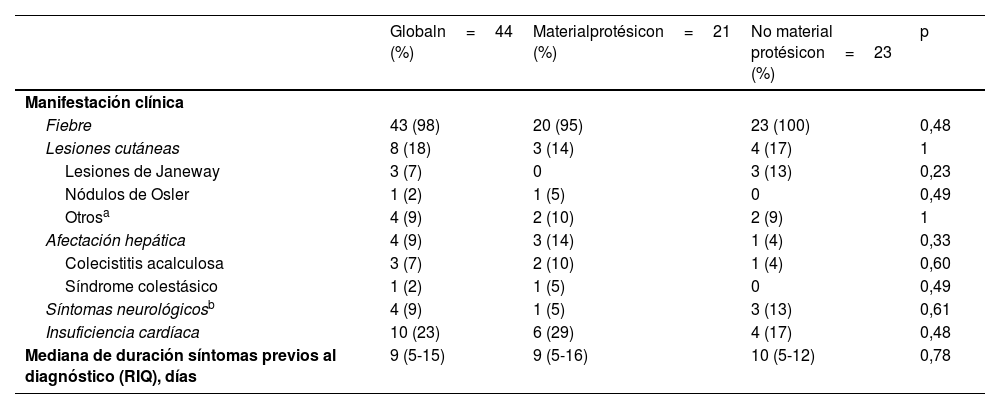
Manifestaciones clínicasLos 44 episodios de EI se clasificaron en 40 (91%) episodios de endocarditis definida y 4 (9%) episodios de endocarditis posible. La localización de las lesiones en EI afectó a cavidades derechas en 24 (55%) episodios, a cavidades izquierdas en 16 (36%) episodios, y en 4 (9%) casos la afectación fue bilateral.
La fiebre fue un síntoma prácticamente universal que se documentó en 43 (98%) de las 44 historias clínicas (tabla 3). Otros síntomas descritos en la presentación clínica fueron, por orden de prevalencia: insuficiencia cardíaca en 10 (23%) episodios, lesiones cutáneas en 8 (18%) episodios (lesiones de Janeway en 3 [7%] episodios y 1 [2%] episodio con nódulos de Osler, paniculitis septal, exantema petequial, exantema maculopapuloso y exantema urticarial), y afectación hepática y sintomatología neurológica en 4 (9%) episodios, de los que 3 (7%) casos de la primera correspondieron a una colecistitis acalculosa.
Manifestaciones clínicas de los 44 episodios de endocarditis infecciosa (EI)
| Globaln=44 (%) | Materialprotésicon=21 (%) | No material protésicon=23 (%) | p | |
|---|---|---|---|---|
| Manifestación clínica | ||||
| Fiebre | 43 (98) | 20 (95) | 23 (100) | 0,48 |
| Lesiones cutáneas | 8 (18) | 3 (14) | 4 (17) | 1 |
| Lesiones de Janeway | 3 (7) | 0 | 3 (13) | 0,23 |
| Nódulos de Osler | 1 (2) | 1 (5) | 0 | 0,49 |
| Otrosa | 4 (9) | 2 (10) | 2 (9) | 1 |
| Afectación hepática | 4 (9) | 3 (14) | 1 (4) | 0,33 |
| Colecistitis acalculosa | 3 (7) | 2 (10) | 1 (4) | 0,60 |
| Síndrome colestásico | 1 (2) | 1 (5) | 0 | 0,49 |
| Síntomas neurológicosb | 4 (9) | 1 (5) | 3 (13) | 0,61 |
| Insuficiencia cardíaca | 10 (23) | 6 (29) | 4 (17) | 0,48 |
| Mediana de duración síntomas previos al diagnóstico (RIQ), días | 9 (5-15) | 9 (5-16) | 10 (5-12) | 0,78 |
La mediana de duración de síntomas previos al diagnóstico fue de 9días (RIQ 5-15días). El episodio con la mayor demora diagnóstica (108días) ocurrió en un paciente con CIV con clínica muy leve e inespecífica de febrícula y artralgias y antecedentes de varios ciclos de antibioterapia oral. La sintomatología clínica y la duración de los síntomas previos al diagnóstico en los grupos con y sin material protésico fueron similares (tabla 3).
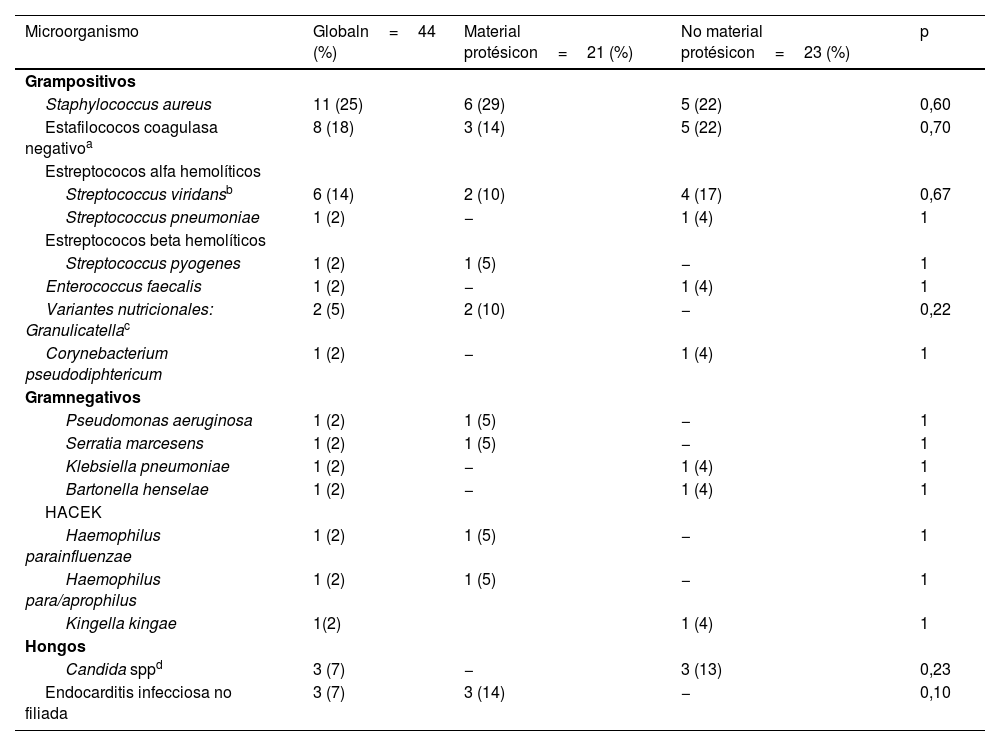
Hallazgos microbiológicosDurante el periodo de estudio se identificaron los patógenos causantes de la EI en 41 (93%) de los 44 episodios. Los microorganismos más prevalentes fueron, por orden de frecuencia (n; %): Staphylococcus aureus (11; 24%), Staphylococcus epidermidis (8; 18%), Streptococcus viridans (6; 14%), Candida spp. (3; 7%) y Granulicatella spp. (2; 5%). El resto de los microorganismos identificados se aislaron en un único episodio (tabla 4). Las tasas de resistencia a la meticilina en las infecciones estafilocócicas fueron del 9% y del 50% en S.aureus y S.epidemidis, respectivamente.
Hallazgos microbiológicos de los 44 episodios de endocarditis infecciosa (EI)
| Microorganismo | Globaln=44 (%) | Material protésicon=21 (%) | No material protésicon=23 (%) | p |
|---|---|---|---|---|
| Grampositivos | ||||
| Staphylococcus aureus | 11 (25) | 6 (29) | 5 (22) | 0,60 |
| Estafilococos coagulasa negativoa | 8 (18) | 3 (14) | 5 (22) | 0,70 |
| Estreptococos alfa hemolíticos | ||||
| Streptococcus viridansb | 6 (14) | 2 (10) | 4 (17) | 0,67 |
| Streptococcus pneumoniae | 1 (2) | − | 1 (4) | 1 |
| Estreptococos beta hemolíticos | ||||
| Streptococcus pyogenes | 1 (2) | 1 (5) | − | 1 |
| Enterococcus faecalis | 1 (2) | − | 1 (4) | 1 |
| Variantes nutricionales: Granulicatellac | 2 (5) | 2 (10) | − | 0,22 |
| Corynebacterium pseudodiphtericum | 1 (2) | − | 1 (4) | 1 |
| Gramnegativos | ||||
| Pseudomonas aeruginosa | 1 (2) | 1 (5) | − | 1 |
| Serratia marcesens | 1 (2) | 1 (5) | − | 1 |
| Klebsiella pneumoniae | 1 (2) | − | 1 (4) | 1 |
| Bartonella henselae | 1 (2) | − | 1 (4) | 1 |
| HACEK | ||||
| Haemophilus parainfluenzae | 1 (2) | 1 (5) | − | 1 |
| Haemophilus para/aprophilus | 1 (2) | 1 (5) | − | 1 |
| Kingella kingae | 1(2) | 1 (4) | 1 | |
| Hongos | ||||
| Candida sppd | 3 (7) | − | 3 (13) | 0,23 |
| Endocarditis infecciosa no filiada | 3 (7) | 3 (14) | − | 0,10 |
Los agentes etiológicos responsables de las infecciones en los grupos con y sin material protésico fueron similares. Debe señalarse, no obstante, que los tres casos de infección fúngica ocurrieron en paciente sin material protésico y portadores de CVC.
Hallazgos de laboratorioLos valores medios (±DE) de los niveles de hemoglobina y PCR fueron de 10,8 (±4,4) y 140 (±106)mg/l, y los recuentos de leucocitos y neutrófilos fueron de 12.270 (±6.156) y 8.546 (±5.855) células/μl, respectivamente. Las infecciones de material protésico tuvieron recuentos de leucocitos, de neutrófilos y valores medios de PCR más elevados y menor recuento plaquetario que los casos de infecciones sin material protésico, pero sin alcanzar la significación estadística.
Pruebas de imagenEn todos los episodios se realizó ecografía transtorácica, y además se realizó 18F-FDG-PET/TC en 9 (20%) episodios; 7 (16%) de estos episodios ocurrieron en pacientes con material protésico, y con ecografía transesofágica en 3 (7%) episodios.
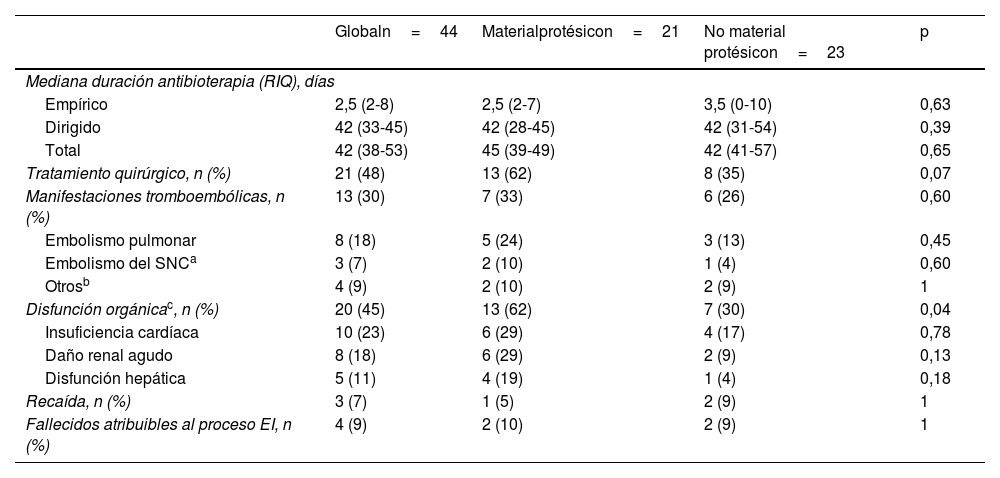
Tratamiento y resultado clínicoEl tratamiento antimicrobiano empírico fue variado en función de circunstancias individuales. En el episodio de infección por S.aureus resistente a meticilina el tratamiento empírico fue discordante por estar basado en betalactámicos y se optimizó posteriormente tras los resultados de hemocultivo y de sensibilidad antimicrobiana. El tratamiento antimicrobiano dirigido se realizó habitualmente de acuerdo con las pautas recomendadas en las guías clínicas de referencia para el manejo de la EI y una mayoría de los episodios en los años más recientes estuvieron incluidos dentro de programas de optimización del uso de antimicrobianos. En los 44 episodios de EI, las medianas de duración de antibioterapia total, empírica y dirigida fueron, respectivamente, de 42días (RIQ: 38-52 días), 2días (RIQ: 2-8 días) y 42días (RIQ: 33-45 días), mientras que los valores medios (±DE) correspondientes a estas mismas variables fueron de 47,5 (±29) días, 5,9 (±9,2) días y 45,4 (±27,6) días (tabla 5). La mediana de duración de antibioterapia total fue similar en las EI de cavidades derechas e izquierdas (42 vs 45días, p=0,94) y en las EI complicadas y no complicadas (50 vs 38días; p=0,38).
Tratamiento y resultado clínico de los 44 episodios de endocarditis infecciosa (EI)
| Globaln=44 | Materialprotésicon=21 | No material protésicon=23 | p | |
|---|---|---|---|---|
| Mediana duración antibioterapia (RIQ), días | ||||
| Empírico | 2,5 (2-8) | 2,5 (2-7) | 3,5 (0-10) | 0,63 |
| Dirigido | 42 (33-45) | 42 (28-45) | 42 (31-54) | 0,39 |
| Total | 42 (38-53) | 45 (39-49) | 42 (41-57) | 0,65 |
| Tratamiento quirúrgico, n (%) | 21 (48) | 13 (62) | 8 (35) | 0,07 |
| Manifestaciones tromboembólicas, n (%) | 13 (30) | 7 (33) | 6 (26) | 0,60 |
| Embolismo pulmonar | 8 (18) | 5 (24) | 3 (13) | 0,45 |
| Embolismo del SNCa | 3 (7) | 2 (10) | 1 (4) | 0,60 |
| Otrosb | 4 (9) | 2 (10) | 2 (9) | 1 |
| Disfunción orgánicac, n (%) | 20 (45) | 13 (62) | 7 (30) | 0,04 |
| Insuficiencia cardíaca | 10 (23) | 6 (29) | 4 (17) | 0,78 |
| Daño renal agudo | 8 (18) | 6 (29) | 2 (9) | 0,13 |
| Disfunción hepática | 5 (11) | 4 (19) | 1 (4) | 0,18 |
| Recaída, n (%) | 3 (7) | 1 (5) | 2 (9) | 1 |
| Fallecidos atribuibles al proceso EI, n (%) | 4 (9) | 2 (10) | 2 (9) | 1 |
Además de la antibioterapia, un total de 21 (48%) episodios necesitaron tratamiento quirúrgico (realizado con una media de 38 [±39] días después del diagnóstico de EI). Las indicaciones más frecuentes del tratamiento quirúrgico fueron infección no controlada (48%) y disfunción valvular con insuficiencia cardiaca (38%).
Se identificaron manifestaciones tromboembólicas en 13 (30%) episodios, de los cuales 8 (17%) casos fueron de embolismo pulmonar, 3 (7%) casos de embolismo en el sistema nervioso central (SNC) y 4 (9%) casos en otras localizaciones, incluyendo 2 episodios asociados con afectación pulmonar y del SNC. La tasa de complicaciones tromboembólicas fue más elevada en los episodios de EI causados por S.aureus comparados con otras etiologías infecciosas, pero sin alcanzar la significación estadística (45% vs 24%, p=0,16). Cinco de las manifestaciones embólicas se diagnosticaron por 18F-FDG-PET/TC, realizado únicamente en 9 casos de EI. Por otra parte, menos de la mitad (45%) de los casos de EI se asociaron con disfunción orgánica, siendo la más frecuente la insuficiencia cardíaca (n=10; 23%), seguida del daño renal agudo (DRA) (n=8; 18%) y la disfunción hepática (DH) (n=5; 11%).
Los episodios con evolución no favorable incluyeron 4 (9%) fallecimientos atribuibles a la EI, 3 (7%) recaídas, con respuesta posterior favorable al tratamiento, y 4 (9%) casos de curación con secuelas.
El grupo de episodios asociados a material protésico tuvo una mayor tasa de disfunción orgánica (62% vs 30%; p=0,04) que la observada en los episodios sin material protésico, con proporción de episodios con DRA y DH que fueron, respectivamente, 3 y 4 veces más elevados. No hubo diferencias estadísticamente significativas entre ambos grupos en las proporciones de manifestaciones tromboembólicas y requerimientos quirúrgicos.
Análisis multivariante: variables predictoras de EI complicadaSe categorizaron 28 (64%) episodios como EI complicada. Se encontró una asociación significativa por análisis bivariante entre EI complicada con presencia de material protésico (p=0,005), sin que se encontraran diferencias estadísticamente significativas para el resto de las variables predictoras analizadas: edad <3años, duración de síntomas previos al diagnóstico <9días, PCR >140mg/l (p=0,05) e infecciones por gérmenes con virulencia incrementada (según especificado en la sección de pacientes y métodos) (tabla material suplementario). Los predictores independientes de EI complicada por análisis multivariante mediante modelo de regresión logística binaria fueron el material protésico (OR: 6,2; IC95%: 1,2-31,8; p=0,03) y los valores de PCR >140mg/l (OR: 7,3; IC95%: 1,4-40; p=0,02).
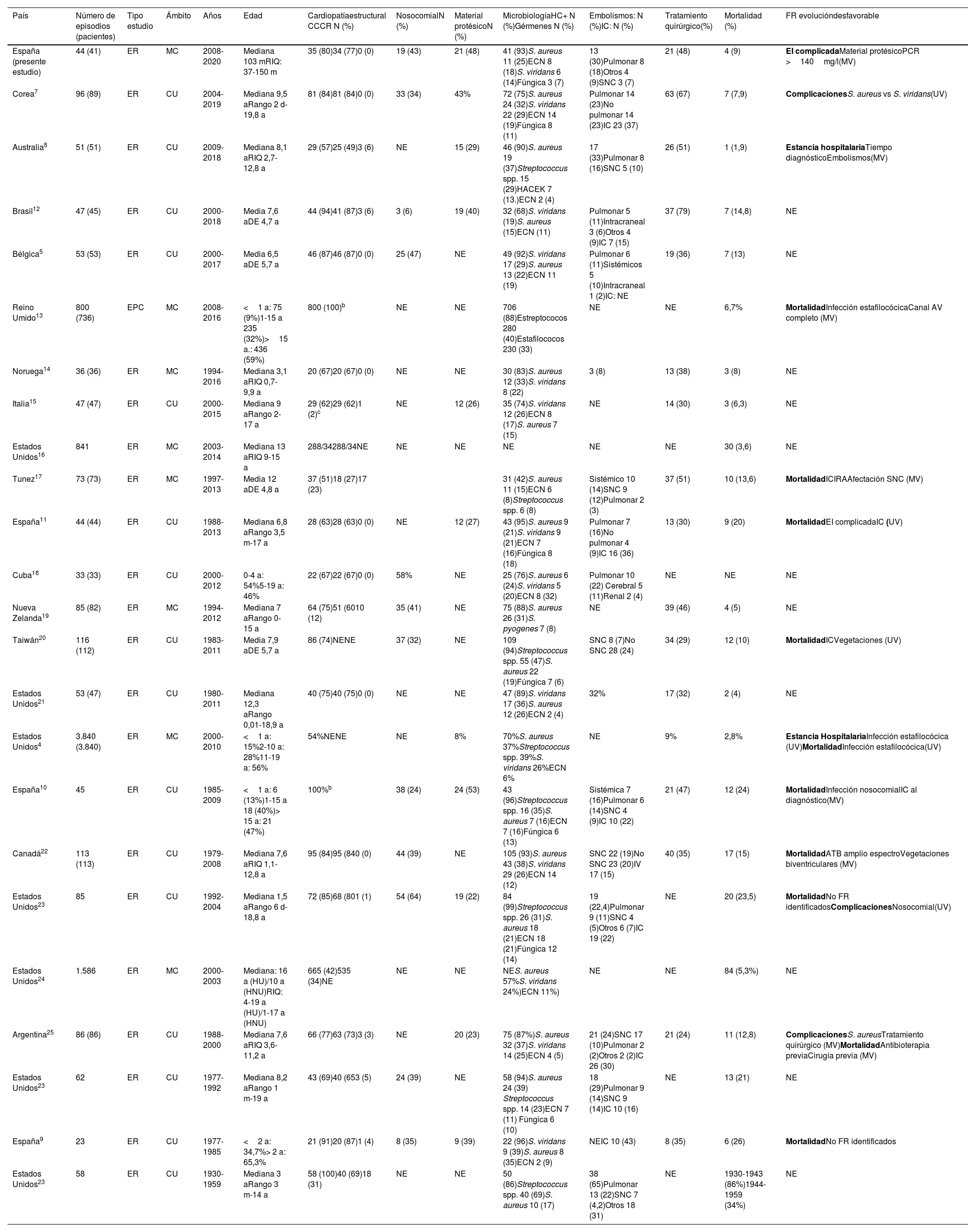
DiscusiónEl presente estudio ilustra sobre la epidemiología, la etiología microbiológica, la clínica y el resultado de una serie de casos de EI en pacientes pediátricos ingresados en seis de los principales hospitales terciarios de Andalucía. Los hallazgos más significativos se resumen en la tabla 6, y para su comparación se incluyen los estudios publicados sobre EI pediátrica desde el año 2000 y un estudio previo adicional de nuestro país4,5,7-25.
Resumen de las características epidemiológicas, microbiología y resultado en los estudios de endocarditis infecciosa (EI) pediátricas publicados desde el año 2000a
| País | Número de episodios (pacientes) | Tipo estudio | Ámbito | Años | Edad | Cardiopatíaestructural CCCR N (%) | NosocomialN (%) | Material protésicoN (%) | MicrobiologíaHC+ N (%)Gérmenes N (%) | Embolismos: N (%)IC: N (%) | Tratamiento quirúrgico(%) | Mortalidad (%) | FR evolucióndesfavorable |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| España (presente estudio) | 44 (41) | ER | MC | 2008-2020 | Mediana 103 mRIQ: 37-150 m | 35 (80)34 (77)0 (0) | 19 (43) | 21 (48) | 41 (93)S. aureus 11 (25)ECN 8 (18)S. viridans 6 (14)Fúngica 3 (7) | 13 (30)Pulmonar 8 (18)Otros 4 (9)SNC 3 (7) | 21 (48) | 4 (9) | EI complicadaMaterial protésicoPCR >140mg/l(MV) |
| Corea7 | 96 (89) | ER | CU | 2004-2019 | Mediana 9,5 aRango 2 d-19,8 a | 81 (84)81 (84)0 (0) | 33 (34) | 43% | 72 (75)S. aureus 24 (32)S. viridans 22 (29)ECN 14 (19)Fúngica 8 (11) | Pulmonar 14 (23)No pulmonar 14 (23)IC 23 (37) | 63 (67) | 7 (7,9) | ComplicacionesS. aureus vs S. viridans(UV) |
| Australia8 | 51 (51) | ER | CU | 2009-2018 | Mediana 8,1 aRIQ 2,7-12,8 a | 29 (57)25 (49)3 (6) | NE | 15 (29) | 46 (90)S. aureus 19 (37)Streptococcus spp. 15 (29)HACEK 7 (13.)ECN 2 (4) | 17 (33)Pulmonar 8 (16)SNC 5 (10) | 26 (51) | 1 (1,9) | Estancia hospitalariaTiempo diagnósticoEmbolismos(MV) |
| Brasil12 | 47 (45) | ER | CU | 2000-2018 | Media 7,6 aDE 4,7 a | 44 (94)41 (87)3 (6) | 3 (6) | 19 (40) | 32 (68)S. viridans (19)S. aureus (15)ECN (11) | Pulmonar 5 (11)Intracraneal 3 (6)Otros 4 (9)IC 7 (15) | 37 (79) | 7 (14,8) | NE |
| Bélgica5 | 53 (53) | ER | CU | 2000-2017 | Media 6,5 aDE 5,7 a | 46 (87)46 (87)0 (0) | 25 (47) | NE | 49 (92)S. viridans 17 (29)S. aureus 13 (22)ECN 11 (19) | Pulmonar 6 (11)Sistémicos 5 (10)Intracraneal 1 (2)IC: NE | 19 (36) | 7 (13) | NE |
| Reino Umido13 | 800 (736) | EPC | MC | 2008-2016 | <1 a: 75 (9%)1-15 a 235 (32%)>15 a.: 436 (59%) | 800 (100)b | NE | NE | 706 (88)Estreptococos 280 (40)Estafilococos 230 (33) | NE | NE | 6,7% | MortalidadInfección estafilocócicaCanal AV completo (MV) |
| Noruega14 | 36 (36) | ER | MC | 1994-2016 | Mediana 3,1 aRIQ 0,7-9,9 a | 20 (67)20 (67)0 (0) | NE | NE | 30 (83)S. aureus 12 (33)S. viridans 8 (22) | 3 (8) | 13 (38) | 3 (8) | NE |
| Italia15 | 47 (47) | ER | CU | 2000-2015 | Mediana 9 aRango 2-17 a | 29 (62)29 (62)1 (2)c | NE | 12 (26) | 35 (74)S. viridans 12 (26)ECN 8 (17)S. aureus 7 (15) | NE | 14 (30) | 3 (6,3) | NE |
| Estados Unidos16 | 841 | ER | MC | 2003-2014 | Mediana 13 aRIQ 9-15 a | 288/34288/34NE | NE | NE | NE | NE | NE | 30 (3,6) | NE |
| Tunez17 | 73 (73) | ER | MC | 1997-2013 | Media 12 aDE 4,8 a | 37 (51)18 (27)17 (23) | 31 (42)S. aureus 11 (15)ECN 6 (8)Streptococcus spp. 6 (8) | Sistémico 10 (14)SNC 9 (12)Pulmonar 2 (3) | 37 (51) | 10 (13,6) | MortalidadICIRAAfectación SNC (MV) | ||
| España11 | 44 (44) | ER | CU | 1988-2013 | Mediana 6,8 aRango 3,5 m-17 a | 28 (63)28 (63)0 (0) | NE | 12 (27) | 43 (95)S. aureus 9 (21)S. viridans 9 (21)ECN 7 (16)Fúngica 8 (18) | Pulmonar 7 (16)No pulmonar 4 (9)IC 16 (36) | 13 (30) | 9 (20) | MortalidadEI complicadaIC (UV) |
| Cuba18 | 33 (33) | ER | CU | 2000-2012 | 0-4 a: 54%5-19 a: 46% | 22 (67)22 (67)0 (0) | 58% | NE | 25 (76)S. aureus 6 (24)S. viridans 5 (20)ECN 8 (32) | Pulmonar 10 (22) Cerebral 5 (11)Renal 2 (4) | NE | NE | NE |
| Nueva Zelanda19 | 85 (82) | ER | MC | 1994-2012 | Mediana 7 aRango 0-15 a | 64 (75)51 (6010 (12) | 35 (41) | NE | 75 (88)S. aureus 26 (31)S. pyogenes 7 (8) | NE | 39 (46) | 4 (5) | NE |
| Taiwán20 | 116 (112) | ER | CU | 1983-2011 | Media 7,9 aDE 5,7 a | 86 (74)NENE | 37 (32) | NE | 109 (94)Streptococcus spp. 55 (47)S. aureus 22 (19)Fúngica 7 (6) | SNC 8 (7)No SNC 28 (24) | 34 (29) | 12 (10) | MortalidadICVegetaciones (UV) |
| Estados Unidos21 | 53 (47) | ER | CU | 1980-2011 | Mediana 12,3 aRango 0,01-18,9 a | 40 (75)40 (75)0 (0) | NE | NE | 47 (89)S. viridans 17 (36)S. aureus 12 (26)ECN 2 (4) | 32% | 17 (32) | 2 (4) | NE |
| Estados Unidos4 | 3.840 (3.840) | ER | MC | 2000-2010 | <1 a: 15%2-10 a: 28%11-19 a: 56% | 54%NENE | NE | 8% | 70%S. aureus 37%Streptococcus spp. 39%S. viridans 26%ECN 6% | NE | 9% | 2,8% | Estancia HospitalariaInfección estafilocócica (UV)MortalidadInfección estafilocócica(UV) |
| España10 | 45 | ER | CU | 1985-2009 | <1 a: 6 (13%)1-15 a 18 (40%)> 15 a: 21 (47%) | 100%b | 38 (24) | 24 (53) | 43 (96)Streptococcus spp. 16 (35)S. aureus 7 (16)ECN 7 (16)Fúngica 6 (13) | Sistémica 7 (16)Pulmonar 6 (14)SNC 4 (9)IC 10 (22) | 21 (47) | 12 (24) | MortalidadInfección nosocomialIC al diagnóstico(MV) |
| Canadá22 | 113 (113) | ER | CU | 1979-2008 | Mediana 7,6 aRIQ 1,1-12,8 a | 95 (84)95 (840 (0) | 44 (39) | NE | 105 (93)S. aureus 43 (38)S. viridans 29 (26)ECN 14 (12) | SNC 22 (19)No SNC 23 (20)IV 17 (15) | 40 (35) | 17 (15) | MortalidadATB amplio espectroVegetaciones biventriculares (MV) |
| Estados Unidos23 | 85 | ER | CU | 1992-2004 | Mediana 1,5 aRango 6 d-18,8 a | 72 (85)68 (801 (1) | 54 (64) | 19 (22) | 84 (99)Streptococcus spp. 26 (31)S. aureus 18 (21)ECN 18 (21)Fúngica 12 (14) | 19 (22,4)Pulmonar 9 (11)SNC 4 (5)Otros 6 (7)IC 19 (22) | NE | 20 (23,5) | MortalidadNo FR identificadosComplicacionesNosocomial(UV) |
| Estados Unidos24 | 1.586 | ER | MC | 2000-2003 | Mediana: 16 a (HU)/10 a (HNU)RIQ: 4-19 a (HU)/1-17 a (HNU) | 665 (42)535 (34)NE | NE | NE | NES. aureus 57%S. viridans 24%)ECN 11%) | NE | NE | 84 (5,3%) | NE |
| Argentina25 | 86 (86) | ER | CU | 1988-2000 | Mediana 7,6 aRIQ 3,6-11,2 a | 66 (77)63 (73)3 (3) | NE | 20 (23) | 75 (87%)S. aureus 32 (37)S. viridans 14 (25)ECN 4 (5) | 21 (24)SNC 17 (10)Pulmonar 2 (2)Otros 2 (2)IC 26 (30) | 21 (24) | 11 (12,8) | ComplicacionesS. aureusTratamiento quirúrgico (MV)MortalidadAntibioterapia previaCirugía previa (MV) |
| Estados Unidos23 | 62 | ER | CU | 1977-1992 | Mediana 8,2 aRango 1 m-19 a | 43 (69)40 (653 (5) | 24 (39) | NE | 58 (94)S. aureus 24 (39) Streptococcus spp. 14 (23)ECN 7 (11) Fúngica 6 (10) | 18 (29)Pulmonar 9 (14)SNC 9 (14)IC 10 (16) | NE | 13 (21) | NE |
| España9 | 23 | ER | CU | 1977-1985 | <2 a: 34,7%> 2 a: 65,3% | 21 (91)20 (87)1 (4) | 8 (35) | 9 (39) | 22 (96)S. viridans 9 (39)S. aureus 8 (35)ECN 2 (9) | NEIC 10 (43) | 8 (35) | 6 (26) | MortalidadNo FR identificados |
| Estados Unidos23 | 58 | ER | CU | 1930-1959 | Mediana 3 aRango 3 m-14 a | 58 (100)40 (69)18 (31) | NE | NE | 50 (86)Streptococcus spp. 40 (69)S. aureus 10 (17) | 38 (65)Pulmonar 13 (22)SNC 7 (4,2)Otros 18 (31) | NE | 1930-1943 (86%)1944-1959 (34%) | NE |
CC: cardiopatía congénita; Canal AV: canal auriculoventricular; CR: cardiopatía reumática; CU: centro único; DE: desviación estándar; ECN: estafilococos coagulasa negativos; EPC: estudio prospectivo de cohortes; ER: estudio retrospectivo; FR: factores de riesgo; HC: hemocultivo; HNU: hospital no universitario; HU: hospital universitario; IC: insuficiencia cardíaca; IRA: insuficiencia renal aguda; MC: multicéntrico; MV: multivariante; NE: no especificado; RIQ: rango intercuartílico; SNC: sistema nervioso central; UV: univariante.
Las CC son el principal factor predisponente de la EI en la edad pediátrica, estimándose que los niños con CC presentan un riesgo de desarrollar EI 15-170 veces superior al de la población general14. La prevalencia de CC en las series de casos de EI pediátrica presentan un rango variable entre el 27 y el 100%, lo que se podría justificar por diferencias en los protocolos de recogida de información, períodos temporales, poblaciones de referencia y tipos de centros hospitalarios4,5,7-25. En esta serie de casos las CC fueron un factor de riesgo preexistente en el 77% de los casos de EI, siendo la CIV, la TA y la TF las CC acianóticas y cianóticas identificadas con mayor frecuencia, respectivamente, lo que es consistente con los hallazgos comunicados en las series contemporáneas de EI5,7,8. A este respecto, TOF (22,8%), CIV (19,6%) y válvula aórtica bicúspide (10,7%) fueron las CC más prevalentes en un reciente estudio prospectivo realizado en el Reino Unido, que incluyó 800 episodios de EI en 736 pacientes con antecedentes de CC, de los que 300 de estos tenían <16años13. Ningún paciente tuvo afectación valvular reumática: esta tuvo cierta relevancia en los estudios históricos de EI y más recientemente en población aborigen y de países menos desarrollados8,9,12,17,19,23,25.
En el presente estudio, los CVC y las disfunciones del sistema inmune, factores predisponentes habitualmente descritos en las series de EI pediátricas, se presentaron respectivamente en el 20% y el 16% de los casos de EI7,8,23,24. Los episodios de EI con presencia de CVC como factor predisponente se manifestaron en el 89% con afectación de cavidades derechas y fueron responsables de los tres episodios de infecciones fúngicas, observaciones concordantes con las características descritas para las EI en los pacientes portadores de CVC26.
Algo menos de la mitad (48%) de los episodios de EI en esta cohorte de pacientes estuvieron relacionados con la presencia de material protésico, una tasa más elevada que en la mayoría de comunicaciones de EI pediátrica con rango entre el 8 y el 53%. En los casos descritos, 8 pacientes eran portadores de conducto valvulado de vena yugular bovina tipo Contegra, con tasas de incidencia más elevadas de EI que los homoinjertos criopreservados27.
Los episodios de EI en el grupo de material protésico tuvieron mayores tasas de CC y de disfunción orgánica. Las proporciones de episodios con DRA y DH fueron respectivamente 3 y 4 veces más elevadas que las observadas en los episodios sin material protésico, y aunque la diferencia no fue estadísticamente significativa, posiblemente por la baja frecuencia de estas complicaciones, podría ser considerada relevante desde el punto de vista clínico. Estos hallazgos se podrían relacionar tanto con el material protésico en sí mismo como porque ocurren, generalmente, en cardiopatías más complejas. Además, la presencia de material protésico fue un predictor independiente por análisis multivariante de EI complicada. Este hallazgo no es insospechado, porque el material protésico se considera un factor que predispone a los niños con EI al desarrollo de complicaciones graves que pueden requerir cirugía precoz2.
En la presente serie la mediana de duración de síntomas previos al diagnóstico fue de 9días, pero hubo casos con importante demora diagnóstica por presentación inicial indolente e inespecífica, y en otros episodios el diagnóstico precoz se vio dificultado por síntomas atípicos que pueden oscurecer el diagnóstico, como fueron los tres niños con colecistitis acalculosa. Esta es una complicación descrita de forma excepcional en la EI, aunque probablemente esté infradiagnosticada, generalmente en el contexto de infecciones por S.aureus28. El diagnóstico precoz de la EI pediátrica puede ser también complicado por las diferencias en la presentación en niños en función de la edad y por la menor sensibilidad de la ecocardiografía en el grupo de pacientes con material protésico1,2,29.
La fiebre fue el síntoma más frecuente. Esta puede cursar inicialmente de forma muy variable, desde cuadros indolentes con síntomas inespecíficos a sintomatología grave de sepsis e insuficiencia cardíaca, observada en el 23% de los episodios2. Se detectaron lesiones cutáneas características de la EI en 5 (11%) episodios, una proporción similar a la comunicada en otras series de EI pediátrica y que es inferior a la descrita en pacientes adultos2,8,11,15,19.
S.aureus, seguido de ECN y S.viridans, fueron los microorganismos aislados más frecuentemente en los pacientes del estudio. Estos microrganismos son los más relevantes en la etiología de la EI en niños, con diferencias en sus frecuencias relativas (tabla 6)4,7-25. En una revisión sistemática de la literatura, S.aureus fue el microorganismo más prevalente, como en el presente estudio y en otras series más recientes7,8,14,19,30. Por el contrario, S.viridans continúa teniendo una mayor relevancia como agente causal de EI pediátrica en otras series recientes de países desarrollados5,15. Las tasas elevadas de S.aureus pueden suponer un motivo de preocupación. Este microorganismo se asoció con un mayor riesgo de complicaciones y mortalidad en estudios de EI con un número más elevado de casos y en pacientes adultos, aunque no en la presente serie de casos, discrepancia que podría estar en relación con las limitaciones de potencia estadística de nuestro estudio6,13,25.
La tasa de complicaciones tromboembólicas fue del 30%, comparable a la registrada en la mayoría de estudios de EI pediátrica, con rango entre el 8 y el 46% (tabla 6)4,7-25. Es posible que un mayor uso de técnicas de imagen avanzadas multimodales podría haber incrementado la detección de complicaciones relativamente silentes desde el punto de vista clínico. En la serie descrita se utilizó el 18F-FDG-PET/TC en 9 episodios. Esta técnica de imagen es potencialmente un instrumento útil y fiable en el algoritmo diagnóstico de la EI para la identificación de embolismos sépticos y la evaluación de infecciones de material protésico cuando los resultados del estudio ecocardiográfico no son concluyentes29. No obstante, la información en relación al papel de esta y otras técnicas de imagen avanzadas en la EI es insuficiente para hacer recomendaciones generales.
La tasa de requerimientos quirúrgicos fue del 48%, y la de mortalidad, del 9%, ambas similares a las descrita en las series de EI pediátrica4,5,7-25. Los valores de PCR >140mg/l y el material protésico fueron predictores independientes de EI complicada, lo que puede ayudar a la identificación precoz de pacientes con posibles necesidades quirúrgicas. Resulta interesante señalar a este respecto que el diagnóstico precoz o tardío no estuvo asociado con desarrollo de EI complicada. Otras variables asociadas de forma independiente con complicaciones y posibles necesidades quirúrgicas y con mortalidad en los diferentes estudios de EI pediátrica se muestran en la tabla 64,7-25.
Este estudio tiene las limitaciones inherentes a los estudios retrospectivos, con potenciales sesgos de selección e información; por otra parte, el limitado número de pacientes puede haber afectado a la potencia estadística y a la probabilidad de cometer errores tipoII.
En resumen, los hallazgos del presente estudio subrayan las elevadas morbilidad y complejidad del manejo de la EI pediátrica. La información generada podría ser útil para una mejor identificación de los perfiles epidemiológicos y clínicos de los pacientes pediátricos con EI y sus formas complicadas. Finalmente, sería recomendable la realización de estudios prospectivos multicéntricos, con una muestra más amplia de pacientes, para tratar de responder a las áreas de incertidumbre con el objetivo de optimizar el manejo diagnóstico y terapéutico de este grave cuadro.
Conflicto de interesesNo existen conflictos de intereses entre los autores.
A los miembros de REPA Dolores Falcón Neyra, Olaf Werner Neth, Juan Luis Santos Pérez y Laura Martín Pedraz.