La infección por el virus de la hepatitis C (VHC) es curable en la mayoría de los casos tratados, siendo actualmente una prioridad diagnosticar a todos los infectados. Para ello se necesitan, especialmente en poblaciones de difícil diagnóstico, métodos diagnósticos simples, como es el uso de muestras de gotas de sangre seca (GSS), como alternativa a la extracción de sangre mediante venopunción. Como paso previo para poder implantarlo como método diagnóstico de detección de pacientes con VHC dentro del Sistema Nacional de Salud se precisa evaluar la precisión diagnóstica en equipos de uso hospitalario habitual.
MetodologíaSe evaluaron in vitro y en ensayo de campo muestras de GSS tras ser procesadas en el equipo Cobas 6800, estableciendo una correlación con el resultado obtenido con sangre completa. Se realizaron pruebas de correlación y de variabilidad intraensayo de la determinación con sangre completa y GSS para cuantificar la carga viral del VHC.
ResultadosEn muestras de sangre completa, con una carga viral≥3 log10UI/ml, se detectó viremia en todos los casos cuando se utilizaron eluciones de 2 gotas (94 detecciones de 95 eluciones de círculos). El rendimiento con 2 gotas fue menor en muestras con <3 log10UI/ml (7/20). La correlación entre la viremia determinada con sangre completa y con GSS fue excelente (máximo con 2 gotas, r2=0,906; p<0,001), con un coeficiente de variación del 0,05%. En práctica clínica habitual con muestras de pacientes analizados (n=61) se obtuvo igualmente una excelente precisión diagnóstica.
ConclusiónLa determinación de la carga viral mediante GSS, procesando al menos 2 gotas, es un método fiable para el diagnóstico de infección por el VHC. La estandarización del método es factible en nuestro equipo Cobas 6800 local, y nuestros resultados respaldan la incorporación de esta herramienta diagnóstica al Sistema Nacional de Salud para facilitar planes de microeliminación.
Because hepatitis C virus (HCV) infection is curable in the majority of cases, the diagnosis of all infected patients has become a priority. In difficult-to-diagnose populations, simpler diagnostic methods are required such as the use of dried blood spots (DBS) as an alternative to blood drawn by venipuncture (VP). Before being able to include it as a HCV diagnostic detection method within the Spanish National Health System, the diagnostic accuracy of standard hospital equipment must be evaluated.
MethodologyDBS samples were evaluated in vitro and in a field test after being processed in the Cobas 6800 system, establishing a correlation with the result by VP. Performance with different viral loads and intra-assay variability was compared.
ResultsIn samples with a viral load of>3 log10IU/ml, viraemia was detected in all cases when at least two blood spot elutions were used (94 detections out of 95 spot elutions). The performance with 2 spots was lower in samples with<3 log10IU/ml (7/20). Correlation between VP and DBS viraemia was excellent (maximum with 2 spots, r2=0.906, P<.001) with a coefficient of variation of 0.05%. In routine clinical practice with specimens from screened subjects (n=61), excellent diagnostic accuracy was also observed.
ConclusionViral load detection using DBS of at least two spots is a reliable method for HCV diagnosis. The standardisation of the method is feasible and our results support the incorporation of this diagnostic tool in Spain's Public Health System.
La infección por el virus de la hepatitis C (VHC) es una de las principales causas de morbimortalidad de etiología hepática a nivel mundial1. Las repercusiones que tiene a largo plazo son muy variables, y van desde alteraciones mínimas hasta la aparición de cirrosis hepática descompensada y carcinoma hepatocelular2.
La asistencia clínica a los pacientes con infección por el VHC ha mejorado considerablemente en los últimos años gracias fundamentalmente a los avances en el tratamiento. Estos permiten alcanzar respuesta viral sostenida y curación de la infección en la práctica totalidad de los pacientes, evitando la progresión de la enfermedad y la aparición de complicaciones3. Sin embargo, uno de los obstáculos para que los pacientes se beneficien del tratamiento es la falta de diagnóstico de la infección y derivación al especialista4. En colectivos como son los usuarios de drogas por vía parenteral otra de la limitaciones para el acceso por parte de los pacientes al tratamiento y, por tanto, a la curación, es el rechazo a someterse a una venopunción (VP) para extracción de sangre y el diagnóstico por el mal acceso venoso que presentan, dificultades para traslado al centro hospitalario por problemas económicos o estigmatización que complican el diagnóstico5.
Actualmente se pueden detectar anticuerpos frente al VHC y viremia a partir de una muestra de gota de sangre seca (GSS) sobre papel tras extracción por punción dactilar. Este test ha demostrado, con distintos kits comerciales, una alta sensibilidad y especificidad6–8. La gran ventaja como método diagnóstico de este procedimiento es el escaso volumen de sangre que requiere (unas pocas gotas depositadas sobre papel y secadas al aire), la facilidad de transporte y conservación de las muestras hasta su procesamiento en el laboratorio. Además, no requiere personal con adiestramiento específico, es menos invasivo y es mejor aceptado, en especial en aquellos pacientes con poca accesibilidad venosa, como los usuarios de drogas por vía parenteral con antecedentes de flebitis9.
Un test diagnóstico de este tipo no solo facilita el diagnóstico, sino que, además, es más aceptable por parte del sujeto a cribar, 2 estrategias fundamentales para identificar a los pacientes infectados y facilitar su posterior evaluación terapéutica y curación.
El control de la infección por el VHC dentro del Sistema Nacional de Salud, según el actual Plan Nacional10, pasa necesariamente por diagnosticar y tratar colectivos tradicionalmente difíciles de vincular a la atención sanitaria. El diagnóstico descentralizado o fuera del centro hospitalario con recogida de muestra para test de GSS en el lugar donde se encuentra el individuo a diagnosticar, pero con gestión hospitalaria mediante procesamiento en el centro de referencia, ha demostrado ser útil como método de cribado oportunista en iniciativas puntuales11,12. Sin embargo, para que se facilite y pueda instaurarse un cribado sistemático en estos colectivos se precisa de la implementación de este procedimiento en el Sistema Nacional de Salud, como una herramienta equivalente a la determinación de viremia desde plasma por VP. A falta de un protocolo por el fabricante, la Organización Mundial de la Salud recomienda validar y estandarizar localmente este procedimiento. Con el fin de poder implementar este método diagnóstico en el circuito asistencial habitual, y a través de él diagnosticar el VHC, especialmente en aquellos en los que la VP resulta un obstáculo, este estudio evalúa la precisión diagnóstica de un protocolo aplicado sobre una muestra de GSS sobre papel en el equipo Cobas 6800 de nuestro centro hospitalario adscrito al Sistema Nacional de Salud.
Material y métodosMuestras incluidasEste estudio prospectivo constó de una evaluación in vitro a partir de muestras de GSS con sangre de sujetos infectados por VHC, y una evaluación en el ensayo de campo a partir de muestras obtenidas de sujetos incluidos durante el periodo de julio-septiembre de 2018, en un estudio iniciado en enero de 2017 que evalúa la eficacia de cribado voluntario de VHC en centros de atención al drogodependiente del área norte de la isla de Tenerife, con determinación de anticuerpos frente a VHC mediante GSS, recogidas por farmacéuticos y auxiliares de farmacia.
Para las 2 evaluaciones se dispuso de muestras de sangre total por VP en tubos EDTA-tripotásico para obtener valores de referencia, y se utilizó la misma muestra para cargar los círculos en la evaluación in vitro para obtener resultados de GSS. Ambas muestras fueron procesadas en el equipo Cobas 6800, que trabaja con el mismo volumen de muestra en ambos casos.
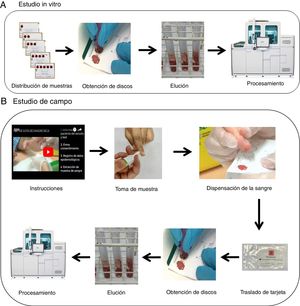
Estudio in vitroPara el proceso de la validación in vitro se comparó el rendimiento diagnóstico y la variabilidad intraensayo sobre un total de 300 círculos cargados con muestras de 20 sujetos infectados por el VHC de los que se disponía de los datos de carga viral.
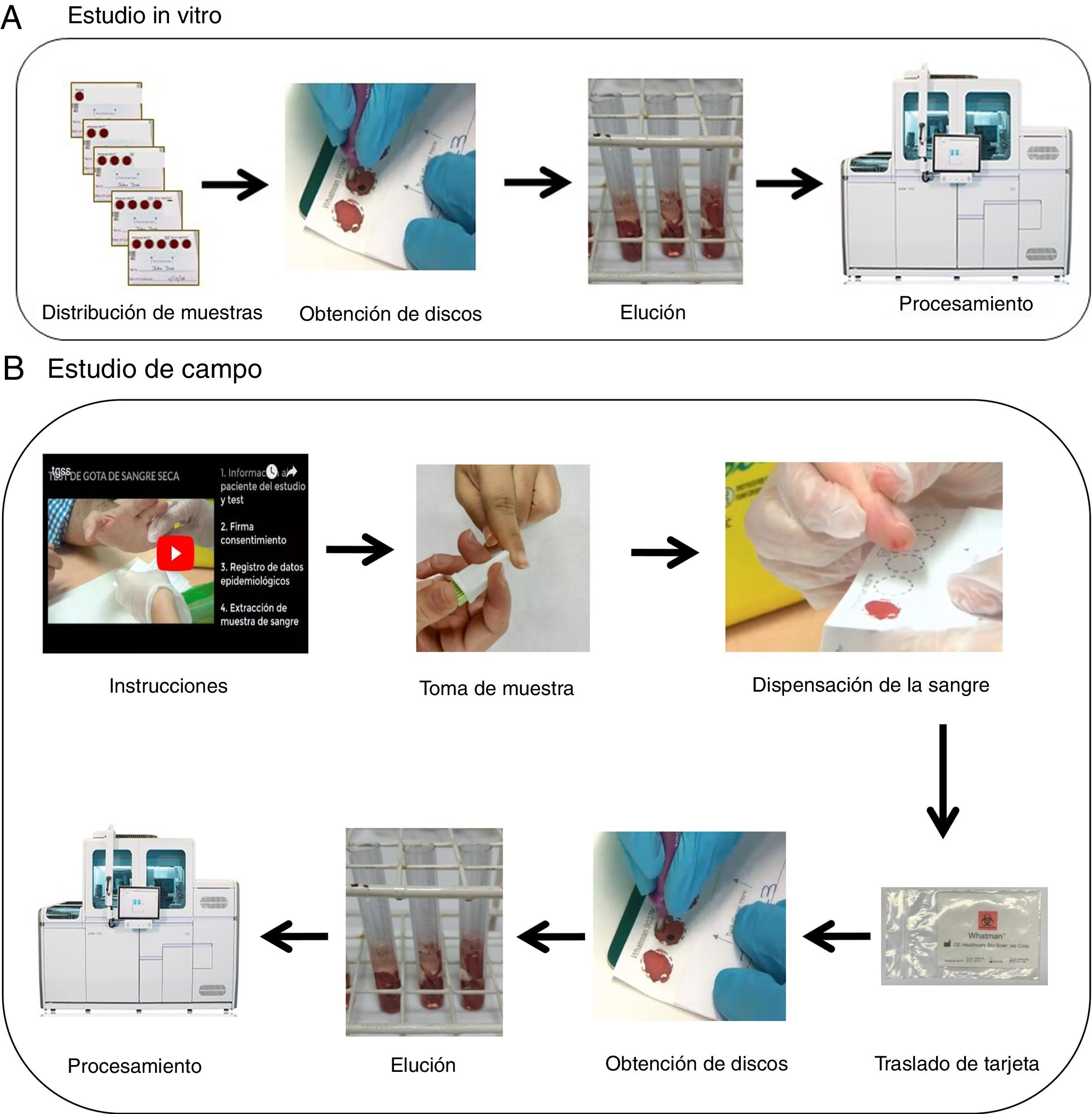
Para la recogida de las muestras se utilizaron tarjetas con papel tipo Whatman 903© (Merck, Alemania) de 5 círculos (fig. 1A). Se emplearon un total de 5 tarjetas por paciente (100 tarjetas en total) que se cargaron de uno a 5 círculos (es decir, 15 círculos por paciente, y un total de 300 círculos) con 80μl de sangre anticoagulada con EDTA- tripotásico. Los resultados fueron expresados cuantitativamente (log10UI/ml) y cualitativamente como positivos si se detectaba viremia, o negativos estratificándose en 4 grupos: carga viral muy baja (<3 log10UI/ml); baja (≥3-4 log10UI/ml); media (>4-6log10UI/ml) y alta (>6 log10UI/ml).
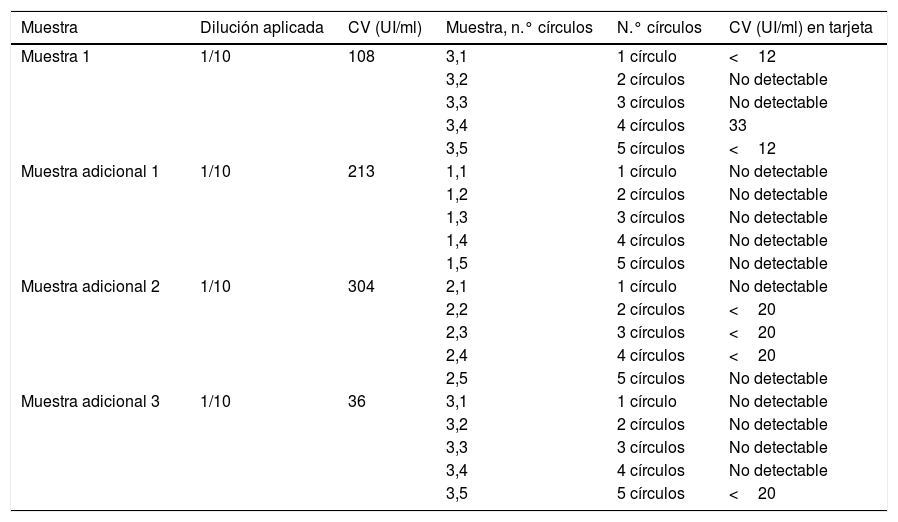
Como la incidencia de pacientes con cargas virales muy bajas (<3 log10UI/ml) es muy reducida, para poder evaluar la precisión del test de GSS en este tipo de pacientes se diluyeron 1/10 o 1/100 muestras de sangre de 3 sujetos adicionales (con cargas virales conocidas) en suero fisiológico, hasta lograr valores en la muestra de <3 log10UI/ml, para su posterior dispensación en los círculos de papel.
Estudio de campoAl personal encargado de obtener la muestra para el test de GSS se le formó en la obtención de la misma mediante previa entrevista y con entrega de material, entre el que estaba la visualización de un vídeo on-line (https://www.youtube.com/watch?v=Jagy918AXTc) con la intención de que recogiera, tras el pinchazo con lanceta (MenaLancetPro©, 23G, Menarini), una muestra suficiente para completar hasta 5 círculos en cada tarjeta. Las tarjetas fueron trasladadas a temperatura ambiente (entre 22-23°C) desde la extracción hasta el procesamiento con una mediana de 17,5 días (rango 14-21 días) (fig. 1B).
Procesamiento de muestra y equipoLas muestras desde el papel se obtuvieron manualmente de cada círculo delineado con ayuda de un sacabocados en pequeños discos, que se colocaron en tubos del equipo de Roche Diagnostics (tubo 5ml PS 12×75mm sin enrases, referencia: 30080.1, Deltalab, Barcelona), se añadió 1.500μl de reactivo de lisis para uso en equipos Cobas 6800/8800 (REF P/N: 06997538190) en aquellos tubos con 4 círculos o menos y 2.000μl en aquellos en los que se pudo obtener 5 círculos. Se colocaron los tubos al baño María durante 15minutos, agitándolos en vórtex a los 7-8minutos. Se separó el sobrenadante a un nuevo tubo y se introdujeron en el equipo Cobas 6800 (Roche Molecular Systems, Pleasanton, CA) para la posterior determinación de carga viral (log10UI/ml).
Análisis estadísticoLos resultados se expresaron como valores absolutos, porcentuales, media y su desviación estándar. Se utilizó la «t» de Student para variables cuantitativas que siguieron la normalidad o U-Mann Withney para aquellos que no seguían una distribución normal, mientras que las variables cualitativas fueron comparadas mediante el test de la Chi-cuadrado. Se estudiaron correlaciones mediante coeficiente de Pearson y análisis de coeficientes de variación. Los resultados se expresaron en media±desviación estándar. El análisis de datos se realizó con SPSS 15. Diferencias con un valor de p<0,05 se consideraron estadísticamente significativas.
Aspectos éticosEste estudio, de conformidad con los principios de la Declaración de Helsinki, adoptada por la 18.ª Asamblea Médica Mundial, Helsinki, Finlandia, en 1964 y enmendada en Tokio (1975), Venecia (1983), Hong Kong (1989), Sudáfrica (1996), Edimburgo (2000), Washington (2002), Tokio (2004), Seúl (2008) y Brasil (2013); y las Leyes y Reglamentos vigentes en Europa y España, fue aprobado por el Comité ético del Hospital Universitario de Canarias, y a los pacientes se les entregó consentimiento informado y lo firmaron para la recogida de muestras.
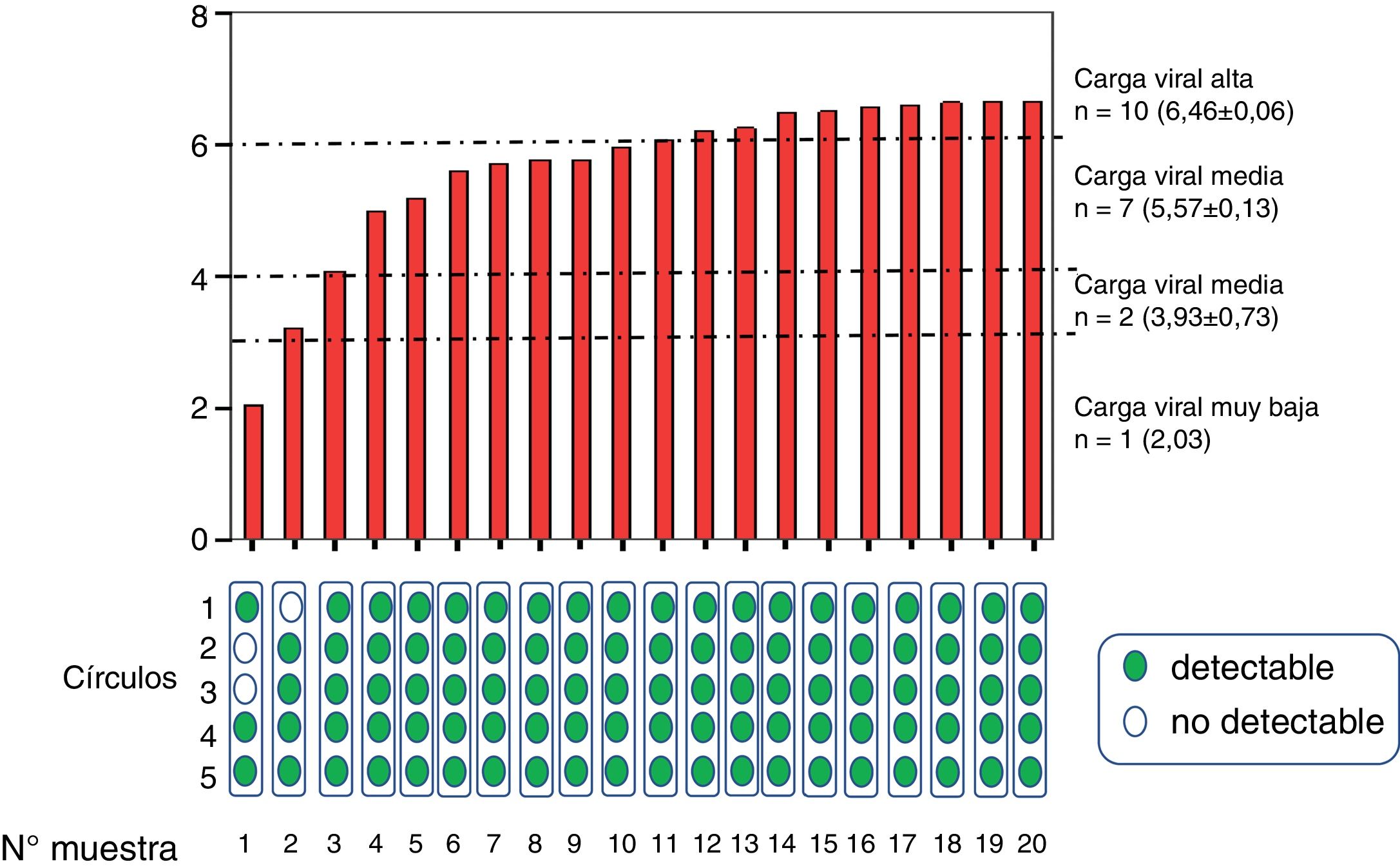
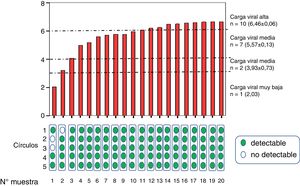
ResultadosEstudio in vitroLas muestras una vez procesadas se agruparon en grupo con carga viral alta (n=10, 6,4±0,06log10 UI/ml), media (n=7, 5,5±0,3 log10 UI/ml), baja (n=2, 3,9±0,7log10UI/ml) y muy baja (n=1, 2,03 log10UI/ml) (fig. 2).
Viremia media determinada en muestras de venopunción de pacientes agrupadas según tuvieran carga viral muy baja, baja, media y alta. En la parte inferior se muestran los resultados de viremia detectable (verde) o indetectable (blanco), según el número de círculos empleados en la determinación tras su elución.
Se detectó viremia en el 100% de los círculos y promedios evaluados de muestras con al menos carga viral media. En muestras de un paciente que presentaba viremia baja (3,21 log10UI/ml) se precisó del promedio de al menos 2 círculos para que fuera detectable, y en muestras de otro paciente con viremia muy baja (2,03log10UI/ml) se precisó de más círculos para que se pudiera detectar viremia de forma fiable. En muestras diluidas adicionales con viremia muy baja (n=3, 2,1±0,2 log10UI/ml) solo se detectó viremia (y en rango<20UI/ml) en 4 de las 15 diluciones de GSS, por lo que globalmente se detectó carga viral en 7 de 20 diluciones (tabla 1).
Distribución de resultados de las muestras diluidas
| Muestra | Dilución aplicada | CV (UI/ml) | Muestra, n.° círculos | N.° círculos | CV (UI/ml) en tarjeta |
|---|---|---|---|---|---|
| Muestra 1 | 1/10 | 108 | 3,1 | 1 círculo | <12 |
| 3,2 | 2 círculos | No detectable | |||
| 3,3 | 3 círculos | No detectable | |||
| 3,4 | 4 círculos | 33 | |||
| 3,5 | 5 círculos | <12 | |||
| Muestra adicional 1 | 1/10 | 213 | 1,1 | 1 círculo | No detectable |
| 1,2 | 2 círculos | No detectable | |||
| 1,3 | 3 círculos | No detectable | |||
| 1,4 | 4 círculos | No detectable | |||
| 1,5 | 5 círculos | No detectable | |||
| Muestra adicional 2 | 1/10 | 304 | 2,1 | 1 círculo | No detectable |
| 2,2 | 2 círculos | <20 | |||
| 2,3 | 3 círculos | <20 | |||
| 2,4 | 4 círculos | <20 | |||
| 2,5 | 5 círculos | No detectable | |||
| Muestra adicional 3 | 1/10 | 36 | 3,1 | 1 círculo | No detectable |
| 3,2 | 2 círculos | No detectable | |||
| 3,3 | 3 círculos | No detectable | |||
| 3,4 | 4 círculos | No detectable | |||
| 3,5 | 5 círculos | <20 |
CV: carga viral.
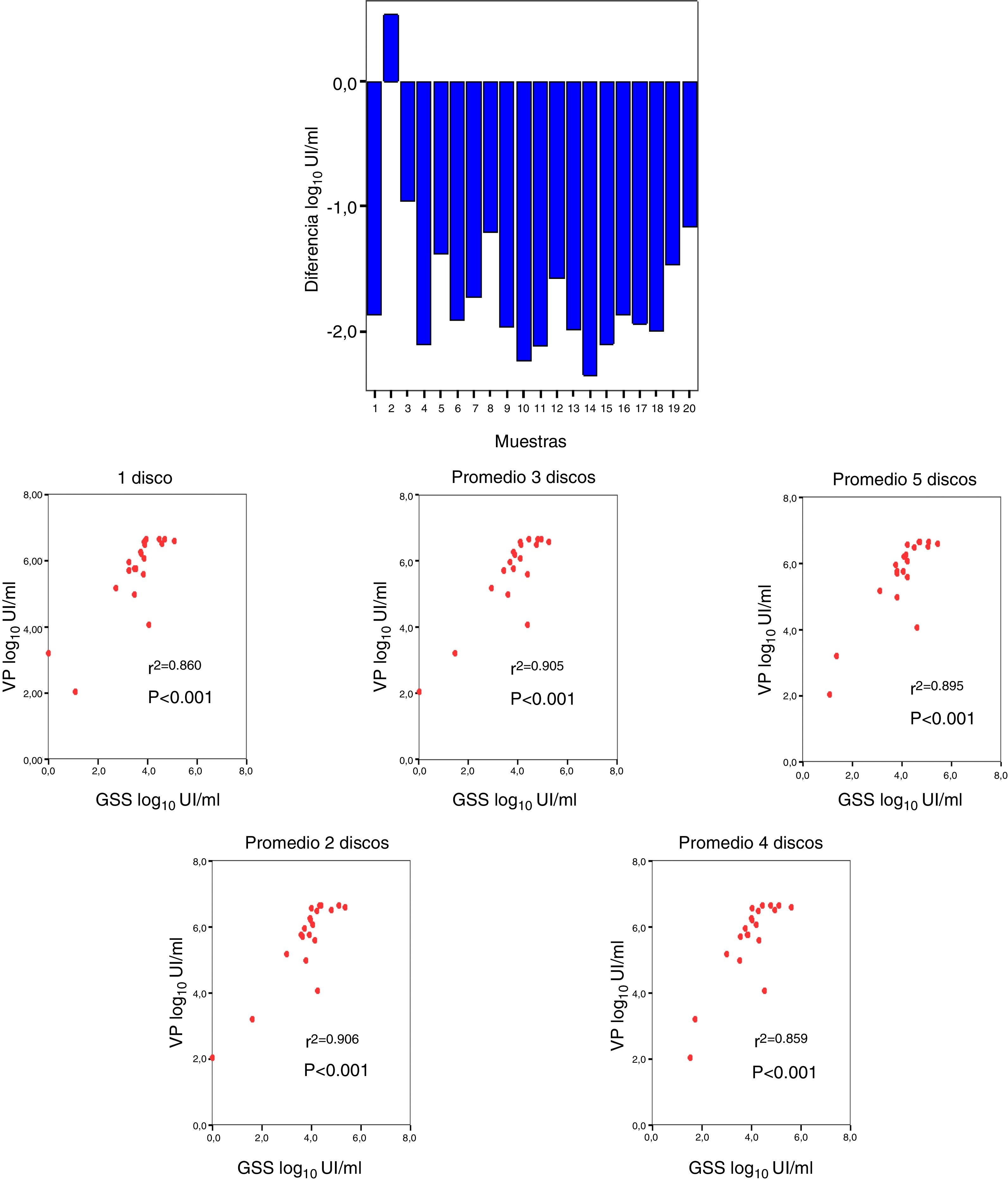
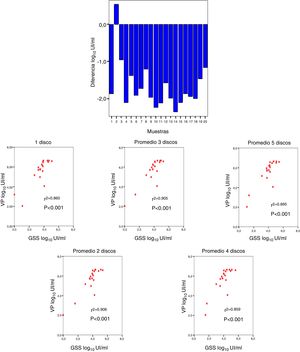
Se realizó la comparación entre la viremia detectada por VP con respecto a la obtenida procedente de GSS, obteniéndose una diferencia media de –1,66 log10UI/ml (fig. 3A). La correlación entre la viremia detectada en VP y en GSS fue elevada para cualquier promedio de círculos utilizados por tarjeta. La máxima correlación se obtuvo cuando se usaron 2 círculos (r2=0,906; p<0,001) (fig. 3B).
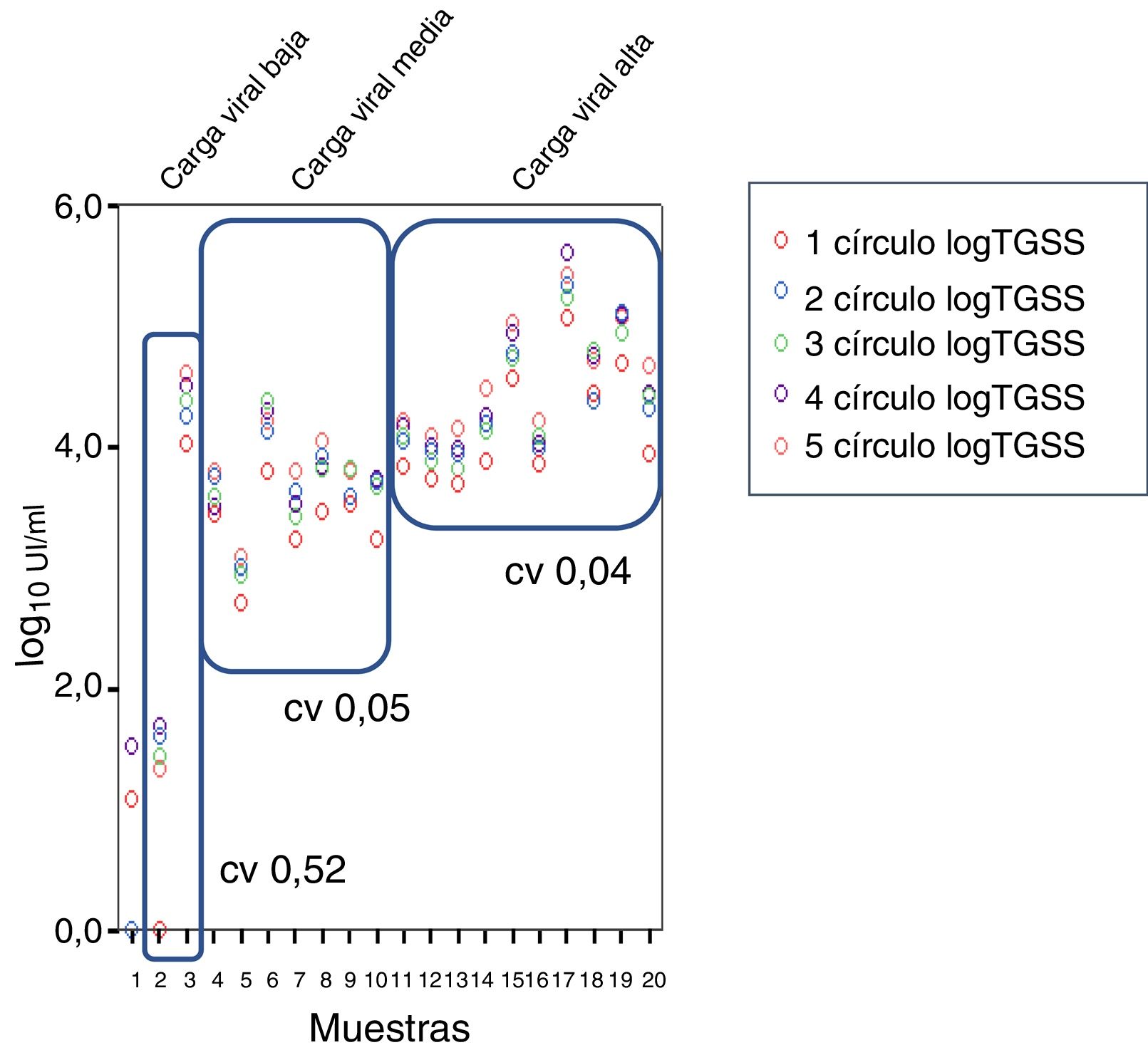
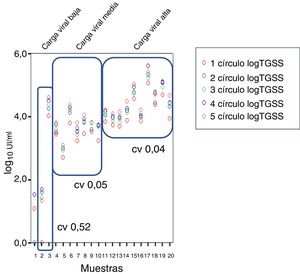
En cuanto a los coeficientes de variación (CV) se obtuvo un CV del 0,57%, 0,05% y 0,04% para viremia baja, media y alta, respectivamente (fig. 4).
Estudio de campoPara la validación de las muestras en la práctica clínica real se testaron un total de 61 sujetos, 34 sujetos con carga viral positiva (mediana 6,41log10UI/ml, rango 3,9-7,81 log10UI/ml), el 79,4% presentaba carga viral alta y 27 con carga viral indetectable. En el grupo que presentaba carga viral detectable la mayoría eran hombres, con una edad media en torno a los 50 años (tabla 2). En todos ellos se pudo obtener al menos 4 círculos durante la obtención de la muestra de GSS. Las tarjetas fueron trasladadas a temperatura ambiente con una mediana de 17,5 días (rango 14-21 días) desde la extracción hasta el procesamiento.
Distribución de resultados según cargas virales en sujetos con resultado positivo y características en el ensayo en práctica clínica real
| Carga viral baja | Carga viral media | Carga viral alta | |
|---|---|---|---|
| n=1 | n=6 | n=27 | |
| Edad (media±DE) | 51 | 48±9,54 | 50,1±10,4 |
| Sexo (hombre), % | 0 | 40 | 92,6 |
| Genotipo (1, 3, 4): % | 1: 100 | 1: 33 | 1: 70,8 |
| 3: 50 | 3: 12,5 | ||
| 4: 17 | 4: 16,7 | ||
| Carga viral log10UI/ml (media±DE) | 3,9 | 5,62±0,25 | 6,63±0,45 |
| Círculos evaluados (media±DE) | 5 | 4,67±0,81 | 4,07±1,17 |
La precisión diagnóstica obtenida demuestra una sensibilidad, especificidad, valor predictivo positivo y valor predictivo negativo del 100% en nuestra muestra de práctica clínica real (tabla 3).
Precisión diagnóstica obtenida con test de gota de sangre seca (GSS)
| Criterio de referencia (viremia en plasma por venopunción) | |||
|---|---|---|---|
| Positivo | Negativo | Total | |
| Resultado de viremia en GSS | |||
| Positivo | 34 | 0 | 34 |
| Negativo | 0 | 27 | 27 |
| Total | 34 | 27 | 61 |
| IC 95% | |||
|---|---|---|---|
| Límite inferior | Límite superior | ||
| Prevalencia de la enfermedad | 55% | 42,51% | 68,24% |
| Pacientes correctamente diagnosticados | 100,00% | 92,62% | 99,85% |
| Sensibilidad | 100,00% | 87,36% | 99,73% |
| Especificidad | 100,00% | 84,50% | 99,66% |
| Valor predictivo positivo | 100,00% | 87,36% | 99,73% |
| Valor predictivo negativo | 100,00% | 84,50% | 99,66% |
Nuestros resultados indican que a partir del protocolo descrito, y en el equipo utilizado Cobas 6800, la determinación de carga viral desde muestra de GSS, procesando al menos 2 círculos, es un método de expresión cualitativa fiable en la detección de la mayoría de pacientes con infección activa por el VHC.
Además de detectar correctamente la presencia de viremia con el protocolo utilizado, la correlación observada entre viremia obtenida por VP y en GSS fue excelente. En un estudio publicado en el que se utilizó un único disco impregnado con similares cantidades de muestra (50μl de sangre) y en una tarjeta de equivalentes características a las utilizadas en este estudio, se encontró una correlación similar7. A pesar de esta observación, en la era de los antivirales de acción directa, en la que por sus características de alta eficacia pangenotípicas no sería preciso cuantificar ni genotipar, por cuanto no condiciona ni el tipo de terapia ni su duración, solo la presencia o no del virus, el valor de establecer una correlación excelente entre ambos métodos, aun con la diferencia cuantitativa descrita o el excelente coeficiente de correlación entre muestras observado, parece por otra parte poco relevante13. Además, las pruebas de determinación de carga viral a lo largo del tratamiento actualmente están en desuso y circunscritas a la práctica para verificar el cumplimiento terapéutico3. De hecho, casi todos los sujetos obtienen cargas virales indetectables de manera temprana debido a los efectos directos de los nuevos tratamientos en la replicación viral. Es por ello que, en la monitorización de los nuevos tratamientos se podría prescindir de la cuantificación de ARN, y se podría empezar a sustituir por pruebas cualitativas que confirmen la infección al inicio del tratamiento y la respuesta viral sostenida tras la finalización del mismo13. En este sentido, en los últimos años se ha vuelto a utilizar la determinación del antígeno del core del VHC por resultar más económico y sencillo que determinar la viremia14,15.
Nuestros resultados muestran que, en las condiciones analizadas, para pacientes con viremia media y alta es suficiente un solo círculo para obtener un resultado positivo; sin embargo, en aquellos pacientes con una viremia baja se precisan 2 círculos. Postulamos que esto puede estar condicionado por el almacenamiento de la muestra con una degradación de las pocas copias de ARN presentes en la GSS16. De hecho, en un estudio que comparó muestras almacenadas a temperatura ambiente con respecto a almacenamiento a –20°C, se objetivó una diferencia de hasta 3 veces en los niveles de ARN, después de 6 días de su extracción7. Sin embargo, otro estudio no observó diferencias de valor de ARN detectables después de cerca de un año, pero no se cuantificó para conocer si hubo disminución en los niveles de la carga viral17. Por último, un estudio más reciente no observó variaciones en la estabilidad del VHC en muestras de GSS durante el período de un año18. No obstante, esta limitación se reduciría aprovechando la facilidad de obtención de la muestra con la lanceta adecuada y utilizando en la determinación de la viremia el total de círculos disponibles en la tarjeta, que son hasta 5.
Tras la validación del método in vitro se realizó un estudio posterior de validación en la práctica clínica real en un programa de cribado en centros de atención a la drogodependencia, colectivo de alta prevalencia de infección y de difícil vinculación con la atención médica para el diagnóstico5. Estos centros o unidades en los que los pacientes son asistidos por facultativos médicos, psicólogos, asistentes sociales y farmacéuticos, son clave para el éxito de los planes que se pongan en marcha para diagnosticar, e incluso tratar, a estos pacientes sin hasta ahora asistencia del VHC. Sin duda, para la implementación de esta herramienta diagnóstica hará falta reajustes organizativos y dotación estructural, que no obstante, dada la simplicidad del test, serán menores. Además, la simplicidad permite que el test sea efectuado por distintos integrantes del centro. De hecho, en nuestro caso, fueron los farmacéuticos quienes colaboraron en la recogida de las muestras, como ocurre en otros lugares en los que se han puesto en marcha cribados mediante GSS19. Incluso es probable que en el futuro, al igual que se ha evaluado en pacientes con infección por el virus de la inmunodeficiencia humana, sea el propio paciente quien recoja la muestra20,21.
El test de GSS demostró ser un método sensible y específico para la cuantificación de ARN del VHC en comparación con los resultados obtenidos tras VP. De los resultados obtenidos en nuestro estudio podemos observar una elevada precisión diagnóstica. Estos resultados son incluso superiores a los publicados en otros trabajos en los que obtiene una sensibilidad del 100% y una especificidad el 95,8%18, y en otro estudio que demostró una sensibilidad del 98% y una especificidad del 94,3%22. Probablemente, esta mayor precisión que hemos descrito, con nuestro protocolo, provenga de la metodología de identificación. Los trabajos anteriormente citados emplearon la plataforma de extracción de Abbott M2000 y RT-PCR18, y una qPCR22 que posee un límite de detección del ARN del virus de 50UI/ml, mientras que nuestro equipo tiene un límite de 12UI/ml.
El hecho de que el test presente un valor predictivo negativo muy elevado, es especialmente importante en este colectivo de pacientes y en poblaciones de riesgo de infección, ya que se podría plantear como herramienta alternativa para diagnóstico y cribado en poblaciones de difícil acceso a diagnóstico convencional por VP, a pesar de presentar baja sensibilidad en aquellos pacientes con cargas virales muy bajas, ya que con ello se podría establecer un diagnóstico en un muy elevado número de pacientes (aunque no en su totalidad) que no se diagnosticarían de ninguna otra forma en nuestro sistema sanitario como tampoco ocurre en otros23, con el propósito de poder alcanzar los objetivos propuestos por la Organización Mundial de la Salud para el año 2030 de elevar al 90% los diagnosticados y tratar a no menos del 80% en la estrategia global de eliminación de la hepatitis C24. Esta debe estar focalizada en programas centrados en la eliminación de la infección en pacientes de centros de atención al drogodependiente, penitenciarios o centros de inserción social, entre otros. Recientemente, nuestro grupo evaluó la aceptación de este método para el diagnóstico de la infección por el VHC a través de la recogida de muestra dactilar, objetivando ser muy bien aceptado no solo en población general, sino en individuos en riesgo de exclusión social. Esto es particularmente interesante en este colectivo de alta prevalencia en viremia, en el que la detección de infección resulta fundamental y en el que este método acercaría el diagnóstico a estos pacientes, también reacios a utilizar el sistema sanitario para el diagnóstico de enfermedades mediante extracción de sangre12. Cabe destacar que el test de GSS permite, como es en nuestro caso, en población con elevada seroprevalencia e infección activa por VHC (30-60%) determinar el ARN directamente. No obstante, en población general con una cifra de prevalencia menor (0,5-3%)25,26, aun pudiéndose poner a punto la técnica para determinar anticuerpos desde una muestra de GSS y realizar el diagnóstico en un solo paso (en el caso de presencia de anticuerpo-VHC se realizaría el ARN), al ser menos ventajosa en esta población general el uso de GSS, prevalecería el empleo de la convencional extracción de sangre por VP, que también permite el diagnóstico en un solo paso ahorrando costes y pérdidas de pacientes27,28.
Este método diagnóstico de la GSS en papel no es excluyente de otros métodos diagnósticos descentralizados, que por su rapidez en la obtención de resultados son una interesante herramienta aplicados en centros o lugares de atención (centros point of care) cuando interese especialmente un diagnóstico y asistencia inmediata, especialmente en colectivos de difícil vinculación con asistencia sanitaria convencional29–31. Sin embargo el test de GSS, integrado en la rutina de análisis de muestras en un laboratorio de referencia, permite su lectura centralizada y gestión del resultado, que es sin duda ventajoso desde el punto de vista de la salud pública a efectos de registros y estudios de epidemiología32.
Este estudio no está exento de limitaciones. Las muestras para el estudio de campo se obtuvieron de una población con una elevada prevalencia de VHC, como son los pacientes que acuden a los centros de atención al drogodependiente, y que no es representativa de la población general. No obstante, el objetivo de este apartado del estudio fue validar en práctica clínica real la viabilidad del test de GSS, y en ese sentido este estudio tiene más valor, pues es en esta población donde este test tiene una mayor aplicabilidad por las razones comentadas. Por otra parte, las cargas virales se evaluaron en muestras con genotipos mayoritariamente del tipo 1, que son los más prevalentes en población general, pero que contrasta con los porcentajes más elevados de genotipo 3 que tienen los pacientes asistidos por los centros de atención a las drogodependencias. Sin embargo, no se espera que el tipo de genotipo influya en el rendimiento de detección de carga viral23,33. En cuanto a la correlación entre muestras por VP y GSS, aunque la correlación fue muy elevada, cabría esperar que la mayor correlación fuera cuando se utilizaran los 5 círculos. Sin embargo, en nuestras muestras fue máxima con 2 círculos. Esto pudiera ser debido a que quizás no se utilizó la cantidad de reactivo de lisis necesaria para permitir la completa elución del ARN del virus desde la totalidad de los 5 círculos, o a un impedimento físico, ya que quizás a mayor número de círculos, y por consiguiente de discos en el tubo, menor superficie del disco que entra en contacto con el reactivo de lisis y menor elución se produce. Por último, en aquellos pacientes que presenten viremias muy bajas (<0,01% de los casos en la práctica clínica)13 se precisaría de más estudios que confirmaran que la utilización de este test para la determinación de viremia es fiable. En este tipo de pacientes nuestro protocolo resulta ineficaz y cabría esperar la presencia de falsos negativos, sobre todo en población con coinfección por virus de la inmunodeficiencia humana en la que ha sido descrita una mayor frecuencia de pacientes con cargas virales muy bajas34,35. En este sentido no debemos olvidar que en todo programa de cribado se asume una tasa de falsos negativos, que en este caso sería asumible, dada la baja frecuencia de individuos con cargas virales inferiores a 3 logaritmos. Además, en este y otros colectivos de difícil acceso sanitario, esta alternativa diagnóstica es la única vía de diagnóstico factible. Por último, quedaría por evaluar si la determinación de anticuerpos o antígeno del core16, en vez de viremia en estos casos, mejoraría el rendimiento.
En conclusión, el uso de muestra de GSS para la determinación de la viremia del VHC parece ser una alternativa al diagnóstico a partir de muestra por VP de elevada precisión diagnóstica. Por sus ventajas, especialmente en colectivos de alta prevalencia de infección y acceso diagnóstico complicado, la implementación de este método y su estandarización podrían permitir incorporar esta herramienta al Sistema Nacional de Salud para facilitar la implementación de planes de microeliminación en nuestro país.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradecemos la labor y dedicación de los técnicos de laboratorio del Laboratorio Central del Hospital Universitario de Canarias, a los investigadores de FUNCANIS Verónica Casañas, Sara García y Pablo Yanes, así como al personal de los Centros de Atención al Drogodependiente ANTAD y San Miguel Adicciones por su participación activa en el proyecto.