La infección de endoprótesis de aorta abdominal (EVAR) es una entidad infrecuente, pero con una elevada mortalidad. Son escasas las publicaciones al respecto en nuestro país y no hay un consenso definitivo acerca de su manejo. Se acepta como gold standard la cirugía de explante, planteándose como alternativas la antibioterapia asociada a drenaje o limpieza del saco.
MétodosRevisión retrospectiva descriptiva de las endoprótesis aórticas tipo EVAR infectadas en nuestro centro terciario (Hospital Universitario de Cruces) en la última década (2010-2019).
ResultadosDescribimos las características clínicas y microbiológicas de 10 infecciones de EVAR, así como su manejo y resultados obtenidos. La incidencia de infección de EVAR fue del 3%. El tiempo medio hasta la presentación clínica de la infección fue de 16,9 meses (mediana de 4,5 meses). Se logró el diagnóstico microbiológico en el 100% de los casos (predominio de cocos grampositivos). La mortalidad global fue del 50% (sin embargo, la supervivencia fue del 100% tras limpieza quirúrgica del saco).
ConclusionesEl cultivo de muestras de colecciones periprotésicas y saco aneurismático muestra una gran rentabilidad, llegando al diagnóstico microbiológico en todos los casos, a pesar de ser negativos los hemocultivos en un 50%. Destacan los buenos resultados obtenidos con la limpieza quirúrgica y preservación del dispositivo, asociada a antibioterapia. Sin embargo, en nuestra serie de casos se aprecia una importante heterogeneidad, lo que dificulta elaborar recomendaciones de manejo y obliga a individualizar el tratamiento.
Aortic endograft infection is an infrequent but life-threatening complication after endovascular abdominal aortic repair (EVAR). There is no consensus on management of endograft infection and little evidence has been published in our country. Endograft explantation is considered the “gold standard” treatment whereas percutaneous or surgical perigraft and sac drainage associated to antibiotics should be considered and alternative therapy.
MethodsWe carried out a retrospective and descriptive review of abdominal aortic endograft infections at our tertiary center (Hospital Universitario Cruces) during last ten years (2010–2019).
ResultsWe describe the clinical and microbiological characteristics of 10 EVAR infections, their management and outcomes. The incidence of graft infection after EVAR was 3%. The mean time to the clinical presentation of infection was 16.9 months (median 4.5 months). The microbiological diagnosis was reached in 100% of cases (predominance of gram-positive species). The overall mortality rate was 50% (although the survival rate was 100% after surgical drainage of the sac).
ConclusionsPerigraft or aneurysm sac aspiration culture shows their diagnostic utility as microbiological diagnosis was reached in all cases despite of blood cultures being only positive in 50% of the samples. Surgical drainage and endograft preservation combined with antibiotherapy show remarkable results. The high heterogeneity in our case series makes difficult to offer general recommendations, thus far, a tailored approach to treatment is suggested.
La reparación endovascular (EVAR) es considerada hoy en día la técnica preferente para el tratamiento de los aneurismas de aorta abdominal (AAA)1,2. Dada la menor mortalidad inicial de la EVAR frente a la cirugía abierta (1,2-1,6% frente a 4,2-5,2%3,4) y su menor morbilidad perioperatoria, en la actualidad aproximadamente el 80% de las reparaciones son realizadas mediante esta técnica1–4.
La EVAR no está exenta de complicaciones de distinta índole (endofugas, hematomas, isquemia de extremidades, síndrome postimplantación, etc.). Una de las complicaciones más temidas es la infección de la endoprótesis aórtica, infrecuente pero potencialmente letal. Su incidencia oscila entre el 0,2-5%, según las diferentes series publicadas, pero su mortalidad global es cercana al 50%5.
Recientemente la European Society for Vascular Surgery (ESVS) ha publicado una guía clínica para el manejo de las infecciones de prótesis y endoprótesis vasculares. Los autores recomiendan como tratamiento de elección el explante quirúrgico de la prótesis con una reconstrucción in situ. El manejo conservador (sin explante) con drenaje percutáneo o quirúrgico se considera una alternativa en pacientes de alto riesgo quirúrgico6.
Disponemos de escasas publicaciones españolas acerca del tratamiento óptimo de infecciones asociadas a EVAR, limitándose a pequeñas series de casos. La serie más extensa fue publicada por Fernández Prendes et al.5 con 7 casos tratados en el Hospital Universitario Central de Asturias7,8. Nuestro objetivo es describir la serie de casos diagnosticados de infección de endoprótesis aórtica en los últimos años en nuestro centro, así como divulgar nuestra estrategia terapéutica en función de nuestra experiencia y revisión de la literatura, con el fin de estimular la generación de información acerca de esta complicación infecciosa de difícil manejo. Sería de interés poder aunar esfuerzos en crear consensos en torno al diagnóstico y tratamiento que mejoren el pronóstico de estos pacientes.
MétodosSe realizó una revisión retrospectiva de la base de datos de EVAR llevados a cabo en el servicio de Angiología y Cirugía Vascular del Hospital Universitario Cruces desde enero de 2010 hasta diciembre de 2019, tanto de manera electiva como urgente. Se seleccionaron aquellos casos complicados con infección de la endoprótesis.
La infección de la endoprótesis aórtica se definió con criterios clínicos, imagen diagnóstica compatible (en TC o PET) y aislamiento microbiológico en muestras de sangre, aspirado percutáneo preoperatorio de colección periprotésica o material protésico explantado u otras muestras intraoperatorias9. El diagnóstico fue consensuado por el grupo multidisciplinar de Angiología y Cirugía Vascular, Medicina Interna y Enfermedades Infecciosas.
Se diseñó una base de datos en formato Excel y se llevó a cabo una revisión anonimizada con seguimiento de las historias clínicas hasta diciembre de 2019. El análisis descriptivo se efectuó mediante el software SPSS Statistics 19®.
ResultadosCaracterísticas demográficas y comorbilidadesDurante el periodo de 10 años (2010-2019) que recoge el estudio se identificaron 10 infecciones de endoprótesis aórtica de un total de 329 procedimientos, con una incidencia acumulada del 3%. El 100% de los casos fueron varones con una edad media de 71,10años. Hay que destacar el gran tamaño de los aneurismas, con un diámetro medio de 7,56cm. El tabaquismo y la hipertensión arterial fueron las comorbilidades más frecuentes (70%). La dislipidemia (DLP) (50%) y la cardiopatía isquémica (30%) fueron las siguientes en prevalencia. El resto de comorbilidades (insuficiencia renal, diabetes, inmunosupresión y cáncer) se presentaron en <20% de los casos. El 100% de los pacientes recibió profilaxis antibiótica preoperatoria con cefazolina 2g, dosis única endovenosa, según protocolo hospitalario.
Factores de riesgo y periodo hasta la infecciónSolo 2 de los casos presentaron infecciones de otro origen en el postoperatorio que provocaron la infección del implante: un caso de bacteriemia y un caso de infección intraabdominal. Desde la cirugía inicial hasta la infección de la endoprótesis (periodo de intervalo) los pacientes tuvieron una media de 1,9ingresos hospitalarios y de 27,6días de hospitalización. En el periodo de intervalo el 30% se sometieron a alguna cirugía mayor, otro 30% a procedimientos invasivos intravasculares y un 60% a procedimientos invasivos extravasculares.
Presentación clínica, diagnóstico y manejo (tabla 1)El tiempo medio desde la EVAR hasta la presentación clínica de la infección fue de 16,9meses, con una mediana de 4,5 meses. De los 10 casos 5 se definieron como infecciones precoces (primeros 4 meses postimplante). La fiebre estuvo presente en el 70% de los pacientes al diagnóstico, el dolor abdominal o lumbar en el 60%, mientras que la combinación de los 2 anteriores en el 40%. Analíticamente, al diagnóstico el 100% de los pacientes mostró una elevación de la PCR, con una media de 175mg/l. Otros datos como la leucocitosis (solo presente en el 30%) fueron menos significativos.
Características clínicas, método diagnóstico, tratamiento y pronóstico
| ID | Edad | Motivo | Tipo de endoprótesis | Cuidados sanitarios | Meses hasta la infección | Clínica | Origen probable | Microorganismo (muestra) | Tratamiento Qx | Antimicrobiano | Seguimiento |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 68 | AAA (9cm) Hallazgo casual | Endurant® | Dos reingresos (22d)Un proc. extravascInfecciones | 3 | Asintomático | Flebitis | SAMS(HC+; explante+) | Qx urgente por rotura de AAA | Cloxacilina | Fallece intraQx |
| 2 | 74 | AAA (9cm)Hallazgo casual | Gore Excluder® | Dos reingresos (28d)Infección postQxInfecciónEndofuga tipo i | 3 | Fiebre, dolor lumbar | Bacteriemia post Qx | E. faecium(HC+; explante+) | Explante y bypass axilo-bifemoral | Vancomicina | Fallece a los 5d (FMO postQx) |
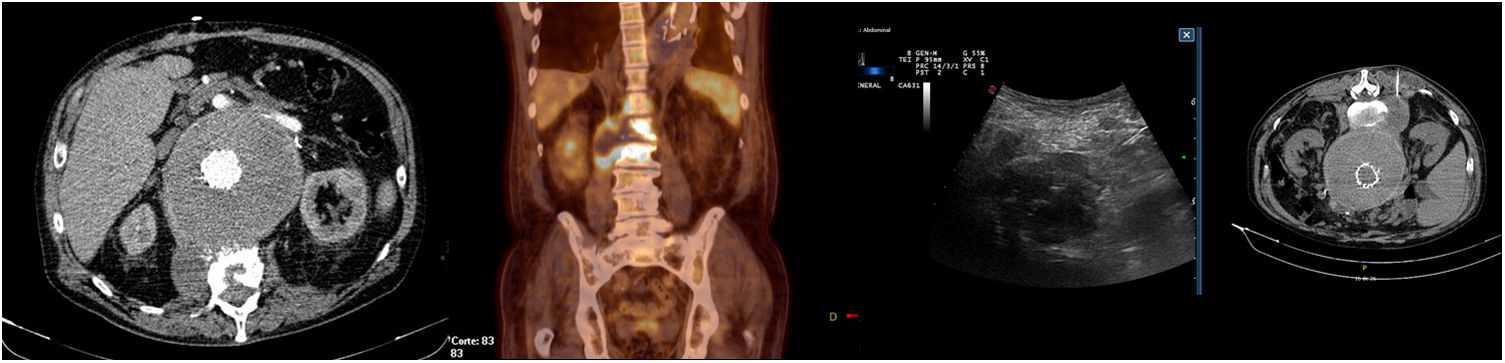
| 3 | 68(fig. 1) | AAA (8,2cm)Dolor abdominal | Valiant® | Qx inicial urgenteCuatro reingresos (47d)Una QxUn proc. intraVDos proc. extraVEndofuga tipo ii | 42 | Fiebre, dolor lumbar | Extracción dental | S. viridans(HC+; aspirado+; explante–) | Explante y bypass axilo-bifemoral | Ceftriaxona | Fallece a los 10d(Shock séptico) |
| 4 | 75 | AAA (6cm)Hallazgo casual | Nellix® | Un reingreso (5d) | 4 | Fiebre | Fístula aorto-duodenal | P. mirabilis, B. thetaiotaomicron(HC+; explante+) | Explante y bypass axilo-bifemoral | Ceftriaxona y metronidazol | Fallece a los 15d (FMO postQx) |
| 5 | 59 | Rotura AAA (6cm) | Endurant® | Qx inicial urgenteInfección post Qx | 5 | Fiebre, drenaje retroperitoneal purulento | Infección intraabdominal | E.coli, E.faecium, E.faecalis (HC–; drenaje percutáneo+; explante cultivo– y PCR–) | Explante y bypass aorto-aórtico con homoinjerto criopreservado | Vancomicina y piperacilina/tazobactam 3s | Vivo tras 48m |
| 6 | 81 | AAA (8,5cm) Hallazgo casual | Endurant® | - | 3 | Dolor lumbar, pérdida ponderal | Contaminación Qx inicial | C. acnes (HC–; aspirado+; explante+) | Explante y bypass Ao-biI (prótesis de Dacron) | Ceftriaxona 8s y después moxifloxacino 4s | Vivo tras 60m |
| 7 | 80 | AAA (5,9cm) Hallazgo casual | Anaconda® | - | 1 | Fiebre, dolor lumbar | Contaminación Qx inicial | C. albicans (HC–; aspirado+, material Qx+) | Limpieza Qx y epiplonplastia | Anidulafungina 6s y después fluconazol 6m | Vivo tras 31m |
| 8 | 64 | AAA (6cm) Hallazgo casual | Endurant® | Un reingreso (7d)Dos proc ExtraVEndofuga tipo ii | 21 | Dolor abdominal y lumbar | Toxiinfección alimentaria | Listeria monocytogenes (HC–; aspirado+, material Qx+) | Limpieza Qx y parche pericardio bovino | Ampicilina iv 6s | Vivo tras 36m |
| 9 | 68 | AAA (8cm)Hallazgo casual | Endurant® | Siete reingresos (86d)Dos QxDos proc. intraVUn proc. extraVInfecciones | 72 | Fiebre, dolor lumbar | Flebitis asociada a VVP con bacteriemia | SAMS(HC+) | Abstención Qx | Cloxacilina 2s Indefinido: Ciprofloxacino+ Clindamicina | Fallece a los 12m (infección de EVAR) |
| 10 | 74 | AAA (9cm) Hallazgo casual | Gore Excluder® | Un reingreso (2d)Un proc. intraVInfeccionesEndofuga tipo ii | 15 | Fiebre | Probable fistula aortoentérica | E. faecium, B. fragilis(HC–; aspirado+) | Abstención Qx | Daptomicina y metronidazol 6s indefinido: doxiciclina y metronidazol | Fallece a los 41m, otras causas |
AAA: aneurisma aorta abdominal; Ao-biI: aorto-biiliaco; aspirado: aspirado percutáneo; Ax-biF: axilo-bifemoral; d: días; ExtraV/IntraV: Extra/intra-vascular; FMO: fracaso multiorgánico; GEA: gastroenteritis aguda; HC: hemocultivos; ID: identificador; IV: intravenoso; m: meses; PCR: PCR del gen 16S ARN ribosomal; Pipe-Tazo: piperacilina-tazobactam; Qx: cirugía; s: semanas; SAMS: S. aureus meticilín-sensible; VVP: vía venosa periférica.
Se obtuvo diagnóstico microbiológico etiológico prequirúrgico en todos los casos (10/10). Los hemocultivos extraídos en el momento de sospecha de infección de EVAR fueron positivos en el 50% de los casos, en el 50% restante el diagnóstico se consiguió mediante aspiración ecoguiada del saco aneurismático infectado antes de la cirugía. Respecto a los microorganismos implicados los grampositivos estuvieron presentes en el 80% de las muestras, enterobacterias gramnegativas en el 20% y Candida sp. en el 10%; 30% fueron infecciones polimicrobianas. En cuanto al diagnóstico radiológico la TC fue diagnóstica en el 90% de los casos. En 6 de los pacientes de nuestra serie se realizó PET-TC, siendo esta patológica en 5 de los 6 casos.
En 8 de los 10 pacientes se optó por el tratamiento quirúrgico. En 6 de ellos se decidió realizar un explante de la endoprótesis infectada (ID 1-6). Un paciente fue intervenido de manera urgente por rotura del saco aneurismático asociado a la infección endoprotésica, falleciendo durante la cirugía. En los otros 5 pacientes el explante se realizó con éxito. Entre estos la mortalidad intrahospitalaria precoz (<30 días poscirugía) fue del 60% (3/5), falleciendo los pacientes en la unidad de reanimación a los 5, 10 y 15 días por fracaso multiorgánico. Los otros 2 pacientes (40%) siguen vivos en la actualidad. En 2 pacientes (ID 7,8) se procedió a tratamiento quirúrgico del foco, con conservación del implante: se realizó una apertura y limpieza quirúrgica del saco aneurismático y posterior cobertura de la endoprótesis con parche de pericardio bovino y epiplonplastia. En los últimos 2 pacientes (ID 9,10), dadas las comorbilidades y el elevado riesgo quirúrgico se decidió tratamiento conservador con antibioterapia. En estos últimos 4 casos, en los que no se explantó la endoprótesis, la mortalidad intrahospitalaria precoz fue del 0% y la supervivencia a largo plazo global fue del 75% (100% en aquellos con limpieza quirúrgica y 50% en los de tratamiento médico). La mortalidad global fue del 50%.
DiscusiónLa infección de la endoprótesis tras la EVAR tiene una incidencia variable de entre el 0,2% y el 5%. Los 2 metaanálisis publicados por Li et al.10 y por Argyriou et al.2 demuestran una tendencia a la baja, con una incidencia del 0,2% y del 0,6% respectivamente. La incidencia en pequeñas series de casos es mayor, como en la única serie de casos publicada recientemente en nuestro país por el grupo de Fernández Prendes et al.5, quienes describen una incidencia del 1,48%. Nuestra serie de casos muestra una incidencia ligeramente superior (3%), permanece dentro de lo esperado y podría ser explicable por la alta tasa de factores de riesgo a los que nuestros casos fueron expuestos en el periodo de intervalo (desde la EVAR hasta la presentación de la infección) donde merece destacarse la necesidad de nuevos ingresos hospitalarios y otros procedimientos invasivos, así como la inclusión de las EVAR urgentes.
Las infecciones de EVAR se clasifican como precoces cuando ocurren en los primeros 4 meses tras el implante, donde la infección ocurre fundamentalmente por contaminación durante la cirugía inicial. En estos casos suelen implicarse microorganismos más virulentos y dan lugar a un cuadro más agudo y con datos de severidad. Durante este periodo se está formando la neoíntima y ocurre la endotelización del dispositivo, por lo que el riesgo de infección, en caso de siembra hematógena, también está aumentado. Las infecciones tardías, más allá del 4.° mes, son principalmente secundarias a siembra hematógena de microorganismos en procedimientos invasivos o bacteriemias de otros focos. En ocasiones se pueden producir fístulas aortoentéricas por crecimiento del saco aneurismático e infectarse la pared del saco6,9,11–14. En las principales series y metaanálisis las infecciones tardías son especialmente relevantes, con una media desde la implantación hasta la presentación de la infección de 25 meses2,15–17. En nuestra serie el 50% de las infecciones de EVAR fueron precoces, pero solo en el 20% se consideró la contaminación en la cirugía inicial como mecanismo patogénico. El origen más frecuente de todas las infecciones fue la bacteriemia de otro origen (50%) y un 20% fue asociado a fistula aortoentérica. En definitiva, ante todo caso de bacteriemia en portadores de endoprótesis aórtica el tratamiento antibiótico debe ser enérgico y debe realizarse un esfuerzo diagnóstico para descartar la infección de la endoprótesis.
Los factores de riesgo que se han identificado para la infección de EVAR se podrían agrupar en2,5,6,17:
- -
Comorbilidades.
- -
Factores quirúrgicos: EVAR urgente, fiebre antes del EVAR, procedimiento en sala de radiología y embolización de arteria hipogástrica.
- -
Factores posquirúrgicos: infecciones y bacteriemia posoperatorias (<30días), procedimientos invasivos vasculares y no vasculares.
- -
Otros: endofuga tipo ii, fístula aortoentérica.
Cabe reflexionar acerca de la profilaxis antibiótica (ATB) en los procedimientos dentales invasivos que requieran manipulación de la región gingival o periapical del diente o perforación de la mucosa oral, como plantean algunos autores, por extrapolación del riesgo de endocarditis infecciosa, si bien en el caso de implantes vasculares se observan controversias en la literatura1,6. En uno de nuestros paciente la infección de endoprótesis fue por una extracción dental sin profilaxis con bacteriemia secundaria por Streptococcus viridans, por lo que podríamos considerar a los pacientes con EVAR de alto riesgo para la infección por siembra hematógena de origen odontogénico.
La presentación clínica de la infección de endoprótesis aórtica es insidiosa muchas veces, lo que dificulta y retrasa su diagnóstico. Las manifestaciones clínicas más frecuentes consisten en fiebre, malestar general y/o dolor abdominal, que según los estudios están presentes en el 60-80% de los casos. En otras ocasiones puede aparecer como un síndrome general, sangrado digestivo (por fistula aortoentérica) o incluso permanecer asintomáticos un 5-10% de los casos y alcanzar el diagnóstico mediante controles de imagen en las sucesivas revisiones programadas2,5,15,18,19. También se han descrito casos con presentación clínica de espondilodiscitis por contigüidad (nuestra experiencia con el paciente ID 3)11,20–22, isquemia de miembros inferiores o embolias sépticas. Nuestra serie muestra unas proporciones similares a lo descrito en la bibliografía.
Para el diagnóstico es necesario, por lo tanto, una combinación de criterios clínicos, radiológicos y microbiológicos. En 2016 se publicaron los criterios Management of Aortic Graft Infection Collaboration (MAGIC) para intentar simplificar y facilitar unos criterios diagnósticos que ayuden a identificar con precocidad las infecciones de prótesis vasculares6,9. Según estos criterios se considera diagnóstico cuando se cumple un criterio mayor de una categoría y otro criterio (mayor o menor) de cualquier otra categoría (tabla 2).
Criterios MAGIC
| Clínica/cirugía | Radiología | Microbiología | |
|---|---|---|---|
| Criterios mayores | Pus microscópica confirmada (periprotésica o en saco) en cirugíaHerida abierta con exposición de prótesis o fístulaFístula aortoentérica, aortobronquial, etc.Colocación de prótesis en sitio infectado (aneurisma micótico…). | Líquido periprotésico en TC≥3 meses tras implanteGas periprotésico en TC≥7 semanas tras implanteAumento de gas periprotésico en controles seriados | Cultivo de explante (+)Cultivo de muestra intraoperatoria (+)Cultivo de muestra de aspirado de colección o saco (+) |
| Criterios menores | Datos de infección local (eritema, calor, induración, etc.)Fiebre>38°C con infección de prótesis como causa más probable | Otros: gas periprotésico, líquido o inflamación de tejidos blandos sospechoso. Crecimiento de aneurisma, discitis/osteomielitis, engrosamiento de la pared intestinal, PET/TC compatible, gammagrafía con leucocitos compatible… | Hemocultivos (+) sin otra causa justificableMarcadores analíticos de infección con infección de prótesis como causa más probable: elevación de reactantes, PCR, leucocitosis, etc. |
Adaptada de Lyons et al.9.
Dentro de las pruebas de imagen la TC es una técnica rápida, relativamente barata. En infecciones muy precoces y las crónicas o de baja virulencia la sensibilidad disminuye de manera drástica12,23. Recientemente varios estudios han tratado de validar la PET-TC, obteniendo una sensibilidad y especificidad globales cercanas e incluso superiores a la técnica de referencia que era la TC11,12,23–26. La nueva guía de la ESVS recomienda la TC como técnica diagnóstica de primera línea y la PET/TC como técnica adicional en aquellos casos con TC no concluyente (fig. 1)6.
El diagnóstico microbiológico no es fácil. Aproximadamente 1/3 de los hemocultivos suelen ser negativos10,15,27, por lo que siempre que se pueda se realizará un aspirado de las colecciones periaórticas o del saco aneurismático para aumentar la rentabilidad diagnóstica, y por supuesto es obligatorio el estudio microbiológico del material protésico en caso de explante, así como de tejidos periprotésicos intraoperatorios (pared aórtica, trombo o líquido periprotésico), bien por métodos tradicionales de cultivo bien por métodos de biología molecular6,13. El conocimiento de la flora implicada en las infecciones de endoprótesis aórtica facilita la elección de la antibioterapia empírica, aunque es muy variable y obliga a un esquema de antibioterapia de amplio espectro. Los cocos grampositivos están implicados hasta en la mitad de los casos: S. aureus en un 19,2-53% (uno de cada 5 suelen ser SARM); S. coagulasa negativos (SCN) en un 3,3-15%, Streptococcus sp. en un 15% y enterococos en un 3,3-7,7%. Los bacilos gramnegativos se aíslan en aproximadamente un 30%: predomina E. coli con un 7,7-23,1% y la prevalencia de P. aeruginosa es de aproximadamente el 4%. Por último, podremos encontrar infecciones fúngicas en el 10% y anaerobios estrictos (Bacteroides sp., Cutibacterium sp.) en un 5%. Las infecciones por anaerobios suelen darse en el contexto de infecciones polimicrobianas que en caso de tratarse de flora entérica (enterobacterias, enterococos, Bacteroides sp., etc.) debe hacernos sospechar de la presencia de fístula aortoentérica2,10,12,16,28.
El tratamiento de elección es el explante de la prótesis infectada. La mortalidad posquirúrgica precoz (<30 días) es variable en las diferentes series de casos, entre el 5,5-30%2,15,18,19. La nueva guía de la ESVS recomienda como tratamiento de elección el explante con recontrucción in situ con injerto autólogo de vena, aunque admite que cada técnica in situ o extraanatómica tiene sus ventajas y desventajas, y no recomienda la reconstrucción in situ con material protésico en áreas muy contaminadas6,12. La mayor revisión de casos de EVAR infectados tratados con mantenimiento de la endoprótesis, realizada por Moulakakis et al.27, refleja una mortalidad global del 44,8% (40% en los casos tratados con limpieza quirúrgica y 50% en aquellos tratados con antibioterapia únicamente). Recientemente Shukuzawa et al.17 han publicado una serie de 15 infecciones de EVAR, donde el 80% fueron tratados conservando el implante infectado (de elección en su centro) con una mortalidad precoz del 16,7%. Los pacientes que por edad y comorbilidad es poco probable que sobrevivan un explante quirúrgico se pueden beneficiar de un abordaje semiconservador con extirpación parcial del injerto, limpieza intraoperatoria o tratamiento médico conservador/paliativo6. En definitiva, para la elección del tratamiento es necesario un abordaje multidisciplinar e individualizado, teniendo en cuenta las características del paciente y la experiencia del centro.
Respecto a la terapéutica antimicrobiana los estudios son escasos. En la mayoría de las series se inicia una antibioterapia de amplio espectro y se continúa con una terapia dirigida en caso de aislamiento microbiológico, que se prolonga hasta las 6 semanas o más, o de forma indefinida en caso de tratamiento subóptimo o alto riesgo de recurrencia (gérmenes virulentos, reconstrucción in situ con infección extensa u otras circunstancias que no garantizan la curación del cuadro clínico)12,28.
El Groupe de Recherche sur les Infections de Prothèses vasculaires publicó en 2015 el primer documento de consenso para el manejo antibiótico de las infecciones de prótesis vasculares28. Más recientemente otro grupo de trabajo italiano ha publicado una actualización del manejo multidisciplinar de las infecciones de prótesis aórticas abdominales29. Se trata de recomendaciones con bajo grado de evidencia B-III/C-III, con evidencia extrapolada muchas veces del manejo de la endocarditis infecciosa o las infecciones de prótesis osteoarticulares.
En las tablas 3 y 4 describimos la estrategia de terapia antimicrobiana empírica y dirigida en las infecciones de endoprótesis aórticas que llevamos a cabo en nuestro hospital, basada en la experiencia acumulada de estos años, el patrón de resistencias de los microorganismos en nuestra área sanitaria y la actualización periódica con la literatura.
Tratamiento antibiótico empírico
| Situación clínica | Ausencia de alergia a B-lactámicos | Alergia a B-lactámicos |
|---|---|---|
| Infección sin datos de sepsis ni complicaciones mecánicas potencialesa | Retrasar ATB hasta la toma de muestras para estudio microbiológico (hemocultivos, punción percutánea de muestras del foco infeccioso) | |
| Infección con sepsis no grave y sin factores de riesgo de microorganismos BLEE/MDR | Piperazilina-tazobactam+vancomicina/daptomicina | Aztreonam+metronidazol+vancomicina/daptomicina |
| Infección con sepsis grave y/o con factores de riesgo de microorganismos BLEE/MDR | Meropenem+vancomicina/daptomicina±amikacinab±caspofunginac | Aztreonam+metronidazol+vancomicina/daptomicina+amikacina±Caspofunginac |
ATB: antibiótico; BLEE: betalactamasas de espectro extendido; MDR: multirresistente.
Tratamiento antibiótico dirigido (condicionado a sensibilidad según antibiograma)
| Microorganismo | Tratamiento de inicio | Tratamiento secuencial | |
|---|---|---|---|
| Sin alergias | Alergia a B-lactámicos | ||
| SAMSSCNMSSAMRSCNMR | Cloxacilina+rifampicinaa | Vancomicina/daptomicina+rifampicinaaDaptomicina/vancomicina+rifampicinaa | LinezolidQuinolona+rifampicinaQuinolona+cotrimoxazolDoxiciclina+rifampicinaCotrimoxazol+rifampicina |
| Streptococcus sp. | Ceftriaxona | Vancomicina | Cefixima/levofloxacino |
| Enterococcus sp. | Sensible a penicilina:Ampicilina±gentamicina | Resistente a penicilina o alergia a B-lactámicos:Vancomicina/daptomicina | Amoxicilina clavulánico/LevofloxacinoResistente a penicilina: linezolid |
| Enterobacterias | Ceftriaxona/ceftazidima /cefepimaBLEE: meropenem | Aztreonam/quinolona+aminoglucósido | Cefixima/ciprofloxacino/cotrimoxazolBLEE: ertapenemb |
| Pseudomonas sp. | Ceftazidima/piperacilina tazobactam | Aztreonam/quinolona+aminoglucósido | Quinolona |
| Anaerobiosc | Bacteroides sp.: MetronidazolC. acnes: ceftriaxona | MetronidazolCefixima/moxifloxacino | |
| Candida sp. | Equinocandina | Fluconazol | |
SAMS/SAMR: S. aureus meticilín-sensible/resistente; SCNMS/SCNMR: S. coagulasa negativo meticilín-sensible/resistente.
En caso de implante conservado tras cirugía de limpieza, rifampicina a partir del 5.° día una vez que los HC sean negativos.
Una vez que obtengamos los resultados microbiológicos podremos modificar la pauta antibiótica inicial hacia la terapia dirigida según la sensibilidad del microorganismo y ajustada a la gravedad del cuadro clínico. Se procurará administrar antibióticos bactericidas y que alcancen elevados niveles plasmáticos hasta confirmar la estabilidad clínica del paciente. En nuestro hospital, en aquellos casos en los que se haya realizado un procedimiento quirúrgico definitivo con explante de la endoprótesis, limpieza de las eventuales colecciones del foco inicial y colocación de un bypass extra-anatómico, administramos antibioterapia endovenosa durante 2 semanas desde la cirugía y de 4 a 6 semanas en caso de reconstrucción in situ. Sin embargo, cuando se opta por mantener el implante tras la limpieza quirúrgica y cobertura con tejido autólogo o parche, prolongamos el tratamiento antibiótico hasta completar 12 o 16 semanas, previa comprobación de una correcta evolución por la evaluación clínica y por imagen de PET/TC. En el caso de la única infección por levadura (Candida albicans) tratada mediante este método, decidimos prolongar el tratamiento antifúngico hasta 6 meses. En aquellas ocasiones en las que no se pueda realizar un acto quirúrgico sobre la endoprótesis aórtica infectada se continuará el tratamiento antibiótico con la estrategia basada en la supresión crónica de la infección según la sensibilidad del microorganismo y la tolerancia del paciente. Debemos recalcar la posibilidad y beneficio para estos pacientes de recibir tratamientos endovenosos dirigidos en régimen de terapia antibiótica domiciliaria endovenosa, de forma similar a los pacientes con endocarditis infecciosa bajo supervisión del servicio de hospitalización a domicilio, evitando así largas estancias hospitalarias. Este método nos permite prolongar el tratamiento intravenoso, en particular cuando es difícil asegurar niveles adecuados de algunos antibióticos en el tejido vascular y sobre la prótesis no explantada cuando son administrados por vía oral. En este sentido, el momento adecuado para la secuenciación a terapia antibiótica oral se decide en función de la evolución clínica, evolución por TC y las opciones disponibles de terapia oral efectiva para el microorganismo causante y su tolerancia.
Podemos concluir que la infección de la endoprótesis tras EVAR es una entidad poco frecuente, pero con una elevada morbimortalidad. Para la filiación microbiológica además de los hemocultivos se debe intentar siempre que sea posible el cultivo de la muestra del saco aneurismático guiado por eco/TC, dado que aumenta la rentabilidad diagnóstica. La antibioterapia empírica inicial debe ser de amplio espectro con cobertura para cocos grampositivos (incluidos SAMR), enterobacterias (individualizando el riesgo de enterobacterias con mecanismos de resistencia) y anaerobios, así como considerar la posible implicación de levaduras en caso de fístula aortoentérica. En todo paciente con un riesgo quirúrgico asumible el tratamiento de elección es el explante de la endoprótesis con reconstrucción in situ o extraanatómica, si bien la limpieza quirúrgica conservando el implante ha demostrado ser una alternativa razonable. Lamentablemente hasta ahora carecemos de guías clínicas consensuadas y basadas en la evidencia científica para recomendar un tratamiento antibiótico óptimo en eficacia y duración.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.