Los circuitos de diagnóstico de la hepatitisC son complejos. El diagnóstico de infección activa en la misma muestra simplificaría el proceso estableciendo un acceso rápido al tratamiento. Nuestro objetivo fue estimar el impacto sanitario y económico del diagnóstico de la infección crónica en un solo paso (D1P) comparado con el diagnóstico tradicional (DTRA) en Andalucía (8,39 millones de personas).
MétodosSe realizó un árbol de decisión para estimar la derivación de los pacientes con infección crónica, pérdidas de seguimiento, acceso al tratamiento y costes del diagnóstico de la infección, para ambos procesos. Los costes unitarios, en euros (€) de 2018, de los recursos sanitarios (visitas médicas, anticuerpos, carga viral y genotipo), sin considerar el coste farmacológico, se obtuvieron de fuentes públicas de Andalucía.
ResultadosDel total de la población estimada (269.526 pacientes), 1.389 pacientes serían derivados al especialista en el D1P y 1.063 en el DTRA, siendo tratados 1.320 y 1.009, respectivamente. Con el D1P ningún paciente con carga viral negativa sería remitido al especialista, frente a los 540 con el DTRA. El D1P generaría un ahorro de costes de 184.928€ frente al DTRA (15.671.493 vs 15.856.421€). Al comparar el D1P frente a DTRA, el ahorro por paciente con carga viral positiva derivado al especialista sería de 3.644€ (11.279 vs 14.923€).
ConclusionesEl diagnóstico en un solo paso conseguirá un aumento de pacientes diagnosticados, aumentará el acceso de los pacientes crónicos al tratamiento y generará un ahorro de costes, demostrando su eficiencia en el sistema sanitario en Andalucía.
The cascade of care of the hepatitisC are complex. The diagnosis of active infection in the same serum sample would simplify the process establishing a rapid access for patients to treatment. Our objective was to estimate the impact on healthcare and economic outcomes of the diagnosis of chronic infection in one-step diagnosis compared to standard diagnosis in Andalusia (8.39 million people).
MethodsA decision tree was developed to estimate the referral of patients with chronic infection, loss of follow-up, access to treatment and costs of the diagnosis of the infection, for both processes. The unit costs (€, 2018) of the health resources (medical visits, antibodies, viral load and genotype), without considering the pharmacological cost, were obtained form public sources in Andalusia.
ResultsOf the total estimated population (269,526 patients), 1,389 patients would be referred to the specialised care in the one-step diagnosis and 1,063 in de standard diagnosis, being treated 1,320 and 1,009, respectively. In one-step diagnosis, no negative viral loud patient would be referred to specialist versus 540 with standard diagnosis. One-step diagnosis would generate a cost saving of €184,928 versus standard diagnosis (€15,671,493 vs €15,856,421). When compared one-step diagnosis to standard diagnosis, the savings per patient with positive viral load referred to specialist would be €3,634 (€11,279 vs €14,923).
ConclusionThe one-step diagnosis will achieve an increase in diagnosed patients, will increase the access of chronic patient to treatment and will generate cost savings, demonstrating its efficiency in the system in Andalusia.
El virus de la hepatitis C (VHC) tiene una alta seroprevalencia en la población española, cercana al 1%1-3, con tasas de viremia del 31 al 45%1-3. La enfermedad crónica se asocia a una elevada morbimortalidad4,5 y es la causa de un gran número de muertes hepáticas6.
Los antivirales de acción directa actuales pueden llegar a curar la enfermedad en >95% de los casos7-9, reduciendo el riesgo de desarrollo de complicaciones hepáticas y mortalidad asociada al virusC10,11, pero para ello es necesario vincular el diagnóstico al tratamiento.
En España, en el año 2015 se implantó el Plan Estratégico para el Abordaje de la HepatitisC (PEAHC) con el fin de disminuir la morbimortalidad derivada de la infección crónica por el VHC mediante la prevención, el diagnóstico y el tratamiento de forma eficiente9. Gracias a las acciones realizadas desde entonces se ha conseguido reducir de forma importante el número de pacientes infectados en nuestro país9,12. A pesar de ello, todavía existen muchas personas que desconocen su estado de infección2,13.
El diagnóstico de la infección consta de una serología para detectar anticuerpos frente al VHC (anti-VHC), que indican el contacto previo con el virus, y la realización de pruebas para la detección de marcadores virológicos, tales como ARN-VHC o el antígeno del core del VHC, que informan si existe infección activa7-9.
Los circuitos habituales de diagnóstico son complejos, y algunos pacientes anti-VHC+ detectados no son remitidos al especialista para su evaluación y tratamiento posterior14. Por este motivo, organizaciones como la Organización Mundial de la Salud (OMS) han desarrollado directrices, entre las que figura la simplificación del diagnóstico de la hepatitisC15. Asimismo, las asociaciones científicas también recomiendan un diagnóstico rápido16. En este sentido, el diagnóstico de infección activa en la misma muestra de suero simplificaría el proceso y establecería un acceso ágil de los pacientes al tratamiento. Algunos estudios han evaluado la implantación del diagnóstico de la infección crónica en un solo paso en Andalucía, mostrando que su instauración aumentaría significativamente la derivación de pacientes con infección activa a atención especializada, consiguiendo con ello incrementar los pacientes evaluados para el tratamiento17. Sin embargo, solo el 33% de los centros españoles lo realizan18.
Desde otra perspectiva, las repeticiones de pruebas de diagnóstico innecesarias que se realizan a causa de derivaciones entre especialistas constituyen una ineficiencia del sistema, repercutiendo en un mayor impacto económico asociado al coste del diagnóstico y dificultando el acceso de los pacientes al tratamiento al posibilitar un mayor número de pérdidas de pacientes en cada solicitud de una analítica.
El aumento de las tasas de diagnóstico es un factor clave para avanzar en la eliminación del VHC. Así, un diagnóstico rápido para la identificación de pacientes virémicos que facilite y garantice el acceso al tratamiento es indispensable. Pese a que el diagnóstico en un solo paso no está implementado de forma general en Andalucía, la mayoría de los laboratorios consideran que es factible, aunque con algunas barreras técnicas y económicas a superar19. Por ello, el objetivo del estudio fue estimar el impacto sanitario y económico del diagnóstico de la infección crónica en un solo paso (D1P) en comparación con el diagnóstico tradicional (DTRA) en Andalucía.
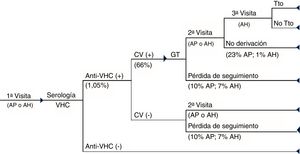
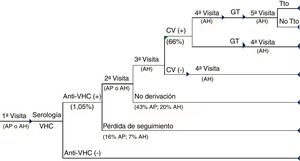
MetodologíaSe diseñó un árbol de decisión (Excel 2010) comparando dos alternativas de diagnóstico para el VHC: D1P y DTRA (figs. 1 y 2).
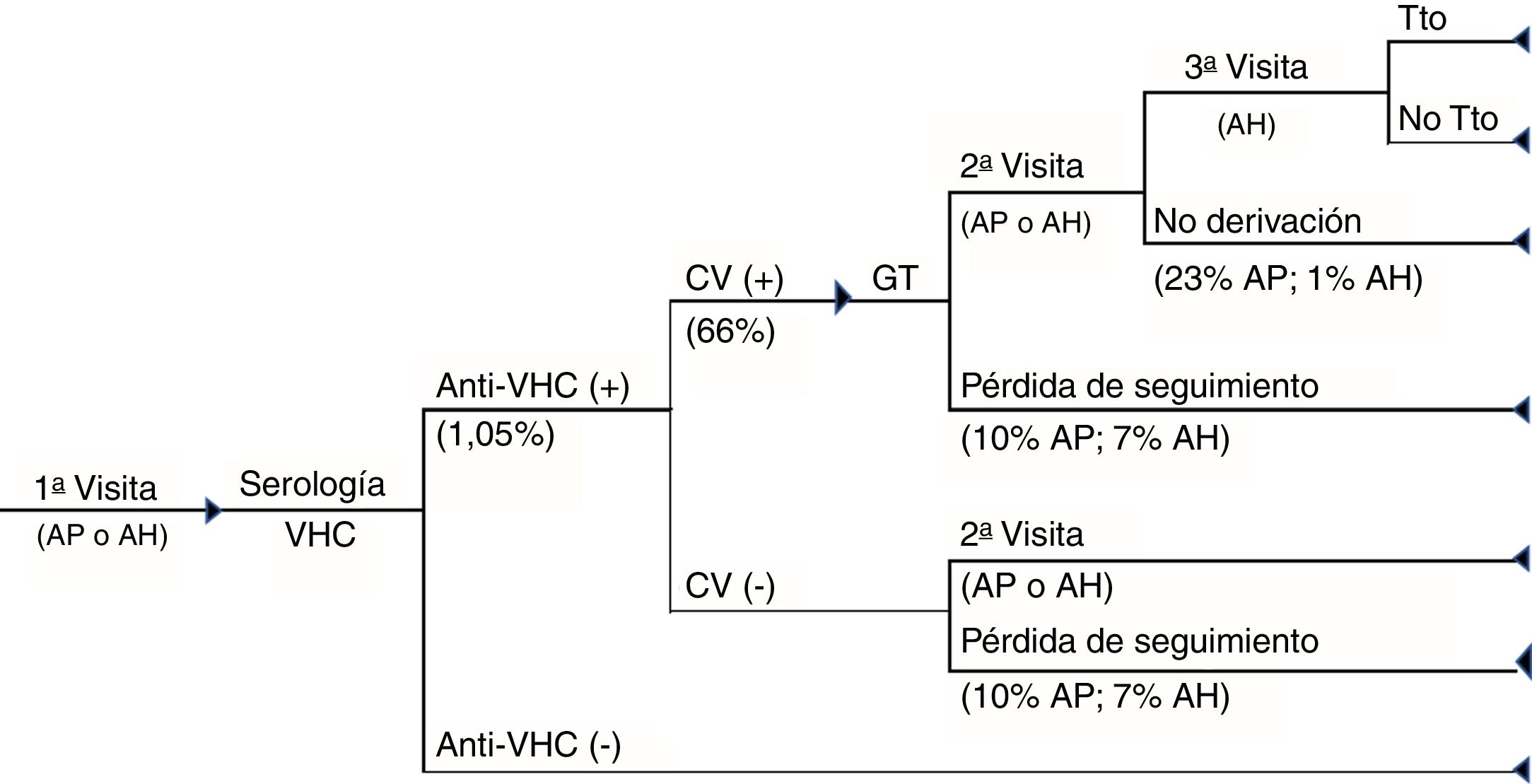
Circuito asistencial del D1P. Circuito asistencial de los pacientes con hepatitisC crónica del diagnóstico en un solo paso desde la primera visita a atención primaria o atención hospitalaria hasta el diagnóstico de la infección y acceso o no a tratamiento de los pacientes.AH: atención hospitalaria; AP: atención primaria; CV (+): carga viral positiva; CV (−): carga viral negativa; GT: genotipo; Tto: tratamiento.
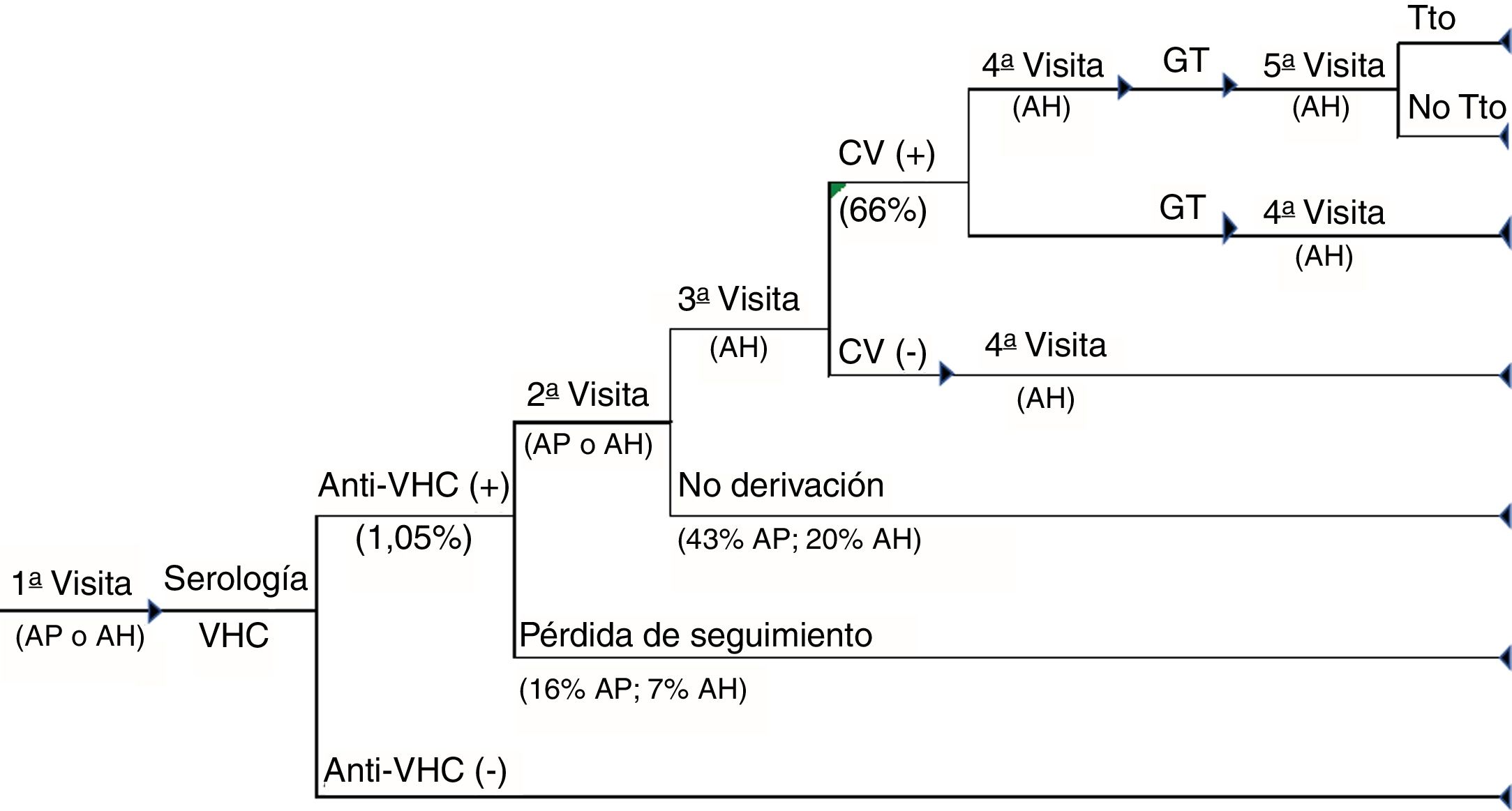
Circuito asistencial del DTRA. Circuito asistencial de los pacientes con hepatitisC crónica del diagnóstico estándar desde la primera visita a atención primaria o atención hospitalaria hasta el diagnóstico de la infección y acceso o no a tratamiento de los pacientes.AH: atención hospitalaria; AP: atención primaria; CV (+): carga viral positiva; CV (−): carga viral negativa; GT: genotipo; Tto: tratamiento.
El análisis requirió la asesoría de un panel de expertos formado por seis clínicos de diferentes áreas sanitarias (microbiología y parasitología clínica, digestivo, hepatología e infectología) con más de 25años de experiencia para validar los valores obtenidos en la literatura y para estimar y consensuar el consumo de recursos asociado al circuito asistencial para el diagnóstico de la hepatitisC.
Para construir el árbol de decisión, a partir de la opinión de expertos se estableció el circuito asistencial para cada diagnóstico y se definieron las secuencias de pruebas y visitas médicas para el diagnóstico y tratamiento de la hepatitisC crónica. Los porcentajes de cada rama del árbol de decisión fueron asignados en base a la mejor evidencia científica publicada. En los casos en que los datos no estaban disponibles, estos fueron establecidos por el panel de expertos.
Se estimó que, en un año, un total de 269.526 personas en Andalucía serían susceptibles de acudir a una consulta de atención primaria o a una consulta externa hospitalaria rutinaria (con una distribución del 67%/33%, respectivamente) y se les realizaría una serología para el diagnóstico del VHC.
El circuito asistencial para el D1P se basó en la realización, en una única muestra de sangre, de una serología para la detección de anticuerpos anti-VHC, confirmada mediante polymerase chain reaction (PCR), con objeto de medir la carga viral (CV) y el genotipo, si la prueba es positiva. Si el paciente es virémico, es derivado al especialista para la valoración de su tratamiento (fig. 1).
En el circuito asistencial del DTRA, además de las visitas médicas entre pruebas en los pacientes positivos, se incluyó la derivación al centro de atención especializada (en el 31% de los pacientes), la repetición de la serología antes de la realización de la CV (en el 10%) y una visita adicional al especialista antes de realizar el genotipo (en el 15%). Los pacientes virémicos son derivados al especialista para la evaluación de su tratamiento (fig. 2).
Por último, en ambos circuitos se consideraron las pérdidas de seguimiento de los pacientes al no acudir a recoger los resultados y la no derivación al especialista de pacientes con anti-VHC+. Asimismo, se asumió que todos los pacientes con anti-VHC− no acudían a consulta para la recogida de los resultados.
Los recursos sanitarios asociados al diagnóstico fueron: anti-VHC, CV, genotipo y visitas médicas (atención primaria y especializada). El análisis se realizó bajo la perspectiva del Servicio Andaluz de Salud, por lo que solo se incluyeron costes directos sanitarios diferenciales (euros [€] de 2018). Los costes de los recursos sanitarios necesarios para la realización del modelo se obtuvieron a partir de los precios públicos de servicios sanitarios de la Junta de Andalucía y de bases de datos de hospitales20,21 y se muestran en la tabla 1. El coste del personal de laboratorio por prueba realizada se calculó a partir de una jornada de trabajo diaria de un técnico de laboratorio22 y el tiempo estimado para analizar la prueba de diagnóstico. El coste de una consulta médica al especialista hospitalario se estimó como el promedio de costes de los diferentes especialistas relacionados con la hepatitisC. En el análisis no se consideró el coste farmacológico de los tratamientos antivirales. Debido a que el horizonte temporal considerado es un año, no se consideró ninguna tasa de descuento para los costes.
Parámetros y costes unitarios considerados en el análisis
| Parámetros | Caso base | Rango de valores (min-max) | Referencia |
|---|---|---|---|
| Generales | |||
| Población diana | 269.526 | 529.678 | Panel de expertos |
| Valores (%) | Valores (%) | ||
|---|---|---|---|
| Primera consulta | |||
| Primera consulta, AP | 67 | 55-74 | Panel de expertos |
| Primera consulta, AH | 33 | 18-45 | Panel de expertos |
| Prevalencia VHC (+) | 1,05 | 0,8-1,9 | 1-3 |
| Carga viral (+) | 66 | 62-70 | 17 |
| Tratamiento | 95 | 90-100 | Panel de expertos |
| Específicos DTRA | |||
| Recogida de resultados | |||
| Atención primaria | 84 | 72-95 | Panel de expertos |
| Atención hospitalaria | 93 | 90-99 | Panel de expertos |
| No derivación del paciente | |||
| Atención primaria | 43 | 28-50 | [17] |
| Atención hospitalaria | 20 | 15-25 | Panel de expertos |
| Repetición de la serología | 10 | 5-15 | Panel de expertos |
| Visita extra antes del GT | 15 | 10-19 | Panel de expertos |
| Específicos D1P | |||
| Recogida de resultados | |||
| Atención primaria | 90 | 85-95 | Panel de expertos |
| Atención hospitalaria | 93 | 90-99 | Panel de expertos |
| No derivación de paciente a tratamiento | |||
| Atención primaria | 23 | 15-31 | Panel de expertos |
| Atención hospitalaria | 10 | 5-15 | Panel de expertos |
| Costes directos unitarios | Caso base | Rango de valores | Referencia |
|---|---|---|---|
| Visitas médicas | |||
| Atención primaria | 18,0 € | 13,5 - 29,8 € | 20 |
| Atención hospitalaria | 128,4 € | 88,0 -147,4 € | 21 |
| Pruebas de diagnósticoa | |||
| Anticuerpos VHC | 1,9 € | 1,3 - 2,4 € | 21 |
| Carga viral | 35,0 € | 24,5 - 45,5 € | 21 |
| Genotipado | 37,2 € | 26,0 - 48,3 € | 21 |
Los resultados que permitieron analizar la efectividad de la detección y el acceso al tratamiento se dividieron en función del valor que aportan al Sistema de Salud y a los pacientes en: a)resultados positivos: número de pacientes con CV+ derivados al especialista y con acceso a tratamiento; b)resultados negativos: número de pacientes con CV− derivados al especialista, pérdidas de seguimiento y la no derivación.
Los resultados económicos se expresaron como el coste total de los recursos sanitarios utilizados durante el diagnóstico del paciente en el D1P frente al coste total en el DTRA, así como el coste promedio por paciente con CV+ o CV− derivado al especialista.
Análisis de sensibilidadLa incertidumbre fue medida con análisis de sensibilidad univariantes que evaluaron el efecto de cada parámetro de forma individual sobre los resultados, en base a un rango de valores máximos y mínimos. En los parámetros sin información a partir de literatura publicada se asumió una variación de ±20% o el dato aportado directamente por el panel de expertos. El rango de valores máximos y mínimos para cada parámetro se muestra en la tabla 1. Además, se realizó un análisis con una variación del ±10%, del ±20% y del ±30% sobre el coste unitario de las pruebas de diagnóstico de la infección.
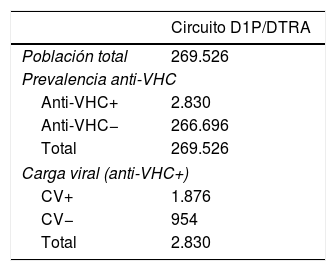
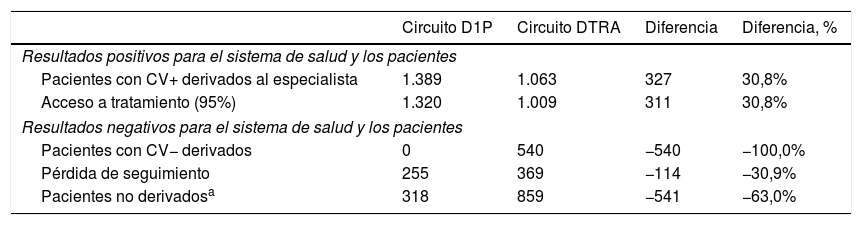
ResultadosDel total de la población considerada como susceptible de acudir a consulta y a la que sería realizada una serología para el diagnóstico del VHC en Andalucía en un año, que se cifró en 269.526 personas, 2.830 tendrían anti-VHC+ y 1.876 una CV+ (tabla 2). De estos pacientes virémicos se diagnosticarían y derivarían al especialista para el seguimiento de la enfermedad un 31% de pacientes adicionales con CV+ con el D1P (1.389 pacientes) frente al DTRA (1.063 pacientes), lo que repercutiría en un mayor número de pacientes con acceso a tratamiento (1.320 y 1.009 con el D1P y el DTRA, respectivamente) (tabla 3).
Resultados poblacionales
| Circuito D1P/DTRA | |
|---|---|
| Población total | 269.526 |
| Prevalencia anti-VHC | |
| Anti-VHC+ | 2.830 |
| Anti-VHC− | 266.696 |
| Total | 269.526 |
| Carga viral (anti-VHC+) | |
| CV+ | 1.876 |
| CV− | 954 |
| Total | 2.830 |
CV+: carga viral positiva; CV−: carga viral negativa; D1P: diagnóstico en un solo paso; DTRA: diagnóstico tradicional; VHC: virus de la hepatitis C.
Resultados clínicos
| Circuito D1P | Circuito DTRA | Diferencia | Diferencia, % | |
|---|---|---|---|---|
| Resultados positivos para el sistema de salud y los pacientes | ||||
| Pacientes con CV+ derivados al especialista | 1.389 | 1.063 | 327 | 30,8% |
| Acceso a tratamiento (95%) | 1.320 | 1.009 | 311 | 30,8% |
| Resultados negativos para el sistema de salud y los pacientes | ||||
| Pacientes con CV− derivados | 0 | 540 | −540 | −100,0% |
| Pérdida de seguimiento | 255 | 369 | −114 | −30,9% |
| Pacientes no derivadosa | 318 | 859 | −541 | −63,0% |
Además, de los 2.830 pacientes con anti-VHC+, con el D1P ningún paciente con CV− sería remitido de forma innecesaria al especialista, frente a los 540 con el DTRA. En comparación con el D1P, con el DTRA un 63% más de pacientes con serología positiva no serían derivados al especialista para su valoración (859 y 318 con el DTRA y el DIP, respectivamente) y en 114 pacientes adicionales se produciría una pérdida de seguimiento (tabla 3).
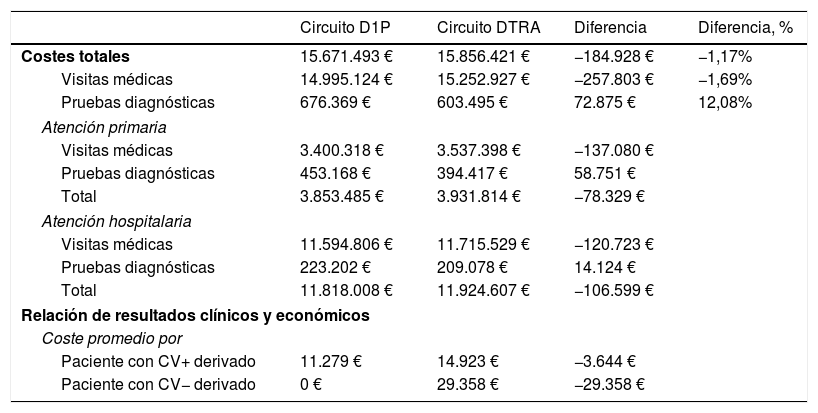
Los resultados económicos mostraron que el D1P supusieron un coste total de 15.671.493€, frente a 15.856.421€ con DTRA, consiguiendo un ahorro de costes de 184.928€ para toda la población evaluada (tabla 4). El coste de las visitas médicas supuso el mayor peso del coste total. Al comparar el D1P frente a DTRA, el ahorro por paciente con CV positiva derivado al especialista fue de 3.644€ (11.279€ vs 14.923€) (tabla 4).
Resultados económicos
| Circuito D1P | Circuito DTRA | Diferencia | Diferencia, % | |
|---|---|---|---|---|
| Costes totales | 15.671.493 € | 15.856.421 € | −184.928 € | −1,17% |
| Visitas médicas | 14.995.124 € | 15.252.927 € | −257.803 € | −1,69% |
| Pruebas diagnósticas | 676.369 € | 603.495 € | 72.875 € | 12,08% |
| Atención primaria | ||||
| Visitas médicas | 3.400.318 € | 3.537.398 € | −137.080 € | |
| Pruebas diagnósticas | 453.168 € | 394.417 € | 58.751 € | |
| Total | 3.853.485 € | 3.931.814 € | −78.329 € | |
| Atención hospitalaria | ||||
| Visitas médicas | 11.594.806 € | 11.715.529 € | −120.723 € | |
| Pruebas diagnósticas | 223.202 € | 209.078 € | 14.124 € | |
| Total | 11.818.008 € | 11.924.607 € | −106.599 € | |
| Relación de resultados clínicos y económicos | ||||
| Coste promedio por | ||||
| Paciente con CV+ derivado | 11.279 € | 14.923 € | −3.644 € | |
| Paciente con CV− derivado | 0 € | 29.358 € | −29.358 € | |
CV+: carga viral positiva; CV−: carga viral negativa; D1P: diagnóstico en un solo paso; DTRA: diagnóstico tradicional.
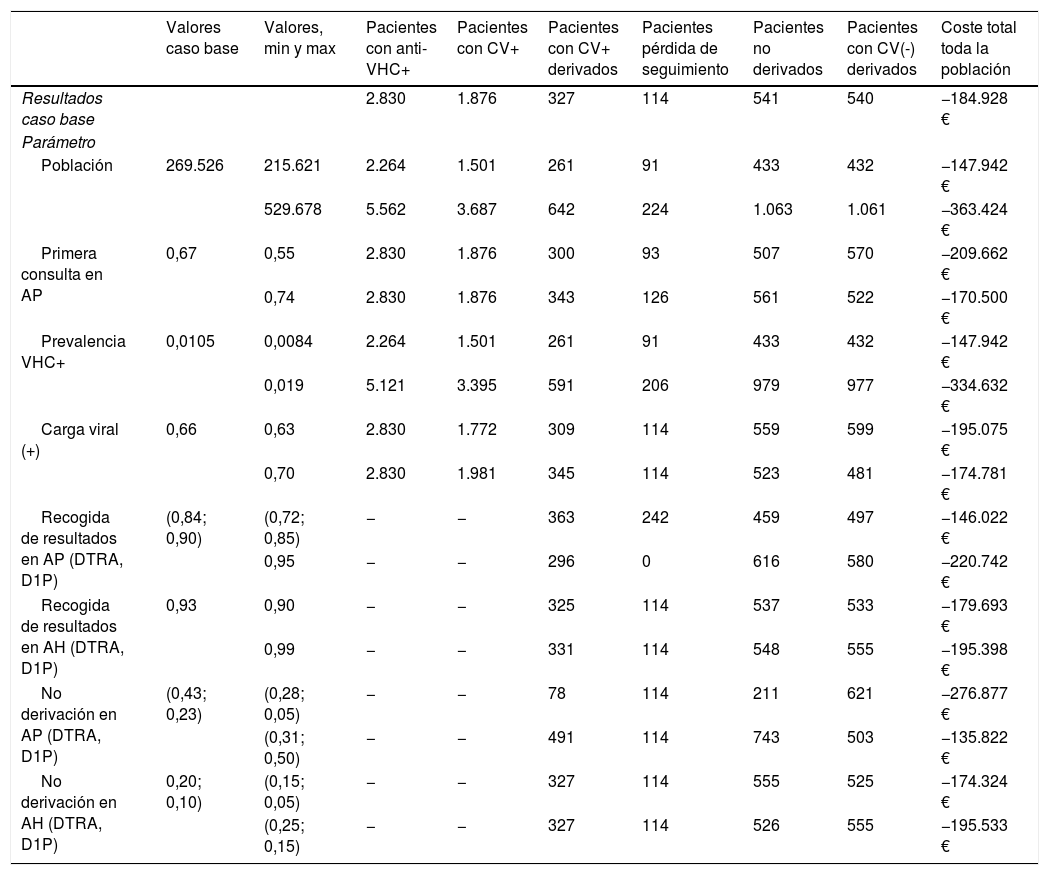
Los análisis de sensibilidad muestran la robustez del análisis del caso base, de forma que cualquier variación en los valores mínimos y máximos de los parámetros incluidos en el análisis aumenta o disminuye la diferencia en el número de pacientes con anti-VHC+ y con CV+ detectados, pero mantiene el hecho de que el D1P produce mejores resultados clínicos que el DTRA.
Por otro lado, en todos los análisis de sensibilidad univariantes realizados, frente al DTRA, el D1P generó ahorros al sistema sanitario, variando el coste total para toda la población entre −103.222€ y −363.424€. Los parámetros con mayor influencia en los resultados económicos fueron la población y el coste de la visita médica a atención hospitalaria.
En la tabla 5 se muestran los resultados de los análisis de sensibilidad con los parámetros asociados a la población y al circuito asistencial con mayor influencia en los resultados finales.
Resultados del análisis de sensibilidad
| Valores caso base | Valores, min y max | Pacientes con anti-VHC+ | Pacientes con CV+ | Pacientes con CV+ derivados | Pacientes pérdida de seguimiento | Pacientes no derivados | Pacientes con CV(-) derivados | Coste total toda la población | |
|---|---|---|---|---|---|---|---|---|---|
| Resultados caso base | 2.830 | 1.876 | 327 | 114 | 541 | 540 | −184.928 € | ||
| Parámetro | |||||||||
| Población | 269.526 | 215.621 | 2.264 | 1.501 | 261 | 91 | 433 | 432 | −147.942 € |
| 529.678 | 5.562 | 3.687 | 642 | 224 | 1.063 | 1.061 | −363.424 € | ||
| Primera consulta en AP | 0,67 | 0,55 | 2.830 | 1.876 | 300 | 93 | 507 | 570 | −209.662 € |
| 0,74 | 2.830 | 1.876 | 343 | 126 | 561 | 522 | −170.500 € | ||
| Prevalencia VHC+ | 0,0105 | 0,0084 | 2.264 | 1.501 | 261 | 91 | 433 | 432 | −147.942 € |
| 0,019 | 5.121 | 3.395 | 591 | 206 | 979 | 977 | −334.632 € | ||
| Carga viral (+) | 0,66 | 0,63 | 2.830 | 1.772 | 309 | 114 | 559 | 599 | −195.075 € |
| 0,70 | 2.830 | 1.981 | 345 | 114 | 523 | 481 | −174.781 € | ||
| Recogida de resultados en AP (DTRA, D1P) | (0,84; 0,90) | (0,72; 0,85) | − | − | 363 | 242 | 459 | 497 | −146.022 € |
| 0,95 | − | − | 296 | 0 | 616 | 580 | −220.742 € | ||
| Recogida de resultados en AH (DTRA, D1P) | 0,93 | 0,90 | − | − | 325 | 114 | 537 | 533 | −179.693 € |
| 0,99 | − | − | 331 | 114 | 548 | 555 | −195.398 € | ||
| No derivación en AP (DTRA, D1P) | (0,43; 0,23) | (0,28; 0,05) | − | − | 78 | 114 | 211 | 621 | −276.877 € |
| (0,31; 0,50) | − | − | 491 | 114 | 743 | 503 | −135.822 € | ||
| No derivación en AH (DTRA, D1P) | 0,20; 0,10) | (0,15; 0,05) | − | − | 327 | 114 | 555 | 525 | −174.324 € |
| (0,25; 0,15) | − | − | 327 | 114 | 526 | 555 | −195.533 € | ||
AH: atención hospitalaria; AP: atención primaria; CV+: carga viral positiva; CV−: carga viral negativa; D1P: diagnóstico en un solo paso; DTRA: diagnóstico tradicional.
El virus de la hepatitis C (VHC) representa una elevada carga de la enfermedad hepática a nivel mundial. El objetivo internacional establecido por la OMS es la eliminación de la hepatitis en el año 203023. En España, este objetivo se prevé conseguirlo en 202124. Para alcanzarlo es necesario avanzar en varios sentidos y consolidar varios pilares. El primero de ellos sería impulsar el cribado y el diagnóstico precoz. Desde la implantación del PEAHC se ha tratado a numerosos pacientes, la mayoría en estados avanzados de la enfermedad9, generando un perfil de paciente con una enfermedad más leve, asintomática y difícil de detectar. Un cribado general en población adulta ayudaría a aumentar el diagnóstico de los casos de infección activa ocultos, que desconocen que padecen la enfermedad25. Además, hay estudios, en España y en otros países, que muestran que el cribado es coste-efectivo13,25-27.
El segundo pilar que favorecería conseguir la eliminación de la enfermedad sería fomentar medidas encaminadas a mejorar el proceso relacionado con el diagnóstico de pacientes con el VHC. En España, los circuitos asistenciales para el diagnóstico son excesivamente complicados. La duración total desde la primera visita al médico de atención primaria o al especialista hasta que el paciente recibe el diagnóstico puede extenderse hasta un año28,29. Además, durante ese tiempo se realizan numerosas visitas médicas y repetición de pruebas innecesarias que ocasionan pérdidas de pacientes con diagnóstico positivo de infección e incrementan los costes. La implementación del D1P ayudaría a mejorar la continuidad asistencial, reduciendo tiempos para el diagnóstico y evitando la pérdida de seguimiento de pacientes virémicos, reforzando así los resultados en salud y económicos del cribado de hepatitisC.
En este sentido, los resultados de nuestro análisis afianzan la importancia de implantar estrategias para mejorar el proceso de diagnóstico de la infección por el VHC. Nuestro estudio muestra que, para la población estimada susceptible de realizar una serología para el VHC en Andalucía, el D1P frente el DTRA ahorraría costes, al tiempo que lograría mejores resultados en salud. El D1P aporta mayor efectividad, considerando el número de pacientes detectados, diagnosticados y con acceso a tratamiento. Además, el D1P tiene un menor coste asociado a la disminución de pruebas diagnósticas y de visitas médicas, por lo que es una estrategia coste-efectiva.
Estudios realizados en otros países han evaluado la eficiencia de la realización de pruebas de diagnóstico rápido frente a las pruebas de rutina o diagnóstico estándar, pero debido a las diferencias en la definición del diagnóstico rápido o de la prueba utilizada para su realización, en las poblaciones a estudio o en la metodología, el presente estudio no se puede comparar con ellos. No obstante, sus conclusiones son similares, concluyendo que la utilización de diagnósticos rápidos para detectar la infección por el VHC es coste-efectiva, incrementando el número de personas con infección detectadas30.
Por otra parte, el refuerzo de la colaboración interniveles y entre los diferentes profesionales sanitarios es primordial en cualquier estrategia para implementar una medida efectiva y eficiente. En la mayoría de los hospitales españoles hay recursos disponibles suficientes para desarrollar el D1P (81%)18. Sin embargo, solo se lleva a cabo en el 31% de ellos18. La colaboración de todos los agentes involucrados en el proceso es necesaria para continuar avanzando hacia la eliminación.
Además, otro punto que aportaría un valor adicional al D1P sería establecer estrategias de alerta en atención primaria y especializada ante un resultado positivo con infección activa, haciendo más efectivo todavía el diagnóstico de la infección31-33.
Entre las limitaciones del estudio se debe mencionar la escasez de información clínica y económica en la literatura publicada para la modelización de los circuitos asistenciales y la realización del análisis. Actualmente no se dispone de datos publicados sobre la distribución de pacientes en los circuitos asistenciales. Tampoco hay información disponible en la literatura sobre el coste de algunas de las pruebas y visitas médicas, lo que hizo necesaria la participación de un panel de expertos. Para recoger el efecto de la variabilidad de los parámetros principales sobre los resultados se realizaron análisis de sensibilidad. En los diferentes escenarios de prevalencia (anti-VHC y CV), de población o variación de costes, el resultado del estudio se mantuvo coste-efectivo.
Por último, el pilar final para alcanzar la eliminación del VHC sería favorecer el acceso a tratamiento de los pacientes virémicos. En este contexto, los antivirales de acción directa actuales con una efectividad superior al 95% en términos de respuesta virológica sostenida7-9, además de reducir la morbimortalidad hepática relacionada con el VHC, mejoran la supervivencia, la calidad de vida de los pacientes y han demostrado ser coste-efectivos10,11. El modelo del presente estudio no ha considerado los resultados en salud que se conseguirían con el acceso al tratamiento de los antivirales de acción directa, medidos como años de vida ganados o años de vida ajustados por calidad, y los costes totales a largo plazo.
ConclusiónEn base a los resultados presentados en el estudio, se puede concluir que el D1P de los pacientes con hepatitisC crónica es una estrategia eficiente frente al DTRA en los centros de Andalucía, que aporta valor adicional al sistema sanitario y a los pacientes, debido a la reducción de visitas médicas y pruebas diagnósticas no necesarias y a los costes asociados a estos procesos.
FinanciaciónPara el desarrollo del proyecto se ha recibido una financiación no condicionada a resultados de Gilead Sciences.
Conflicto de interesesFederico García ha recibido subvenciones para asistir a congresos y reuniones científicas, compensación financiera por charlas y subvenciones para el desarrollo de proyectos de investigación y actividades de educación biomédica de Gilead Sciences, Merck Sharp & Dohme, ViiV Healthcare, Abbvie, Abbott, Roche, Qiagen, Werfen y Hologic. No hay conflicto de intereses con respecto a la publicación de este artículo.
Juan Carlos Alados ha recibido subvenciones para asistir a congresos y reuniones científicas, compensación financiera por conferencias y actividades de educación biomédica de Gilead Sciences, Abbvie, Abbott Diagnostic y Roche Diagnostic. No hay conflicto de intereses con respecto a la publicación de este artículo.
Juan Macías ha prestado servicios de consultoría, ha recibido pagos por conferencias, incluido el servicio de panel de expertos, y ha sido investigador en ensayos clínicos por Bristol Myers-Squibb, Gilead y Merck Sharp & Dome. No hay conflicto de intereses con respecto a la publicación de este artículo.
Juan Manuel Pascasio ha asistido a panel de expertos y conferencias para Gilead y Abbvie. No hay conflicto de intereses con respecto a la publicación de este artículo.
Francisco Téllez ha asistido a cursos, congresos y reuniones científicas para Abbvie, Gilead y MSD. No hay conflicto de intereses con respecto a la publicación de este artículo.
Marta Casado ha sido asesora y oradora de Gilead Sciences, Abbvie y MSD. No hay conflicto de intereses con respecto a la publicación de este artículo.
Raquel Domínguez-Hernández y Miguel Ángel Casado son empleados de Pharmacoeconomics & Outcomes Research Iberia (PORIB), una consultora especializada en Evaluación Económica de Intervenciones Sanitarias que ha recibido una financiación no condicionada a resultados de Gilead Sciences para el desarrollo del proyecto.