El diagnóstico en un solo paso (DUSP) es necesario para conseguir los objetivos de eliminación de la hepatitis C, pero en 2017 solo el 31% de los hospitales españoles hacía DUSP. Tras ese hallazgo, el DUSP fue recomendado por las sociedades científicas involucradas en el diagnóstico y tratamiento de la hepatitis C.
ObjetivosEvaluar el grado de implementación del DUSP en 2019, y conocer la implantación de test de diagnóstico rápido y/o en gota seca (TDR y/o DBS) en los hospitales españoles.
MétodosEstudio transversal mediante encuesta realizada en octubre de 2019 dirigida a hospitales generales españoles con≥200 camas, públicos, o privados con acreditación docente.
ResultadosRespondieron 129 (80%) hospitales. El DUSP lo hace el 89% de los centros vs. el 31% en 2017 (p<0,001). De 2017 a 2019 los centros que utilizan alertas para mejorar la continuidad asistencial aumentaron del 69 al 86% (p=0,002). En 2019, el 11% de los centros puede determinar anti-VHC en gota seca, el 15% viremia en gota seca, el 0,85% anti-VHC en saliva, y el 37% de anticuerpos y/o viremia con test point of care. El 43% de los hospitales disponen al menos de un método diagnóstico con TDR y/o DBS.
ConclusionesLa implantación del DUSP ha aumentado significativamente, llegando al 89% de los hospitales en 2019. Las recomendaciones de las sociedades científicas podrían haber contribuido a la implantación del DUSP. Por otra parte, el acceso a los TDR y/o DBS es insuficiente y se necesitan medidas encaminadas a mejorar su implementación.
Reflex testing is necessary to achieve the objectives of hepatitis C elimination. However, in 2017 only 31% of Spanish hospitals performed reflex test. As a consequence of that finding, reflex testing was recommended by scientific societies involved in the diagnosis and treatment of hepatitis C.
ObjectiveTo evaluate the degree of implementation of reflex testing in 2019 and to know the implementation of rapid diagnostic and/or dried blood spot testing (RDT and / or DBS) in Spanish hospitals.
MethodsCross-sectional study through a survey conducted in October 2019 to Spanish general hospitals with at least 200 beds, public or private with teaching accreditation.
Results129 (80%) hospitals responded. Reflex testing is performed by 89% of the centers vs. 31% in 2017 (P<.001). From 2017 to 2019, centers using alerts to improve continuity of care increased from 69% to 86% (P=.002). In 2019, 11% of centers can determine anti-HCV in dried spot, 15% viremia in dried spot, 0.85% anti-HCV in saliva, and 37% of antibodies and/or viremia with point of care test. 43% of hospitals have at least one diagnostic method with RDT and/or DBS.
ConclusionThe implementation of reflex testing has increased significantly, reaching 89% of hospitals in 2019. The recommendations of scientific societies could have contributed to the implementation of reflex testing. On the other hand, access to RDT and/or DBS is insufficient and initiatives are needed to improve their implementation.
La hepatitis C es la principal causa de cirrosis hepática y de carcinoma hepatocelular, es la indicación más frecuente de trasplante hepático en Europa, produce una considerable pérdida de productividad, disminuye la calidad de vida de los pacientes, y contribuye notablemente al aumento del gasto sanitario1,2. En España, en 2018, la prevalencia estimada de anticuerpos anti-VHC en la población general adulta estaba entre el 0,85% y el 1,1% y la prevalencia de viremia entre el 0,22% y el 0,34%. Con las cifras más conservadoras, en 2018, habría 337.107 personas con anti-VHC y 76.839 serían virémicas, de las cuales, un 29,4% desconocería que está infectado3,4.
Desde el año 2015, el tratamiento con agentes antivirales de acción directa permite la curación de la mayoría de los pacientes5–8 por lo que es posible eliminar la enfermedad, para lo cual se han propuesto diversas iniciativas9–14. El diagnóstico en un solo paso (DUSP) consiste en efectuar las determinaciones necesarias para el diagnóstico definitivo de hepatitis C en una misma muestra15–18. El DUSP es la forma más eficiente en el cribado de la hepatitis C, indispensable para prescribir el tratamiento pertinente de forma precoz. Esta estrategia, seguida de una comunicación efectiva de los resultados, permitiría que todos los pacientes diagnosticados accedan precozmente al tratamiento, siendo además coste/efectiva respecto a la práctica clínica habitual19–21 y está recomendada por las principales asociaciones científicas22.
Una encuesta realizada en 2017 en España demostró que, a pesar de que el 80% de los hospitales españoles disponía de recursos para hacer DUSP, solo se efectuaba en el 31%23. Tras esa encuesta, se elaboró un documento de posicionamiento recomendando el DUSP24 avalado por las sociedades científicas SEIMC, AEEH, SEPD y por la Alianza para la Eliminación de las Hepatitis víricas en España (AEHVE), acompañado de actividades formativas y de difusión. En este periodo, también se han empezado a utilizar nuevos test de diagnóstico rápido y/o en gota seca (TDR y/o DBS) que utilizan suero y plasma, sangre capilar, o fluido crevicular, que facilitan la detección sin necesidad de venopunción, centrifugación, o congelación ni personal cualificado25,26. Por estas razones, estas pruebas se consideran apropiadas para el acceso a las poblaciones vulnerables como migrantes, personas sin hogar o en centros de adicciones.
Estos factores podrían haber contribuido a modificar la situación del diagnóstico de la hepatitis C en los últimos 2 años en los hospitales españoles. Por estas razones, se ha realizado este estudio con los objetivos de describir la situación del diagnóstico de la hepatitis C, especialmente en cuanto al DUSP, en España en 2019 y compararla con los resultados del año 2017. Como objetivo secundario, se pretende conocer la situación del acceso a nuevas estrategias de diagnóstico, consideradas imprescindibles para lograr la eliminación del VHC, en los hospitales españoles.
MetodologíaSe trata de un estudio observacional, transversal, con obtención de datos mediante encuesta dirigida a hospitales del Catálogo Nacional de Hospitales27 con los siguientes criterios de inclusión: 1) ser un hospital general (se excluyen los hospitales monográficos psiquiátricos, traumatológicos...); 2) con al menos 200 camas; y 3) que sea público, o, si es privado, que tenga acreditación docente.
Se identificó al responsable del diagnóstico de hepatitis C de cada hospital seleccionado mediante e-mail cuando estaba disponible o mediante llamada telefónica al hospital. A cada responsable se le envió un correo electrónico en el que se le invitaba a participar, se explicaba el proyecto, y se adjuntaba el cuestionario en formato Excel que recoge las variables de interés: servicio que realiza el diagnóstico, pasos en el diagnóstico, proceso de comunicación de resultados, utilización de procedimientos diagnósticos TDR y/o DBS, determinaciones analíticas realizadas en el año 2018, y opinión sobre DUSP, test que debe disponer el hospital y procesos de comunicación. A los hospitales que no respondieron en 2 semanas, se les envió un recordatorio, y a los que no respondieron, se les llamó por teléfono haciendo hasta 3 intentos de contacto telefónico.
En el análisis estadístico, las variables categóricas se describen como proporción (%). Las variables continuas con distribución normal se describen con la media y la desviación estándar (DE), y las que no tienen distribución normal con la mediana y el rango intercuartílico (RIQ). Las asociaciones estudiadas han sido entre variables categóricas, por lo que se utilizó el test de la chi-cuadrado de Pearson o el test exacto de Fisher. Se usó el contraste de hipótesis a 2 colas (α=0,05; β=0,2). Los análisis estadísticos han sido realizados con el paquete estadístico SPSS Versión 20®.
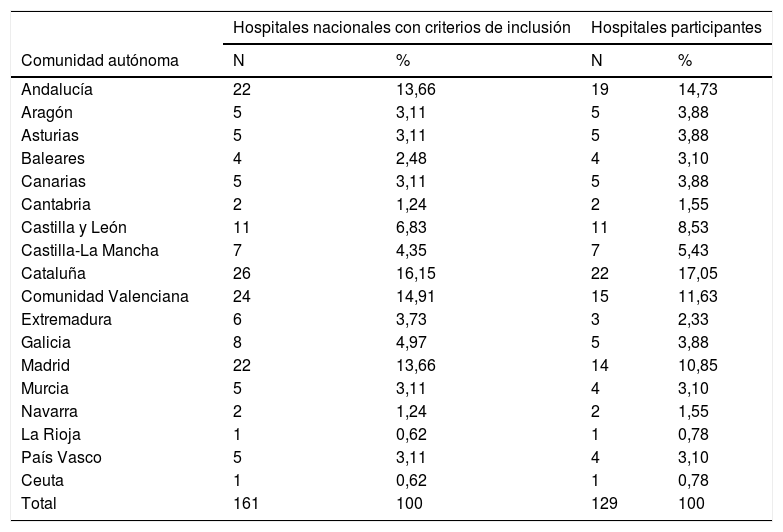
ResultadosHospitales participantesReunían criterios de inclusión 161 hospitales. La encuesta se realizó entre el 11 de septiembre y el 26 de octubre de 2019. Respondieron 129 centros (tasa de respuesta: 80,1%). La lista de hospitales participantes se muestra en el anexo (material adicional). La tabla 1 muestra la distribución por comunidades autónomas (CCAA) de los hospitales participantes. Entre los 129 hospitales participantes, 119 (92,2%) tienen dependencia patrimonial pública, y 127 (98,4%) tienen docencia MIR. Los hospitales tienen entre 200 y 1.500 camas (mediana: 469 camas; RIQ: 300-800 camas).
Distribución de hospitales por comunidades autónomas
| Hospitales nacionales con criterios de inclusión | Hospitales participantes | |||
|---|---|---|---|---|
| Comunidad autónoma | N | % | N | % |
| Andalucía | 22 | 13,66 | 19 | 14,73 |
| Aragón | 5 | 3,11 | 5 | 3,88 |
| Asturias | 5 | 3,11 | 5 | 3,88 |
| Baleares | 4 | 2,48 | 4 | 3,10 |
| Canarias | 5 | 3,11 | 5 | 3,88 |
| Cantabria | 2 | 1,24 | 2 | 1,55 |
| Castilla y León | 11 | 6,83 | 11 | 8,53 |
| Castilla-La Mancha | 7 | 4,35 | 7 | 5,43 |
| Cataluña | 26 | 16,15 | 22 | 17,05 |
| Comunidad Valenciana | 24 | 14,91 | 15 | 11,63 |
| Extremadura | 6 | 3,73 | 3 | 2,33 |
| Galicia | 8 | 4,97 | 5 | 3,88 |
| Madrid | 22 | 13,66 | 14 | 10,85 |
| Murcia | 5 | 3,11 | 4 | 3,10 |
| Navarra | 2 | 1,24 | 2 | 1,55 |
| La Rioja | 1 | 0,62 | 1 | 0,78 |
| País Vasco | 5 | 3,11 | 4 | 3,10 |
| Ceuta | 1 | 0,62 | 1 | 0,78 |
| Total | 161 | 100 | 129 | 100 |
N: número de hospitales.
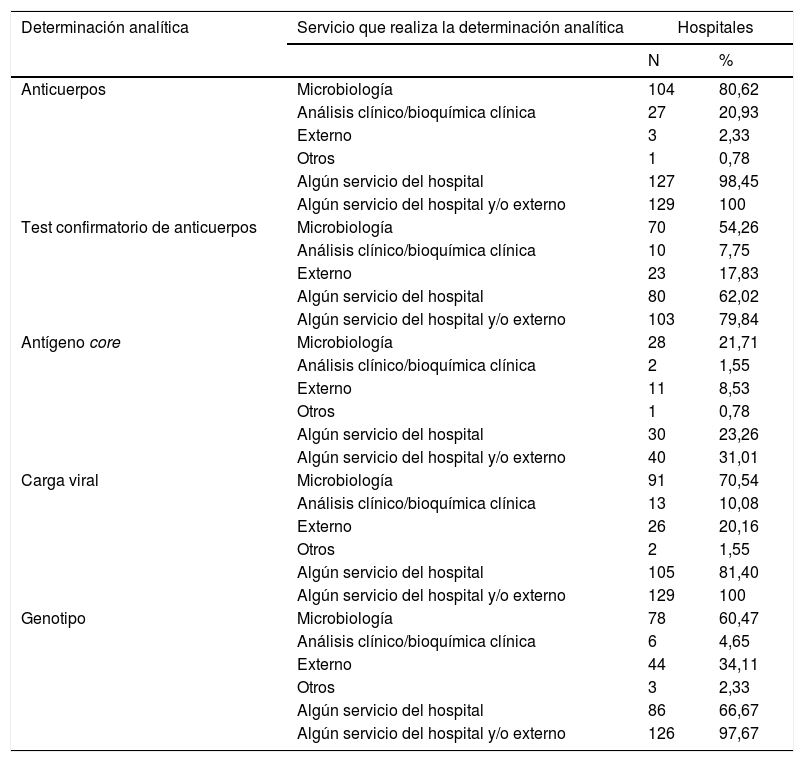
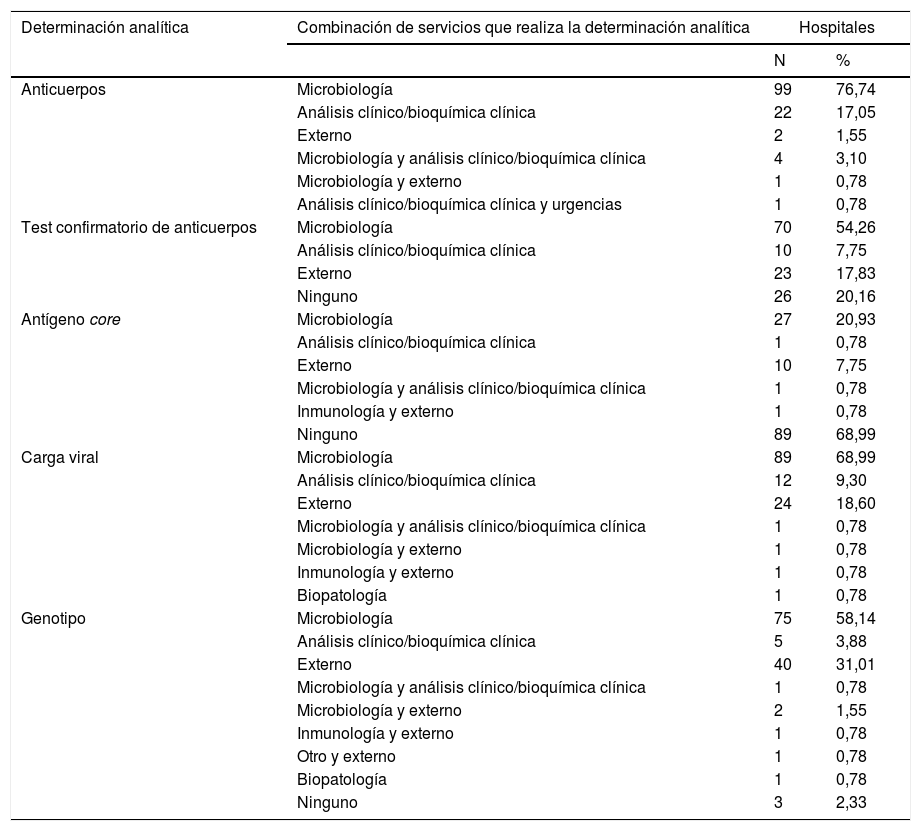
En la tabla 2 se muestran los servicios que realizan determinaciones analíticas en el diagnóstico del VHC, y en la tabla 3 las combinaciones de los servicios que las realizan.
Servicios que realizan las determinaciones analíticas en el diagnóstico del VHC
| Determinación analítica | Servicio que realiza la determinación analítica | Hospitales | |
|---|---|---|---|
| N | % | ||
| Anticuerpos | Microbiología | 104 | 80,62 |
| Análisis clínico/bioquímica clínica | 27 | 20,93 | |
| Externo | 3 | 2,33 | |
| Otros | 1 | 0,78 | |
| Algún servicio del hospital | 127 | 98,45 | |
| Algún servicio del hospital y/o externo | 129 | 100 | |
| Test confirmatorio de anticuerpos | Microbiología | 70 | 54,26 |
| Análisis clínico/bioquímica clínica | 10 | 7,75 | |
| Externo | 23 | 17,83 | |
| Algún servicio del hospital | 80 | 62,02 | |
| Algún servicio del hospital y/o externo | 103 | 79,84 | |
| Antígeno core | Microbiología | 28 | 21,71 |
| Análisis clínico/bioquímica clínica | 2 | 1,55 | |
| Externo | 11 | 8,53 | |
| Otros | 1 | 0,78 | |
| Algún servicio del hospital | 30 | 23,26 | |
| Algún servicio del hospital y/o externo | 40 | 31,01 | |
| Carga viral | Microbiología | 91 | 70,54 |
| Análisis clínico/bioquímica clínica | 13 | 10,08 | |
| Externo | 26 | 20,16 | |
| Otros | 2 | 1,55 | |
| Algún servicio del hospital | 105 | 81,40 | |
| Algún servicio del hospital y/o externo | 129 | 100 | |
| Genotipo | Microbiología | 78 | 60,47 |
| Análisis clínico/bioquímica clínica | 6 | 4,65 | |
| Externo | 44 | 34,11 | |
| Otros | 3 | 2,33 | |
| Algún servicio del hospital | 86 | 66,67 | |
| Algún servicio del hospital y/o externo | 126 | 97,67 | |
N: número de hospitales.
Combinaciones de servicios que realizan las determinaciones analíticas en el diagnóstico del VHC
| Determinación analítica | Combinación de servicios que realiza la determinación analítica | Hospitales | |
|---|---|---|---|
| N | % | ||
| Anticuerpos | Microbiología | 99 | 76,74 |
| Análisis clínico/bioquímica clínica | 22 | 17,05 | |
| Externo | 2 | 1,55 | |
| Microbiología y análisis clínico/bioquímica clínica | 4 | 3,10 | |
| Microbiología y externo | 1 | 0,78 | |
| Análisis clínico/bioquímica clínica y urgencias | 1 | 0,78 | |
| Test confirmatorio de anticuerpos | Microbiología | 70 | 54,26 |
| Análisis clínico/bioquímica clínica | 10 | 7,75 | |
| Externo | 23 | 17,83 | |
| Ninguno | 26 | 20,16 | |
| Antígeno core | Microbiología | 27 | 20,93 |
| Análisis clínico/bioquímica clínica | 1 | 0,78 | |
| Externo | 10 | 7,75 | |
| Microbiología y análisis clínico/bioquímica clínica | 1 | 0,78 | |
| Inmunología y externo | 1 | 0,78 | |
| Ninguno | 89 | 68,99 | |
| Carga viral | Microbiología | 89 | 68,99 |
| Análisis clínico/bioquímica clínica | 12 | 9,30 | |
| Externo | 24 | 18,60 | |
| Microbiología y análisis clínico/bioquímica clínica | 1 | 0,78 | |
| Microbiología y externo | 1 | 0,78 | |
| Inmunología y externo | 1 | 0,78 | |
| Biopatología | 1 | 0,78 | |
| Genotipo | Microbiología | 75 | 58,14 |
| Análisis clínico/bioquímica clínica | 5 | 3,88 | |
| Externo | 40 | 31,01 | |
| Microbiología y análisis clínico/bioquímica clínica | 1 | 0,78 | |
| Microbiología y externo | 2 | 1,55 | |
| Inmunología y externo | 1 | 0,78 | |
| Otro y externo | 1 | 0,78 | |
| Biopatología | 1 | 0,78 | |
| Ninguno | 3 | 2,33 | |
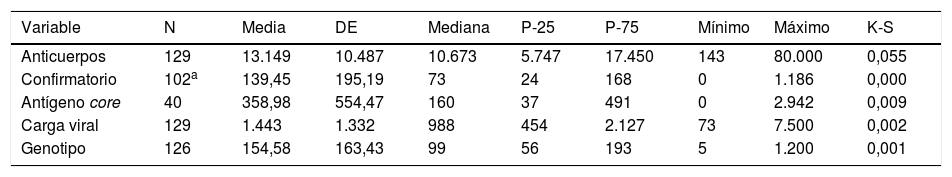
Los 129 hospitales realizan determinación de anticuerpos (Ac) para el VHC en sus propios servicios y/o en servicios externos. Dos (2,2%) centros no disponen de determinación de Ac y lo solicitan a servicios externos. En un centro se realiza en el propio centro y además se pide a un servicio externo. Los 129 centros hicieron una media de 13.149 (DE: 10.487), un mínimo de 143, y un máximo de 80.000 determinaciones de Ac en 2018 (tabla 4).
Determinaciones analíticas realizadas en el año 2018
| Variable | N | Media | DE | Mediana | P-25 | P-75 | Mínimo | Máximo | K-S |
|---|---|---|---|---|---|---|---|---|---|
| Anticuerpos | 129 | 13.149 | 10.487 | 10.673 | 5.747 | 17.450 | 143 | 80.000 | 0,055 |
| Confirmatorio | 102a | 139,45 | 195,19 | 73 | 24 | 168 | 0 | 1.186 | 0,000 |
| Antígeno core | 40 | 358,98 | 554,47 | 160 | 37 | 491 | 0 | 2.942 | 0,009 |
| Carga viral | 129 | 1.443 | 1.332 | 988 | 454 | 2.127 | 73 | 7.500 | 0,002 |
| Genotipo | 126 | 154,58 | 163,43 | 99 | 56 | 193 | 5 | 1.200 | 0,001 |
DE: desviación estándar; K-S: test de Kolmogórov-Smirnov; N: número de hospitales que dieron cifras de determinaciones; P-25: percentil 25; P-75: percentil 75.
El test confirmatorio de Ac lo realizan 103 (79,8%) centros en sus propios servicios y/o en servicios externos. Lo lleva a cabo algún servicio del hospital en 80 (62,0%) centros, y 23 (17,8%) hospitales lo solicitan a servicios externos. El número anual de determinaciones de diagnóstico confirmatorio osciló entre 0 y 1.186 (mediana: 73,0; RIQ: 24-168) (tabla 4).
Cuarenta hospitales (31%) realizan determinación del antígeno core (Ag) en sus propios servicios y/o en servicios externos. Hay 99 (76,7%) hospitales que no disponen de determinación de Ag, pero 10 (7,8%) de ellos lo solicitan a servicios externos. En un centro se realiza en el propio centro y además lo piden a un servicio externo. El número anual de determinaciones de Ag osciló entre 0 y 2.942 (mediana: 160; RIQ: 37-491) (tabla 4).
La determinación de carga viral (CV) la realizan los 129 (100,0%) hospitales en sus propios servicios y/o en servicios externos. Hay 24 (18,6%) hospitales que no disponen en su centro de determinación de CV, pero todos ellos lo solicitan a servicios externos. Dos centros que disponen de determinación de CV en su propio centro, además lo piden a servicios externos. El médico de atención primaria puede solicitar la determinación de CV en 71 (55%) hospitales. El número anual de determinaciones de CV osciló entre 73 y 7.500 (mediana: 988; RIQ: 454-2.127) (tabla 4).
La determinación del genotipo (GT) la realizan 126 (97,7%) centros en sus propios servicios y/o en servicios externos. Hay 43 (33,3%) hospitales que no disponen de determinación del GT, de los que 40 (31,0%) lo solicitan a servicios externos. Cuatro centros que disponen de determinación de GT en su propio centro, además lo piden a servicios externos. El médico de atención primaria puede solicitar la determinación del GT en 53 (41,1%) hospitales. El número anual de determinaciones del GT osciló entre 5 y 1.200 (mediana: 99; RIQ: 56-193) (tabla 4).
Perfiles diagnósticos según los medios disponiblesA partir de los test diagnósticos disponibles en los propios servicios de los hospitales, se identificaron 8 perfiles diagnósticos, según el hospital disponga de determinación de: 1) solo Ac (19 hospitales; 14,7%); 2) Ac y CV (15 hospitales; 11,6%; 3) Ac y Ag (2 hospitales; 1,6%); 4) Ac, CV y GT (62 hospitales; 48,1%); 5) Ac, Ag y CV (5 hospitales; 3,9%); 6) Ac, Ag, CV y GT (23 hospitales; 17,8%); 7) Ac y GT (un hospital; 0,8%), y 8) ninguna (2 hospitales; 1,6%) (tabla 5).
Perfiles de medios diagnósticos disponibles
| Perfil de medios diagnóstico disponibles en el hospital | N | % |
|---|---|---|
| Solo Ac | 19 | 14,73 |
| Ac y CV | 15 | 11,63 |
| Ac y Ag | 2 | 1,55 |
| Ac, CV y genotipo | 62 | 48,06 |
| Ac, Ag y CV | 5 | 3,88 |
| Ac, Ag, CV y genotipo | 23 | 17,83 |
| Ac y genotipo | 1 | 0,78 |
| Ninguno | 2 | 1,55 |
| Total | 129 | 100 |
| Perfil de medios diagnósticos totales (disponibles en el hospital y externos) | N | % |
|---|---|---|
| Ac y CV | 2 | 1,55 |
| Ac, CV y genotipo | 87 | 67,44 |
| Ac, Ag y CV | 1 | 0,78 |
| Ac, Ag, CV y genotipo | 39 | 30,23 |
| Total | 129 | 100 |
Ac: anticuerpos; Ag: antígeno core; CV: carga viral; N: número de hospitales.
Considerando los test diagnósticos que el hospital puede realizar en sus propios servicios y en servicios externos, se identificaron 4 perfiles diagnósticos: 1) Ac y CV; 2) Ac, CV y GT; 3) Ac, Ag y CV; y 4) Ac, Ag, CV y GT. El número de hospitales de cada perfil fue respectivamente: 2 (1,6%), 87 (67,5%), 1 (0,8%) y 39 (30,2%) (tabla 5).
Para que un hospital pueda realizar DUSP debe disponer de determinación de Ac y CV o de Ac y Ag. En consecuencia, todos los hospitales pueden realizar DUSP con medios propios y/o externos, y 107 (82,9%) hospitales pueden llevarlo a cabo en sus propios servicios (tabla 5).
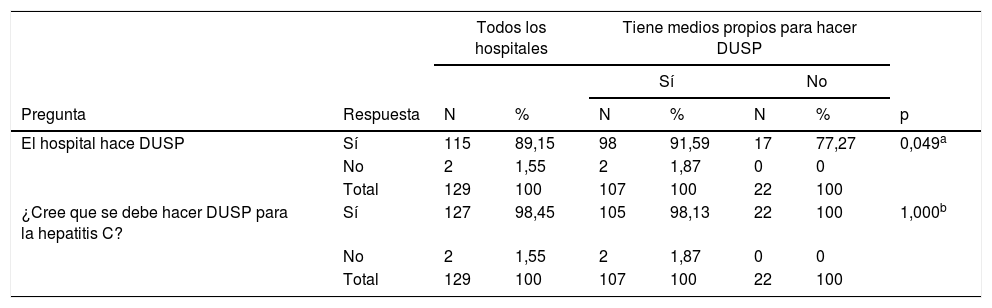
Diagnóstico en un solo pasoEl DUSP se puede realizar por servicios propios o externos en todos los centros. Sin embargo, ante un resultado de Ac positivo para VHC, el DUSP se realiza en 115 (89,1%) hospitales. De los 107 (82,9%) centros que pueden realizar el DUSP en sus propios servicios, lo realizan 98 (91,6%), mientras que de los 22 hospitales que lo tienen que llevar a cabo en un servicio externo, lo hacen 17 (77,3%) (p=0,049) (tabla 6).
Asociación entre opiniones del encuestado y disponibilidad de medios diagnósticos en el propio hospital
| Todos los hospitales | Tiene medios propios para hacer DUSP | |||||||
|---|---|---|---|---|---|---|---|---|
| Sí | No | |||||||
| Pregunta | Respuesta | N | % | N | % | N | % | p |
| El hospital hace DUSP | Sí | 115 | 89,15 | 98 | 91,59 | 17 | 77,27 | 0,049a |
| No | 2 | 1,55 | 2 | 1,87 | 0 | 0 | ||
| Total | 129 | 100 | 107 | 100 | 22 | 100 | ||
| ¿Cree que se debe hacer DUSP para la hepatitis C? | Sí | 127 | 98,45 | 105 | 98,13 | 22 | 100 | 1,000b |
| No | 2 | 1,55 | 2 | 1,87 | 0 | 0 | ||
| Total | 129 | 100 | 107 | 100 | 22 | 100 | ||
| Todos los hospitales | El hospital hace DUSP | |||||||
|---|---|---|---|---|---|---|---|---|
| Sí | No | |||||||
| Pregunta | Respuesta | N | % | N | % | N | % | p |
| ¿Cree que se debe hacer DUSP para la hepatitis C? | Sí | 127 | 98,45 | 115 | 100 | 12 | 85,71 | 0,011b |
| No | 2 | 1,55 | 0 | 0 | 2 | 14,29 | ||
| Total | 129 | 100 | 115 | 100 | 14 | 100 | ||
| Todos los hospitales | Puede hacer determinación de AC en gota seca | |||||||
|---|---|---|---|---|---|---|---|---|
| Sí | No | |||||||
| Pregunta | Respuesta | N | % | N | % | N | % | p |
| ¿Cree que en su hospital se debe disponer del test de Ac en gota seca? | Sí | 36 | 27,91 | 11 | 78,57 | 25 | 21,74 | <0.001a |
| No | 93 | 72,09 | 3 | 21,43 | 90 | 78,26 | ||
| Total | 129 | 100 | 14 | 100 | 115 | 100 | ||
| Todos los hospitales | Puede hacer determinación de CV en gota seca | |||||||
|---|---|---|---|---|---|---|---|---|
| Sí | No | |||||||
| Pregunta | Respuesta | N | % | N | % | N | % | p |
| ¿Cree que en su hospital se debe disponer del test de CV en gota seca? | Sí | 45 | 34,88 | 18 | 90 | 27 | 24,77 | <0.001a |
| No | 84 | 65,12 | 2 | 10 | 82 | 75,23 | ||
| Total | 129 | 100 | 20 | 100 | 109 | 100 | ||
| Todos los hospitales | Puede hacer determinación rápida de AC en saliva | |||||||
|---|---|---|---|---|---|---|---|---|
| Sí | No | |||||||
| Pregunta | Respuesta | N | % | N | % | N | % | p |
| ¿Cree que su hospital debe disponer del test rápido de Ac en saliva? | Sí | 22 | 17,05 | 0 | 0 | 22 | 17,19 | 1,000b |
| No | 107 | 82,95 | 1 | 100 | 106 | 82,81 | ||
| Total | 129 | 100 | 1 | 100 | 128 | 100 | ||
| Todos los hospitales | Puede hacer determinación rápida de CV con sistema point of care | |||||||
|---|---|---|---|---|---|---|---|---|
| Sí | No | |||||||
| Pregunta | Respuesta | N | % | N | % | N | % | p |
| ¿Cree que en su hospital se debe tener algún sistema point of care (tipo GeneXpert) para detección rápida de CV? | Sí | 92 | 71,32 | 46 | 95,83 | 46 | 56,79 | <0.001a |
| No | 37 | 28,68 | 2 | 4,17 | 35 | 43,21 | ||
| Total | 129 | 100 | 48 | 100 | 81 | 100 | ||
| Todos los hospitales | El hospital utiliza alguna estrategia de comunicación | |||||||
|---|---|---|---|---|---|---|---|---|
| Sí | No | |||||||
| Pregunta | Respuesta | N | % | N | % | N | % | p |
| ¿Cree que debe existir algún tipo de alerta ante el diagnóstico de una infección activa por el VHC? | Sí | 116 | 89,92 | 107 | 96,40 | 9 | 50 | <0.001 |
| No | 13 | 10,08 | 4 | 3,60 | 9 | 50 | ||
| Total | 129 | 100 | 111 | 100 | 18 | 100 | ||
N: número de hospitales.
Test estadístico utilizado: aChi-cuadrado; bTest exacto de Fisher.
De los 115 hospitales que realizan DUSP, 46 (40%) determinan CV+GT; 44 (38,3%) solo CV; 8 (7%) Ag+CV+GT; 7 (6,1%) determinan solo Ag; 6 (5,2%) Ag+CV; y 4 (3,5%) Ag+GT.
A la pregunta sobre si cree que debe realizarse DUSP, 127 (98,4%) hospitales respondieron afirmativamente: los 115 (100%) que hacen DUSP, y 12 (85,7%) de los 14 hospitales que no hacen DUSP (p=0,011). A la misma pregunta respondieron afirmativamente 105 (98,1%) de los 107 centros que tienen medios propios para hacer DUSP y los 22 (100%) centros que no tienen medios propios para hacer DUSP (tabla 6).
Diagnóstico en más de un paso: retraso diagnósticoDe los 14 hospitales que ante un resultado de Ac positivo no realizan DUSP, 13 han ofrecido información sobre lo que hacen. En 7 (53,8%) se recomienda una segunda muestra, y en 6 (46,2%) no se hace nada, simplemente se espera una segunda petición. El tiempo de retraso desde la positividad del Ac hasta la determinación de la CV tiene una media de 3,65 (DE: 3,34) semanas, un mínimo de una semana, y un máximo de 12 semanas.
Test de diagnóstico rápido y/o en gota secaEn 14 (10,9%) hospitales se puede hacer determinación de Ac en gota seca, en 20 (15,5%) de CV en gota seca, en uno (0,8%) de Ac en saliva, y en 48 (37,2%) centros se dispone de test point of care (pruebas en el sitio de atención al paciente) para la determinación rápida de CV. En conjunto, 48 (43,4%) hospitales disponen al menos de un método diagnóstico con TDR y/o DBS, y 18 (14%) centros disponen de más de un método para la infección por el VHC.
A la pregunta «¿Cree que en su hospital se debe disponer del test de Ac en gota seca?», 36 (27,9%) hospitales respondieron afirmativamente, pero esta proporción fue mayor (78,6%) en los 14 hospitales que pueden hacer determinación de Ac en gota seca que en los 115 que no pueden hacerla (21,7%) (P<0.001) (tabla 6).
A la pregunta «¿Cree que en su hospital se debe disponer del test de CV en gota seca?», 45 (34,9%) hospitales respondieron afirmativamente, pero esta proporción fue mayor (90%) en los 20 hospitales que pueden hacer determinación de CV en gota seca que en los 109 que no pueden hacerla (24,8%) (p=0,000) (tabla 6).
A la pregunta «¿Cree que en su hospital se debe disponer del test rápido de Ac en saliva?», 22 (17,1%) hospitales respondieron afirmativamente. El único hospital que dispone de esta técnica respondió negativamente, como lo hicieron 106 (82,8%) de los 128 hospitales que no pueden hacerlo (24,8%) (p=1,000) (tabla 6).
A la pregunta «¿Cree que en su hospital se debe tener algún sistema point of care (tipo GeneXpert) para detección rápida de CV?», 92 (71,3%) hospitales respondieron afirmativamente, pero esta proporción fue mayor (95,8%) en los 48 hospitales que disponen de algún sistema point of care que en los 81 que no pueden hacerla (56,8%) (p=0,000) (tabla 6).
Estrategias de comunicación de resultadosCuando hay una infección activa por VHC, en 111 (86,0%) hospitales se utiliza alguna estrategia de comunicación (57 usan más de una), mientras que en 18 (14,0%) no se emplea ninguna. Las estrategias de comunicación utilizadas son: alerta en el informe en 69 (53,5%) hospitales, contacto directo con el médico solicitante en 51 (38,5%), contacto con el médico responsable del tratamiento en 44 (34,1%), y otra estrategia en 19 (14,7%). Entre estas otras estrategias, se citaron: registro en la historia electrónica, comunicación al servicio de aparato digestivo, comunicación al centro de salud, comunicación al preventivista, notificaciones mensuales al servicio de digestivo, o cita directa al servicio de digestivo sin pasar por atención primaria.
A la pregunta «¿Cree que debe existir algún tipo de alerta ante el diagnóstico de una infección activa por el VHC?», 116 (89,9%) hospitales respondieron afirmativamente, pero esta proporción fue mayor (96,4%) en los 111 hospitales que utilizan alguna estrategia de comunicación que en los 18 que no utilizan ninguna (50,0%) (p=0,000) (tabla 6).
Comparaciones con la encuesta de 2017La tasa de respuesta fue superior en la encuesta de 2019 que en la de 2017. De los 161 hospitales con criterios de inclusión, en 2019, respondieron 129 (tasa de respuesta 80,1%) vs. 90 de 160 en 2017 (56,3%) (p=0,000). Asimismo, en 2019 se ha verificado una mayor adherencia al DUSP que en 2017: el DUSP se realiza en 115 de 129 (89,1%) de los centros que respondieron en 2019 vs. 28 de 90 (31,1%) en 2017 (p<0,001). De los 79 centros que participaron en ambas encuestas, en 2017 realizaban DUSP 22 (27,8%) mientras que en 2019 lo hacen 70 (88,6%) (p=0,000). De los 57 centros que no realizaban DUSP en 2017, 48 (84,21%) lo hacen en 2019. Además, ha aumentado el número de respondedores que creen que se debe realizar el DUSP desde el 43,3% (39/90) en 2017 al 98,4% (127/129) en 2019 (p=0,000). Finalmente, también se ha verificado un aumento en el número de centros que utilizaba algún sistema de alerta para mejorar la continuidad asistencial, que aumentó del 68,9% en 2017 al 86,0% en 2019 (p=0,002), aunque ya en 2017, el 88,9% de los respondedores creían que debe existir algún tipo de alerta ante el diagnóstico de una infección activa por el VHC, proporción que en 2019 es del 89,9%.
DiscusiónEn el estudio realizado en 2017, solo el 31% realizaba DUSP23, habiendo aumentado al 89% en 2019. Más interesante es el hallazgo de que de los 79 centros que participaron en ambas encuestas realizaban DUSP el 28% en 2017, y el 89% en 2019, y que de los 57 centros que no realizaban DUSP en 2017, 48 (84%) lo realizan en 2019. También, en la encuesta de 2017, el 43% de los hospitales encuestados opinaban que se debe realizar el DUSP, mientras que esa proporción es del 98% en 2019.
Esta mejora en la realización del DUSP puede deberse a numerosos factores. Quizá el factor más determinante es que tras la encuesta de 2017 se elaboró un documento de posicionamiento recomendando el DUSP avalado por diversas sociedades científicas españolas (SEIMC, AEEH, SEPD) y por la AEHVE24, y lo acompañaron de actividades formativas y de difusión. Además, en estos años, la hepatitis C ha sido objeto de numerosas publicaciones, ha dado lugar a recomendaciones de sociedades científicas sobre detección precoz, diagnóstico y tratamiento, diversos organismos nacionales e internacionales también han elaborado recomendaciones que incluyen su eliminación9,10,12,25,26, y finalmente, incluso la sociedad también expresa su percepción sobre el problema de la hepatitis C y la esperanza de curación con los tratamientos actuales28.
Además de la mejora en el DUSP, el presente estudio muestra diferencias interesantes con respecto al estudio realizado en 2017. En primer lugar, la tasa de respuesta ha sido más alta: 80,1% en 2019 vs. 56,3% en 2017. Este aumento en parte puede ser debido a que la encuesta de 2019 incluyó llamadas telefónicas a los no respondedores, pero también al aumento del interés de los profesionales sanitarios por la gran presencia de la hepatitis C en el ámbito científico y social comentado más arriba.
El grado de utilización del test confirmatorio de Ac es similar al del 2017. Actualmente lo realiza el 80% de los centros, mientras que en 2017 lo hacía el 75%. Ante este resultado, se debe tener en cuenta que, dado que la sensibilidad y especificidad de la serología son cercanas al 100%25,29 realizar pruebas confirmatorias de Ac no aporta mejoras en el diagnóstico y sustrae tiempo y recursos para implantar el DUSP. Hay evidencia suficiente para respaldar que el uso de métodos adicionales para la confirmación de los Ac anti-VHC debe abandonarse en la práctica clínica en la red española de laboratorios de diagnóstico, ya que supone una barrera para el manejo clínico apropiado, la continuidad asistencial, y obstaculiza la eliminación del VHC en España30.
La determinación del GT en servicios propios o externos la realizan el 98% de los centros. El genotipificado no es imprescindible para iniciar tratamiento con regímenes pangenotípicos y nunca debe suponer una barrera para el tratamiento, pero creemos que en los centros en que se pueda disponer de GT en un tiempo de respuesta razonable no supone ningún inconveniente obtener este dato.
Afortunadamente, nuestro estudio demuestra que, con respecto a 2017, los retrasos diagnósticos innecesarios han disminuido. Se ha descrito que existe retraso diagnóstico en la infección por el VHC y, consecuentemente, en el tratamiento31–34 especialmente en poblaciones vulnerables35,36 debido a la discontinuidad asistencial entre la detección de Ac y la confirmación de la infección activa mediante CV37. De nuestro estudio se infiere que por haber aumentado la proporción de hospitales que hacen DUSP del 31% al 89% entre 2017 y 2019, los retrasos diagnósticos innecesarios han disminuido en una alta proporción de hospitales. Sin embargo, sería deseable que todos los hospitales hiciesen el DUSP, porque todos tienen medios propios o externos para realizarlo. La implantación del DUSP mejoraría la eficiencia19,20 y evitaría duplicidades como externalizar pruebas pudiendo realizarlas el propio hospital. No hacer DUSP supone un retraso diagnóstico, que en los hospitales que en 2019 no hacen DUSP puede oscilar entre 1 y 12 semanas. Además, en el 46% de los hospitales que hoy no realizan DUSP no se hace nada, simplemente se espera a recibir una segunda petición.
La estrategia de comunicación de resultados también es altamente variable. Cuando hay una infección activa por VHC, un 14% de los hospitales no utilizan ninguna estrategia de comunicación, proporción que era del 31% en 2017. Aun así, persiste una enorme variabilidad de estrategias de comunicación, entre las que las más frecuentes son alerta en el informe, contacto directo con el médico solicitante, y contacto con el médico responsable del tratamiento. Probablemente esta variabilidad se explique por las diferentes características de los hospitales, pero si esto supusiese un retraso en el diagnóstico, deberían desarrollarse estrategias de comunicación efectivas que contribuyan a disminuir el tiempo entre el resultado diagnóstico y el inicio del tratamiento. Como en la encuesta de 2017, el 90% de los respondedores cree que debe existir algún tipo de alerta ante el diagnóstico de una infección activa por el VHC.
Aunque fue un objetivo secundario, este trabajo pone de manifiesto un aspecto importante para lograr la eliminación del VHC: el uso de TDR y/o DBS es marginal en los hospitales encuestados. Y, quizás lo que es más importante, los profesionales encuestados creen que disponer de este tipo de tecnología no es necesario para el diagnóstico de esta infección (solo el 28% de los encuestados opina que su hospital debe disponer del test de Ac en gota seca, y el 35% del test de CV en gota seca). Uno de los pilares de la eliminación de la hepatitis C es un diagnóstico adecuado de la infección en poblaciones vulnerables, y para lograr este diagnóstico es imprescindible el uso de dispositivos de point-of-care, siendo el DBS uno de los más usados y eficientes. Este trabajo demuestra la importante labor de formación y concienciación todavía necesarias en amplios colectivos médicos, para que consideren estos nuevos modelos de diagnóstico (TDR y/o DBS) como herramientas clave en la eliminación de la hepatitis C. La obtención del marcado CE de una de las determinaciones de viremia, que certifica la calidad y seguridad de la PCR en gota seca, puede ser clave en este sentido.
Una limitación del estudio realizado en 2017 podría ser la baja tasa de respuesta23, pero esta limitación no afecta al presente estudio, dada la alta tasa de respuesta. En el estudio actual, como la tasa de respuesta ha sido diferente entre CCAA, podría ocurrir que algunas CCAA estén sobre- o subrepresentadas. Sin embargo, las diferencias en la tasa de respuesta son pequeñas, y no es esperable que las políticas de salud de las CCAA influyan lo suficiente como para pensar que los hallazgos del presente estudio tengan sesgos relevantes en su interpretación a nivel nacional.
En resumen, podemos concluir que la proporción de hospitales que hacen DUSP ha aumentado de forma relevante desde 2017, llegando a ser del 89% en 2019. Las medidas recomendadas por SEIMC, AEEH, SEPD, y AEHVE, acompañadas de actividades formativas y de difusión, podrían haber contribuido al incremento de la implantación del DUSP. Sin embargo, los nuevos modelos asistenciales de diagnóstico (TDR y/o DBS), herramientas clave para la eliminación de la hepatitis C en España, están disponibles en menos de la mitad de los hospitales, por lo que se necesitan medidas encaminadas a mejorar su implementación.
FinanciaciónEl presente trabajo ha sido financiado por la Fundación Española del Aparato Digestivo.
Conflicto de interesesJavier Crespo: Grants, Advisory y Speakerbureaus de Abbvie, Gilead, MSD y Janssen.
Antonio Aguilera: Grants y Speaker bureaus de Gilead.
Javier García-Samaniego: Lectures y Consultant: Abbvie, BMS, Gilead, Janssen, y MSD. Grants: BMS, Gilead.
José María Eiros ha realizado trabajos de asesoría para las compañías Abbvie y Gilead
José Luis Calleja: Consultor y speaker: Gilead, Abbvie, MSD.
Federico García: Grants,Advisory y Speaker bureaus de Roche, Hologic, Werfen, ViiV, Abbvie, Janssen, MSD, y Gilead.
Antonio Javier Blasco y Pablo Lázaro han recibido financiación de la Fundación Española del Aparato Digestivo para el desarrollo metodológico del proyecto y redacción del manuscrito.
Agradecemos a los hospitales e investigadores colaboradores de cada centro que han respondido a la encuesta (ver anexo) su participación aportando los datos con los que ha sido posible realizar el presente estudio.