Las micobacterias son un amplio grupo de microorganismos en el que múltiples especies son causa de una importante morbimortalidad, como la tuberculosis y la lepra. La aparición y diseminación de cepas del complejo Mycobacterium tuberculosis resistentes a diversos fármacos constituye en la actualidad uno de los problemas sanitarios de mayor gravedad a nivel mundial. Por otro lado, las micobacterias diferentes de M. tuberculosis y Mycobacterium leprae, denominadas micobacterias no tuberculosas (MNT), son aislamientos cada vez más frecuentes, requiriendo en muchos casos un tratamiento que precisa una orientación sobre la sensibilidad de estos microorganismos a los antimicrobianos. En el presente artículo se revisan los métodos para determinar la sensibilidad in vitro a los antimicobacterianos de los aislamientos del complejo M. tuberculosis y las MNT más relevantes. Además, también se realiza un análisis de las técnicas moleculares de detección rápida de la resistencia a partir de las muestras clínicas.
Mycobacteria are a large group of microorganisms, multiple species of which are major causes of morbidity and mortality, such as tuberculosis and leprosy. At present, the emergence and spread of multidrug-resistant strains of Mycobacterium tuberculosis complex are one of the most serious health problems worldwide. Furthermore, in contrast to M. tuberculosis and Mycobacterium leprae, non-tuberculous mycobacteria (NTM) are more frequently isolated and, in many cases, treatment is based on drug susceptibility testing. This article is a review of the different methods to determine the in vitro drug susceptibility of M. tuberculosis complex and the most relevant NTM isolates. The molecular techniques currently used for rapid detection of resistance of clinical specimens are also analysed.
Actualmente se han descrito más de 170 especies de micobacterias, y muchas de ellas son una causa importante de morbimortalidad en el ser humano. Entre ellas destaca la tuberculosis (TB) causada por el complejo Mycobacterium tuberculosis1, Según la OMS, cerca de 9,6 millones de personas enfermaron de TB en 2014 y 1,5 millones murieron por ella, siendo la primera causa de muerte por un agente infeccioso1. Además, en los últimos años han aparecido y se están diseminando cepas resistentes a múltiples fármacos. Así se estima que 480.000 personas desarrollaron una TB multirresistente (MDR-TB; resistencia al menos a la isoniazida y a la rifampicina) a nivel mundial en 2014, de los que el 9% tendrían una resistencia extendida (XDR-TB) al menos a uno de los fármacos inyectables de segunda línea (capreomicina, kanamicina o amikacina) y una fluoroquinolona. Por todo ello, la detección rápida de la resistencia a los antituberculosos es fundamental para lograr un tratamiento adecuado y prevenir la aparición y diseminación de la MDR-TB. Por otro lado, las micobacterias no tuberculosas (MNT) o ambientales han ido tomando un mayor protagonismo, siendo muchas de ellas patógenas (micobacteriosis) y requiriendo un tratamiento específico que, en muchos casos, deberá ser orientado por las pruebas de sensibilidad in vitro a los antimicrobianos2-4.
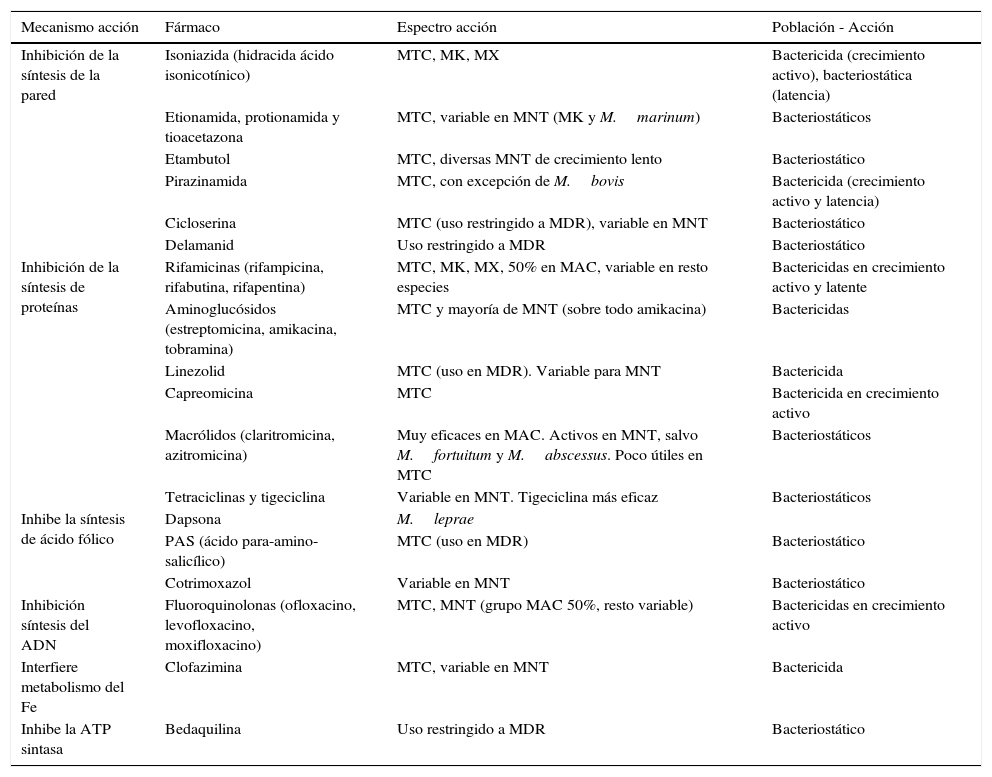
AntimicrobianosAunque el arsenal terapéutico para las infecciones micobacterianas es muy limitado, en la actualidad se dispone de algunos fármacos nuevos, si bien no todos tienen la misma actividad ni se utilizan para tratar el mismo tipo de infecciones o las diferentes especies (tabla 1)5.
Mecanismo y espectro de acción de los antimicobacterianos
| Mecanismo acción | Fármaco | Espectro acción | Población - Acción |
|---|---|---|---|
| Inhibición de la síntesis de la pared | Isoniazida (hidracida ácido isonicotínico) | MTC, MK, MX | Bactericida (crecimiento activo), bacteriostática (latencia) |
| Etionamida, protionamida y tioacetazona | MTC, variable en MNT (MK y M.marinum) | Bacteriostáticos | |
| Etambutol | MTC, diversas MNT de crecimiento lento | Bacteriostático | |
| Pirazinamida | MTC, con excepción de M.bovis | Bactericida (crecimiento activo y latencia) | |
| Cicloserina | MTC (uso restringido a MDR), variable en MNT | Bacteriostático | |
| Delamanid | Uso restringido a MDR | Bacteriostático | |
| Inhibición de la síntesis de proteínas | Rifamicinas (rifampicina, rifabutina, rifapentina) | MTC, MK, MX, 50% en MAC, variable en resto especies | Bactericidas en crecimiento activo y latente |
| Aminoglucósidos (estreptomicina, amikacina, tobramina) | MTC y mayoría de MNT (sobre todo amikacina) | Bactericidas | |
| Linezolid | MTC (uso en MDR). Variable para MNT | Bactericida | |
| Capreomicina | MTC | Bactericida en crecimiento activo | |
| Macrólidos (claritromicina, azitromicina) | Muy eficaces en MAC. Activos en MNT, salvo M.fortuitum y M.abscessus. Poco útiles en MTC | Bacteriostáticos | |
| Tetraciclinas y tigeciclina | Variable en MNT. Tigeciclina más eficaz | Bacteriostáticos | |
| Inhibe la síntesis de ácido fólico | Dapsona | M.leprae | |
| PAS (ácido para-amino-salicílico) | MTC (uso en MDR) | Bacteriostático | |
| Cotrimoxazol | Variable en MNT | Bacteriostático | |
| Inhibición síntesis del ADN | Fluoroquinolonas (ofloxacino, levofloxacino, moxifloxacino) | MTC, MNT (grupo MAC 50%, resto variable) | Bactericidas en crecimiento activo |
| Interfiere metabolismo del Fe | Clofazimina | MTC, variable en MNT | Bactericida |
| Inhibe la ATP sintasa | Bedaquilina | Uso restringido a MDR | Bacteriostático |
MAC: M.avium complex; MDR: tuberculosis multirresistente; MK: M.kansasii; MNT: micobacterias no tuberculosas; MTC: M.tuberculosis complex; MX: M.xenopi.
Los fármacos denominados de primera línea incluyen a los administrados como primera elección y son la isoniazida (H), la rifampicina (R), el etambutol (E), la pirazinamida (Z) y, por razones históricas, también la estreptomicina (S)5-7. Los 4 primeros son los recomendados por la OMS en una pauta de 6 meses (2HREZ+4HR). Ante casos de resistencia, alergia, intolerancia, toxicidad hepática o interacción frente a uno o más de estos fármacos, debe recurrirse a los de segunda línea, que incluyen las rifamicinas (rifabutina, rifapentina), las quinolonas (ofloxacino, levofloxacino, moxifloxacino), los aminoglucósidos (amikacina, tobramicina), la capreomicina, la cicloserina, el linezolid, los análogos de la isoniazida (etionamida, protionamida), la clofazimina, PAS o tioacetazona5-7. En casos de MDR-TB o XDR-TB puede, además, recurrirse a fármacos de aparición reciente, como la bedaquilina y/o el delamanid8.
Fármacos utilizados frente a las micobacterias no tuberculosasEl tratamiento de las MNT, con la excepción de la lepra, está menos estandarizado que el de la TB, con amplias variaciones entre especies2,9. Para la mayoría de las especies de crecimiento lento la base del tratamiento son la claritromicina, el etambutol y la amikacina, complementadas con otros fármacos como quinolonas, rifamicinas, linezolid y probablemente, con menor grado de eficacia, cefalosporinas, carbapenems y tetraciclinas. Las infecciones por Mycobacterium kansasii y Mycobacterium xenopi se tratan de forma similar a la TB, salvo la pirazinamida, ya que no tiene actividad frente a las MNT2,9. Las especies de crecimiento rápido son resistentes a los fármacos antituberculosos clásicos y tienen también a la claritromicina como base del tratamiento, con excepción de Mycobacterium fortuitum, que es resistente, así como el 80-85% de los aislamientos de Mycobacterium abscessus2,9.
Pruebas de sensibilidad a los fármacos en Mycobacterium tuberculosis complexLa historia de las pruebas de sensibilidad frente al complejo M.tuberculosis surge paralela al desarrollo del tratamiento farmacológico específico de la TB, que se inicia con el descubrimiento de la estreptomicina en 1944. Desde un primer momento ya se observó que la monoterapia lograba una mejoría clínica inicial seguida de una recaída de la enfermedad. Este fenómeno, conocido como fall and rise, se debía a la selección de bacterias resistentes. La OMS, en el año 2000, definió las resistencias en varias categorías desde un punto de vista epidemiológico: a)Resistencia en casos nuevos: cepas aisladas en pacientes que nunca han recibido tratamiento antituberculoso durante más de un mes. b)Resistencia en casos tratados: cepas aisladas en pacientes que previamente han recibido tratamiento antituberculoso durante más de un mes. c)Multirresistencia (MDR-TB): resistencia conjunta al menos a la isoniazida y a la rifampicina. d)Polirresistencia: resistencia a más de un fármaco sin que estén incluidos isoniazida y rifampicina a la vez. e)Resistencia combinada: suma de todas las resistencias en un área concreta. Indica la carga de cepas resistentes en una comunidad. En 2006 se añadió la categoría Resistencia extendida (XDR-TB), que se ha comentado en la introducción.
La confirmación definitiva de la resistencia del complejo M.tuberculosis a los fármacos debe realizarse siempre con métodos microbiológicos. En los estudios de los años sesenta de Canetti, Rist y Grosset10 se estableció la frecuencia de mutaciones espontáneas asociadas a cada fármaco. En el caso de la isoniazida, del etambutol y de la estreptomicina aparecía una mutante resistente entre 10−5 y 10−7 bacterias, a la rifampicina una entre 10−7 y 10−9 y a la pirazinamida una entre 10−2 y 10−4. La frecuencia teórica de mutantes resistentes para más de un fármaco sería la suma exponencial de las individuales de cada fármaco. Del mismo modo, también se estimaron las poblaciones bacterianas presentes en las lesiones. Así, los infiltrados de poca extensión tendrían poblaciones de 103-105 bacterias, y las cavidades llegarían a las 107-109 bacterias, lo que hace muy improbable que se generen de manera espontánea mutaciones simultáneas a más de un fármaco. En TB se habla de resistencia cuando el 1% o más de la población bacteriana es resistente a un determinado fármaco10.
Las concentraciones críticas de los diferentes fármacos fueron establecidas por consenso internacional y representan las concentraciones más bajas que inhiben el crecimiento de las «cepas salvajes» (sensibles) del complejo M.tuberculosis que nunca han estado expuestas a los mismos, mientras que no inhiben a las cepas procedentes de pacientes que no responden al tratamiento, consideradas resistentes. Inicialmente fueron postuladas para el medio de Löwenstein-Jensen, y después se establecieron equivalencias para los medios de agar 7H10 y 7H11 de Middlebrook, así como para los sistemas automatizados de cultivo en medio líquido.
Las pruebas de sensibilidad in vitro en M.tuberculosis complex deberían realizarse al primer aislamiento que se obtenga de un nuevo paciente, en casos de sospecha de fracaso terapéutico y ante recidivas de la enfermedad7,11-13. Además, cuando la TB afecte simultáneamente a más de un órgano, los estudios deberían individualizarse para cada localización, sin presuponer que el resultado vaya a ser siempre coincidente. Deberían incluirse todos los fármacos de primera línea (isoniazida, rifampicina, pirazinamida, etambutol y estreptomicina), ya que proporcionan información sobre el esquema terapéutico actualmente recomendado para la mayoría de los pacientes7,11-14. Los fármacos de segunda línea tradicionales (amikacina, capreomicina, clofazimina, cicloserina, etionamida, kanamicina y PAS) y los nuevos, como las fluoroquinolonas (ciprofloxacino, levofloxacino, moxifloxacino), el linezolid y, en determinado casos, la rifabutina, deberían ser evaluados siempre que: a)una cepa sea resistente a la isoniazida, rifampicina, etambutol o pirazinamida; b)cuando mediante técnicas moleculares se detecten mutaciones en genes que codifican resistencia a la isoniazida y/o a la rifampicina, y c)cuando se disponga de información clínico-epidemiológica que así lo aconseje13-15.
Métodos basados en medios de cultivo sólidosEl método de las concentraciones absolutas, descrito por Meissner, se basa en la comparación del número de colonias en presencia del fármaco con el número de colonias en el medio de cultivo sin el fármaco. Los resultados se ven afectados por el tamaño del inóculo y por la precisión en la definición de la concentración crítica de cada fármaco. El método de la relación de resistencias, descrito por Mitchison, compara la concentración inhibitoria mínima (CIM) de una determinada cepa con la de una cepa de referencia. Los resultados dependen de la adecuada estandarización de los fármacos y del inóculo, aunque no precisa definir las concentraciones críticas. El método de las proporciones múltiples descrito por Canetti, Rist y Grosset10 en 1963 evidencia la proporción de bacilos resistentes que están presentes en un cultivo. La resistencia del microorganismo se considera clínicamente significativa cuando la población bacteriana resistente supera el 1%. Es el método más exacto y el que menos falsos resultados proporciona, por lo que es el más utilizado en todo el mundo7,11,13,16. El método de la epsilometría (E-test) se basa en un gradiente de difusión antimicrobiano que combina los principios de la difusión en disco y la dilución en agar en el estudio de la sensibilidad in vitro. Es una técnica cuantitativa para determinar la CIM de los antimicrobianos17.
Métodos basados en medios de cultivo líquidosEn la actualidad existen 2 sistemas no radiométricos para las pruebas de sensibilidad: BACTECTM MGITTM 960 (Becton-Dickinson Diagnostics, Sparks, MD, EE.UU.) y VersaTREK® (Thermo Scientific, Westlake, OH, EE.UU.)7,11,13,18. Ambos utilizan el medio 7H9 de Middlebrook suplementado, y el crecimiento se evidencia mediante la detección del consumo/producción de determinados gases. Las concentraciones críticas iniciales y secundarias que se analizan vienen predeterminadas por el fabricante para los fármacos de primera línea. Sin bien la detección de MDR-TB no suele comportar problema alguno, existen algunas discrepancias interlaboratorios con la estreptomicina, el etambutol y la pirazinamida. En el caso de la pirazinamida, al ser activa en medio ácido (pH 5,5), el pH del medio de cultivo debería adecuarse a estas condiciones, a pesar de que un 10% aproximadamente de los aislamientos de M.tuberculosis no crecen bien a ese pH. Por otro lado, también es posible analizar concentraciones críticas de otros fármacos de segunda línea si se dispone de sustancia valorada.
Métodos de sensibilidad alternativosEn las técnicas basadas en micobacteriófagos, al añadir los fagos a un cultivo en presencia de antibiótico, estos infectarán únicamente las micobacterias viables, que serán las resistentes. Se han aplicado en las pruebas de sensibilidad a la isoniazida y rifampicina, pero presentan problemas de sensibilidad, especificidad y una alta tasa de contaminaciones. La citometría de flujo, mediante colorantes de ácidos nucleicos permeables a nivel celular, evidencia las micobacterias viables (los controles y las resistentes a los fármacos) con niveles más altos de señal fluorescente en comparación con las no viables (sensibles a los fármacos). Uno de los inconvenientes es el elevado coste de los equipos. La microdilución en caldo (Mycotb Sensititre® Thermo Scientific) permite determinar la CIM a múltiples fármacos. La mayor dificultad reside en la lectura e interpretación de los resultados, debido a que el crecimiento de estas bacterias no es homogéneo. La prueba de la nitrato reductasa se basa en la capacidad del complejo M.tuberculosis para reducir los nitratos a nitritos. Para ello se emplean tubos de Löwenstein-Jensen que incorporan KNO3 con y sin fármacos. La observación microscópica de la sensibilidad a los fármacos (microscopic-observation drug-susceptibility, MODS) se basa en la detección precoz de las típicas cuerdas (cord factor) que exhibe el complejo M.tuberculosis, con la ayuda de un microscopio de luz invertida. La prueba de microtitulación con resazurina (resazurin microtiter assay, REMA) es un método indirecto basado en la detección de cambios de color en el medio de cultivo debidos a la oxidación (azul) y reducción (rosa) de la resazurina.
La OMS considera que la nitrato reductasa, MODS y REMA son técnicas sencillas y baratas que pueden emplearse para el cribado rápido de las resistencias a la isoniazida y la rifampicina en países con bajos recursos11,13,19. Los datos de sensibilidad y especificidad superan el 95%.
Pruebas de sensibilidad a los antimicrobianos en las micobacterias no tuberculosasAunque se han descrito más de 160 especies de MNT, solo se recomienda la realización de pruebas de sensibilidad en los aislados clínicamente significativos para los cuales se haya demostrado una correlación entre los resultados in vitro con los resultados in vivo2,13. Así, el Clinical and Laboratory Standards Institute (CLSI) establece recomendaciones tan solo para el grupo Mycobacterium avium complex, M.kansasii, Mycobacterium marinum y micobacterias no pigmentadas de crecimiento rápido7.
Pruebas de sensibilidad en micobacterias no tuberculosas de crecimiento lentoEn general, el CLSI recomienda como metodología de elección la microdilución en caldo con el medio de cultivo Mueller-Hinton ajustado con cationes (MHCA) y suplementado con OADC o ADC. Sin embargo, en algunos casos existen alternativas a esta metodología.
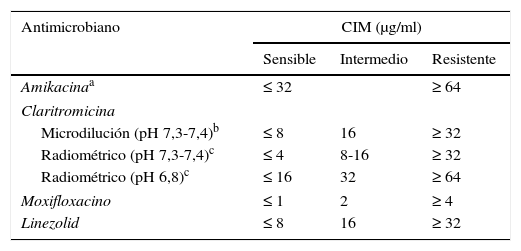
Recomendaciones para Mycobacterium avium complexEl tratamiento de M.avium complex (MAC) se basa en el uso de la claritromicina como fármaco esencial o principal, y de etambutol y rifampicina (o rifabutina) como acompañantes, si bien hay datos de que otros antibióticos (amikacina, linezolid y moxifloxacino) podrían tener utilidad en algunos casos. Dado que únicamente se ha demostrado una correlación clínica con las pruebas in vitro para los macrólidos, el CLSI recomienda que solo se estudien estos fármacos7. No obstante, cuando se presenta resistencia a la claritromicina es razonable analizar otros fármacos (moxifloxacino, linezolid y aminoglucósidos). La actividad de la claritromicina es muy sensible al medio de cultivo y a su pH, de forma que las CIM generalmente utilizadas como puntos de corte corresponden a un medio MHCA a pH ligeramente básico de 7,3-7,4. Otro método que puede usarse es la macrodilución utilizando los sistemas BACTEC™ MGIT™ 960 y VersaTREK®2,13. Actualmente existe una técnica comercial de microdilución en placas de microtitulación (Slomyco, Sensititre®, Thermo Scientific), que permite realizar la sensibilidad in vitro de una forma sencilla y reproducible con una incubación estándar de 7 días. Aunque incluye 13 antimicrobianos con múltiples concentraciones, es importante mantener los criterios de interpretación expuestos previamente (tabla 2).
Criterios de interpretación de las pruebas de sensibilidad del complejo M.avium mediante microdilución en caldo
| Antimicrobiano | CIM (μg/ml) | ||
|---|---|---|---|
| Sensible | Intermedio | Resistente | |
| Amikacinaa | ≤ 32 | ≥ 64 | |
| Claritromicina | |||
| Microdilución (pH 7,3-7,4)b | ≤ 8 | 16 | ≥ 32 |
| Radiométrico (pH 7,3-7,4)c | ≤ 4 | 8-16 | ≥ 32 |
| Radiométrico (pH 6,8)c | ≤ 16 | 32 | ≥ 64 |
| Moxifloxacino | ≤ 1 | 2 | ≥ 4 |
| Linezolid | ≤ 8 | 16 | ≥ 32 |
En los tratamientos habituales de las infecciones por esta micobacteria se incluye la rifampicina (o la rifabutina), la isoniazida y un tercer fármaco (etambutol o estreptomicina) durante 18 meses (al menos 12 meses de cultivos negativos). En los casos de posible resistencia se deberá realizar la sensibilidad in vitro a estos y otros antimicrobianos potencialmente activos (claritromicina, moxifloxacino o levofloxacino, amikacina, linezolid y rifabutina)2,7,13. Un aspecto a destacar es que M.kansasii presenta, de forma natural, una sensibilidad algo disminuida a la isoniazida en comparación con M.tuberculosis, aunque tiene actividad clínica.
El método recomendado es la microdilución, aunque se han usado las proporciones en agar 7H10 de Middlebrook y los sistemas automáticos no radiométricos. Como se mencionó previamente en el MAC, en la actualidad existe una técnica comercial de microdilución que, aunque incluye múltiples antimicrobianos con diversas concentraciones, es importante seguir los criterios de interpretación vigentes (CLSI).
Recomendaciones para Mycobacterium marinumEn la actualidad solo se recomienda la realización de estudios de sensibilidad a los antimicrobianos en esta especie, cuando exista un fracaso clínico y microbiológico, mediante el método de microdilución en caldo a 28-30°C durante 7 días2,7,13.
Otras micobacterias no tuberculosas de crecimiento lentoDe forma genérica se recomienda llevar a cabo estudios de sensibilidad in vitro mediante microdilución en caldo, con los mismos fármacos y a las mismas concentraciones que en M.kansasii, para todas las especies que tengan un buen crecimiento (no deficientes) y en los que se detecte un fracaso terapéutico y cultivos positivos persistentes.
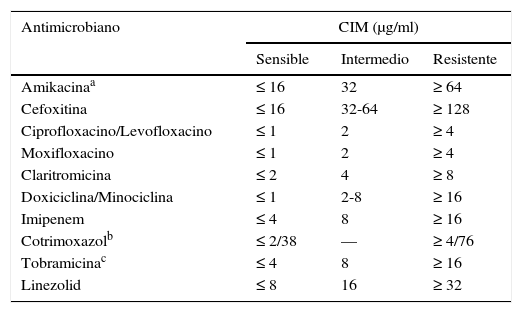
Pruebas de sensibilidad en micobacterias no tuberculosas de crecimiento rápidoEl tratamiento de estos microorganismos se realiza habitualmente con fármacos frente a los cuales el resto de especies son resistentes o, al menos, poseen una sensibilidad menor. Por todo ello, el estudio de sensibilidad in vitro presenta ciertas características diferenciales con el resto de las micobacterias. La técnica recomendada es la microdilución en caldo con una incubación de 3-4 días a 30°C (tabla 3)2,3,7,13. Otros métodos presentan problemas de interpretación y no deben emplearse. Hay que tener en cuenta la posible presencia de metilasas inducibles erm, por lo que para detectar este fenómeno se recomienda reincubar las placas hasta 14 días, valorando el aumento de la CIM a los macrólidos. En el momento actual existe una técnica comercial de microdilución diseñada específicamente para micobacterias de crecimiento rápido y actinomicetales aerobios (Rapmyco, Sensititre®, Thermo Scientific).
Criterios de interpretación de las pruebas de sensibilidad de las micobacterias de crecimiento rápido mediante microdilución en caldo
| Antimicrobiano | CIM (μg/ml) | ||
|---|---|---|---|
| Sensible | Intermedio | Resistente | |
| Amikacinaa | ≤ 16 | 32 | ≥ 64 |
| Cefoxitina | ≤ 16 | 32-64 | ≥ 128 |
| Ciprofloxacino/Levofloxacino | ≤ 1 | 2 | ≥ 4 |
| Moxifloxacino | ≤ 1 | 2 | ≥ 4 |
| Claritromicina | ≤ 2 | 4 | ≥ 8 |
| Doxiciclina/Minociclina | ≤ 1 | 2-8 | ≥ 16 |
| Imipenem | ≤ 4 | 8 | ≥ 16 |
| Cotrimoxazolb | ≤ 2/38 | — | ≥ 4/76 |
| Tobramicinac | ≤ 4 | 8 | ≥ 16 |
| Linezolid | ≤ 8 | 16 | ≥ 32 |
La resistencia a los antibacterianos se debe fundamentalmente a mutaciones cromosómicas en genes que codifican su diana o las enzimas activadoras. Pueden ser espontáneas o inducidas por los fármacos tras exposición a la monoterapia2,3,20,21.
IsoniazidaLa resistencia se asocia sobre todo a mutaciones en 2 genes (68-90%): a)el gen katG, que es responsable de la activación del fármaco; la mutación más frecuente afecta al codón 315 y se relaciona con la resistencia de alto nivel (60-70% de resistencias), y b)el gen inhA, que interviene en la síntesis de la pared bacteriana. Las mutaciones (8-20%) causan resistencia de bajo nivel y cruzada con etionamida13,20,21. Las MNT, salvo M.kansasii y M.xenopi, son resistentes por incapacidad de activación del fármaco2,3,13.
Rifampicina y otras rifamicinasLa resistencia a M.tuberculosis complex está relacionada con mutaciones en el gen rpoB (>95%), implicado en la síntesis de proteínas. Los codones 526 y 531 son los más afectados y confieren resistencia de alto nivel y cruzada con otras rifamicinas13,20,21. Las mutaciones en algunos codones mantendrían la sensibilidad a la rifabutina. Se han descrito mutaciones similares en MNT.
Aminoglucósidos y capreomicinaLa resistencia se basa en mutaciones ribosomales implicadas en la síntesis de las proteínas. La resistencia a la estreptomicina se asocia a mutaciones (50-60%) en los genes rpsL y rrs (codones 530-912), mientras que la resistencia a la amikacina, a la kanamicina y a la capreomicina, a mutaciones en el gen rrs (codones 1400-1500)13,20,21. Existe resistencia cruzada parcial entre ellos, existiendo aislamientos resistentes a la estreptomicina que pueden ser sensibles a los demás. El gen tlyA se ha vinculado con la resistencia a la capreomicina y el gen eis, con la kanamicina.
EtambutolLa resistencia está relacionada con mutaciones en el gen embB, que interviene en la síntesis de la pared bacteriana. La mayoría (60-80%) se han descrito en los codones 306 y 40613,20,21. Algunas especies de MNT presentan resistencia natural2,3.
PirazinamidaLa resistencia se asocia a mutaciones a lo largo del gen pncA (72-97%) que regula la activación del fármaco. Mycobacterium bovis y su variante BCG, así como las MNT, presentan resistencia natural.2,3,13,20,21
FluoroquinolonasEl mecanismo más frecuente son las mutaciones en los genes gyrA (85%) y gyrB (10%). Existe resistencia cruzada entre las fluoroquinolonas, pero no completa, según los codones afectados2,3,13,20,21.
Macrólidos y ketólidosLa resistencia está vinculada a mutaciones del gen 23S ribosomal y, sobre todo, a metilasas inducibles reguladas por el gen erm. Estas se observan en especies como M.fortuitum y M.abscessus subsp. abscessus y subsp. bolletii2.
BetalactámicosLa resistencia se asocia a disminución de la permeabilidad y afinidad de las PBP y, mayormente, a betalactamasas2,3.
Tetraciclinas y glicilglicinasLa resistencia a las tetraciclinas se debe a proteínas de protección del ribosoma o bombas de expulsión2,3. Hasta el momento no se ha demostrado la resistencia a la tigeciclina.
OxazolidinonasLa resistencia de las micobacterias al linezolid se asocia a mutaciones en el gen 23S rRNA13,20.
CotrimoxazolEn micobacterias no está claro el mecanismo de resistencia.
Bedaquilina y delamanidLa resistencia a la bedaquilina se ha asociado con una mutación en el gen mmpR, y la resistencia al delamanid, con mutaciones en los genes fbiA y fgd122.
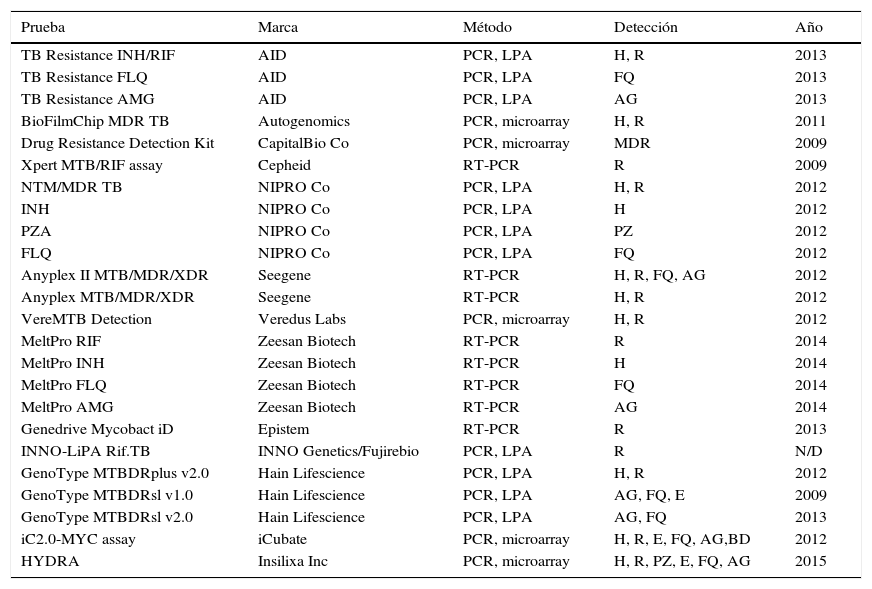
Detección molecular de las resistenciasEl método de referencia para determinar la resistencia a los fármacos antituberculosos es la prueba de sensibilidad fenotípica convencional, aunque los resultados se suelen demorar varias semanas7,11,13. La detección molecular de la resistencia, basada en evidenciar mutaciones cromosómicas, ofrece resultados rápidos y útiles21,23. Las técnicas comerciales son las más utilizadas debido a su mayor estandarización (tabla 4). Las más implantadas son Xpert® MTB/RIF Assay (Cepheid, Sunnyvale, CA, EE.UU.) y GenoType® MTBDRplus (Hain Lifescience, Nehren, Alemania), ambas aprobadas por la OMS para el diagnóstico rápido de la MDR-TB. El Xpert® MTB/RIF permite el diagnóstico del complejo M.tuberculosis y la detección de las mutaciones de resistencia a la rifampicina en <2h, con una mínima manipulación, limitada a introducir la muestra en un cartucho donde se desarrolla íntegramente el proceso de amplificación y detección. El sistema utiliza 5 sondas fluorescentes que cubren la secuencia natural de la región de 81pb del gen rpoB donde ocurren más del 95% de las resistencias a la rifampicina. Para el diagnóstico de TB pulmonar y extrapulmonar la sensibilidad es del 95-98% en muestras con microscopia positiva y del 67-69% ante microscopia negativa, tomando como referencia el cultivo24. La especificidad es del 99%. En síntesis, Xpert MTB/RIF® aporta un 23% más de casos positivos que la microscopia. Sus inconvenientes más importantes son que solo detecta la resistencia a la rifampicina y su coste económico, aunque para países de bajos recursos es 6-7 veces inferior (menos de 10€)24. El GenoType® MTBDRplus se basa en la amplificación e hibridación reversa sobre tiras de nitrocelulosa que contienen sondas inmovilizadas correspondientes a secuencias naturales y secuencias de las mutaciones más frecuentes de los genes rpoB (rifampicina) y katG e inhA (isoniazida). Actualmente puede usarse a partir de cultivos o sobre muestras clínicas, incluso con baciloscopia negativa. Diversos metaanálisis establecen una sensibilidad global del 98% para la resistencia a la rifampicina y del 84,3% para la isoniazida, con especificidad del 98-99,5%. Las muestras con microscopia negativa pueden tener un 5-12% de resultados inválidos por baja sensibilidad. Se han descrito resultados no interpretables por ausencia simultánea de bandas naturales y mutadas en el mismo locus, debidas a mutaciones no contenidas en el kit. Otra posibilidad son resultados discrepantes con genotipo sensible y fenotipo resistente, debido a mecanismos distintos a los detectados por el producto comercial. La opción genotipo resistente y fenotipo sensible estaría causada por la coexistencia de poblaciones mixtas o heterorresistentes o resistencias de bajo nivel, que se han descrito en el 4-13% de los casos25. Al menos el 50% de los pacientes con MDR-TB son resistentes a otros fármacos. Así se han comercializado pruebas de detección de mutaciones de resistencia a fármacos de segunda línea. El producto más conocido es el GenoType® MTBDRsl (Hain Lifescience). Coexisten dos versiones: v1.0 y v2.0. La primera está dirigida a mutaciones de resistencia a la capreomicina y a los aminoglucósidos amikacina y kanamicina en el gen rrs (codones 1401 y 1484), así como a las fluoroquinolonas en el gen gyrA (codones 90,91 y 94), y al etambutol en el gen embB (codón 306). Un análisis reciente observó una buena sensibilidad para las fluoroquinolonas (83-85%), pero menor para los aminoglucósidos (77%), imputable a la kanamicina (69,9%)26. La versión v2.0 persigue mejorar el rendimiento incluyendo el gen gyrB para las fluoroquinolonas y el gen eis para la kanamicina, suprimiendo el etambutol del kit. Se ha evaluado recientemente con una sensibilidad del 96% para la kanamicina. No obstante, se ha observado también una disminución de la especificidad para los inyectables (91%), por la detección de mutaciones de significado aún incierto en el gen eis en algunas cepas sensibles27. Aparte de los anteriores, también tienen cierta difusión los productos INNO-Lipa® RifTB (INNO Genetics, Gent, Belgium/Fujirebio, Tokio, Japón), Anyplex II™ MTB/MDR/XDR (Seegene, Seúl, Corea) y el TB Resistance® Assay (AID; Autoimmun Diagnostika, Strassberg, Alemania)18,21,23. Aunque no obvian las pruebas fenotípicas de sensibilidad, la principal utilidad de los métodos de detección molecular de resistencia, en nuestro entorno, es confirmar o descartar de forma rápida y en mayor o menor medida, según los fármacos, la resistencia en casos de sospecha elevada. Recientemente se ha comercializado un método (GenoType® NTM-DR, Hain Lifescience) que, además de identificar algunas especies de MNT, permite la detección del gen erm en M.abscessus, y de las mutaciones en los genes rrs (aminoglucósidos) y/o rrl (macrólidos).
Métodos comercializados para la detección de mutaciones de resistencia a los fármacos antituberculosos
| Prueba | Marca | Método | Detección | Año |
|---|---|---|---|---|
| TB Resistance INH/RIF | AID | PCR, LPA | H, R | 2013 |
| TB Resistance FLQ | AID | PCR, LPA | FQ | 2013 |
| TB Resistance AMG | AID | PCR, LPA | AG | 2013 |
| BioFilmChip MDR TB | Autogenomics | PCR, microarray | H, R | 2011 |
| Drug Resistance Detection Kit | CapitalBio Co | PCR, microarray | MDR | 2009 |
| Xpert MTB/RIF assay | Cepheid | RT-PCR | R | 2009 |
| NTM/MDR TB | NIPRO Co | PCR, LPA | H, R | 2012 |
| INH | NIPRO Co | PCR, LPA | H | 2012 |
| PZA | NIPRO Co | PCR, LPA | PZ | 2012 |
| FLQ | NIPRO Co | PCR, LPA | FQ | 2012 |
| Anyplex II MTB/MDR/XDR | Seegene | RT-PCR | H, R, FQ, AG | 2012 |
| Anyplex MTB/MDR/XDR | Seegene | RT-PCR | H, R | 2012 |
| VereMTB Detection | Veredus Labs | PCR, microarray | H, R | 2012 |
| MeltPro RIF | Zeesan Biotech | RT-PCR | R | 2014 |
| MeltPro INH | Zeesan Biotech | RT-PCR | H | 2014 |
| MeltPro FLQ | Zeesan Biotech | RT-PCR | FQ | 2014 |
| MeltPro AMG | Zeesan Biotech | RT-PCR | AG | 2014 |
| Genedrive Mycobact iD | Epistem | RT-PCR | R | 2013 |
| INNO-LiPA Rif.TB | INNO Genetics/Fujirebio | PCR, LPA | R | N/D |
| GenoType MTBDRplus v2.0 | Hain Lifescience | PCR, LPA | H, R | 2012 |
| GenoType MTBDRsl v1.0 | Hain Lifescience | PCR, LPA | AG, FQ, E | 2009 |
| GenoType MTBDRsl v2.0 | Hain Lifescience | PCR, LPA | AG, FQ | 2013 |
| iC2.0-MYC assay | iCubate | PCR, microarray | H, R, E, FQ, AG,BD | 2012 |
| HYDRA | Insilixa Inc | PCR, microarray | H, R, PZ, E, FQ, AG | 2015 |
AG: aminoglucósidos; BD: bedaquilina; E: etambutol; FQ: fluoroquinolonas; H: isoniazida; LPA: line probe assay; N/D: no disponible; PCR: polymerase chain reaction; PZ: pirazinamida; R: rifampicina; RT-PCR: real-time PCR.
Modificado de Tuberculosis Diagnostics Technology and Market Landscape, UNITAID WHO 2015.
Los autores han declarado no tener ningún conflicto de intereses.