Presentamos el mayor estudio realizado en Galicia sobre prevalencia y distribución de genotipos/subtipos del VHC.
MétodosEstudio retrospectivo recopilando al total de pacientes crónicamente infectados por VHC entre el 1 de enero del 2000 y el 31 de diciembre del 2015 en 3de las principales áreas sanitarias: Santiago, Pontevedra y Vigo. Recogimos datos sobre prevalencia y distribución de genotipos/subtipos, vías de transmisión, género, edad y coinfección con VIH/VHB.
ResultadosReclutamos a 4.469 pacientes, con una mediana de edad 50 años (RIC 57-45), el 72,3% hombres, el 0,4% coinfectado con otro genotipo, el 20,6% coinfectado con VIH y un 35,2% con VHB. Transmisión parenteral (83,1%), desconocida (15,3%), sexual (1,4%) y vertical (0,2%). Distribución de genotipos: 62,9% VHC-1 (29,2% VHC-1a y 31,9% VHC-1b), 3,4% VHC-2, 21,0% VHC-3, 12,6% VHC-4 y 0,1% VHC-5.
ConclusiónLa distribución de genotipos muestra diferencias significativas respecto a la observada en España. Dicha distribución varía con la edad, el género, la coinfección con VIH o VHB, y dentro de áreas geográficas.
We present the largest study conducted in Galicia on the prevalence and distribution of HCV genotypes/subtypes.
MethodsRetrospective study collecting the total number of patients chronically infected by HCV between 2000.01.01 to 2015.12.31 in 3of the main health areas: Santiago, Pontevedra and Vigo.
ResultsWe collected a total of 4469 patients. The median age was 50 years (IQR 57-45), 72,3% were men, 0,4% were coinfected with another genotype, 20,6% were coinfected with HIV and 35.2% with HBV. The main route of transmission was parenteral (83,1%), followed by unknown (15,3%), sexual (1,4%) and vertical (0,2%). The distribution of genotypes was: 62,9% HCV-1 (29,2% HCV-1a and 31,9% HCV-1b), 3,4% HCV-2, 21,0% HCV-3, 12,6% HCV-4 and 0,1% HCV-5.
ConclusionThe distribution of genotypes in Galicia shows significant differences with respect to that observed in Spain. This distribution varies with age, gender, coinfection with HIV and/or HBV, and within geographical areas.
El VHC puede clasificarse mediante métodos filogenéticos en 7 genotipos principales y en una gran variedad de subtipos, que muestran distintos patrones de distribución geográfica1,2. La epidemia de la infección por el VHC sigue en continuo desarrollo y los parámetros epidemiológicos conocidos en Galicia hace más de una década no son útiles en la actualidad3,4.
MétodosDiseño y características. Estudio multicéntrico retrospectivo recopilando el total de pacientes crónicamente infectados por el VHC diagnosticados entre el 1 de enero del 2000 y el 31 de diciembre 2015 en las áreas sanitarias (AS) de Santiago, Pontevedra y Vigo. Los datos epidemiológicos y clínicos fueron obtenidos manteniendo la confidencialidad y el anonimato según las indicaciones y los requisitos de los respectivos Comités de Ética de Investigación. Se recogieron datos demográficos, clínicos y virológicos: genotipo/subtipo, género, edad, localidad, ruta de transmisión y coinfección con VHB o VIH. Para conocer la prevalencia de las variantes filogenéticas del genotipo 1a, así como la presencia del polimorfismo Q80K, fueron escogidos al azar 73 pacientes con este genotipo y se secuenció la región NS35, analizándola posteriormente en geno2phenoHCV.
Análisis estadístico. Para estudiar el efecto de cada genotipo/subtipo del VHC sobre las diferentes variables cualitativas se empleó el test de la chi al cuadrado (χ2). Para las cuantitativas se emplearon el test de Student o la prueba U de Mann-Whitney, dependiendo si la distribución era o no normal, respectivamente, determinado por el test de Kolmogorov-Smirnov. En todos los casos se consideraron estadísticamente significativos valores de p < 0,05. Todos los análisis se llevaron a cabo mediante SPSS v20.0 (IBM Corp. Armonk Released 2012. IBM SPSS Statistics for Windows, Version 20.0. Armonk, NY: IBM Corp.).
ResultadosLos resultados corresponden al periodo 2000-2015 y pertenecen a 4.469 pacientes no seleccionados infectados crónicamente con el VHC.
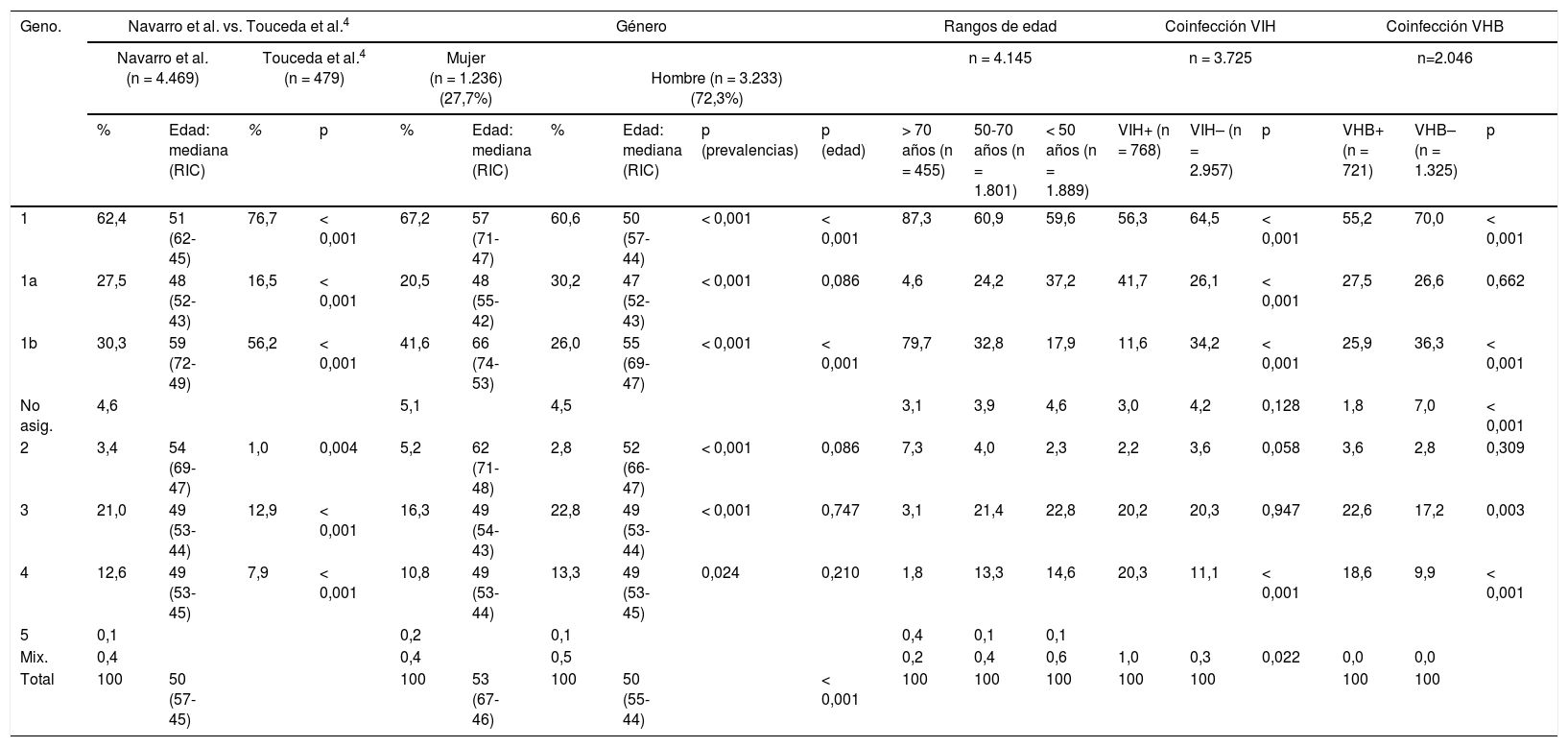
En la tabla 1 se muestra la distribución de genotipos/subtipos en el total de la población de nuestro estudio, así como su comparación con el trabajo de Touceda et al.4; también aparece reflejada la distribución en ambos géneros, edades y grupos de coinfección con VHB o VIH.
Distribución de genotipos en el total de la población, en distintos subgrupos y comparación con el estudio realizado por Touceda et al.4
| Geno. | Navarro et al. vs. Touceda et al.4 | Género | Rangos de edad | Coinfección VIH | Coinfección VHB | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Navarro et al. (n = 4.469) | Touceda et al.4 (n = 479) | Mujer (n = 1.236) (27,7%) | Hombre (n = 3.233) (72,3%) | n = 4.145 | n = 3.725 | n=2.046 | |||||||||||||
| % | Edad: mediana (RIC) | % | p | % | Edad: mediana (RIC) | % | Edad: mediana (RIC) | p (prevalencias) | p (edad) | > 70 años (n = 455) | 50-70 años (n = 1.801) | < 50 años (n = 1.889) | VIH+ (n = 768) | VIH– (n = 2.957) | p | VHB+ (n = 721) | VHB– (n = 1.325) | p | |
| 1 | 62,4 | 51 (62-45) | 76,7 | < 0,001 | 67,2 | 57 (71-47) | 60,6 | 50 (57-44) | < 0,001 | < 0,001 | 87,3 | 60,9 | 59,6 | 56,3 | 64,5 | < 0,001 | 55,2 | 70,0 | < 0,001 |
| 1a | 27,5 | 48 (52-43) | 16,5 | < 0,001 | 20,5 | 48 (55-42) | 30,2 | 47 (52-43) | < 0,001 | 0,086 | 4,6 | 24,2 | 37,2 | 41,7 | 26,1 | < 0,001 | 27,5 | 26,6 | 0,662 |
| 1b | 30,3 | 59 (72-49) | 56,2 | < 0,001 | 41,6 | 66 (74-53) | 26,0 | 55 (69-47) | < 0,001 | < 0,001 | 79,7 | 32,8 | 17,9 | 11,6 | 34,2 | < 0,001 | 25,9 | 36,3 | < 0,001 |
| No asig. | 4,6 | 5,1 | 4,5 | 3,1 | 3,9 | 4,6 | 3,0 | 4,2 | 0,128 | 1,8 | 7,0 | < 0,001 | |||||||
| 2 | 3,4 | 54 (69-47) | 1,0 | 0,004 | 5,2 | 62 (71-48) | 2,8 | 52 (66-47) | < 0,001 | 0,086 | 7,3 | 4,0 | 2,3 | 2,2 | 3,6 | 0,058 | 3,6 | 2,8 | 0,309 |
| 3 | 21,0 | 49 (53-44) | 12,9 | < 0,001 | 16,3 | 49 (54-43) | 22,8 | 49 (53-44) | < 0,001 | 0,747 | 3,1 | 21,4 | 22,8 | 20,2 | 20,3 | 0,947 | 22,6 | 17,2 | 0,003 |
| 4 | 12,6 | 49 (53-45) | 7,9 | < 0,001 | 10,8 | 49 (53-44) | 13,3 | 49 (53-45) | 0,024 | 0,210 | 1,8 | 13,3 | 14,6 | 20,3 | 11,1 | < 0,001 | 18,6 | 9,9 | < 0,001 |
| 5 | 0,1 | 0,2 | 0,1 | 0,4 | 0,1 | 0,1 | |||||||||||||
| Mix. | 0,4 | 0,4 | 0,5 | 0,2 | 0,4 | 0,6 | 1,0 | 0,3 | 0,022 | 0,0 | 0,0 | ||||||||
| Total | 100 | 50 (57-45) | 100 | 53 (67-46) | 100 | 50 (55-44) | < 0,001 | 100 | 100 | 100 | 100 | 100 | 100 | 100 | |||||
Distribución de genotipos en porcentaje.
Geno.: genotipos; Mix.: infecciones mixtas; No asig.: genotipo 1 no subtipificado; p: p-valor; RIC: rango intercuartílico; VHB: virus de la hepatitis B; VIH: virus de la inmunodeficiencia humana.
Dentro de 1a, el clado ii fue el más prevalente (69,9%), no detectando en ningún caso el polimorfismo Q80K, mientras que sí se encontró en el 18,2% de los clado i.
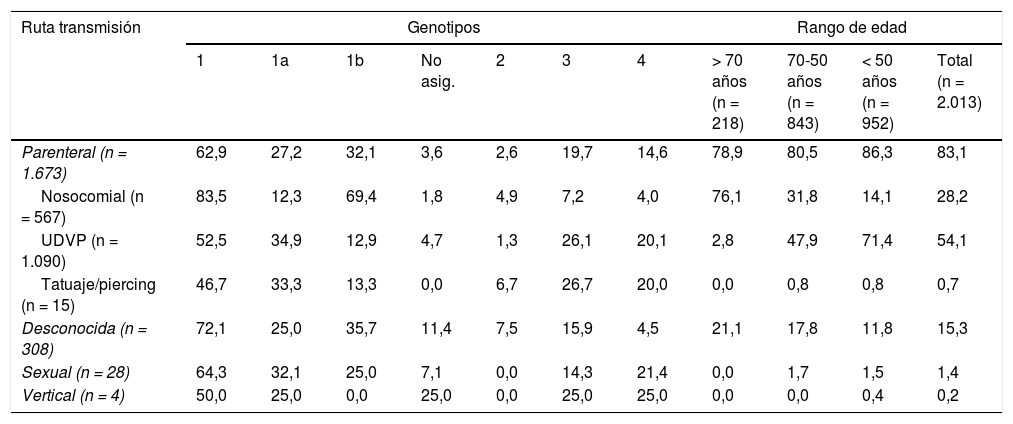
En la tabla 2 vienen representadas las principales vías de transmisión y su asociación con los diferentes genotipos/subtipos, y su distribución en los distintos rangos de edad.
Distribución de los principales genotipos del VHC en cada ruta de transmisión y rango de edad
| Ruta transmisión | Genotipos | Rango de edad | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 1a | 1b | No asig. | 2 | 3 | 4 | > 70 años (n = 218) | 70-50 años (n = 843) | < 50 años (n = 952) | Total (n = 2.013) | |
| Parenteral (n = 1.673) | 62,9 | 27,2 | 32,1 | 3,6 | 2,6 | 19,7 | 14,6 | 78,9 | 80,5 | 86,3 | 83,1 |
| Nosocomial (n = 567) | 83,5 | 12,3 | 69,4 | 1,8 | 4,9 | 7,2 | 4,0 | 76,1 | 31,8 | 14,1 | 28,2 |
| UDVP (n = 1.090) | 52,5 | 34,9 | 12,9 | 4,7 | 1,3 | 26,1 | 20,1 | 2,8 | 47,9 | 71,4 | 54,1 |
| Tatuaje/piercing (n = 15) | 46,7 | 33,3 | 13,3 | 0,0 | 6,7 | 26,7 | 20,0 | 0,0 | 0,8 | 0,8 | 0,7 |
| Desconocida (n = 308) | 72,1 | 25,0 | 35,7 | 11,4 | 7,5 | 15,9 | 4,5 | 21,1 | 17,8 | 11,8 | 15,3 |
| Sexual (n = 28) | 64,3 | 32,1 | 25,0 | 7,1 | 0,0 | 14,3 | 21,4 | 0,0 | 1,7 | 1,5 | 1,4 |
| Vertical (n = 4) | 50,0 | 25,0 | 0,0 | 25,0 | 0,0 | 25,0 | 25,0 | 0,0 | 0,0 | 0,4 | 0,2 |
Distribución de genotipos en porcentaje.
No asig.: genotipo 1 no subtipificado; UDVP: usuarios de drogas por vía parenteral.
Encontramos diferentes patrones de distribución para los genotipos del VHC entre las diversas AS. El genotipo 1 es el más prevalente en todas, mientras que el 1b y el 4 son más frecuentes en Santiago, el 1a y el 2 lo son en Vigo y el 3 en Pontevedra, convirtiéndose en el segundo más importante en esta AS.
El método de genotipificación más empleado fue Siemens reverse hybridisation (LiPA) (94,7%) seguido por Roche linear arrays (5,2%) y secuenciación (0,2%).
DiscusiónEs conocido que la distribución de genotipos se asocia al sexo, la edad y especialmente las rutas de transmisión: 1b y 2 están ligados a las transfusiones de sangre y procedimientos médicos inseguros, mientras que 1a, 3 y 4 están principalmente asociados con UDVP6,7.
La distribución hallada es similar a la observada en trabajos recientes realizados en España8. Sin embargo, aparecen algunas variaciones, como resultado de la evolución constante de los patrones epidemiológicos del VHC, evidenciando la importancia de conocer la epidemiología de este virus a nivel local/regional. Los pacientes infectados por el genotipo 1 (62,4%), principalmente por el 1b (30,3%), forman el grupo más frecuente, aunque lo son significativamente menos que en el resto del país8. Por el contrario, los genotipos asociados al UDVP son significativamente más prevalentes: 1a (27,6%), 3 (21,0%) y 4 (12,6%). Esto confirma que en Galicia, al igual que ocurre en España y otros países europeos, los genotipos 1 y 3 son los más frecuentemente detectados en la población general8,9.
Respecto a la distribución de los clados dentro del genotipo 1a, el ii es el más prevalente, con el 69,9%, siendo menor a lo descrito en el resto de España, donde es del 76,4%10. Por su parte, respecto al polimorfismo Q80K, que en España ha sido observado en el 42,0% del clado i y en el 1,8% del ii10, nosotros únicamente lo detectamos en el 18,2% del clado i. Esta menor prevalencia del clado i y del polimorfismo Q80K en nuestra región nos hace considerar que las terapias afectadas por este polimorfismo pueden ser una buena opción de tratamiento para un porcentaje mayoritario de pacientes infectados por el genotipo 1a en nuestra región.
Respecto a sexos, se observan diferentes patrones de distribución de genotipos de acuerdo con la ruta de transmisión predominante en cada grupo. Los genotipos 1, 1b y 2 son más prevalentes entre mujeres, mientras que 1a, 3 y 4 están marcadamente asociados al UDVP y predominante en hombres. Observando la edad de los pacientes, la tendencia de prevalencia de 1 (1b y 1a), 3 y 4 es dependiente de la edad, de forma directamente proporcional en 1 y 1b, e inversamente proporcional en el resto, como también ha sido descrito en otros trabajos8. De acuerdo con estos hallazgos, encontramos diferencias en la mediana de edad de los pacientes infectados con los distintos genotipos, donde 1a y 1b mostraron la menor y mayor mediana de edad para hombres y mujeres, respectivamente. Esas diferencias fueron más marcadas cuando comparamos hombres con mujeres con 1b y 2, dichas diferencias no se observan en 4 y sorprendentemente, a diferencia de lo descrito en España8, tampoco en 1a y 3.
Nuestros datos sobre la distribución de genotipos por grupos de edad muestran que 1b (79,7%) es el más prevalente en nacidos antes de 1945, 1a, 3 y 4 aumentan de forma significativa en nacidos después de 1945. Esto coincide con lo que ya se conocía en otros estudios realizados en Europa y España6-8.
Respecto a las vías de transmisión, a diferencia de lo descrito en investigaciones similares en España8,11 y Galicia3,4, donde la principal vía de transmisión es desconocida, en nuestro estudio es la parenteral (83,1%). Como esperábamos, 1b y 2 se asocian a la transmisión nosocomial y desconocida. En la parenteral 1b y 1a fueron los más frecuentemente identificados. A diferencia de otros estudios realizados en Europa occidental, en los que el genotipo 3 es el más frecuente en la población general, así como en asociados al UDVP9, nuestros pacientes UDVP estaban infectados principalmente por 1a. De acuerdo con estos resultados, también parece bastante probable que la introducción del genotipo 4 en Galicia, al igual que ocurrió en Europa y EE. UU., se relacionara con el UDVP y ocurriera a partir de los años 8012, una década después de que lo hicieran 1a y 313, lo que explicaría la mayor asociación de este genotipo con mujeres, a diferencia de 1a y 3, al coincidir su llegada (vinculada con UDVP) con una mayor incorporación del sexo femenino en este factor de riesgo14.
Coinfecciones con VHB o VIH demostraron que los patrones y las prevalencias son similares, excepto para el genotipo 1, donde 1a predomina sobre 1b en coinfectados con VIH y, a diferencia de lo observado a nivel nacional, también en coinfectados con VHB8. En coinfectados con VIH además el segundo genotipo más prevalente es el 4, siendo el significativamente más asociado con dicha coinfección. La distribución de genotipos en coinfectados con VIH fue similar a la de UDVP y confirmamos que en este grupo los pacientes coinfectados con VIH son principalmente predominantes15; además en ellos se observa una significativa mayor prevalencia de coinfección con distintos genotipos del VHC. Sorprendentemente, a diferencia de lo que ocurre en España8,11, no observamos asociación del genotipo 3 con la coinfección con VIH y sí una mayor prevalencia de 4 en coinfectados con VHB8.
Este estudio analizó la distribución geográfica de los genotipos del VHC en 3de las principales AS de Galicia. Como ocurre en otros países de nuestro entorno, la distribución de genotipos observada en las diferentes zonas presenta rangos de variación, que creemos que depende principalmente de la edad y las rutas de transmisión predominantes en cada AS.
Respecto a las limitaciones de nuestro estudio, aparte de las propias de los estudios retrospectivos, también se encuentran las relacionadas con los métodos de genotipificación empleados, en concreto para la correcta determinación de los subtipos dentro del genotipo 1.
Los datos presentados en este trabajo representan el estudio más completo realizado hasta la fecha que estima la contribución relativa de cada genotipo a la epidemia de este virus en Galicia y destaca la importancia de conocer las características epidemiológicas del VHC a nivel local/regional.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.