Estimar la prevalencia de la infección por VHC en la población general de un área sanitaria a través de una intervención en Atención Primaria, diferenciando entre nuevos diagnósticos e infecciones previamente diagnosticadas pero no tratadas.
MétodosSe seleccionaron participantes mediante un cuestionario de evaluación de riesgo, realizando un test rápido a todos aquellos con alguna respuesta afirmativa y a todos los mayores de 50 años. Las pruebas positivas se confirmaron en el laboratorio mediante determinación de anticuerpos frente al VHC por enzimoinmunoensayo de micropartículas quimioluminiscente y determinación de la viremia.
ResultadosDel total de 7.991 participantes, el 36,2% presentó cuestionario de riesgo para VHC. Se realizaron 4.717 test, encontrando una proporción de anti-VHC de 0,65% en la población cribada, quedando en 0,46% de infecciones activas. El 51,9% de las personas con test positivo tenían un diagnóstico previo conocido pero no habían recibido tratamiento, por no ser conscientes de ello o no encontrarse vinculados al sistema sanitario, y el 19,2% tuvo un resultado positivo por primera vez. La prevalencia de infección oculta fue mayor en hombres, mayores de 50 años, y personas procedentes de Europa del Este.
ConclusiónEncontramos una prevalencia de infecciones activas superior a la descrita recientemente a nivel nacional, y con mayor porcentaje de pacientes nuevamente diagnosticados que en trabajos similares en otras áreas. Estas diferencias justifican la necesidad de realizar evaluaciones locales de la prevalencia de infección por VHC en cada una de las áreas de salud donde se plantee implementar y monitorizar un programa de microeliminación.
To estimate the prevalence of HCV infection in the general population of a health area through an intervention in Primary Care, differentiating between new diagnoses and infections previously diagnosed but not treated.
MethodsParticipants were selected through a risk assessment questionnaire, with all those who gave at least one affirmative answer and all those over 50 years of age undergoing a rapid test. Positive tests were confirmed in the lab by determination of anti-HCV antibodies by chemiluminescent microparticle immunoassay and determination of viraemia.
ResultsOf the 7,991 participants, 36.2% presented a positive HCV risk questionnaire. 4,717 tests were performed, finding an anti-HCV percentage of 0.65% in the screened population, with 0.46% of active infections. Among the individuals with a positive test result, 51.9% had a known prior diagnosis but had not received treatment, because they were not aware of it or were not linked to the health system, and 19.2% had a positive result for the first time. The prevalence of hidden infection was higher in men, those over 50 years of age and people from Eastern Europe.
ConclusionWe found a prevalence of active infections higher than recently described nationwide, and a higher percentage of newly diagnosed infections than recent similar studies in other areas. These differences justify the need to perform local assessments of the prevalence of HCV infection in each of the health areas where it is planned to implement and monitor a microelimination programme.
La infección por VHC es una de las principales causas de hepatopatía crónica1, y constituye una causa importante de enfermedad en España2, debido al elevado número de infecciones que se produjeron especialmente en las décadas de 1980 y 19903 y al alto porcentaje de cronificación de la infección. Existen pocos estudios epidemiológicos sobre la infección por VHC en España, muchos de ellos provenientes de pequeñas cohortes o realizados en población seleccionada de alto riesgo3–6, en muchas ocasiones sin diferenciar infecciones previamente diagnosticadas o no diagnosticadas, por lo que es difícil conocer la situación real de la infección en la actualidad. En 2014 se estimó una prevalencia estimada de anticuerpos frente al VHC en España del 1,7%7, sin existir información sobre la confirmación virémica en muchos de los estudios analizados. La introducción de los fármacos antivirales de acción directa (AAD) frente al VHC ha abierto la posibilidad de la erradicación de la infección, por lo que existe un interés creciente en disponer de estimaciones actualizadas del porcentaje de infección en nuestro medio. Además, este mismo hecho probablemente esté cambiando la realidad de la infección por VHC de una forma dinámica8,9. Recientemente se han publicado los resultados de la encuesta de seroprevalencia de hepatitis C, llevada a cabo por el Plan Estratégico para el Abordaje de la hepatitis C en el Sistema Nacional de Salud (PEAHC), que muestra una prevalencia de anticuerpos frente al VHC de 0,85%, con una prevalencia de infección activa del 0,22%, en población entre 20 y 80 años10. Estos datos globales pueden ser muy diferentes según cada área sanitaria básica en España, por lo que conocer estas peculiaridades es esencial para plantear planes de microeliminación y poder monitorizar su evolución8,9.
El objetivo de este estudio es estimar la prevalencia de la infección por VHC en la población general de una determinada área sanitaria a través de la intervención en Atención Primaria mediante un cuestionario de evaluación de riesgo, diferenciando entre nuevos diagnósticos e infecciones previamente diagnosticadas pero con pacientes no vinculados. Además se analiza el porcentaje de infecciones activas. El objetivo final es sentar una base para alcanzar y monitorizar un programa de microeliminación de la infección por VHC en nuestra área.
MétodosSubanálisis del estudio DRIVE03 (NCT03145753), que se trata de un estudio prospectivo, con aleatorización agrupada 1:1 realizado en 4 centros de salud (García Noblejas, Mar Báltico, Canal de Panamá y Aquitania) pertenecientes al área sanitaria del Hospital Ramón y Cajal, en Madrid. Se incluyeron personas entre 18 y 70 años que acudían a los centros de salud entre noviembre de 2016 y marzo de 2017. A todos los participantes se les realizó un cuestionario11 de evaluación del riesgo de exposición y condiciones indicadoras (RE y CI) de infección por VIH y VHC, previamente validado para VIH, y a los individuos con al menos una respuesta afirmativa se les realizó un test rápido de VIH o VHC, según correspondiera. La tabla 1 muestra un resumen de las preguntas seleccionadas del cuestionario para la evaluación del riesgo de infección por VHC, que se puede consultar completo en el anexo (ver material adicional). Además, se realizó el test de VHC a todos los individuos mayores de 50 años, independientemente del resultado del cuestionario. Se utilizó la prueba anti-VHC WB/S/P (TürkLab Laboratories, Izmir, Turquía) en gota de sangre, que permite obtener resultados en aproximadamente 15 min12. Los test fueron realizados por personal de enfermería que formaba parte del equipo de investigación. Todas las personas con una prueba de VHC positiva fueron informadas y asesoradas sobre sus resultados, y el personal de coordinación del Servicio de Enfermedades Infecciosas del Hospital Ramón y Cajal fue notificado de inmediato, para realizar la confirmación de la infección en las siguientes 48 h en todos los casos en los que fuera posible para el paciente. En todos los pacientes con resultado positivo se realizó una prueba de confirmación mediante enzimoinmunoensayo de micropartículas quimioluminiscente (CMIA, Architect, Abbott) y se determinó la viremia (antígeno core del VHC, Abbott o ARN del VHC, sistema cobas® 6800, Roche) en la misma muestra mediante diagnóstico en un solo paso13. Además, se comprobó la existencia de resultados positivos previos para VHC mediante la realización de una anamnesis detallada y la revisión de la Historia Clínica Electrónica y los registros del laboratorio de Microbiología del Hospital Ramón y Cajal y la base de datos de la plataforma HORUS de la Comunidad de Madrid. Todos los pacientes que acudieron a la cita en el Hospital Ramón y Cajal recibieron tratamiento con AAD, y se recogieron sus datos de respuesta virológica 12 semanas después de finalizar el tratamiento. Desde el inicio de la terapia con antivirales de acción directa hasta la fecha de inicio del estudio, en nuestro centro se habían iniciado un total de 1.293 tratamientos para la infección por VHC.
Preguntas utilizadas para evaluar el riesgo de exposición y las condiciones indicadoras de infección por VHC
| Riesgo de exposición |
| ¿Ha tenido/tiene pareja con infección por VIH o VHC? |
| ¿Ha tenido/tiene relaciones homosexuales? |
| ¿Le han transfundido alguna vez antes de 1990? |
| ¿Ha utilizado/utiliza drogas ilícitas por vía intravenosa? |
| ¿Cree que ha podido tener algún riesgo para adquirir la infección por VIH/VHC por exposición? |
| Condiciones indicadoras. Señale si ha tenido o tiene: |
| Infección de transmisión sexual (sífilis, gonorrea, Chlamydia, uretritis, herpes, linfogranuloma) |
| Linfoma |
| Cáncer o displasia anal/cervical |
| Hepatitis B/C o enfermedad hepática no explicada |
| Trombocitopenia/linfopenia inexplicada |
| Tuberculosis |
- -
Infección por VHC: paciente con resultado de anticuerpos anti-VHC positivos por CMIA.
- -
Infección por VHC conocida: paciente con infección por VHC en el que constaba algún resultado previo positivo para el VHC documentado en los registros de Microbiología o en la historia clínica, o el paciente lo refería entre sus antecedentes médicos. Dentro de ellos, se distinguen a los pacientes con infección tratada y curada, y aquellos que no eran conscientes del diagnóstico o no se encontraban vinculados a los cuidados sanitarios.
- -
Nuevos diagnósticos de infección por VHC: pacientes con infección por el VHC confirmada durante el estudio DRIVE03, en los que no se encontró constancia de un resultado previo positivo.
- -
Infección activa: pacientes con presencia de replicación viral en el momento de la evaluación en el estudio.
- -
Estimación de la infección oculta por VHC: número estimado de personas con infección por VHC activa en nuestra área de salud, aplicando el porcentaje de infección activa encontrado en nuestra cohorte sobre el total de población del área.
Los datos se incorporaron a una base de datos en Excel-2011 (Microsoft®) mediante un software de lectura de cuestionarios automatizado de desarrollo propio, y se realizó el análisis estadístico utilizando el paquete Stata 15.1 (Stata Corp-LP, College Station, TX, EE. UU.). Para el análisis descriptivo se utilizaron frecuencias, media con desviación estándar o medianas con rango intercuartil (RI). Se calcularon los porcentajes de test positivos en cada subgrupo de población (general, infección por VHC conocida, nuevos diagnósticos) con el intervalo de confianza de 95%. Se utilizó regresión logística para analizar las diferencias en variables independientes entre nuevos diagnósticos y pacientes con diagnóstico previo no vinculados. El porcentaje de infección por VHC en cada grupo de población se ha calculado utilizando como denominador el total de participantes incluidos en el estudio, considerando como casos negativos a aquellos individuos que no presentaron ninguna respuesta afirmativa en el cuestionario y por tanto no se les realizó la prueba rápida.
ResultadosUn total de 7.991 participantes fueron incluidos en el estudio y realizaron el cuestionario de RE y CI. El 65,9% fueron mujeres, la mediana de edad fue de 43 años (RI 33-53). La mayoría de los participantes (40,6%) tenían estudios medios, seguidos de un 33,3% universitarios y 25,1% básicos. El lugar más frecuente de origen fue España (75,5%), seguido de Latinoamérica (15,4%). En los dos años previos al momento de la entrada en el estudio, un 87% habían realizado al menos una visita al médico de Atención Primaria, un 59% a algún otro especialista hospitalario, un 42% a Urgencias y un 20% al médico del trabajo.
Del total de 7.991 participantes, se obtuvieron 2.894 (36,2%) cuestionarios positivos para VHC, de los cuales 2.261 (28,3%) fueron por riesgo de exposición, 1.052 (13,2%) por condiciones indicadoras, y 419 (5,2%) por ambas. A todos ellos se les realizó el test rápido de VHC excepto a 94 (3%), principalmente por negativa por parte del participante. Además, 2.557 participantes presentaban una edad superior a 50 años por lo que también se les realizó el test. Del total de personas mayores de 50 años, 571 (22,3%) presentaron cuestionario positivo para riesgo de exposición y 443 (17,3%) para condiciones indicadoras, con un total de 854 (33,4%) cuestionarios positivos en total.
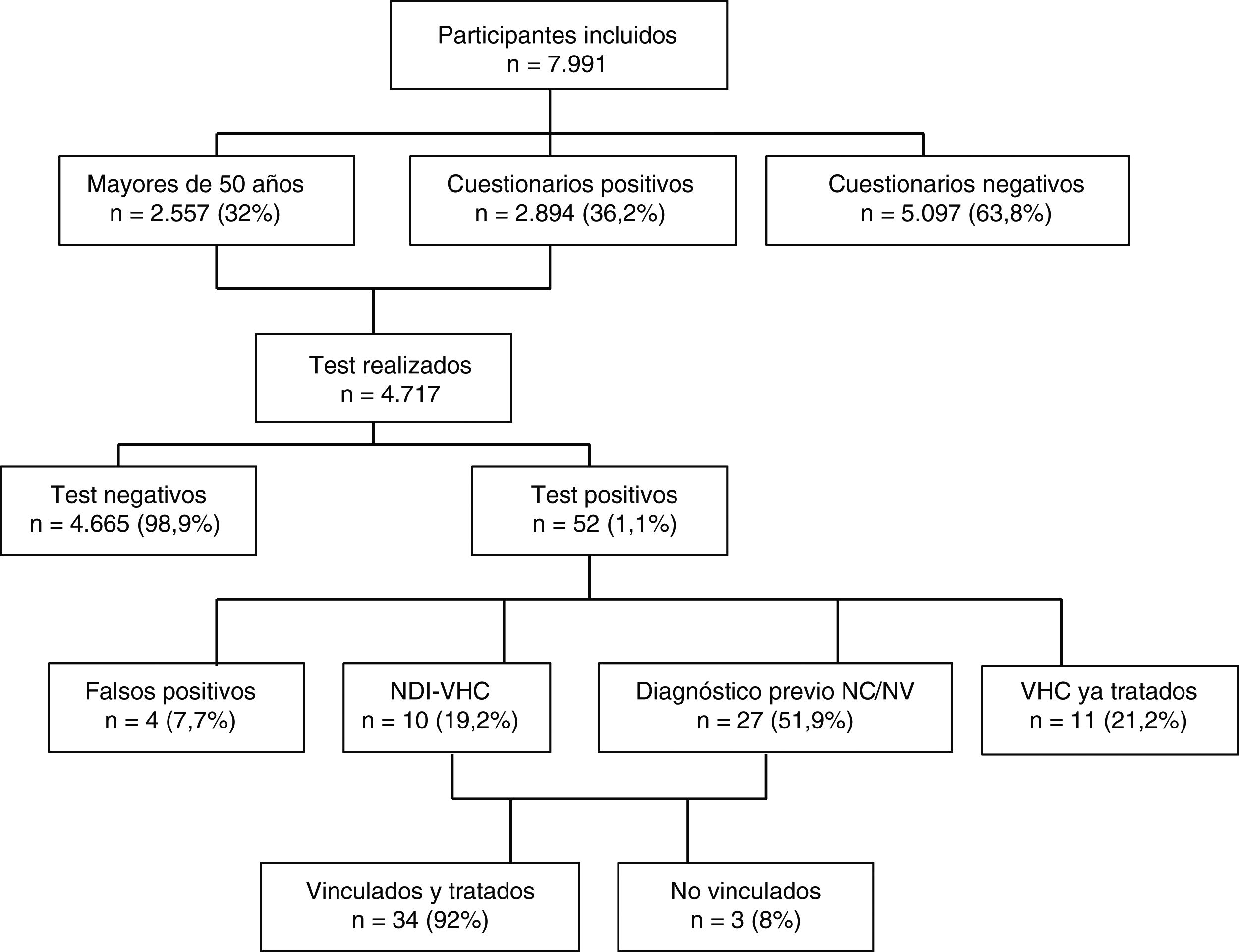
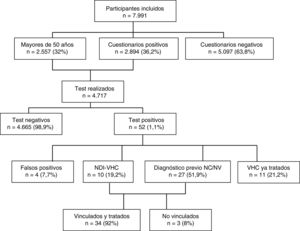
Del total de 4.717 test realizados, 52 (1,1%) resultaron positivos. De ellos 4 (7,7%) resultaron falsos positivos (2 de los cuales se trataban de dudosos positivos) tras realizar las pruebas de CMIA en el hospital, 11 (21,2%) se trataban de personas con infección por VHC conocida y previamente tratada, 10 (19,2%) fueron nuevos diagnósticos de infección por VHC con infección activa y 27 (51,9%) fueron individuos con alguna determinación previa positiva para VHC, pero no eran conscientes de ello o no se encontraban vinculados a los cuidados sanitarios, permaneciendo su infección activa en 26 casos (96%) y habiendo presentado aclaramiento espontáneo uno (4%). La figura 1 muestra el algoritmo para la infección por VHC con el flujo de pacientes en el estudio DRIVE03.
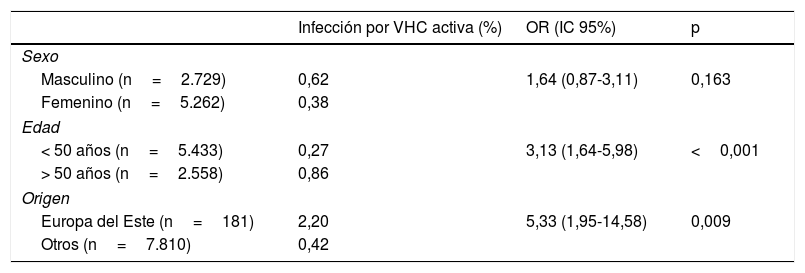
Del total de pacientes con infección por VHC activa, el 53% fueron mujeres, con mediana de edad de 51 años (RI 49-55). El 85% fueron de nacionalidad española, 9% procedentes de Europa del Este y 3% de Latinoamérica. La prevalencia de infección activa fue mayor en hombres, en mayores de 50 años y en personas procedentes de Europa del Este (tabla 2). Del total, 34 (92%) fueron correctamente vinculados. El genotipo de VHC más frecuente fue el 1B (38%), seguido del 1A (27%) y 3A (15%). Los antivirales de acción directa más utilizados fueron Ledipasvir/Sofosbuvir (39%), Grazoprevir/Elbasvir (26%) y Sofosbuvir/Velpatasvir (21%). En todos los casos se obtuvo respuesta viral sostenida a la semana 12.
Factores asociados a la presencia de infección por VHC activa
| Infección por VHC activa (%) | OR (IC 95%) | p | |
|---|---|---|---|
| Sexo | |||
| Masculino (n=2.729) | 0,62 | 1,64 (0,87-3,11) | 0,163 |
| Femenino (n=5.262) | 0,38 | ||
| Edad | |||
| < 50 años (n=5.433) | 0,27 | 3,13 (1,64-5,98) | <0,001 |
| > 50 años (n=2.558) | 0,86 | ||
| Origen | |||
| Europa del Este (n=181) | 2,20 | 5,33 (1,95-14,58) | 0,009 |
| Otros (n=7.810) | 0,42 | ||
IC: intervalo de confianza; OR: odds ratio.
No se encontraron diferencias significativas en la edad (p=0,589), sexo (p=0,697), grado de fibrosis (p=0,390) ni en el score MELD (p=0,193) entre nuevos diagnósticos y pacientes con diagnóstico previo no vinculados.
La tabla 3 muestra los datos de proporción de infección por VHC sobre la población total incluida en el estudio, con subanálisis según diferentes grupos de población, diferenciando entre nuevos diagnósticos de infección por VHC, y pacientes que estaban previamente diagnosticados pero no eran conscientes o no estaban vinculados a los cuidados. En todos los grupos se observó una mayor proporción de infección por VHC en población masculina, con una prevalencia global de 1,1%, siendo más frecuente entre 51-60 años (1,7%) y en el grupo de nivel educativo bajo (1,2%).
Estimación de la proporción y la tasa diagnóstica de VHC por grupos
| Anti VHC+ | |||||||
|---|---|---|---|---|---|---|---|
| Población total(n=7.991) | Porcentaje global (n = 52) | No conscientes o no vinculados (n=27) | Nuevos diagnósticos de VHC (n=10) | ||||
| N (%) | N | Tasa ‰ (95%IC) | N | Tasa ‰ (95%IC) | N | Tasa ‰ (95%IC) | |
| Sexo | |||||||
| Masculino | 2.729 (34) | 30 | 10,99 (7,06-14,93) | 12 | 4,40 (1,91-6,89) | 5 | 1,83 (0,23-3,44) |
| Femenino | 5.262 (66) | 22 | 4,18 (2,43-5,93) | 15 | 2,85 (1,41-4,29) | 5 | 0,95 (0,12-1,78) |
| Edad, años | |||||||
| 18-30 | 1.652 (21) | 1 | 0,61 (0-1,79) | 0 | - | 0 | - |
| 31-40 | 1.814 (23) | 4 | 2,21 (0,04-4,37) | 2 | 1,10 (0-2,63) | 1 | 0,55 (0-1,63) |
| 41-50 | 1.967 (25) | 15 | 7,63 (3,77-11,5) | 9 | 4,58 (1,59-7,56) | 3 | 1,53 (0-3,25) |
| 51-60 | 1.729 (21) | 29 | 16,8 (10,7-22,9) | 16 | 9,25 (4,72-13,79) | 6 | 3,47 (0,69-6,25) |
| > 61 | 829 (10) | 3 | 3,62 (0-7,71) | 0 | - | 0 | - |
| Origen | |||||||
| España | 6.032 (78) | 46 | 7,63 (5,42-9,83) | 24 | 3,98 (2,39-5,57) | 8 | 1,33 (0,41-2,25) |
| Europa del Este | 181 (2) | 4 | 5,52 (0-16,35) | 2 | 11,05 (0-26,36) | 2 | 11,05 (0-26,36) |
| Latinoamérica | 1.228 (15) | 1 | 0,81 (0-2,41) | 1 | 0,81 (0-2,41) | 0 | - |
| África | 86 (1) | 1 | 11,63 (0-34,42) | 0 | - | 0 | - |
| Nivel educativo | |||||||
| Básico | 2.086 (26) | 26 | 12,46 (7,67-17,26) | 15 | 7,19 (3,55-10,83) | 4 | 1,92 (0,04-3,80) |
| Medio | 3.243 (41) | 21 | 6,48 (3,71-9,25) | 10 | 3,08 (1,17-4,99) | 4 | 1,23 (0,02-2,44) |
| Alto | 2.662 (33) | 5 | 1,88 (0,23-3,52) | 2 | 0,75 (0-1,79) | 2 | 0,75 (0-1,79) |
| Total | 7.991 (100) | 52 | 6,51 (4,74-8,28) | 27 | 3,38 (2,10-4,65) | 10 | 1,25 (0,48-2,03) |
Aplicando el porcentaje de infección activa encontrado sobre el total de 373.180 personas del grupo de edad establecido pertenecientes al área de salud, encontramos un número estimado de 1.717 individuos con infección activa no diagnosticada en el área perteneciente al Hospital Ramón y Cajal.
DiscusiónNuestros resultados estiman una proporción de anti-VHC de 0,65% en la población general cribada, quedando en 0,46% de infecciones activas, una vez excluidos los pacientes que ya habían recibido tratamiento para la hepatitis C. El 51,9% de las personas con test rápido positivo tenían un diagnóstico previo conocido, pero no habían recibido tratamiento por no ser conscientes de ello o no encontrarse vinculados al sistema sanitario, y el 19,2% tuvo un resultado positivo por primera vez, resultando en una prevalencia de 0,34% y 0,13%, respectivamente. Estos datos reflejan que la proporción de infecciones no diagnosticadas es baja, aunque el porcentaje de nuevos diagnósticos y de infecciones activas es superior a la reportada en estudios recientes en nuestro medio10,14. Estudios realizados en nuestro país en la década de 1990 estimaban una prevalencia de anti-VHC en España entre el 1,6 y 2,6%, en ocasiones basándose en un único análisis sin existir test de confirmación, por lo que dentro del porcentaje reportado podrían existir resultados falsos positivos, y no diferenciaban entre infecciones activas y no activas15. Una vez descendida la prevalencia de uso de drogas inyectadas y establecidos los controles sanitarios para prevenir la transmisión nosocomial del VHC, es de esperar que la prevalencia de infección por VHC haya descendido, al superar los fallecimientos de personas con VHC a las nuevas infecciones16. En España se han realizado durante los últimos años varias encuestas de seroprevalencia, con resultados dispares. En la Comunidad de Madrid durante los años 2008-2009 se estimó una prevalencia de anti-VHC en la población de 16-80 años del 1,8% (sin existir prueba de confirmación)17. Otras encuestas realizadas en diferentes Comunidades Autónomas han reportado cifras similares a las encontradas en nuestro estudio. En 2009 en el País Vasco se encontró una prevalencia del 0,7% en población menor de 60 años18, y en trabajadores de Madrid y Murcia se reportó una seroprevalencia de anti-VHC del 0,6% entre 2007 y 201019. Con respecto a la proporción de infecciones por VHC ya diagnosticadas, la encuesta del País Vasco encontró que en 3 de cada 4 casos positivos constaba el antecedente de infección por el VHC18, y un trabajo reciente en Navarra situó esta cifra en el 88% de los participantes con resultado positivo14. El recientemente publicado estudio de seroprevalencia en población general en España mostró una prevalencia de 0,85% de anticuerpos frente al VHC, existiendo tan solo un 0,22% de infecciones activas10. Todos estos datos en ocasiones discordantes, en especial los referidos a infecciones activas, reafirman la importancia de conocer la situación en cada área geográfica en la que se plantee implementar un plan de microeliminación de la infección por VHC, así como controlar su evolución8,9.
Al igual que en estudios previos10,14 encontramos una mayor proporción de varones entre el total de individuos con test rápido positivo (1,1% frente a 0,4% en mujeres). El grupo de población con mayor proporción de personas con resultado positivo es el que incluye personas de 51-60 años, coincidiendo con la cohorte de personas nacidas en la década de 1960, dato ya descrito en trabajos previos16 y puesto en relación con los mecanismos de transmisión descritos para España. Los jóvenes menores de 30 años muestran el porcentaje menor de todos los grupos de edad, si bien esta cifra puede cambiar en los próximos años debido al aumento de prácticas de riesgo entre la población joven, especialmente HSH20, que están cambiando la epidemiología de esta infección. Europa del Este se sitúa como el origen más frecuente de los pacientes con infección oculta, coincidiendo con la mayor prevalencia descrita en esta zona1 y probablemente el menor acceso al tratamiento tanto en sus lugares de origen como probablemente en nuestro país. La proporción de individuos anti-VHC positivos aumenta a medida que disminuye el nivel educativo de la población cribada, hallazgo también descrito en estudios en otros medios21, y que hace reflexionar sobre la importancia de la educación de la población, especialmente en el ámbito de las ITS, para evitar la transmisión de estas infecciones. Estos grupos de población con mayor prevalencia de infección deberían además ser objeto de planes de microeliminación específicos, que incluyeran planes de cribado y vinculación a los cuidados.
En nuestra cohorte no se han observado diferencias significativas entre las características demográficas y clínicas de personas nuevamente diagnosticadas y pacientes con diagnóstico previo, debido a que todos los diagnósticos se trataban de infecciones crónicas. Hay que señalar que los cambios epidemiológicos ya comentados, junto con el aumento durante los últimos años de nuevas infecciones en determinados grupos de población20, hacen esencial potenciar las estrategias que faciliten el diagnóstico precoz de estas infecciones y así evitar la progresión del daño hepático. El 95% de los pacientes diagnosticados en nuestro estudio fueron correctamente vinculados al sistema sanitario y retenidos en los cuidados. Una parte esencial de los programas de cribado en Atención Primaria es la vinculación adecuada de los pacientes, para que se beneficien precozmente del tratamiento específico y se mantenga un adecuado seguimiento, lo que se conoce como «linkage to care». Los servicios que realizan el cribado deben disponer de una vía de comunicación bien definida para la derivación de los pacientes de forma rápida y efectiva, con objetivo de aumentar la retención en los cuidados22. La vinculación a los cuidados puede ser subóptima especialmente en algunos grupos vulnerables, como las personas con escasos recursos o usuarios de drogas inyectadas. Existe alguna evidencia que muestra que las intervenciones educativas para el personal de Atención Primaria pueden resultar en una mejor vinculación de los pacientes a los cuidados sanitarios23,24.
El estudio presenta algunas limitaciones. La ausencia de validación previa del cuestionario para el cribado de infección por VHC hace posible la pérdida de algún diagnóstico entre la población no cribada, si bien asumimos una alta sensibilidad y valor predictivo negativo debido a las características abiertas de las preguntas, tal y como se confirmó en el caso del VIH11.
En conclusión, estos datos muestran una prevalencia de anticuerpos frente al VHC similar a la descrita en estudios recientes en nuestro medio, pero con una prevalencia de infecciones activas mayor a la descrita recientemente a nivel nacional10, y con mayor porcentaje de pacientes nuevamente diagnosticados que los publicados en trabajos recientes en otras áreas14. Estas diferencias justifican la necesidad de realizar evaluaciones locales de la prevalencia de infección por VHC en cada una de las áreas de salud donde se plantee implementar y monitorizar un programa de microeliminación. Si bien estos porcentajes de infección son menores a los descritos en series anteriores al desarrollo de los AAD, debemos continuar alerta para realizar el cribado del VHC en Atención Primaria, especialmente en aquellos grupos de población con mayor prevalencia de infección (hombres, mayores de 50 años, nivel socioeconómico bajo), aunque es importante además tener en cuenta los cambios en la situación epidemiológica que están ocurriendo en España durante los últimos años.
FinanciaciónEste estudio ha sido financiado con 3 becas competitivas: Instituto de Salud Carlos III (Plan Estatal de I+D+i 2013-2016), becas PI12-00995, PI16 / 00551, y Ministerio de Sanidad, Seguridad Social e Igualdad, código de proyecto: EC11-144, cofinanciado por el Fondo Regional de Desarrollo Europeo «A way to achieve Europe» (ERDF), parcialmente financiado por el proyecto RD16 / 0025/0001 como parte del Plan Nacional de I+D+i y cofinanciado por ISCIII- Subdirección General de Evaluación y Fondo Europeo de Desarrollo Regional (FEDER).
Conflicto de interesesJavier Martínez-Sanz ha recibido becas de viaje de ViiV Healthcare, Gilead Sciences y Janssen Cilag. Santiago Moreno ha participado en conferencias y ha recibido becas de investigación de Abbott, Boehringer & Ingelheim, Bristol-Myers Squibb, Galaad, Glaxo Smith Kline, Janssen Cilag, Merck Sharp & Dohme, Pfizer, Roche y Schering Plough. María Jesús Pérez Elías ha realizado trabajos de consultoría para Abbvie, Boehringer Ingelheim, ViiV Healthcare, Gilead Sciences y Janssen Cilag; ha recibido becas para investigación clínica de ViiV Healthcare, Gilead Sciences, Janssen y Merck-Sharp & Dome, y ha recibido compensación económica como ponente en eventos financiados por Gilead Sciences, Janssen Cilag, Merck-Sharp & Dome y ViiV Healthcare. Los demás autores declaran no tener ningún conflicto de intereses.
Al Grupo de estudio DRIVE03: C. Gómez-Ayerbe, M. Sánchez Conde, E. Loza, S. del Campo Terrón, A. Sánchez, A. Moreno, M. Rodríguez (Hospital Universitario Ramón y Cajal, Madrid); A. Cano, A. Fernández, M.E. Calonge, C. Santos (C.S. García Noblejas, Madrid); S. Ares (C.S. Mar Báltico, Madrid); C. Labrador (Hospital de la Princesa, Madrid); P. González (SUMMA, Madrid); L. Polo (Hospital General Universitario Gregorio Marañón, Madrid); Y. de la Fuente (C.S. Aquitania, Madrid).