Las infecciones por enterovirus (EV) constituyen las infecciones más frecuentes en el periodo neonatal y provocan en muchos casos el ingreso hospitalario del recién nacido (RN).
El objetivo del estudio es conocer la incidencia de los EV en la etiología de las meningitis neonatales y definir qué características clínicas presentan los RN con meningitis por EV.
Material y métodoEstudio observacional retrospectivo de cohortes. Incluye 91 RN con meningitis y edad gestacional mayor de 34 semanas (SG) atendidos en nuestro centro durante un periodo de 16 años.
ResultadosEl porcentaje de RN con meningitis por EV fue superior al de RN con meningitis bacteriana y representó el 78% (n=71). La mitad de los RN con infección por EV presentó antecedentes de ambiente epidémico entre sus cuidadores. La fiebre apareció en el 96% de los casos como signo clínico y, en general, las alteraciones del sensorio representaron las principales alteraciones neurológicas. Un 71,4% de los pacientes con infección por EV recibió antibióticos.
La detección de EV en muestras de LCR mostró una elevada sensibilidad para el diagnóstico de meningitis por EV. Los tipos de EV más frecuentemente implicados fueron echovirus 11, coxsackievirus B5, echovirus 18, 25 y 7.
ConclusionesLos resultados de esta serie muestran que la infección por enterovirus es una causa común de meningitis neonatal. Estos datos subrayan la importancia de realizar pruebas de detección rápida de EV en lactantes con sospecha de meningitis. Ello permite obtener un diagnóstico precoz y reducir el tratamiento antibiótico, el tiempo de hospitalización y los costes relacionados.
Enterovirus (EV) infections are the most frequent infections in the neonatal period and in many cases lead to hospital admission of the newborn (NB).
The aim of this study was to determine the incidence of EV in the etiology of neonatal meningitis and to define the clinical characteristics of newborns with EV meningitis.
Material and methodRetrospective observational cohort study. Including 91 NBs with meningitis and gestational age greater than 34 weeks gestational age (GA) attended in our center over a period of 16 years.
ResultsThe percentage of NBs with EV meningitis was higher than that of NBs with bacterial meningitis (BM) and accounted for 78% (n=71). Half of the NBs with EV infection had a history of epidemic environment among their caregivers. Fever was present in 96% of cases as a clinical sign and, in general, sensory disturbances represented the main neurological alterations. Antibiotics (ATB) were given to 71.4% of patients with EV infection.
Detection of EV in CSF samples showed a high sensitivity for the diagnosis of EV meningitis. The most frequently implicated EV types were echovirus 11, coxsackievirus B5, echovirus 18, 25 and 7.
ConclusionsThe results of this series show that enterovirus infection is a common cause of neonatal meningitis. These data underline the importance of rapid EV testing of infants with suspected meningitis. This allows early diagnosis and reduces antibiotic treatment, hospitalization time and related costs.
Las infecciones neonatales constituyen una de las enfermedades más prevalentes y representan, junto con la prematuridad y la asfixia neonatal, las principales causas de mortalidad en recién nacidos1. La incidencia de la meningitis bacteriana (MB) no ha variado en los últimos años y se estima entre 0,16 y 0,45 casos/1.000 recién nacidos2. Además de las bacterias como patógenos de la enfermedad diversos estudios han demostrado la importancia de los virus como responsables de meningitis neonatal, aunque su incidencia real se desconoce3,4.
Las infecciones por enterovirus (EV) son frecuentes en la población general y se estima que son responsables de 1.000 millones de infecciones en humanos al año3-6. Los recién nacidos son especialmente vulnerables a la infección por estos virus, estimando una incidencia de 7 casos por cada 1.000 recién nacidos (RN)5,6. Aunque estos virus pueden causar una amplia gama de manifestaciones clínicas, solo el 21% de los neonatos infectados presentan síntomas clínicos5. De los RN que desarrollan clínica aproximadamente el 26% desarrolla cuadros febriles inespecíficos, un 47% meningitis aséptica y el 30% restante manifiesta formas graves con afectación hepática, miocárdica y encefálica6,7.
La meningitis es la manifestación clínica más común de la infección por EV durante el periodo neonatal. La meningitis por EV no puede diferenciarse de la MB solo por los síntomas clínicos. Por este motivo la mayoría de los recién nacidos con meningitis por EV son ingresados en el hospital y tratados con terapia antibiótica de amplio espectro hasta que se dispone de más datos que excluyan un origen bacteriano. La evolución de la enfermedad meníngea suele ser benigna, con baja mortalidad y escasas secuelas a largo plazo. El diagnóstico se establece tras descartar un origen bacteriano y confirmar la presencia de EV en el líquido cefalorraquídeo (LCR). Si se no se detecta EV en el LCR el diagnóstico puede establecerse en función de la presencia de pleocitosis y la detección del virus en otra muestra biológica6,8.
El objetivo de este estudio es conocer la incidencia de los enterovirus como patógenos en la meningitis neonatal y las características epidemiológicas, clínicas y de evolución de los RN con esta enfermedad.
Material y métodosEstudio observacional retrospectivo realizado en una población de RN ingresados en nuestro centro de nivel 3B, en el periodo de tiempo que abarca desde enero de 2002 hasta diciembre de 2017.
PacientesComo criterios de inclusión se admitieron en el estudio los RN con edad gestacional superior a 34 semanas y con edad posnatal inferior a 30 días de vida.
La definición de meningitis incluyó aquellos RN que mostraron clínica neurológica y alteraciones en el LCR definitorios de inflamación meníngea como pleocitosis, aumento de proteínas y/o niveles bajos de glucosa, junto con el aislamiento o detección del EV mediante cultivo vírico o reacción de cadena de la polimerasa (RT-PCR) en el LCR o en otra muestra biológica cuando coexisten alteraciones en el LCR.
Entre los síntomas de afectación neurológica se incluyeron la irritabilidad, la dificultad para despertarse o mantener la vigilia, el rechazo del alimento, el aumento o disminución de los reflejos propios del RN, las alteraciones en el tono muscular en forma de hipotonía o hipertonía, signos de afectación neurológica focal y las convulsiones.
En los RN analizados se examinó la enfermedad materna durante la gestación como la diabetes, la enfermedad hipertensiva del embarazo, la pérdida de bienestar fetal o la asfixia perinatal y la corioamnionitis materna. También se analizó la necesidad de tratamiento antibiótico materno en el momento del parto.
Se analizó si hubo cuadro clínico compatible con proceso infeccioso, o lo que es lo mismo, ambiente epidémico en las madres y otros miembros de la familia en el momento del ingreso del RN. Este dato se obtuvo mediante la anamnesis de la historia clínica a los padres.
DiagnósticoPara el aislamiento de EV en muestras de aspirado nasofaríngeo y heces se utilizó el cultivo celular en 3 líneas celulares (MRC-5, A549, HEp2 y RD) según el manual de laboratorio de poliomielitis de la OMS9. Para la detección de EV en el LCR se realizó un ensayo de RT-PCR (Cepheid®Xpert EV). Todos los EV aislados en el cultivo y todos los detectados en el LCR de los que disponíamos de muestra original fueron caracterizados.
El genotipado de los EV se realizó mediante técnicas de seroneutralización y de secuenciación. Las primeras se aplicaron en los pacientes que presentaron la infección antes de 2009, mientras que las técnicas de secuenciación se realizaron en los casos posteriores a esta fecha. La técnica de seroneutralización se obtiene utilizando mezclas de anticuerpos monoclonales específicos para diferentes tipos de EV conocidos junto a un conjugado que detecta la unión de estos anticuerpos con el antígeno vírico. La técnica de secuenciación se realiza a partir de la amplificación de la región 3’ del gen VP1 de la cápside del EV, utilizando técnicas de PCR convencionales anidadas en RT específicas para las diferentes especies de EV con posterior secuenciación y análisis BLAST de las secuencias obtenidas.
Tratamiento estadísticoEl análisis de la normalidad de las variables se realizó mediante la prueba de Kolmogorov-Smirnov. En el análisis descriptivo se obtuvieron tablas a partir de los resultados, mostrando como indicadores de tendencia central y de dispersión la media y el intervalo de confianza del 95% en las variables cuantitativas y el número y los porcentajes para las variables cualitativas. En el análisis bivariante las comparaciones estadísticas se realizaron mediante el test «t» de Student de datos independientes para las variables cuantitativas, y la prueba de Chi-cuadrado o el test exacto de Fisher para las variables categóricas o cualitativas. Se consideró un error de tipo i del 5%, por tanto, alfa=0,05, aproximación bilateral.
Comité de ética e investigación clínicaEl estudio fue aprobado por el Comité de ética de investigación del Instituto de Investigación de Sant Pau, con código IIBSP-ENT-2020-152-21/084. Durante todo el proceso de investigación se respetaron los principios recogidos en la Declaración de Helsinki. El presente estudio no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
ResultadosSe analizaron 332RN que ingresaron en nuestro centro con el diagnóstico de sospecha de sepsis neonatal. Todos los RN mostraron alteraciones clínicas y parámetros de laboratorio sugestivos de síndrome de respuesta inflamatoria sistémica. En el 32,8% del total de RN valorados (n=109) no se identificó la etiología. En 108RN se obtuvo una bacteria como responsable de la infección y en 115 de los RN el origen de la infección fue un EV (34,6%).
De los casos estudiados 91RN presentaron meningitis en el momento de su ingreso y en el 78% de los casos (n=71) la etiología de la meningitis fue un EV. La incidencia de meningitis en los RN con infección demostrada fue del 40%. En nuestra serie los patógenos más frecuentes en la etiología de la meningitis neonatal fueron los EV y representaron el 78% del total de microorganismos detectados (71RN). A los EV les siguieron el S. agalactiae con 11 casos (12%) y Listeria monocytogenes con 4 casos (4,4%). Cabe mencionar que en ningún RN con meningitis por EV se aisló crecimiento bacteriano en el LCR y tampoco se detectó EV en los RN con MB.
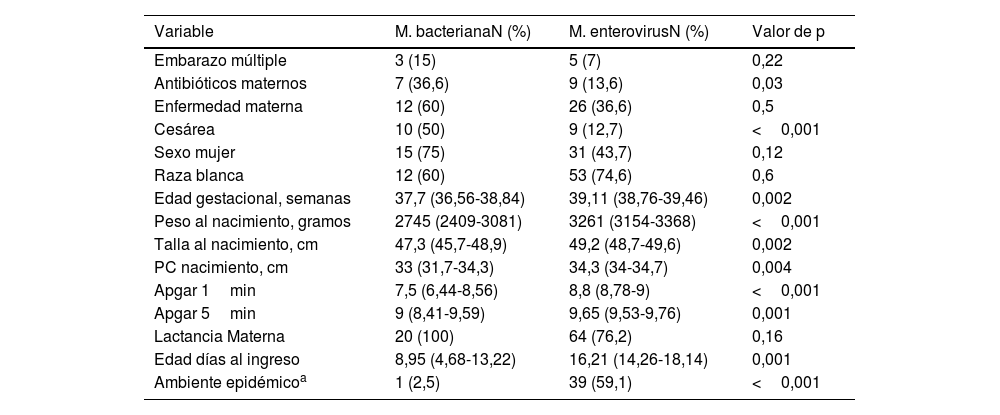
Las características perinatales de los RN con infección por EV se resumen en la tabla 1. Las madres de los RN con meningitis por EV presentaron poca enfermedad durante la gestación, y la mayoría de estos niños correspondían a neonatos a término sanos nacidos mediante parto vaginal.
Características perinatales de los RN afectos de meningitis bacteriana y por EV: número de RN y porcentaje para las variables cualitativas y media e intervalo de confianza para las variables cuantitativas
| Variable | M. bacterianaN (%) | M. enterovirusN (%) | Valor de p |
|---|---|---|---|
| Embarazo múltiple | 3 (15) | 5 (7) | 0,22 |
| Antibióticos maternos | 7 (36,6) | 9 (13,6) | 0,03 |
| Enfermedad materna | 12 (60) | 26 (36,6) | 0,5 |
| Cesárea | 10 (50) | 9 (12,7) | <0,001 |
| Sexo mujer | 15 (75) | 31 (43,7) | 0,12 |
| Raza blanca | 12 (60) | 53 (74,6) | 0,6 |
| Edad gestacional, semanas | 37,7 (36,56-38,84) | 39,11 (38,76-39,46) | 0,002 |
| Peso al nacimiento, gramos | 2745 (2409-3081) | 3261 (3154-3368) | <0,001 |
| Talla al nacimiento, cm | 47,3 (45,7-48,9) | 49,2 (48,7-49,6) | 0,002 |
| PC nacimiento, cm | 33 (31,7-34,3) | 34,3 (34-34,7) | 0,004 |
| Apgar 1min | 7,5 (6,44-8,56) | 8,8 (8,78-9) | <0,001 |
| Apgar 5min | 9 (8,41-9,59) | 9,65 (9,53-9,76) | 0,001 |
| Lactancia Materna | 20 (100) | 64 (76,2) | 0,16 |
| Edad días al ingreso | 8,95 (4,68-13,22) | 16,21 (14,26-18,14) | 0,001 |
| Ambiente epidémicoa | 1 (2,5) | 39 (59,1) | <0,001 |
Apgar 1minuto: escala de vitalidad del RN evaluada al minuto de vida; Apgar 5minutos: escala de vitalidad del RN evaluada a los 5 minutos de vida; PC; perímetro craneal.
Entre las características de los RN con meningitis por EV observamos que estos RN se infectaron a partir de la segunda semana de vida, entre los 8 y los 24 días, y el 76% de los niños recibieron lactancia materna. En el 59,1% de los casos encontramos antecedentes de proceso infeccioso leve entre los miembros de la familia del RN, principalmente la madre y los hermanos.
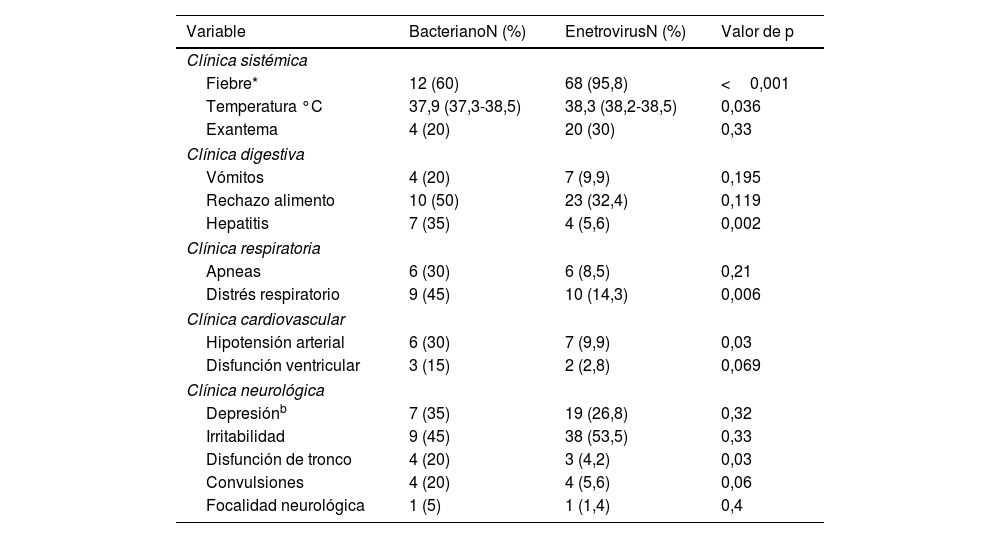
Si analizamos los síntomas y signos clínicos de la infección por EV encontramos que la fiebre se presentó en el 95,8% de los RN y el exantema cutáneo en un 20% (tabla 2), significativamente superior que en los RN con MB. Se valoró la asociación, durante la infección, de disfunción orgánica a nivel cardiovascular, respiratorio, digestivo y neurológico. Los signos clínicos de disfunción orgánica aparecieron con una incidencia significativamente superior en los RN con MB. El distrés respiratorio asociado al cuadro neurológico se presentó en 10RN con meningitis por EV (14,3%) y en el 45% de los RN con MB (p=0,006). La hipotensión arterial también fue superior en los RN con infección bacteriana (30%), mientras que esta solo la padeció el 9,9% de los RN con EV (p=0,03). El 32% de los RN con infección por EV presentó alteraciones digestivas en forma de vómitos y rechazo del alimento. Solo 4RN desarrollaron hepatitis (5,6%) significativamente inferior a los pacientes con MB que desarrollaron hepatitis en el 30% de los casos (p=0,002). Las alteraciones en el sensorio fue la sintomatología neurológica más frecuente. Sin embargo, las convulsiones y la disfunción del tronco encefálico fueron infrecuentes en los RN con meningitis por EV (5,6% y 1,4%, respectivamente).
Disfunción orgánica en los RN afectos de meningitis bacteriana y por EV: número de RN y porcentaje
| Variable | BacterianoN (%) | EnetrovirusN (%) | Valor de p |
|---|---|---|---|
| Clínica sistémica | |||
| Fiebre* | 12 (60) | 68 (95,8) | <0,001 |
| Temperatura °C | 37,9 (37,3-38,5) | 38,3 (38,2-38,5) | 0,036 |
| Exantema | 4 (20) | 20 (30) | 0,33 |
| Clínica digestiva | |||
| Vómitos | 4 (20) | 7 (9,9) | 0,195 |
| Rechazo alimento | 10 (50) | 23 (32,4) | 0,119 |
| Hepatitis | 7 (35) | 4 (5,6) | 0,002 |
| Clínica respiratoria | |||
| Apneas | 6 (30) | 6 (8,5) | 0,21 |
| Distrés respiratorio | 9 (45) | 10 (14,3) | 0,006 |
| Clínica cardiovascular | |||
| Hipotensión arterial | 6 (30) | 7 (9,9) | 0,03 |
| Disfunción ventricular | 3 (15) | 2 (2,8) | 0,069 |
| Clínica neurológica | |||
| Depresiónb | 7 (35) | 19 (26,8) | 0,32 |
| Irritabilidad | 9 (45) | 38 (53,5) | 0,33 |
| Disfunción de tronco | 4 (20) | 3 (4,2) | 0,03 |
| Convulsiones | 4 (20) | 4 (5,6) | 0,06 |
| Focalidad neurológica | 1 (5) | 1 (1,4) | 0,4 |
a Los rangos normales de temperatura axilar para un RN varían entre 36,5 y 37,5°C y se define fiebre cuando la temperatura corporal iguala o supera los 38°C.
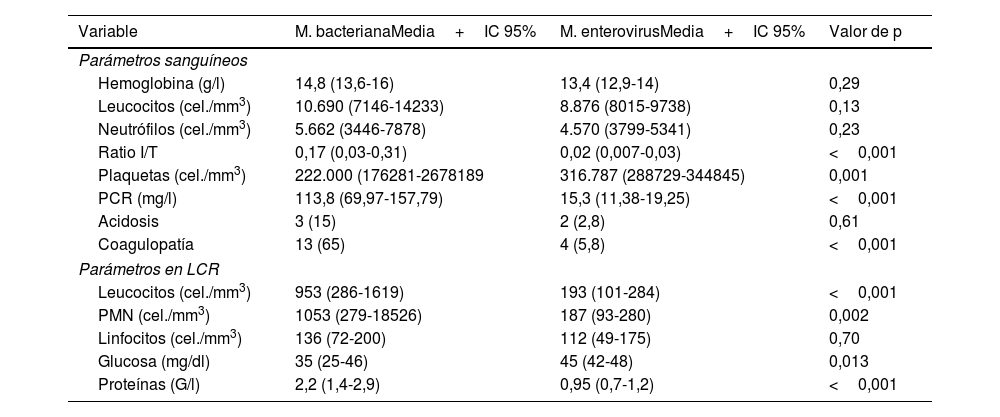
En general, los RN con meningitis por EV no mostraron alteraciones en los parámetros hematológicos, las transaminasas y la proteína C reactiva, al contrario de lo que sucede con los pacientes con MB, en los que son frecuentes la leucocitosis y el aumento de reactantes de fase aguda (tabla 3). En el análisis de las muestras de LCR se observó pleocitosis en el 50,8% de los casos (32RN) con un predominio de polimorfonucleares y concentraciones de proteínas y glucosa normales (tabla 3). Las diferencias en las características del LCR entre ambos grupos de RN con meningitis fueron notables y se observaron diferencias en el recuento de células y concentración de proteínas que fueron significativamente superiores en los RN con MB (p<0,001).
Parámetros sanguíneos y características de LCR de los RN afectos de meningitis bacteriana y por EV: número de RN y porcentaje para las variables cualitativas y media e intervalo de confianza para las variables cuantitativas
| Variable | M. bacterianaMedia+IC 95% | M. enterovirusMedia+IC 95% | Valor de p |
|---|---|---|---|
| Parámetros sanguíneos | |||
| Hemoglobina (g/l) | 14,8 (13,6-16) | 13,4 (12,9-14) | 0,29 |
| Leucocitos (cel./mm3) | 10.690 (7146-14233) | 8.876 (8015-9738) | 0,13 |
| Neutrófilos (cel./mm3) | 5.662 (3446-7878) | 4.570 (3799-5341) | 0,23 |
| Ratio I/T | 0,17 (0,03-0,31) | 0,02 (0,007-0,03) | <0,001 |
| Plaquetas (cel./mm3) | 222.000 (176281-2678189 | 316.787 (288729-344845) | 0,001 |
| PCR (mg/l) | 113,8 (69,97-157,79) | 15,3 (11,38-19,25) | <0,001 |
| Acidosis | 3 (15) | 2 (2,8) | 0,61 |
| Coagulopatía | 13 (65) | 4 (5,8) | <0,001 |
| Parámetros en LCR | |||
| Leucocitos (cel./mm3) | 953 (286-1619) | 193 (101-284) | <0,001 |
| PMN (cel./mm3) | 1053 (279-18526) | 187 (93-280) | 0,002 |
| Linfocitos (cel./mm3) | 136 (72-200) | 112 (49-175) | 0,70 |
| Glucosa (mg/dl) | 35 (25-46) | 45 (42-48) | 0,013 |
| Proteínas (G/l) | 2,2 (1,4-2,9) | 0,95 (0,7-1,2) | <0,001 |
Parámetros hematológicos y valores de normalidad en el RN. Hemoglobina (Hb) 13-15g/l; los leucocitos varían a lo largo del primer mes desde 5.000 cel./mm3 como límite inferior hasta 30.000 durante los primeros 15 días de vida y 15.000cel./mm3 a partir de la segunda semana. Neutrófilos valores normales entre 2.000 y 1.5000cel./mm3 en función de los días de vida. Plaquetas entre 150.000 y 400.000cel./mm3.
Parámetros en LCR y valores de normalidad en el RN. Leucocitos en el LCR hasta 20 cel./mm3 en las primeras 2 semanas de vida y posteriormente<10cel./mm3. Glucosa 50% del valor en sangre. Proteínas en LCR<1,5G/l en la primera semana de vida y<1G/l a partir de esta.
PMN: polimorfonucleares.
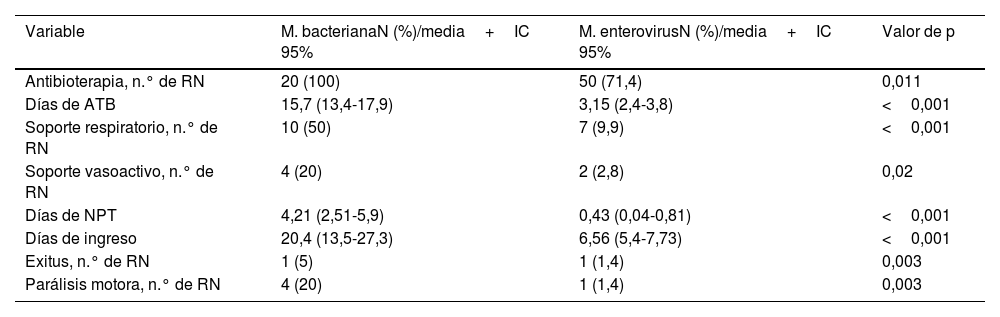
El 51,4% de los RN con meningitis por EV recibió tratamiento antibiótico en biterapia, con cefotaxima y ampicilina. La media de días de tratamiento antibiótico administrado fue de 3,1 días (IC 95%: 2,4-3,8). Un 9,9% de los RN precisó soporte respiratorio y un 2,8% fármacos inotrópicos por inestabilidad hemodinámica (tabla 4). La necesidad de soporte intensivo fue significativamente superior en los RN con MB (tabla 4).
Tratamiento recibido por los RN afectos de meningitis bacteriana y por EV: número de RN y porcentaje para las variables cualitativas y media e intervalo de confianza para las variables cuantitativas
| Variable | M. bacterianaN (%)/media+IC 95% | M. enterovirusN (%)/media+IC 95% | Valor de p |
|---|---|---|---|
| Antibioterapia, n.° de RN | 20 (100) | 50 (71,4) | 0,011 |
| Días de ATB | 15,7 (13,4-17,9) | 3,15 (2,4-3,8) | <0,001 |
| Soporte respiratorio, n.° de RN | 10 (50) | 7 (9,9) | <0,001 |
| Soporte vasoactivo, n.° de RN | 4 (20) | 2 (2,8) | 0,02 |
| Días de NPT | 4,21 (2,51-5,9) | 0,43 (0,04-0,81) | <0,001 |
| Días de ingreso | 20,4 (13,5-27,3) | 6,56 (5,4-7,73) | <0,001 |
| Exitus, n.° de RN | 1 (5) | 1 (1,4) | 0,003 |
| Parálisis motora, n.° de RN | 4 (20) | 1 (1,4) | 0,003 |
ATB: antibioterapia; IGIV: inmunoglobulinas endovenosas; NPT: nutrición parenteral total.
Los RN con meningitis por EV estuvieron ingresados en el hospital una media de 6,56 días (IC 95%: 5,4-7,73), mientras que los RN con infección bacteriana permanecieron ingresados el triple de tiempo (20,4 días, p<0,001). Las formas graves aparecieron en 5RN con meningitis por EV (7%), aunque en estos la meningitis no fue la afectación principal. De los RN con enfermedad grave 3 casos desarrollaron hepatitis, un caso miocarditis y otro paciente presentó afectación hepática y miocárdica asociadas.
En nuestro estudio el 95,8% de los RN con meningitis por EV se recuperaron sin secuelas. Un RN murió y otro desarrolló un déficit motor permanente.
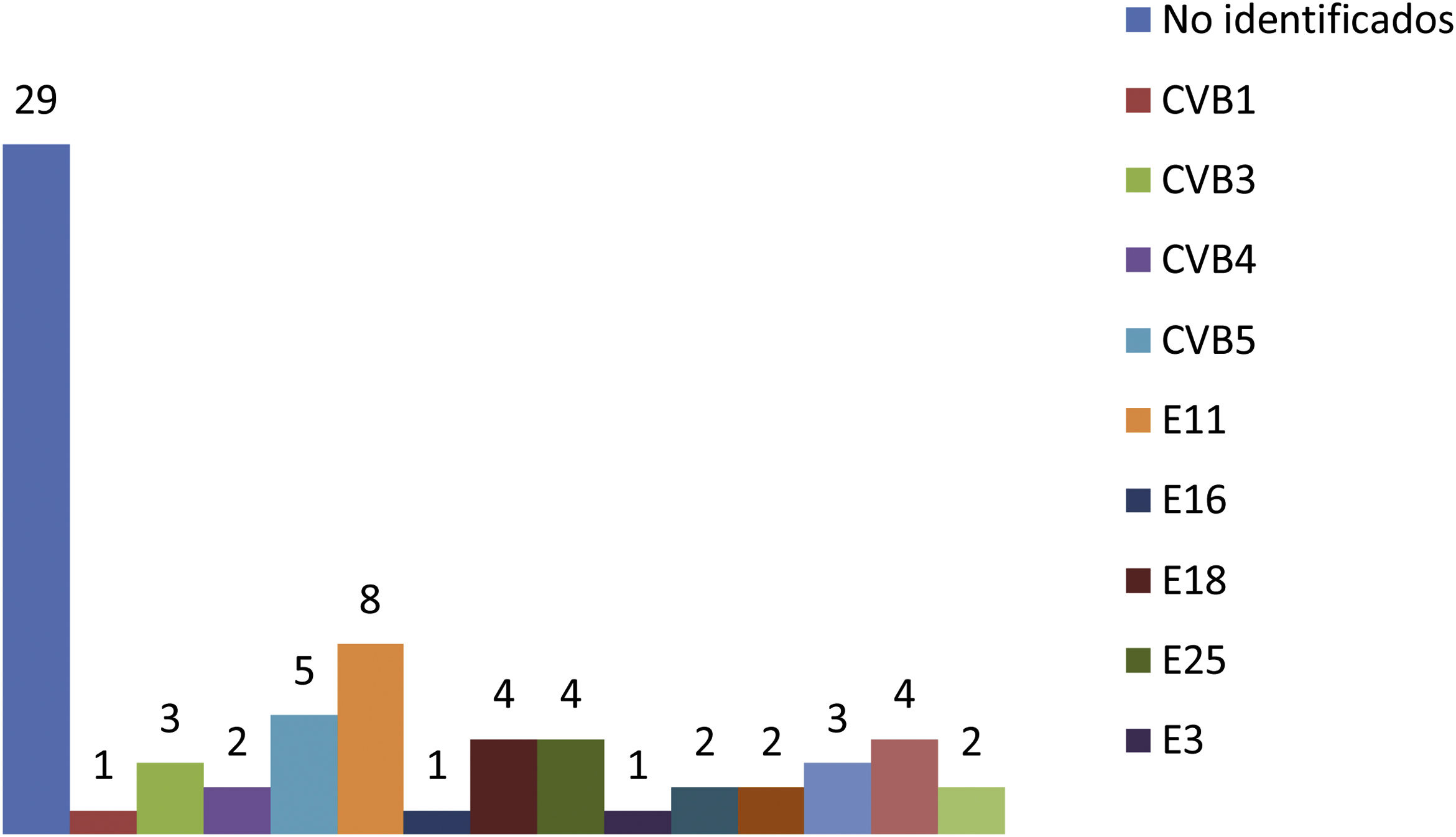
En el estudio microbiológico se utilizó el cultivo viral en las muestras de aspirado nasofaríngeo y heces para aislamiento de los EV, y en el LCR la detección de EV se realizó mediante RT-PCR. La muestra de ANF fue positiva en 52 pacientes (73%) y en 43 pacientes (61%) el virus creció en las heces. La detección de EV en el LCR mediante RT-PCR fue positiva en el 91% de los casos (n=64). Ningún paciente con meningitis por EV mostró una infección bacteriana asociada en sangre, LCR u orina. Se consiguió identificar los genotipos de EV de 42RN con meningitis por este patógeno. Los tipos de EV más frecuentemente aislados fueron echovirus (E) 11 en 8RN, coxsackievirus (CV) B5 en 5 y E 18, E 25 y E 7 con 4 pacientes cada genotipo (fig. 1).
Los genotipos aislados en los pacientes que desarrollaron formas más graves fueron echovirus 11 en el paciente con hepatitis necrosante grave, coxsackievirus B4 en el RN que desarrolló miocarditis grave y echovirus 30 en otro paciente con hepatitis sin coagulopatía. En otros 2 pacientes no se consiguió la caracterización de los EV.
DiscusiónLos RN son especialmente vulnerables a la infección por EV. La expresividad clínica de la enfermedad neonatal es amplia y abarca desde casos asintomáticos hasta enfermedad sistémica grave con necrosis hepática, miocarditis y meningoencefalitis5,6.
Los lactantes con meningitis por EV son RN sanos sin enfermedad, y en los antecedentes frecuentemente se encuentran cuadros catarrales o gastroenteritis en otros miembros de la familia. Los datos obtenidos en nuestro estudio son congruentes con los datos publicados en la literatura, en la que se describe que la fuente de la infección vírica se encuentra en el entorno familiar del RN6–8.
Por lo general, la meningitis por EV aparece más frecuentemente a partir de la segunda semana de vida10,11. Las alteraciones clínicas iniciales de la meningitis neonatal se presentan con rechazo del alimento, vómitos y manifestaciones neurológicas como alteración del sensorio y convulsiones, y estas manifestaciones clínicas son comunes en las meningitis bacterianas y por EV10,11.
La afectación de otros órganos durante la infección meníngea se presenta más frecuentemente asociada a infección bacteriana10. La disfunción orgánica se presentó en nuestro estudio en los RN con MB con una incidencia significativamente superior que en los RN con meningitis por EV, y solo se observó en RN con infección grave por EV.
Las alteraciones respiratorias, descritas durante la infección por EV en el periodo neonatal, se presentan en el 2% de los casos y suelen aparecer asociadas a cuadros graves con afectación hepática y cardiaca11. En nuestro estudio los síntomas respiratorios se presentaron con una incidencia doble a lo referido en la literatura. Sin embargo, las alteraciones respiratorias aparecen frecuentemente durante la evolución de las infecciones meníngeas de origen bacteriano10.
La afectación neurológica en nuestros pacientes fue en la mayoría de los casos leve. En general, las alteraciones neurológicas que muestran los RN durante el curso de la enfermedad son leves y clínicamente se manifiestan con fluctuaciones en el nivel de conciencia, alternando fases de somnolencia e irritabilidad, y no son frecuentes la aparición de síntomas neurológicos más graves, ya que estos se presentan en el contexto de meningoencefalitis asociada a enfermedad hepática y miocárdica6,11,12.
El parámetro bioquímico más útil para diferenciar la etiología bacteriana o vírica en las meningitis parece ser la proteína C reactiva (PCR), y los estudios publicados han demostrado su utilidad para valorar a niños con fiebre y riesgo de presentar infección bacteriana invasiva13,14. En nuestro estudio los valores de PCR en los RN con meningitis por EV fueron normales.
En general las meningitis por EV evolucionan con un aumento moderado, que no supera las 1.000 cel./mm3, de células en el LCR3,8,15.Sin embargo, durante el periodo neonatal la leucocitosis solo está presente en la mitad de los casos15–17. De existir pleocitosis hasta el 30% de los RN muestran un predominio de polimorfonucleares al inicio de la enfermedad11,16,17. Los datos publicados en la literatura, así como los obtenidos en nuestro estudio, muestran que la falta de alteraciones licuorales son frecuentes en las meningitis por EV, y ello podría explicarse por una realización muy precoz del análisis de LCR motivado por la edad del paciente, un posible origen bacteriano y la potencial gravedad del cuadro.
Habitualmente los RN que sufren meningitis por EV tienen una evolución favorable, con recuperación neurológica completa. La aparición de secuelas en el neurodesarrollo se ha asociado más frecuentemente a meningoencefalitis por EV18, pero esto no ha sido demostrado en meningitis sin encefalitis por EV. Los pacientes que desarrollan déficits neurológicos corresponden a meningitis que coexisten con otras manifestaciones más graves de la infección12,15. Algunos estudios han reportado que hasta un 20% de los RN con meningitis por EV no complicadas desarrollan déficits neurológicos durante el seguimiento. Sin embrago, otros estudios no confirman estos hallazgos y no observan diferencias en el desarrollo neurológico de estos niños al compararlos con sus hermanos sanos19,20.
La mayoría de los niños con meningitis por EV no necesitaron de tratamiento de soporte intensivo. No existe un tratamiento específico efectivo para el tratamiento de la infección neonatal grave por EV, aunque estas formas podrían beneficiarse de la administración de inmunoglobulinas a dosis elevadas que proporcionen concentraciones suficientes de anticuerpos para contrarrestar la viremia21.
Los virus entran a través de la mucosa orofaríngea, y desde aquí inician su replicación para después diseminarse a través de la sangre y el tracto digestivo donde se replican activamente durante varias semanas. Por ello es comprensible que las muestras respiratorias y las digestivas sean las que contienen mayor concentración de virus y, en consecuencia, resulten altamente sensibles para el aislamiento y detección de EV. El virus puede detectarse en las heces por técnicas moleculares durante varias semanas y su detección no implica necesariamente una infección aguda5,11. La presencia del virus en fluidos estériles es indicativa de infección aguda en cualquier grupo etario, pero en el RN también lo son las heces y las secreciones respiratorias, especialmente cuando se detectan dentro de las primeras 2 semanas de vida. La técnica de referencia para el aislamiento de EV, según el manual de laboratorio de poliomielitis de la OMS9, es el cultivo viral. Sin embargo, la recuperación mediante cultivo de EV en el LCR es baja, y las técnicas de RT-PCR en el LCR ofrecen ventajas tanto en tiempo como en sensibilidad. Es por ello por lo que la RT-PCR en el LCR se consolida como el método de elección para la detección de EV en estas muestras por su mayor rapidez y sensibilidad22. La RT-PCR en el plasma se recomienda en el estudio de lactantes menores de un mes con sospecha de enfermedad bacteriana invasiva para excluir la infección por EV23,24.
El estudio de EV en el LCR se realizó en todos los RN. En nuestro estudio el LCR fue la muestra más sensible para la detección de infección por EV, similar a la descrita en diferentes artículos23–26. Cabe destacar que nuestro estudio incluye la revisión retrospectiva de pacientes con meningitis por EV, y por ello los resultados deben ser interpretados con cautela. También es preciso destacar que en ningún RN con meningitis bacteriana se detectó EV en las muestras de LCR.
Los principales genotipos de EV que se aislaron en nuestros pacientes fueron E11, CVB5, E18, E25, E7 y CVB3, y estos genotipos representan el 40% de los EV identificados durante el periodo de estudio. Los diferentes estudios publicados demuestran que el predominio de unos genotipos respecto a otros varía en relación con la localización geográfica y la variación genotípica epidémica11. Es por ello por lo que los tipos más frecuentemente aislados en nuestro estudio pueden no coincidir con otros estudios realizados en otros países.
Diferentes publicaciones sugieren una asociación entre la progresión de la enfermedad a formas graves y determinados tipos de EV5,6,15. No todos los autores están de acuerdo con esta afirmación27. En nuestro estudio no hemos encontrado esta asociación y cabe la posibilidad de que los tipos que se relacionan con mayor gravedad, principalmente E11 y coxsackievirus tipo B, son los EV que con más frecuencia se aíslan en el RN.
La mayoría de los RN con meningitis por EV atendidos en los hospitales son tratados con ATB en espera de la evolución de la enfermedad y de los resultados de las pruebas microbiológicas, y ello ocasiona que el tratamiento ATB se prolongue varios días después de su ingreso. Es conocido que la administración de ATB de amplio espectro se asocia a complicaciones en el RN, así como a la colonización intestinal por bacterias multirresistentes. La mayoría de las publicaciones muestran porcentajes entre el 85% y el 100% de lactantes afectos de meningitis víricas tratadas con antibioterapia26,28. Estos datos podrían disminuirse mediante la valoración de los datos clínicos y epidemiológicos y de la práctica de pruebas microbiológicas rápidas que confirmen o excluyan su diagnóstico. La RT-PCR en el LCR para EV tiene una elevada sensibilidad y un valor predictivo positivo del 100%25,26. Estas técnicas permiten obtener un resultado en pocas horas y reducir la terapia antibiótica en el 50% de los lactantes tratados29,30.
ConclusionesLos hallazgos de este estudio muestran que la infección por EV es una causa común de meningitis en el RN (78% de los casos en nuestra serie). Estos datos subrayan la importancia de la rápida detección de EV en neonatos con sospecha de meningitis para obtener un diagnóstico temprano. Ello ayudaría a reducir el uso de tratamiento antibiótico, reduciendo así el tiempo de hospitalización y el coste sanitario asociado.
FinanciaciónEl estudio no ha recibido financiación alguna.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.