Varón de 70 años de raza caucásica, habitante en zona rural de la provincia de Madrid y sin hábitos tóxicos conocidos. Entre sus antecedentes personales, destaca diabetes mellitus tipo 2 y adenocarcinoma bien diferenciado de recto, estadio IV (pT3 N0 M1 por metástasis pulmonares bilaterales, según la clasificación TNM de 2017), en tratamiento quimioterápico activo para enfermedad sistémica (2.a línea), basado en 5-fluorouracilo/leucovorin/oxaliplatino (FOLFOX) y cetuximab, del cual ha completado 5 ciclos con buena tolerancia.
Acude por aparición de una mácula marronácea, indolora y de bordes eritematosos, en la cara anterior de la pierna derecha, de aproximadamente 2×2cm de diámetro, desde hace 72h. En la anamnesis por aparatos y sistemas, niega síndrome febril, aparición de lesiones cutáneas a otros niveles, traumatismo locorregional, picadura de insecto, u otra sintomatología inflamatorio/infecciosa compatible. Asimismo, en la analítica no presenta datos de inmunosupresión. Nunca ha salido de España.
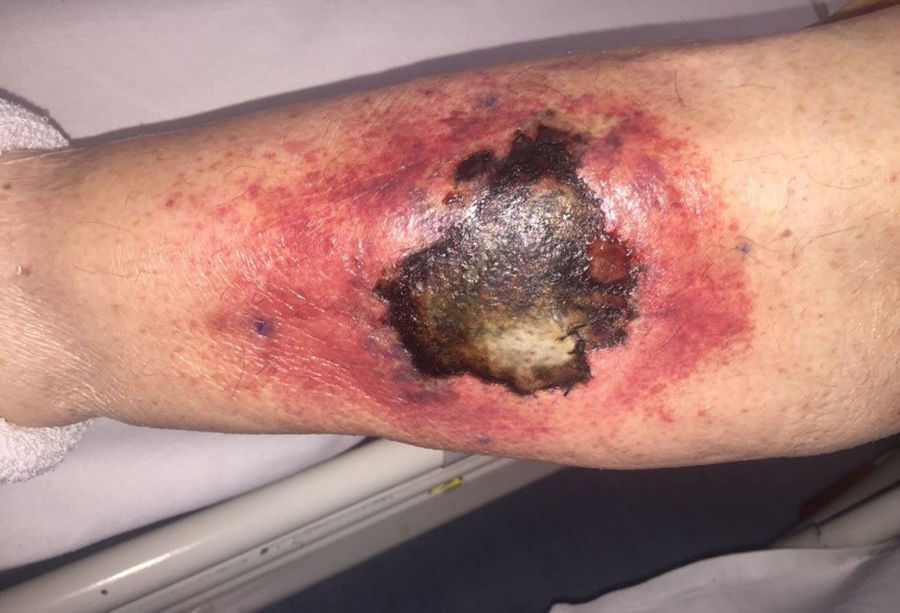
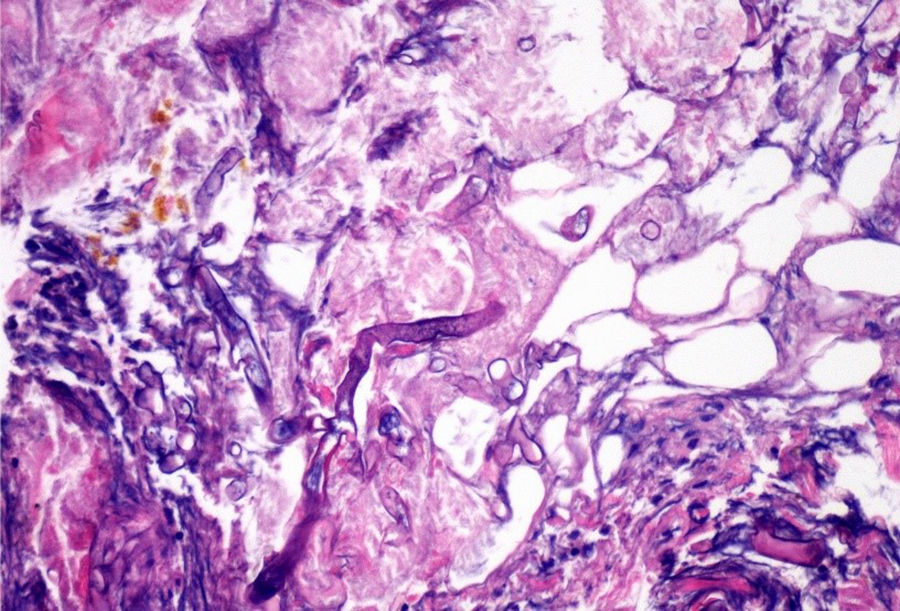
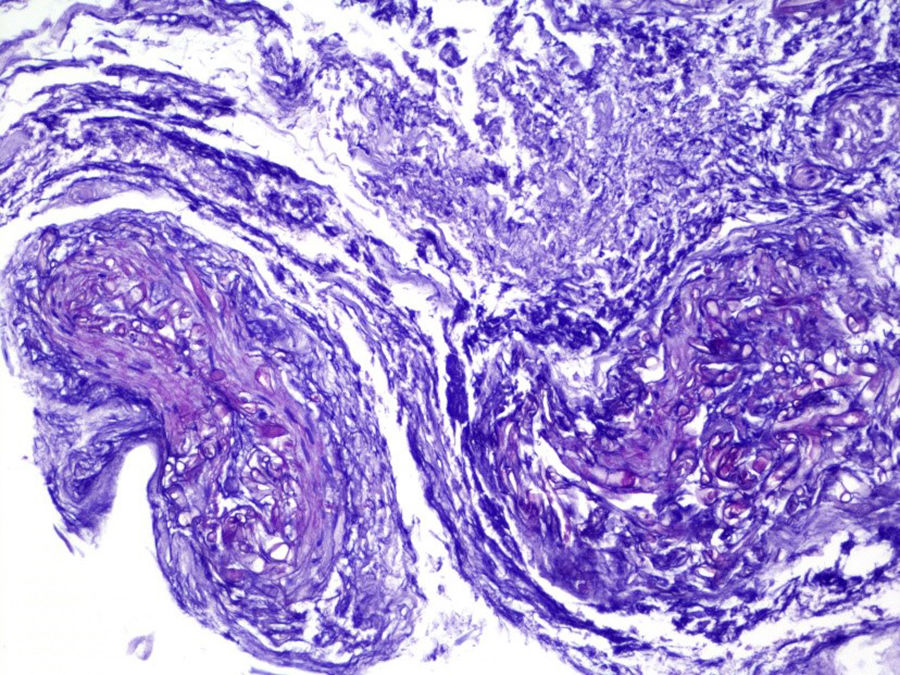
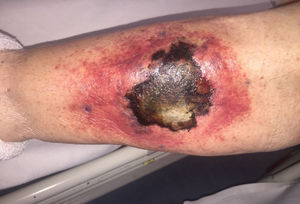
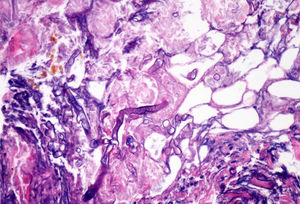
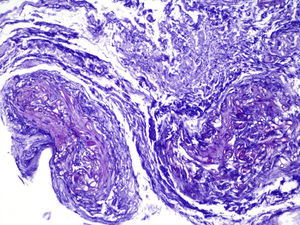
EvoluciónEn las primeras 48h tras el ingreso, la lesión evoluciona, con extensión de los bordes eritematosos, que además se tornan violáceos, y de la mácula central, que se vuelve ulcerosa, con fondo necrótico (fig. 1) y dolorosa espontáneamente. Se obtienen muestras para cultivo y se toma biopsia cutánea, cuyo análisis demuestra la presencia de lesiones necróticas e isquémicas, así como la existencia en dermis e hipodermis de hongos con hifas grandes no tabicadas, algunos de los cuales atraviesan los vasos sanguíneos (figs 2 y 3). En el cultivo extraído a partir de la úlcera creció finalmente una cepa de Rhizopus oryzae.
El diagnóstico diferencial de las úlceras cutáneas producidas por hongos debe incluir a los géneros siguientes: Candida, Aspergillus, Cryptococcus, Fusarium, Trichosporon, Paecilomyces y el grupo de los zigomicetos. En el caso clínico presentado (úlcera cutánea negra) y con la presunción de hongo formador de hifas no tabicadas, el diagnóstico más probable es el de algún género perteneciente al orden de los mucorales, cuya infección es más comúnmente conocida como mucormicosis. En la división de los zigomicetos se encuentran dos órdenes de hongos: los entomoftorales (entomoftoramicosis) y los mucorales (mucormicosis). Los géneros Basidiobolus y Conidiobolus pertenecen al orden de los entomoftorales, hongos parásitos de algunos insectos, cuyas infecciones en el ser humano suelen ser granulomatosas crónicas subcutáneas y se han documentado principalmente en África, Sudamérica, India y Oriente Medio. Dentro de los mucorales, orden de mayor tamaño y mejor estudiado, se encuentran 12 familias, de las cuales la principal productora de enfermedad en el ser humano es la Mucoraceae. Los géneros incluidos en ella son Rhizopus, Mucor, Rhizomucor, Lichtheimia y Apophysomyces. Otros géneros capaces de producir enfermedad en el ser humano son Saksenaea, Cunninghamella y Syncephalastrum1. Todos ellos se encuentran repartidos por toda la naturaleza, hallándose fundamentalmente en la vegetación en descomposición y en el suelo. Algunas especies aquí englobadas pueden ser identificadas a simple vista como formadoras de moho, por ejemplo, sobre el pan o las patatas putrefactos.
Arnold Paltauf fue el primer médico en identificar histológicamente un espécimen productor de mucormicosis, concretamente de Mycosis mucorina (Universidad de Graz, Austria) en 1885.
Se estima que la incidencia de este tipo de infecciones en países con registros validados es de aproximadamente 1-1,5 casos/millón/año2. Es sabido que estos hongos crecen rápidamente (pueden producir colonias lanosas visibles macroscópicamente en 10-15h) y se reproducen a partir de esporas asexuales (esporangiosporas) que pueden transportarse por el aire. Diariamente, los seres humanos entramos en contacto con estas estructuras dada su ubicua distribución, si bien no desarrollamos infección gracias a la efectividad del sistema inmune. Así pues, la mucormicosis se considera una infección propia de pacientes inmunodeprimidos, siendo los principales factores predisponentes la diabetes (especialmente si hay cetoacidosis), las neoplasias hematológicas, el trasplante de progenitores hematopoyéticos o de órgano sólido, el tratamiento prolongado con glucocorticoides, el tratamiento con deferoxamina, la sobrecarga de hierro, y el contacto de piel y mucosas con material sanitario contaminado (vendajes adhesivos, ropa de cama hospitalaria, depresores linguales…).
La infección puede adquirirse por inhalación, ingestión o contaminación de heridas a partir de las esporas presentes en el medio2,3. In vivo, los zigomicetos crecen formando hifas planas sin o con muy escasos tabiques, no pigmentados. Frecuentemente, las hifas son grandes (>10μm) e irregulares o amorfas. Otra característica propia de los mucorales es su capacidad para invadir los vasos sanguíneos, siendo el infarto de los tejidos infectados (escara negra macroscópica) un rasgo distintivo.
Las formas clínicas de mucormicosis humana incluyen2,4:
- –
Rino-orbital-cerebral: la más frecuente. Adquirida a partir de la inhalación de esporas, siendo los senos paranasales las primeras estructuras anatómicas afectadas. La infección progresa con cefalea, dolor facial, fiebre y secreción nasal purulenta. La evolución suele ser rápida sin tratamiento, involucrándose posteriormente el paladar, los cornetes nasales y la órbita ósea.
- –
Pulmonar: adquirida a partir de la inhalación de esporas, que se depositan en bronquiolos y alvéolos. El cuadro clínico es el de una neumonía necrosante, que puede cursar con fiebre y hemoptisis amenazante. Sin tratamiento, puede diseminarse hacia el mediastino u otros órganos por vía hematógena.
- –
Gastrointestinal: infrecuente. Suele ocurrir tras la ingesta de alimentos contaminados con esporas. El estómago es el lugar más frecuentemente afectado. Puede cursar con dolor abdominal y hematemesis. Macroscópicamente, se visualizan lesiones necróticas y úlceras, que pueden evolucionar a perforación y peritonitis.
- –
Cutánea: resultado de la inoculación de esporas en la dermis. Es frecuente el antecedente epidemiológico de traumatismo o quemadura.
- –
Enfermedad diseminada: muy rara, estando presente en momentos de severa inmunodepresión, grandes quemados o pacientes que han recibido deferoxamina a altas dosis. Su tasa de mortalidad es próxima al 100%.
El diagnóstico de cualquier forma clínica se puede realizar rápidamente a través de la identificación de hifas atabicadas y anchas en la muestra tisular. Esto es posible con el examen directo del material tratado con KOH y blanco calcoflúor. Los cortes histopatológicos pueden teñirse con hematoxilina-eosina (H-E) o ácido peryódico de Schiff (PAS). El cultivo puede no aportar crecimientos hasta en el 50% de casos. El 1,3-beta-D-glucano y el antígeno de galactomanano no son útiles como pruebas diagnósticas en las mucormicosis, puesto que estos hongos no muestran estos componentes en su pared celular2,4.
El tratamiento de las mucormicosis debe fundamentarse en dos pilares: erradicación del material fúngico de los tejidos infectados y reconstitución del sistema inmune (o la patología subyacente) del paciente. Es obligada la combinación de cirugía con tratamiento antifúngico prolongado, sea cual sea el cuadro clínico del paciente2. La cirugía debe incluir un desbridamiento amplio e intensivo de los tejidos afectos, tan pronto como se sospeche el diagnóstico.
El inicio de antifúngicos es empírico, siendo la anfotericina B liposomal (dosis de 5mg/kg/día) el fármaco de elección en un primer momento2,4. Posteriormente, si la respuesta clínica del paciente es adecuada, puede cambiarse a posaconazol o isavuconazol orales (terapia escalonada). La dosis estándar de posaconazol es de 300mg/12h el primer día, siguiéndose de 300mg/24h a partir del siguiente. Para el caso de isavuconazol, la dosis de carga ocupa 48h (200mg/8h), reduciéndose posteriormente a 200mg/24h.
En aquellos casos con escasa respuesta a anfotericina B o intolerancia a la misma, puede emplearse una terapia de rescate basada en la sustitución de anfotericina por posaconazol o isavuconazol. No obstante, en estos pacientes debe usarse la vía intravenosa inicialmente, y mantenerla hasta que se obtenga una respuesta clínica favorable. Las dosis de carga son las mismas que en el caso de la vía oral.
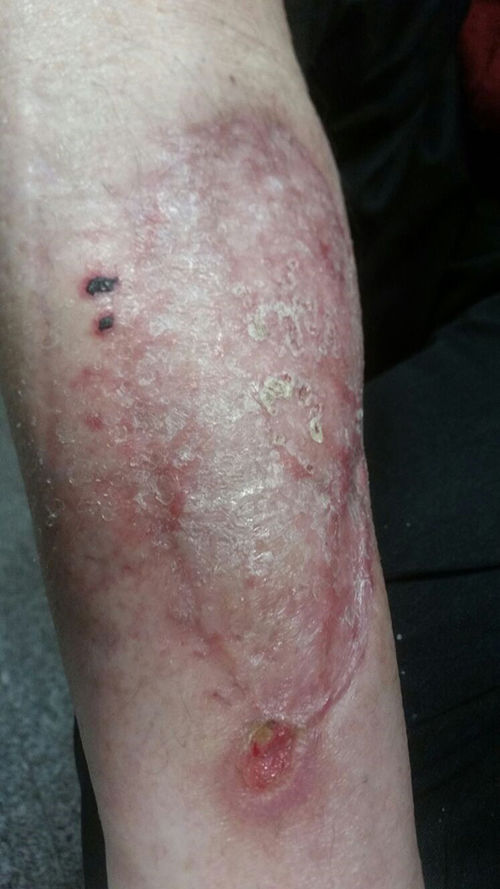
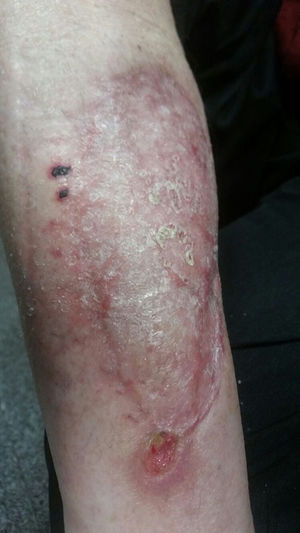
No existe una duración estandarizada del tratamiento antifúngico. El uso de anfotericina B liposomal debe mantenerse hasta que se produzca una respuesta clínica favorable, lo cual suele conllevar varias semanas, o hasta que se produzca intolerancia o empeoramiento clínico. Posteriormente, el uso de azoles debe prolongarse hasta la resolución completa de los síntomas y signos de la infección, lo que puede extenderse varios meses. Esta situación es más frecuente en pacientes con inmunodepresión prolongada. En el caso presentado, se llevó a cabo desbridamiento quirúrgico y ampliación de márgenes hasta encontrar tejido no afecto; posteriormente, tras comprobar una correcta evolución de la herida (que se dejó al descubierto), se efectuó la reconstrucción con injerto cutáneo. Desde el inicio, el paciente recibió anfotericina B liposomal (5mg/kg/día) durante un total de 14 días. Seguidamente, fue dado de alta con posaconazol oral (300mg/día), terapia que prolongó durante 8 semanas. El resultado clínico final se muestra en la figura 4.