El herpes genital es una enfermedad de transmisión sexual causada por los virus herpes simplex tipo1 (VHS-1) y tipo2 (VHS-2), pertenecientes, junto al virus varicela zoster, a la familia alfaherpesviridae. La lesión por VHS continúa siendo la causa más frecuente de úlcera vulvar entre la población sexualmente activa, y su incidencia aumenta cada año. En esta revisión resumiremos la microbiología del virus, la patogenia y la infección en genitales, las manifestaciones clínicas para su correcta identificación, las diferentes técnicas diagnósticas de laboratorio y la elección del correcto tratamiento según sea primera infección, recurrencia o casos especiales. Finalmente, se discute un análisis de costes de la enfermedad por VHS.
Genital herpes is a sexually transmitted disease caused by herpes simplex virus type1 (HSV-1) and type2 (HSV-2) belonging to the alphaherpesvirus family, that includes the varicella zoster virus. HSV infection continues to be the most common cause of vulvar ulcers among the sexually active population. Its incidence increases every year. This review summarises the microbiology of the virus, pathogenesis and infection in genitalia, clinical manifestations and correct identification, the different laboratory diagnostic methods, and choice of the correct treatment according to the first infection, recurrence or special cases. Finally, the cost of routine herpes simplex virus infection is analysed.
El herpes genital es una enfermedad de transmisión sexual causada por los virus herpes simplex tipo1 (VHS-1) y tipo2 (VHS-2) que pertenecen a la familia herpesviridae, que conforman virus de ADN.
Los herpesvirus están constituidos por una estructura bien definida, compuesta por una cápside icosaédrica rodeada de un tegumento que contiene entre 15 y 20 proteínas y que está en contacto directo con la envuelta que engloba numerosas glucoproteínas. El genoma comprende una única molécula de ADN lineal de doble cadena con un tamaño entre 152 y 155kbp. Estos dos virus comparten hasta un 40% de homología en su estructura genómica, alcanzando hasta un 83% en las regiones codificantes, lo que explica en gran medida la reactividad antigénica cruzada entre ellos1-3.
La familia herpesviridae se divide en tres subfamilias: alfa, beta y gamma (basadas en similitudes biológicas y genómicas). Dentro de los alfaherpesvirus se incluyen VHS-1, VHS-2 y virus varicela zoster (VZV). Los seres humanos son los únicos reservorios conocidos.
El VHS-1 es un virus de gran tamaño y neurotrópico que causa principalmente infecciones orales que van desde lesiones leves, como el herpes labial, hasta graves, como la meningoencefalitis. El VHS-2 es muy similar, pero da lugar a infecciones anogenitales o herpes neonatal. En los últimos años estos datos han variado debido a las prácticas de sexo oral, manifestándose VHS-2 en lesiones labiales y aumentando la prevalencia de VHS-1 en infecciones anogenitales. Conforme a estos cambios, debemos romper con la tradicional afirmación de que VHS-2 es igual a herpes genital y que el VHS-1 se limita a infecciones orolabiales con trasmisión no sexual.
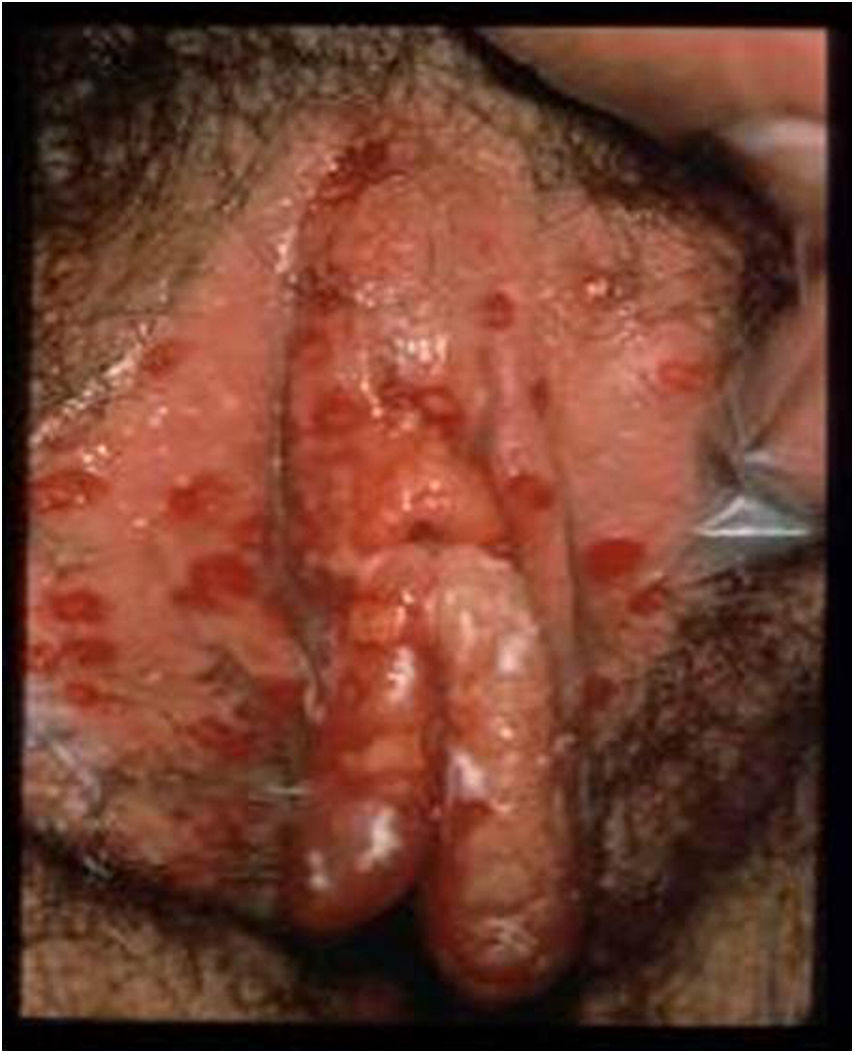
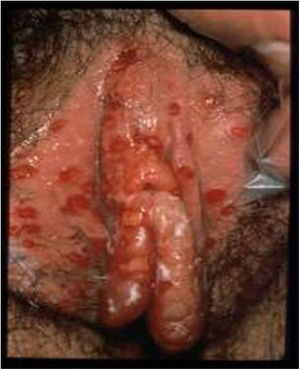
La lesión por VHS continúa siendo la causa más frecuente de úlcera vulvar entre la población sexualmente activa (fig. 1). En los últimos años se ha detectado un continuo aumento de esta infección, debido en parte a los cambios socioculturales y prácticas sexuales de riesgo. La mayoría de estas infecciones son asintomáticas, lo que favorece la transmisión4. Estudios recientes en personas sexualmente activas de entre 14 y 49años en Estados Unidos indican que la prevalencia de VHS-1 es del 47,8%, mientras que la de VHS-2 es del 11,9%; ambas prevalencias aumentan con la edad, y son mayores en mujeres que en hombres5,6.
Lesiones ulcerosas en vulva. Modificado de Garland y Steben13.
Datos de la OMS estiman a nivel mundial que un 11% de la población entre 15 y 49años de edad están infectadas por VHS-27. Por otro lado, hay que considerar la morbimortalidad en el neonato por el riesgo de transmisión durante el embarazo, y como cofactor en la transmisión del VIH8.
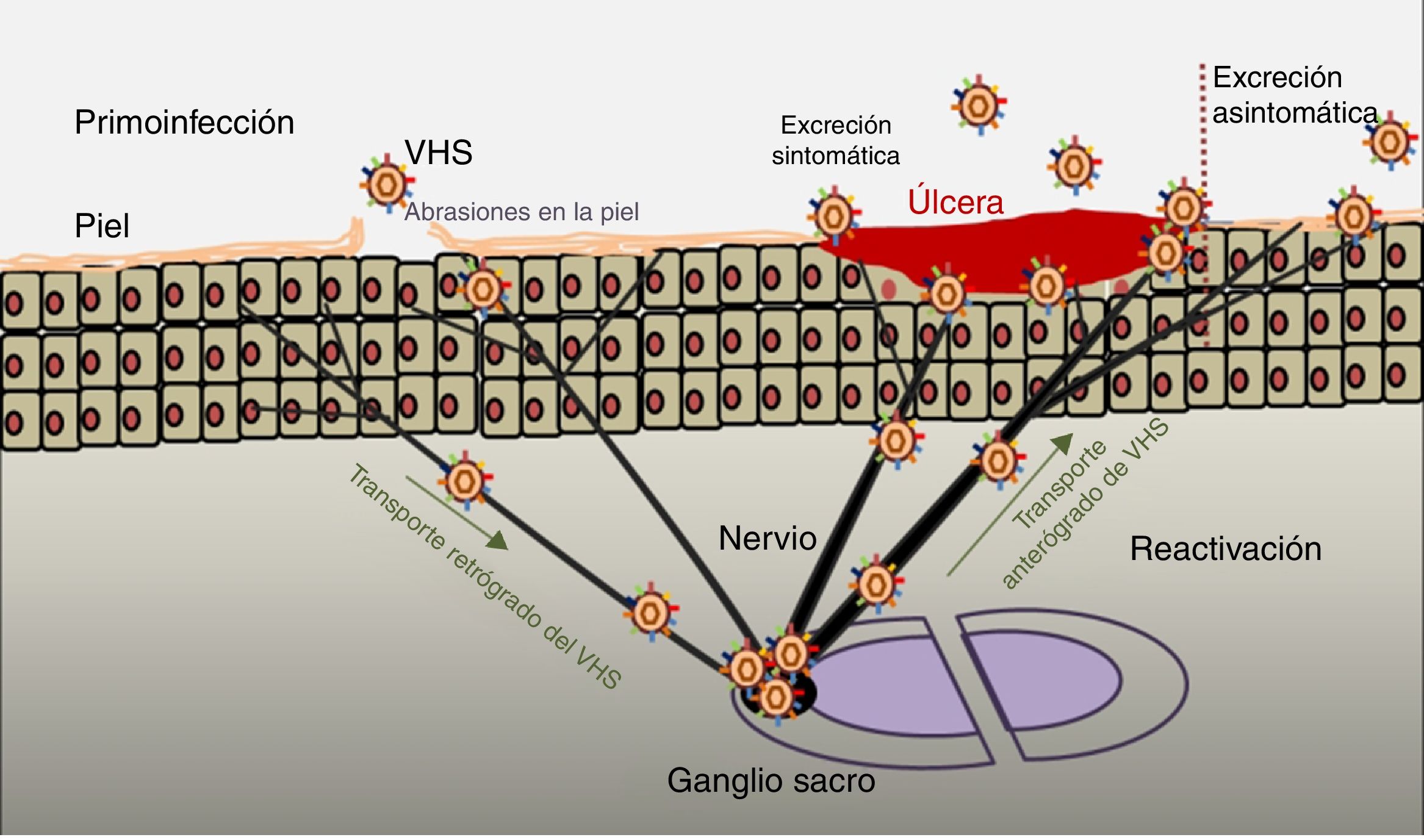
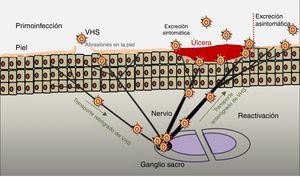
PatogeniaEl ciclo infeccioso del virus se inicia tras el contacto con la mucosa oral o genital, a través de abrasiones o microfisuras en la piel del huésped (fig. 2). La replicación comienza en la epidermis y penetra en las terminaciones cutáneas de los nervios sensitivos. A través del axón de estos nervios es transportado hasta el núcleo de las neuronas de los ganglios sensitivos de la médula espinal (espinales o trigeminales). El VHS puede replicarse dentro de las neuronas ganglionares sensitivas o permanecer en fase de latencia durante meses e incluso años, y reactivarse espontáneamente o en respuesta a diversos estímulos (radiación solar, estrés, fiebre, determinados medicamentos, enfermedades agudas o procesos inmunosupresores). Esta capacidad de reactivación del virus latente se define como enfermedad recurrente por VHS. Cuando se reactiva el virus, desciende a través del nervio sensorial hasta la superficie de los dermatomas inicialmente infectados (orolabial o vulva), continúa la replicación en las células epidérmicas y puede ocasionar excreción asintomática en las secreciones orales o genitales, o bien recurrencias clínicas manifiestas, dando lugar a vesículas e inflamación de ganglios linfáticos locales9,10.
Infección primaria y reactivación.
Modificado de Jaishankar y Shukla43.
Los síntomas y manifestaciones clínicas del herpes genital varían en función del tipo de VHS, sexo, edad, estado inmunitario del paciente y exposición previa al virus. Los episodios en pacientes sin evidencia de infección previa por VHS (infección primaria) se pueden manifestar con una gravedad media mayor que en pacientes con infección previa (herpes genital inicial no primario). En contraposición, y más común, encontramos las infecciones primarias asintomáticas, por lo que la mayoría de las personas con herpes genital u oral desconocen su estado de infección11.
En el caso de herpes genital primario encontramos que entre el 7 y el 50% de los casos están causados por infección VHS-1, mientras que del 50 al 93% se deben a VHS-2. Estas proporciones varían en función del ámbito geográfico y socioeconómico9. El periodo de incubación es de unos 4días (puede llegar a variar entre 2 y 12días). La mayoría de las lesiones clínicamente evidentes están precedidas de una fase prodrómica (2-24h antes de la aparición de las lesiones) que se pueden manifestar con fiebre, malestar general, dolor de cabeza, mialgia, escozor o picor en la zona anal-genital, flujo vaginal anómalo y dolor en piernas, nalgas o genitales. En mujeres inmunocompetentes las lesiones (ampollas que pueden progresar a úlceras) se manifiestan en áreas de infección (vulva, cuello uterino, vagina, periné y/o uretra)12,13, ocasionando uretritis y/o linfoadenopatía inguinal dolorosa. Las complicaciones más frecuentes derivan de las lesiones cutáneas extragenitales, de la afectación del sistema nervioso central y de las sobreinfecciones fúngicas. Con menor frecuencia pueden aparecer radiculomielitis sacra con retención urinaria, mielitis transversa y neuralgia. Las complicaciones se presentan más frecuentemente en las mujeres que en los hombres9,11.
En el herpes genital inicial no primario los síntomas locales y sistémicos son menos graves y se resuelven con mayor rapidez que en las infecciones primarias.
La duración media de la excreción viral es de 12días en la enfermedad primaria y de 7días en la no primaria.
El herpes genital recurrente es uno de los principales problemas de esta enfermedad, ya que depende del tipo de virus, de la intensidad del primer episodio y del propio huésped. Durante el primer año, tras la infección primaria se producen la mayoría de estos casos (80-90% por VHS-2 y 20% por VHS-1). Existe gran variabilidad en cuanto al número de brotes, a la gravedad y al curso natural de las recurrencias14,15.
Las manifestaciones cutáneas suelen aparecer en la misma zona de la infección inicial, a veces inespecíficas y apenas perceptibles, como fisuras y grietas, lo que provoca errores diagnósticos. En ocasiones puede que no se produzcan lesiones, lo que dificulta el diagnóstico de recurrencia. Los síntomas sistémicos son poco frecuentes y de menor gravedad, aunque pueden ser más dolorosos y prolongados en mujeres. La tasa de recurrencias aumenta durante el embarazo, pero tienen una evolución y duración similares14.
DiagnósticoEl diagnóstico clínico es suficiente para iniciar un tratamiento empírico precoz, que acorta y mejora la sintomatología, pero siempre debe confirmarse con pruebas de laboratorio para emitir el pronóstico y proceder a la elección óptima del tratamiento.
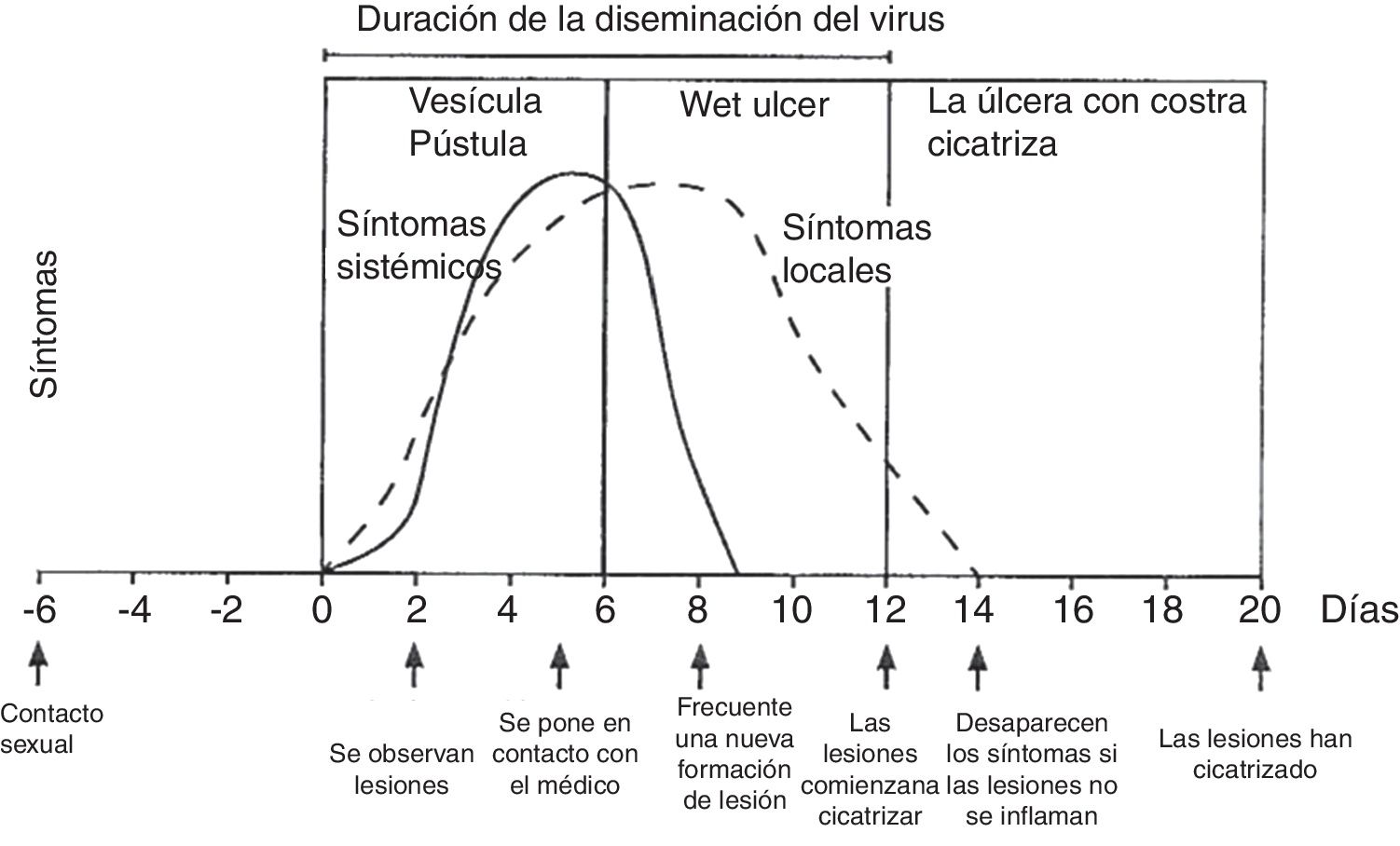
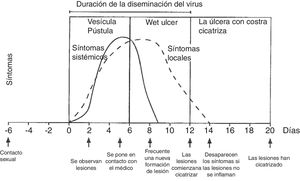
La exploración física se realiza mediante examen externo e interno de genitales, búsqueda de adenopatías (dura, móvil, bilateral y muy dolorosas) y localización del virus en otras zonas (boca y ojos), junto a historia clínica del paciente. La lesión inicial son una o más vesículas agrupadas sobre una base eritematosa. Estas vesículas posteriormente se abren y conducen a ulceraciones poco profundas. En la zona alrededor de los labios y el recto las vesículas se rompen con frecuencia antes de que se noten, pudiendo aparecer costras (fig. 3). En la primoinfección genital el dolor suele durar 10días y las lesiones cicatrizan en 2-3semanas, siendo menos dolorosas y de duración limitada.
Evolución de los síntomas y manifestaciones clínicas en enfermedades herpéticas.
Modificado de Garland y Steben13.
Las técnicas de diagnóstico más utilizadas son:
- -
Frotis de Tzanck, a partir de vesícula no rota. Herramienta barata y rápida de utilizar, pero requiere personal con experiencia y está limitada a este tipo de lesiones15,16.
- -
Cultivo viral: aunque el aislamiento en cultivo celular es relativamente sencillo y rápido en comparación con otros virus, el rendimiento es mayor ante la presencia de vesículas (80%) y la toma de muestras los dos primeros días tras su aparición, y menor en la fase de costra o en las recurrencias (25-50%). Es un método sensible y específico, aunque tedioso. Los efectos citopáticos característicos suelen aparecer en el plazo de 12-48h17,18.
- -
Técnicas de inmunofluorescencia directa/indirecta: técnicas rápidas, baratas, muchas de ellas disponibles totalmente automatizadas o semiautomáticas, con una sensibilidad-especificidad entre el 85 y el 99%19-23.
- -
Serología específica de tipo para anticuerpos IgG anti-VHS específicos: relevante en pacientes con historia de lesión genital atípica no diagnosticada, sospecha de infección de pareja con paciente infectado y gestantes con riesgo de transmisión al recién nacido. Igualmente se trata de técnicas rápidas, baratas, muchas de ellas disponibles totalmente automatizadas o semiautomáticas, pero presentan la limitación de que el anticuerpo para la glucoproteína viral se detecta a partir de las 6-8semanas y aproximadamente en el 5% de los pacientes puede presentar niveles no detectables. Destacan las altas sensibilidad (93-96%) y especificidad (80-98%)24, pero no se recomienda su utilización en pacientes asintomáticos, dado la alta tasa de falsos positivos en la población de bajo riesgo.
- -
Un resultado serológico negativo puede indicar tanto la ausencia de contacto previo con VHS como ausencia de respuesta inmunitaria, ya sea por fase inicial de infección (primoinfección) o alteraciones en el sistema inmune del paciente. Por el contrario, la presencia de anticuerpos totales es evidencia de infección herpética. Una IgM negativa indica una infección no activa en el momento del análisis, mientras que la presencia de IgM manifiesta una infección en evolución (no siempre se trata de infección primaria, ya que en algunas recurrencias es posible detectar cantidades significativas de IgM)25,26.
- -
PCR: su uso en la práctica clínica está en auge gracias a las PCR múltiples que permiten la detección simultánea de los principales organismos presentes en úlceras infecciosas de origen sexual (Treponema pallidum, Haemophilus ducreyi, Chlamydia trachomatis serovarL que provoca el linfogranuloma venéreo y VHS1-2). Esta técnica presenta una alta sensibilidad y especificidad (ambas próximas al 100%), es rápida, sus costes están disminuyendo y, junto a su automatización, permite el acceso a cada vez más laboratorios. Principalmente por su elevada sensibilidad (incluso en casos con carga viral baja) es útil para detectar la excreción viral en pacientes asintomáticos y diagnosticar lesiones negativas en el cultivo. La mayor objeción es el coste económico y el requerimiento de laboratorios y personal especializado. Actualmente existen kits comerciales para la determinación simultánea de varias ITS o infección por herpes simplex exclusivamente que permiten diferenciar entre VHS tipo1 y2, aspecto que el cultivo no permite. Por todos estos motivos la PCR ha ido desplazando progresivamente al cultivo como método de diagnóstico de la infección por VHS27,28.
Las dianas moleculares más utilizadas habitualmente son secuencias conservadas de los genes que codifican las glucoproteínas de superficie gD y gB, o las proteínas enzimáticas DNA polimerasa y timidina quinasa, con diferencias en su secuencia que permiten la discriminación en la detección de VHS-1 y VHS-2, como los aprobados por la FDA para la detección de VHS en lesiones genitales: IsoAmp HSV Assay (BioHelix Corporation), Multi-Code-RTx Herpes Simplex Virus 1&2 Kit (EraGen Biosciences Inc) o BD ProbeTec Herpes Simplex Viruses HSV1&2 (HSV QxAssays)29,30.
TratamientoUn tratamiento «empírico» o «sindrómico» es recomendado por la OMS, ya que los resultados de las pruebas diagnósticas no están disponibles en el momento de la primera visita. Este tratamiento temprano puede llevar a una curación más rápida, al alivio de los síntomas y a una disminución del riesgo de transmisión; está recomendado en pacientes con úlceras genitales sugestivas de infección por VHS, pero presenta la desventaja de una posible administración de terapia inadecuada; por eso es fundamental el seguimiento de los pacientes para evaluar la respuesta al tratamiento y los resultados de las pruebas diagnósticas y reevaluar decisiones terapéuticas en caso de necesidad.
En el primer episodio de herpes genital los antivirales deben emplearse durante los 5primeros días del comienzo del episodio, o durante la formación de nuevas lesiones. El tratamiento de elección es la aplicación de antivirales orales: aciclovir, valaciclovir y famciclovir, que reducen la gravedad y la duración del episodio (grado de evidenciaIb,A)31. Los tratamientos de tipo tópico no se recomiendan, ya que son menos efectivos que los orales y pueden generar resistencias (IV,C). La única indicación de uso de terapia intravenosa es cuando el paciente no puede ingerir o tolerar el tratamiento oral. Los regímenes recomendados para 5-10días son los siguientes:
- •
Aciclovir 400mg tres veces al día, o aciclovir 200mg cinco veces al día.
- •
Famciclovir 250mg tres veces al día.
- •
Valaciclovir 500mg dos veces al día.
Como medidas de apoyo al tratamiento se recomiendan los baños con solución salina y el uso de analgésicos.
En casos de herpes genital recurrente la elección del tratamiento se realiza acorde a la gravedad de los síntomas y al tiempo de recurrencia.
Las pautas de tratamiento varían entre:
Terapia corta (Ib, A):
- •
Aciclovir 800mg tres veces al día durante 2 días.
- •
Famciclovir 1g dos pastillas en un solo día.
- •
Valaciclovir 500mg dos veces durante 3 días.
Tratamiento de 5 días:
- •
Aciclovir 400mg tres veces al día durante 3-5días o aciclovir 200mg cinco veces al día.
- •
Valaciclovir 500mg dos veces al día.
- •
Famciclovir 125mg dos veces al día.
En situaciones especiales, como pacientes VIH positivos, no existen ensayos clínicos para la duración y tratamiento, por lo que algunos clínicos optan por una terapia de 10días con el doble de dosis de alguno de los tratamientos orales antes citados (IV,C). En mujeres embarazadas las pautas de tratamiento y manejo del tratamiento varían según el trimestre de adquisición del virus31,32.
La terapia supresora está recomendada en pacientes con más de seis episodios al año, y consigue reducir los brotes hasta en un 70-80%31. Este régimen terapéutico pretende disminuir el número de recurrencias y el riesgo de transmisión a las parejas sexuales. Las dosis recomendadas son:
- -
Aciclovir 400mg dos veces al día durante 5 días.
- -
Valaciclovir 500mg al día (si la frecuencia es menor de 10 recurrencias/año).
- -
Valaciclovir 1g diario (más de 10 recurrencias/año).
Recientes estudios indican que microbicidas de uso tópico, como por ejemplo los geles de 1% tenofovir o 3% SPL7013, pueden ser una opción prometedora, consiguiendo una reducción del 51% de riesgo de infección por VHS-233,34. Otra alternativa son los inhibidores de helicasa-primasa, como el ASP2151, para el tratamiento de herpes genital recurrente35,36.
Las vacunas terapéuticas son otra potencial estrategia para el manejo de pacientes VHS positivos, aunque muchos de los ensayos previos no han obtenido resultados óptimos32. Nuevos ensayos centrados en la respuesta inmune del hospedador, mediante el uso de péptidos VHS (HerpV), han conseguidos resultados prometedores en faseI y se encuentran en faseI/IIa37-40.
Las vacunas profilácticas continúan en desarrollo y mejora desde hace años, destacando dos compuestas por la subunidadD de la glucoproteínaD de HSV-2, con una eficacia demostrada del 73-74% entre mujeres seronegativas para ambos VHS41.
Análisis de costes en el sistema sanitario por enfermedad VHSUn estudio recientemente publicado42 ha calculado los costes asociados a la infección por VHS en unidades de urgencias en hospitales. En el periodo de 2006-2013 el coste ascendió a 543millones de dólares, pasando de los 45millones de dólares en 2006 a los 91millones en 2013, principalmente debido al aumento de un 24% en el número de pacientes. El estudio recalca la necesidad de una prevención continua y la educación sexual de los pacientes para evitar nuevos casos.
Nivel de evidenciaPara más información y detalles de los niveles de evidencia y grado de recomendación, véase: http://www.iusti.org/regions/Europe/pdf/2013/Levels_of_Evidence.pdf
Conflicto de interesesEl autor declara que no existen potenciales conflictos de intereses con respecto a la investigación, autoría y/o publicación de esta revisión bibliográfica.
El autor quiere agradecer a la Sra. Morilla su revisión y comentarios en esta revisión bibliográfica.
Sección acreditada por el Consell Català de Formació Continuada de les Professions Sanitàries. Consultar preguntas de cada artículo en: http://www.elsevier.es/es-revista-enfermedades-infecciosas-microbiologia-clinica-28-formacion.