COVID-19: Recomendaciones y síntesis de evidencia ante una crisis sanitaria global
Más datosEn la actual crisis provocada por el SARS-CoV-2, surge la necesidad global de conocer y combatir el virus. Una de las estrategias es rastrear y diagnosticar los casos con el fin de aislar e interrumpir la cadena epidemiológica. Por ello, el objetivo de este artículo es describir las distintas pruebas diagnósticas más utilizadas y analizar su validez e indicaciones de uso según la evidencia científica y las principales recomendaciones de sociedades científicas y organismos de referencia nacionales e internacionales. Desde el inicio de la pandemia, la disponibilidad de test ha estado supeditada a las condiciones del propio mercado de fabricación y a las directrices marcadas en cada país. Entre los tipos de test más utilizados cabe destacar la PCR, los test de detección de anticuerpos (IgG e IGM) y anticuerpos totales (Ab), también conocidos como test rápidos, y los test de detección de antígenos en exudado nasofaríngeo u otras muestras respiratorias de vías altas/bajas. Para cada uno de estos test es necesario conocer sus recomendaciones de uso y el procedimiento para la toma de muestras, siendo fundamental para minimizar las alteraciones en los resultados debidas a una manipulación deficitaria. Asimismo, es necesario determinar el momento más adecuado para la toma de muestras y la adecuada interpretación de los resultados obtenidos, que siempre ha de ser considerada junto con la sintomatología del paciente para la toma de decisiones clínicas.
In the current crisis caused by SARS-CoV-2, there is a global need to know and combat the virus. One of the strategies is to track and diagnose cases in order to isolate and interrupt the epidemiological chain. Therefore, the aim of this article is to describe the different most used diagnostic tests and analyze their validity and indications for use according to scientific evidence and the main recommendations of scientific societies and reference organizations at national and international level. Since the beginning of the pandemic, the availability of tests has been subject to the conditions of the manufacturing market itself and to the guidelines set in each country. Among the most used types of tests, it is worth highlighting PCR, antibody detection tests (IgG and IGM) and total antibodies (Ab), also known as rapid tests, and tests for the detection of antigens in nasopharyngeal exudate or other upper/lower respiratory samples. For each of these tests, it is necessary to know their recommendations for use and the procedure for taking samples, which is essential to minimize alterations in the results due to poor handling. Likewise, it is necessary to determine the most appropriate moment for taking samples and their adequate interpretation of the results obtained, which must always be considered together with the patient's symptoms for clinical decision-making.
España, al igual que muchos países, ha vivido una situación crítica y de gran impacto sociosanitario debido al SARS-COV-2, cuya enfermedad derivada ha sido conocida como COVID-19. Si bien el primer caso diagnosticado y aislado que se registró en España fue el 31 de enero en La Gomera, no fue hasta el 24 de febrero cuando el virus se detectó con mayor cuantía de nuevos casos en la Comunidad de Madrid, Cataluña y la Comunidad Valenciana.
En respuesta a la COVID-19, el Gobierno español inicialmente instó a limitar el contacto social como medida general, sin embargo, otros países, además, implementaron pruebas diagnósticas generalizadas para la detección de la infección por SARS-COV-2 desde el principio de la pandemia. Un claro ejemplo de aplicación de esta estrategia es Corea del Sur, con amplia experiencia en otros brotes epidémicos como el del SARS en 2015, y uno de los países que más tests ha realizado por número de habitantes. Desde el inicio del brote en febrero, Corea elevó la alarma a «Serio» el 23 de febrero de 2020. La táctica para la contención de la epidemia fue la realización de test masivos para conocer el número de personas contagiadas1. A fecha de 8 de abril, Corea disponía de 638 clínicas y screening centers, de las cuales el 95% estaban equipadas para la recolección de muestras2. Es así que, con solo una llamada, el call center informaba del centro más cercano para la realización de test, contando con dos tipos de centros: «walk thru» (a pie) y «drive thru» (dentro de vehículo)1,3.
En ausencia de vacuna y tratamientos efectivos3,4, la mejor intervención epidemiológica para combatir la epidemia de SARS-CoV-2 es controlar las fuentes de infección5. Las estrategias incluyen: diagnósticos tempranos, informes, aislamiento y tratamientos de apoyo; publicación oportuna de información epidémica; y mantenimiento de órdenes sociales como el confinamiento de la población6.
Por otra parte, la búsqueda intensificada de casos y el rastreo de contactos se consideran cruciales para la mayoría de los países, y se está intensificando para tratar de localizar casos y detener la transmisión. Uno de los sistemas más extendidos para la confirmación de la infección consiste en la realización de la prueba que analiza la reacción en cadena de la polimerasa, más conocida como PCR, para la infección aguda, aunque se han desarrollado pruebas diagnósticas serológicas y con otras técnicas rápidas, cuyo uso se ha ido extendiendo en función de su disponibilidad7.
Tipos de testLos test de los que se dispone para detectar la presencia de la COVID-19 son:
Reacción en cadena de polimerasa transcriptasa reversa (PCR)Las autoridades chinas publicaron en GenBank y en el portal de GISAID (Global Initiative on Sharing All Influenza Data) database, el genoma completo de SARS-CoV-2. Gracias a esta aportación, el diagnóstico microbiológico de la COVID-19 se ha basado en la detección del material genético (ARN) viral del SARS-CoV-2 desde la obtención de muestras respiratorias de pacientes con síntomas compatibles8.
Diversos laboratorios iniciaron el desarrollo para la detección de SARS-CoV-2 conforme a las guías de la Organización Mundial de la Salud (OMS), la cual inicialmente publicó 5 protocolos para el diagnóstico utilizando la cadena de reacción de polimerasa reactiva con transcriptasa reversa4 (reverse transcriptase polymerase chain reaction [rt-PCR]). El primer test de detección de la rt-PCR validado fue el diseñado por el grupo liderado por el profesor Christian Drosten del Instituto de Virología de Berlín. Este primer estudio estaba basado en la detección del genoma de los SARS-CoV y otros coronavirus relacionados con SARS9.
El procedimiento de PCR en laboratorio consta de dos partes: 1) extracción de ácidos nucleicos y 2) reacción de amplificación. Lo ideal es que ambos procesos estén automatizados para disminuir errores y aumentar la rapidez diagnóstica de todo el proceso5. Los laboratorios de microbiología clínica deben disponer de suficiente material fungible compatible con la infraestructura de la que se dispone en cada centro, con objeto de hacer un diagnóstico rápido y fiable10.
La PCR es una técnica muy sensible y específica, que se realiza en los laboratorios de microbiología para el diagnóstico de diversas enfermedades infecciosas. Por estos motivos, actualmente la PCR es la técnica diagnóstica de referencia. Según los datos recopilados, los hospitales y centros sanitarios españoles inicialmente realizan unas 15.000 PCR al día, cifra que ha ido adaptándose en función de la demanda. La realización de un número tan elevado de determinaciones conlleva la necesidad de suministrar de manera continuada no solo los kits de PCR, sino otros muchos materiales necesarios, como torundas y medios de transporte para la toma de muestras, soluciones de inactivación, reactivos de extracción y diferentes tipos de material plástico. Las determinaciones analíticas con PCR siempre deben ser realizadas por personal experimentado y suelen tardar varias horas hasta ofrecer resultados11.
En España hay capacitados 13 laboratorios para realizar las PCR validados por el Instituto de Salud Carlos III (ISCIII) pertenecientes a 7 universidades y 6 centros de investigación, militares y veterinarios: Universidad de Alcalá de Henares, Centro de Investigación en Sanidad Animal (CISA), Universidad Complutense de Madrid, Centro Militar Veterinario de Madrid, Universidad de León, Laboratorio Regional de Sanidad Animal de León, Centro Biolab-Arcelormittal de I+D de Asturias, Universidad de La Laguna, Universidad de Valladolid, Fundación para el Fomento de la Investigación Sanitaria y Biomédica de la Comunidad Valenciana (FISABIO), Universidad de Castilla-La Mancha, Laboratorio de Identificación Rápida (LABIR) de la Unidad Militar de Emergencias (UME) y Universidad del País Vasco. Estos laboratorios, que según sus capacidades individuales realizan entre 50 y 450 PCR diarias, apoyan a los hospitales de su comunidad y, en algunos casos, prestan apoyo a universidades, centros de referencia, residencias y Cuerpos y Fuerzas de Seguridad del Estado12.
- ∘
Potenciales errores diagnósticos con la PCR
La interpretación de la PCR se debe hacer con prudencia dentro del contexto clínico, sobre todo cuando el resultado es negativo.
- -
Falsos negativos: pueden aparecer falsos negativos por distintas circunstancias; por ejemplo: toma inadecuada de la muestra, por retraso en el transporte, por error en el etiquetado de la muestra a lo largo del proceso. Además, en caso de elevada sospecha clínica y resultado negativo de la PCR su interpretación debe hacerse con prudencia, y se recomienda repetir el estudio4.
- -
Falsos positivos: errores en el etiquetado de la muestra a lo largo del proceso, por contaminación cruzada entre muestras.
- ∘
Tipos de muestras
Muestras del tracto respiratorio:
- a.
Superior: exudado nasofaríngeo/orofaríngeo en pacientes ambulatorios13.
- b.
Inferior: preferentemente lavado broncoalveolar, esputo (si es posible) y/o aspirado endotraqueal especialmente en pacientes con enfermedad respiratoria grave10.
Si un paciente no tiene signos o síntomas de infección del tracto respiratorio inferior o si la toma de muestras del tracto respiratorio inferior está clínicamente indicada, pero no es posible su recolección, se puede optar por estudiar solamente las muestras respiratorias de tracto superior.
Si las pruebas iniciales son negativas en un paciente con una alta sospecha clínica y epidemiológica para SARS-CoV-2, se puede sospechar de falso negativo4 (especialmente cuando solo se han recogido muestras de tracto respiratorio superior o la muestra recogida inicialmente no estaba tomada adecuadamente). Se podrán extraer muestras adicionales, como sangre, orina o heces10. Según las recomendaciones de la CDC europea, solo se podrá confirmar que un paciente ha superado la enfermedad de COVID-19 cuando se obtengan 2 resultados negativos de rt-PCR pasadas 24h o más entre ambos14,15.
Test de detección de anticuerpos (IgG e IGM) y anticuerpos totales (Ab)En respuesta a la creciente pandemia de COVID-19 y la escasez de capacidad y reactivos de pruebas moleculares basadas en laboratorio, múltiples fabricantes de pruebas de diagnóstico han desarrollado y comenzado a vender dispositivos rápidos y fáciles de usar para facilitar las pruebas fuera de los entornos de laboratorio16. Estos kits de pruebas simples se basan en la detección de anticuerpos humanos generados en respuesta a la infección17.
Los test de anticuerpos o serológicos fueron primeramente utilizados por la Duke-NUS Medical School en Singapur. Las pruebas de anticuerpos son diferentes a las PCR porque requieren conocimiento sobre las proteínas que forman la capa viral, específicamente, aquellas proteínas a las que el sistema inmunitario responde desencadenando la producción de anticuerpos que pretenden marcar o neutralizar el virus18.
Los estudios de dinámica de generación de anticuerpos frente a SARS-CoV-2 han mostrado que estos comienzan a producirse a partir del 6.o día del inicio de síntomas a la vez que se observa un descenso de la carga viral. A los 7 días, casi la mitad de los casos tienen anticuerpos totales y a los 15 días casi el 100%, tanto en los casos leves como los graves16. Basado en esto, las técnicas de anticuerpos buscan detectar la respuesta inmune de los pacientes, la cual aumenta según avanza la infección, y ofrecen por tanto la posibilidad de detectar enfermedad activa de varios días de evolución. La presencia de anticuerpos, por otro lado, no excluye la posibilidad de seguir siendo transmisor del virus11 ni tampoco certeza que los mismos sean neutralizantes de cara a futuras infecciones o que provean de inmunidad19.
Existen dos métodos para la detección de los mismos:
- -
Por inmunocromatografía lateral (lateral flow)
Son los denominados kits rápidos por digitopunción. Tienen la ventaja de su fácil uso, no requieren de personal especializado ni para la extracción ni para la realización. Hay diferentes tipos de kits, según detecten los anticuerpos totales (Ab) o específicos (IgG e IgM)20.
El resultado se puede dar en unos 15min. La detección de ambas inmunoglobulinas se interpreta como infección subaguda en curso. Son test sencillos de hacer, pero deben ser interpretados con prudencia, en relación con el curso de la infección, sobre todo por la tasa de falsos negativos en la detección de IgM ya que la respuesta de IgM en un enfermo COVID-19 puede tardar en aparecer desde varios días a 2 semanas21.
Algunos estudios han mostrado que durante los primeros 7 días desde el inicio de síntomas, menos de un 40% de pacientes presentan anticuerpos IgM detectables. Así, estas pruebas no deben ser usadas para descartar un caso durante los primeros días de enfermedad (periodo ventana). Asimismo, la detección de anticuerpos (IgG) después del día 7 solo indica contacto previo con el virus, pero no es útil para confirmar la presencia y excreción del virus, ni descarta enfermedad COVID-19 activa mientras persisten IgM. Servirían también para determinar si se genera inmunidad tras la infección. Este tipo de test se realiza en sangre capilar19.
- -
Por técnica ELISA o inmunoquimioluminiscencia
Requieren personal especializado para la toma de muestra sanguínea por venopunción y de equipamiento específico. Tienen la ventaja que permiten conocer la clase y subclase de inmunoglobulinas, así como la cuantificación de las mismas. Estos son más adecuados para poder realizar estudios cinéticos que permitan analizar de forma adecuada la respuesta inmunitaria frente a SARS-CoV-2. Los resultados pueden estar entre una y tres horas. Según la Sociedad Española de Inmunología, se recomienda realizar este tipo de test para el seguimiento de los pacientes infectados20.
Las pruebas para detectar respuestas de anticuerpos en la población son críticas para apoyar el desarrollo de vacunas y para aumentar nuestra comprensión del alcance de la infección. Pueden, por tanto, ser usadas en estudios epidemiológicos y de vigilancia, así como para identificar pacientes que pueden convertirse en donantes de suero convalecientes para protocolos de tratamiento experimental22. Sin embargo, para el diagnóstico clínico, tales pruebas tienen una utilidad limitada porque no pueden diagnosticar precozmente una infección aguda17. La limitación más importante es su valor predictivo negativo bajo, por lo que un resultado negativo no excluye posible infección23 y, por lo tanto, no puede utilizarse como fundamento único para las decisiones sobre tratamiento o manejo de pacientes18,22.
Test de detección de antígenos en exudado nasofaríngeo u otras muestras respiratorias de vías altas/bajasOtro tipo de prueba de diagnóstico rápido (RDT) detecta la presencia de proteínas virales (antígenos) expresadas por el virus COVID-19 en una muestra del tracto respiratorio de una persona24. Si el antígeno objetivo está presente en concentraciones suficientes, se unirá a anticuerpos específicos fijados a una tira de papel dentro de un cubículo de plástico generando una señal visualmente detectable a los 30min. Los antígenos detectados se expresan solo cuando el virus se replica activamente; por lo tanto, tales pruebas están diseñadas para identificar infecciones agudas o tempranas17,19.
Son menos sensibles que la PCR. En pacientes con síntomas y resultado negativo es preciso realizar una PCR de confirmación. Fueron los primeros adquiridos por el Ministerio de Sanidad y testados por el ISCIII detectando una sensibilidad muy baja en los test valorados. Son más sofisticados desde el punto de vista del desarrollo y los testados hasta el momento han presentado baja sensibilidad en vida real. Existen numerosas empresas que los están desarrollando. Aún disponemos de pocos datos sobre la sensibilidad y especificidad de la detección de antígeno de SARS-CoV-19 en frotis nasofaríngeo25. Es más, la Organización Mundial de la Salud no recomienda, por el momento, el uso de estos Ag RDT17.
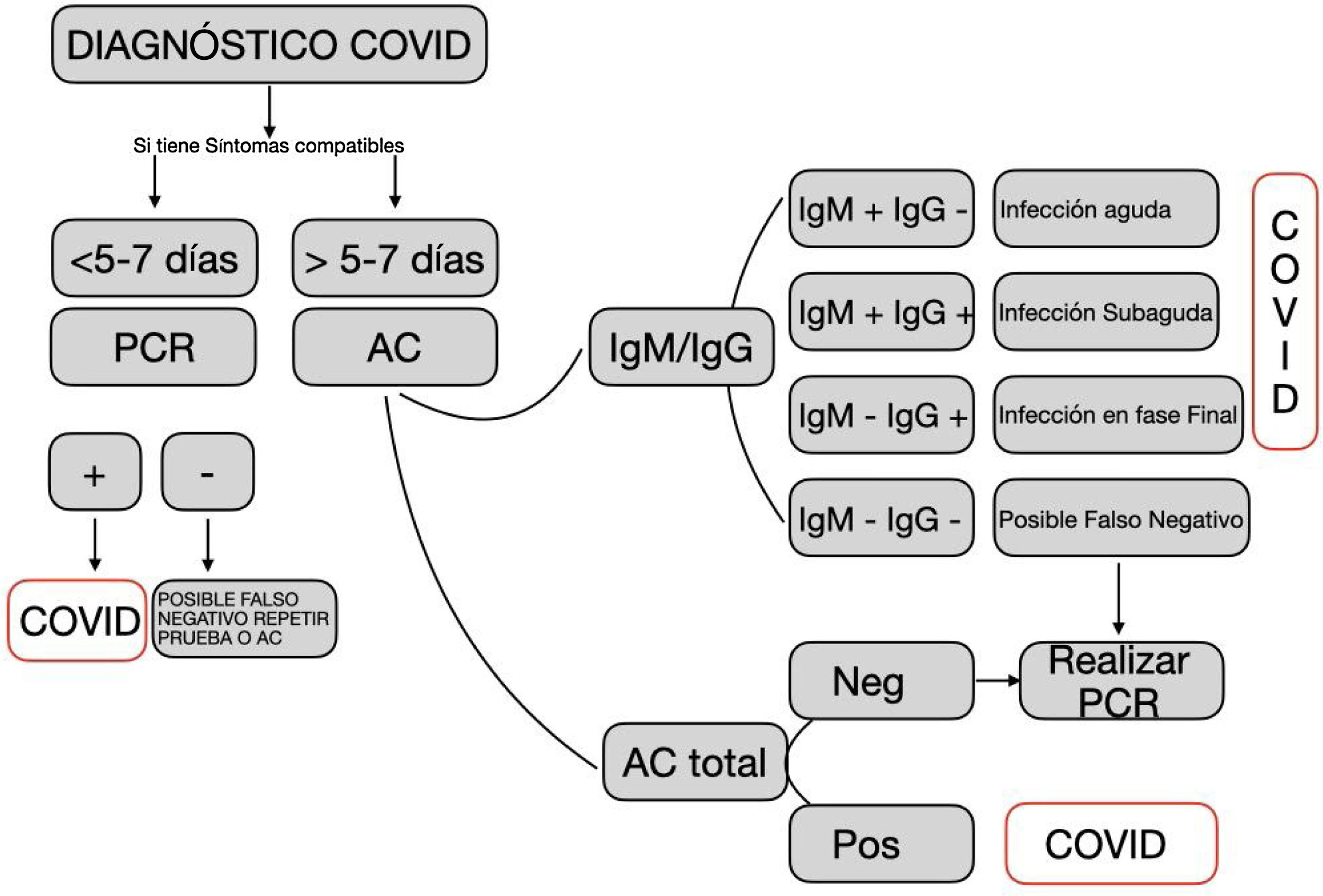
En la figura 1 y tabla 1 se muestran los criterios para la interpretación de los distintos resultados según el tipo de prueba.
Criterios de utilización e interpretación de los tests diagnósticos frente a la COVID-19. Fuente: Elaborada a partir del documento: «Indicaciones y procedimiento de utilización de test diagnósticos de infección COVID-19»25.
Resumen general de interpretación de resultados
| PCR | Ag | IgM | IgG | Interpretación |
|---|---|---|---|---|
| + | − | − | − | Fase presintomática |
| + | +/− | +/− | +/− | Fase inicial (aprox. 1-7 días) |
| +/− | − | + | +/− | 2.ª Fase (8-14 días) |
| +/− | − | ++ | ++ | 3.ª Fase >15 días |
| − | − | +/− | ++ | Infección pasada (inmune) |
Fuente: Ministerio de Sanidad19.
La recogida de muestras puede darse en ámbito hospitalario o comunitario e instituciones residenciales. Se considera imprescindible tener al menos 2 profesionales para la toma de muestras: enfermera o médico en su ausencia, en contacto directo con el paciente y TCAE; esta última se encargará de verificar la correcta identificación de las muestras y forma de transporte y refrigeración.
- En el hospital la recogida de muestra del paciente deberá ser preferentemente en su box o habitación evitando desplazamientos y posible infección cruzada. Las pruebas de PCR son las de elección en hospitales10,25.
- En el ámbito comunitario se realiza la toma de muestras en residencias y centros sociosanitarios del ámbito público o privado. Se priorizará según el mayor número de personas a cribar; se realizarán primero aquellos centros en los que haya habido algún caso positivo de COVID-19. Un equipo del Servicio de Urgencias o un equipo especial formado para intervención domiciliaria y toma de muestras COVID se desplazará hasta la institución. Las pruebas se realizarán al conjunto de residentes, trabajadores y/o colaboradores estables en la institución que pudiesen originar un riesgo de transmisión en el centro. El protocolo de actuación en los centros residenciales de mayores del Gobierno de Canarias y avalados por los últimos datos científicos recogidos en la literatura añade que se desaconseja el uso de test rápidos en población asintomática, por lo que es conveniente realizar PCR y test rápidos conjuntamente26. El único criterio de exclusión para la realización de las dos pruebas será en aquellas personas que ya hayan tenido una PCR positiva y confirmada de COVID-19; en ese caso se realizará solamente el test rápido26. Si el paciente no puede desplazarse de su casa, el equipo de toma de muestras del Servicio de Urgencias o Atención Primaria lo hará en su domicilio. Si por el contrario el usuario puede desplazarse, la toma de muestra se puede hacer en centros preparados para ello. En la comunidad autónoma de Canarias, por ejemplo, se puso inicialmente a disposición un centro de exposiciones con la capacidad de realizar hasta 1.080 pruebas al día27. Algunas comunidades como Galicia, Andalucía y Canarias a mediados de marzo adaptaron nuevos espacios de recogida de muestra para usuarios en su propio vehículo, aportando grandes ventajas. El usuario citado previamente acudía a hacerse la prueba sin bajar de su coche, a esta forma se le denominó «auto-covid»28,29. Las indicaciones que deben seguir son las siguientes: acudir preferentemente solo en el vehículo con la ventanilla cerrada y mascarilla quirúrgica puesta. Si no dispone de mascarilla se le entrega una en el punto de control de identidad dejándola a través de la ventanilla del asiento contiguo. El usuario llega al punto de muestra y sin bajar la ventanilla recibe de nuevo instrucciones mediante carteles y pictogramas con el fin de informar y tranquilizar antes de la toma de muestra28. La enfermera realiza la toma de muestra a través de la propia ventanilla del vehículo.
Con estas dos maneras se agiliza la toma de muestras, se incrementa el número de test en menor tiempo y se optimiza el equipo de protección individual (EPI).
Procedimiento para la recogida de muestraSegún las recomendaciones del Ministerio de Sanidad del Gobierno español, entendemos la recogida de muestras como una exposición de riesgo, por lo tanto es imprescindible contar con EPI30. Es tan importante la correcta colocación del EPI como la retirada. La enfermera que proceda a la obtención de muestra deberá llevar un EPI para prevenir la transmisión de la infección de acuerdo con el riesgo de exposición31.
Muestra PCRSe necesita para la muestra respiratoria hisopo de algodón o poliéster, un contenedor con medio líquido para transportar el hisopo, un segundo embalaje que debe estar seco en su interior y un tercer embalaje que pueda soportar golpes10,32.
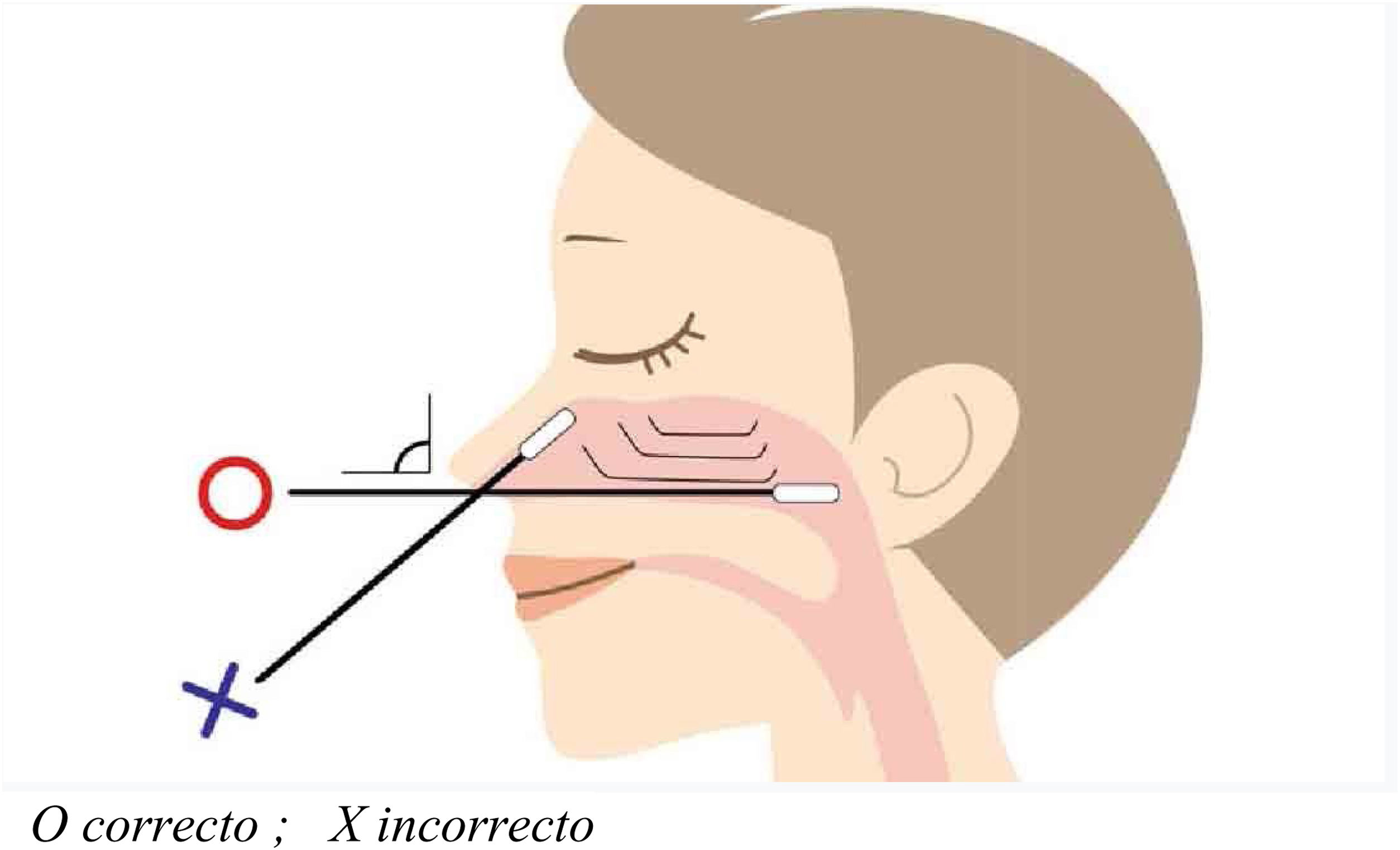
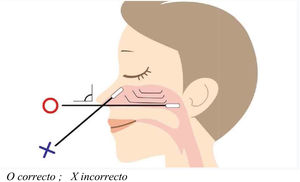
El procedimiento más común consistirá en la recogida de exudado de acceso orofaríngeo o nasofaríngeo (preferiblemente). Es necesario un hisopo seco con punta de algodón o fibra de poliéster; los hisopos de alginato cálcico hechos en material de madera no deben usarse pues podrían inactivar los virus y por tanto invalidar la PCR4,10,33. La obtención de la muestra se realizará por ambas cavidades nasales con el mismo hisopo, insertándose en cada fosa nasal paralela al paladar e introduciendo pasando las coanas hasta llegar a la pared nasofaríngea. Una vez allí se frota el hisopo con cuidado y es retirado con igual cuidado con movimientos rotatorios (fig. 2). Terminada la recogida, el hisopo se coloca en un vial que contiene de 2-3ml de medio de transporte y se desecha el resto del aplicador pudiéndose cerrar la muestra correctamente10,13,32.
Las muestras de PCR se deberán almacenar individualmente con la identificación correcta del usuario en un lugar a 4°C y según el protocolo del Ministerio de Sanidad, podrían estar refrigeradas a esa temperatura de 24 a 48h10,32.
Las muestras clínicas deben ser tratadas como potencialmente infecciosas y se consideran de categoría B: siguiendo la normativa UN3733 deben ser tratadas como otras muestras biológicas de este tipo y, si requieren transporte fuera del centro sanitario o domicilio a un laboratorio, serán transportadas en triple embalaje robusto y que soporte golpes10. Para mayor seguridad y refrigeración, la guía de actuación que preparó el Gobierno de Canarias consideró un cuarto embalaje en neveras transportables hasta los hospitales donde se encontraban los laboratorios de recogida28.
Test rápidos de anticuerpos (totales o específicos de IgG/IgM)Las muestras recomendadas para el diagnóstico por test serológico son de sangre obtenida por extracción de sangre vía venosa periférica o por digitopunción con lanceta25. Este tipo de recogida es más sencillo. La disposición del personal será la misma que la toma de muestra de PCR.
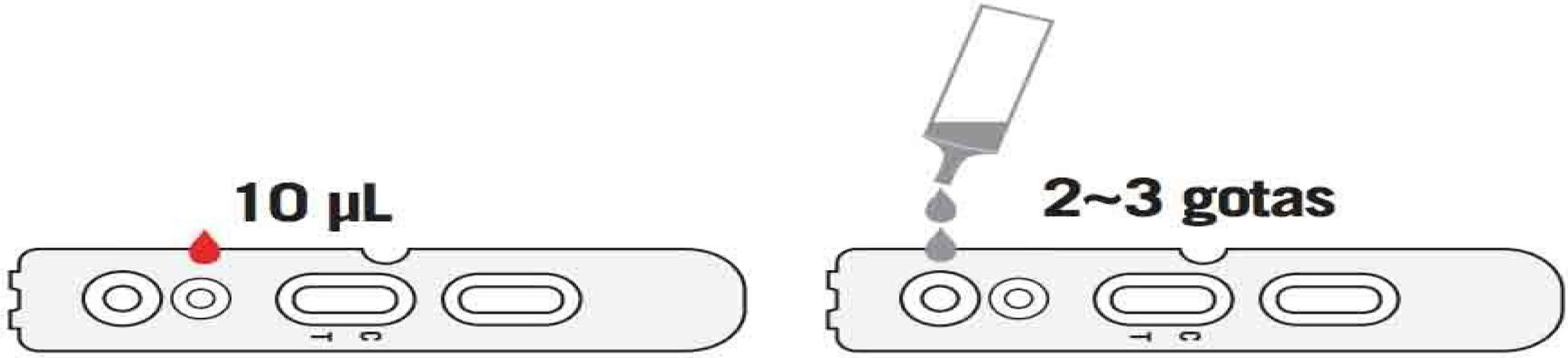
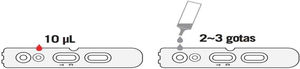
Para la toma de test rápido por capilaridad es necesario tener una gasa con suero fisiológico y otra seca para limpiar el dedo donde realizar la digitopunción, una lanceta, pipeta para la recogida segura de la muestra, cassette del fabricante, campo donde depositar el cassette.
Inmediatamente después, depositar el número de gotas que aparezca en la ficha técnica del fabricante (fig. 3) y esperar de 10 a 15min el resultado de la misma. Pasado este tiempo no es recomendable considerar el resultado como válido.
También es necesario disponer de un reloj visible para controlar los 10min además de formas de etiquetado de muestra como podría ser una pegatina donde anotar la identificación del usuario y la hora de la toma de muestra25.
Por último, el contenedor rígido de residuos biosanitarios clase III será el adecuado para desechar el EPI usado y todo residuo generado en cualquiera de ambas muestras10,32.
Discusión y conclusionesDada la alta especificidad y sensibilidad que posee, el test de preferencia para la confirmación diagnóstica de la COVID-19 es la rt-PCR, la cual, junto con los test de anticuerpos, nos pueden dar una idea de la fase infecciosa en la que se encuentran los pacientes. La recogida de dichas muestras es realizada por personal sanitario entrenado. Normalmente, labor de las enfermeras.
La Organización Mundial de la Salud ha instado repetidamente a los gobiernos a que realicen pruebas y rastreo (de la población). Singapur y Corea del Sur han utilizado con éxito este enfoque para contener sus brotes, mientras que Alemania también ha continuado realizando el rastreo de los contactos.
España protocolizó la realización de la rt-PCR a toda persona con cuadro de infección respiratoria hospitalizada o que cumpliera criterio de ingreso hospitalario, y persona con cuadro de infección aguda de cualquier gravedad que perteneciera a personal sanitario y sociosanitario y otros servicios esenciales.
Según los datos publicados en la Foundation for Innovative New Diagnostics (FIND) localizada en Ginebra, España ha pasado de realizar 37,4 test por cada 100.000 habitantes (dato del 15 de marzo) a 1.989 test por cada 100.000 habitantes (obtenido el 18 de abril) y 9.000 test en agosto de 202034.
La actual legislación española publica en el BOE del 14 de abril que los test diagnósticos para la detección de la COVID-19 se limitan a aquellos casos en los que exista prescripción previa por parte de un facultativo y se ajusten a criterios establecidos por la autoridad sanitaria competente. Cualquier entidad pública o privada que con relación a las pruebas diagnósticas de la COVID-19 adquieran hisopos para toma de muestras, medio de transporte de virus, reactivos de inactivación, kits de extracción de ácidos nucleicos, rt-PCR, o test rápidos diagnósticos deberán ponerlo en conocimiento de la autoridad sanitaria competente de la comunidad autónoma en la que se encuentran ubicados, con indicación expresa del tipo de material, número de unidades adquiridas y destino de uso.
Dada la situación actual de pandemia a nivel mundial, hay una elevada demanda de test por parte de todos los gobiernos hacia los laboratorios para proveer de suficientes kits a las distintas autoridades sanitarias gubernamentales.
Los principales laboratorios, localizados en China, Alemania y EE.UU., se encuentran en la carrera de elaboración de test rápidos para acelerar los procesos diagnósticos poblacionales. Recientemente, Medscape y The Scientist han publicado el 15 de abril la aprobación de la FDA (Food and Drug Administration) para elaborar PCR en muestra de saliva. Aun así, dichas muestras han de ser recogidas por personal experto y dentro de un entorno sanitario.
Dicha premura insta a que las certificaciones y controles que deben pasar los test por los organismos reguladores como FDA, CE, puedan ser menos estrictas y por ende aumentar los errores diagnósticos35. Es más, la CDC eliminó las recomendaciones de criterios de prueba restrictivos, instando a que los médicos usen su criterio clínico para determinar qué test diagnóstico es el que necesita cada paciente36.
En la crisis actual en la que vivimos con la pandemia de la COVID-19, el papel de la enfermera es esencial. Su labor en la toma de muestras, etiquetados, manipulación y manejo correcto, es el primer paso para obtener la información más certera posible. Esta crisis nos obliga a optimizar recursos y a flexibilizar aprendizajes a medida que se van añadiendo nuevos protocolos, procesos diagnósticos y procedimientos de toma de muestras. Por ello, es imprescindible disponer de información actualizada, sintetizada, protocolizada y basada en evidencia.
FinanciaciónNo existen fuentes de financiación públicas ni privadas.
Conflicto de interesesLos autores no declaran ningún conflicto de intereses.