Las técnicas continuas de reemplazo renal se utilizan como medio de depuración sanguínea en pacientes con fracaso renal agudo en situación crítica. Su efectividad depende, en parte, de la permeabilidad del circuito extracorpóreo, siendo la coagulación del filtro la causa más frecuente de interrupción del tratamiento. Esto conlleva riesgo de pérdida hemática para el paciente y prolongación de la terapia.
La heparina sódica es el anticoagulante más utilizado en estas técnicas, pero puede aumentar el riesgo de hemorragia. La anticoagulación regional con citrato ha demostrado ser un método más seguro en comparación con la heparina sódica.
El citrato es una sustancia que actúa inactivando (quelando) el calcio iónico que participa en la cascada de la coagulación. Se infunde a la entrada del circuito y se neutraliza su acción antes de llegar al paciente con reposición de calcio. Por esto se contempla como anticoagulante regional y no sistémico. Sin embargo, este sistema de anticoagulación, a pesar de estar indicado como primera opción por las guías Kidney Disease Improving Global Outcomes (KDIGO), aún no está muy extendido debido a la complejidad que lleva su uso. Requiere una formación específica del personal sanitario, en especial de las enfermeras, que serán las responsables del mantenimiento del circuito mientras dure la terapia.
En este artículo se quiere dar la base que se precisa sobre la anticoagulación en general y el citrato en particular, para llevar a cabo estos procedimientos con seguridad y eficacia.
Continuous renal replacement therapies are used as a means of blood clearance in critically ill patients with acute renal failure. Its effectiveness depends on the permeability of the extracorporeal circuit and filter coagulation is the most frequent cause of treatment interruption. This situation carries a risk of blood loss for the patient.
Sodium heparin is the most widely used anticoagulant in these therapies, but it can increase the risk of bleeding. Regional citrate anticoagulation is a safer method compared to sodium heparin.
Citrate is a substance that works by inactivating ionic calcium that participates in the coagulation cascade. It's infused at the inlet of the circuit and neutralized before reaching the patient with calcium replacement. For this reason, it is considered a regional and non-systemic anticoagulant.
However, this anticoagulation system, despite being indicated as the first option by the KDIGO guidelines (Kidney Disease Improving Outcomes), is not yet widespread due to the complexity of its use. It requires specific training for healthcare personnel, especially nurses, who will be responsible for maintaining the circuit while the therapy lasts.
In this article we want to provide the necessary knowledge about anticoagulation to carry out these procedures safely and effectively.
La coagulación de los circuitos, y en especial de los filtros, es la complicación más frecuente en las técnicas continuas de reemplazo renal (TCRR). Supone un importante gasto sanitario de material fungible, tiempo de trabajo del personal asistencial, pérdida de sangre del paciente (aproximadamente 200 mL por cada circuito coagulado), y además, prolongación de las horas de tratamiento. Así, se puede considerar que aunque son técnicas continuas, su aplicación no funciona las 24 h del día, disminuyendo la eficacia del tratamiento1–5. Son varios los factores que favorecen la coagulación de catéteres, líneas y filtros. En primer lugar, el contacto de la sangre con material extraño activa las células, formando agregados plaquetarios y activando la cascada de coagulación hasta llegar a la formación de fibrina y finalmente al coágulo. En segundo lugar, se activa al contacto de la sangre con el aire que queda en los capilares del hemofiltro tras un mal purgado o en el cazaburbujas. En tercer lugar, las características reológicas de la sangre como serían las turbulencias, principalmente en catéter y conexiones. Cualquier factor que cause un cambio de diámetro en la vía sanguínea, favorecerá la formación de trombo.
Existen algunas medidas encaminadas a mejorar la duración de los circuitos: la reposición prefiltro, la velocidad de la bomba hemática, el control de la fracción de filtración (mantenida por debajo del 25%). Las emboladas de suero no han demostrado aumento de la eficacia en este campo. El correcto diseño de los circuitos y un buen catéter proporcionan mayor duración de la terapia y menos interrupciones de tratamiento6–9. Estas medidas serán de mucha importancia en aquellos casos en que se deba optar por no anticoagular los circuitos. En la mayoría de los casos será necesario utilizar algún fármaco anticoagulante, procurando que tenga el menor efecto sistémico posible y reduciendo al mínimo las complicaciones hemorrágicas que han sido descritas entre el 5 y el 26% de los pacientes, como es el caso de la heparina10.
El fármaco ideal en las TCRR debe prevenir la coagulación del circuito sin inducir hemorragia y debería poseer los siguientes requisitos: (a) vida media corta; (b) acción limitada al circuito extracorpóreo; (c) fácil monitorización; (d) ausencia de efectos adversos sistémicos; y (e) disponer de antagonista en caso de necesidad. En el momento actual, ninguno de los anticoagulantes disponibles puede llegar a cumplir estas premisas. En la práctica diaria, la experiencia previa con una técnica suele ser el mayor condicionante para elegir la anticoagulación.
ObjetivoProporcionar una base teórica fundamental en los conceptos clave asociados a la coagulación de la sangre y el mantenimiento de la permeabilidad de los circuitos de TCRR.
Hemostasia y coagulaciónLa coagulación sanguínea es el proceso por el cual diversos componentes de la sangre líquida se transforman en material semisólido, el coágulo sanguíneo.
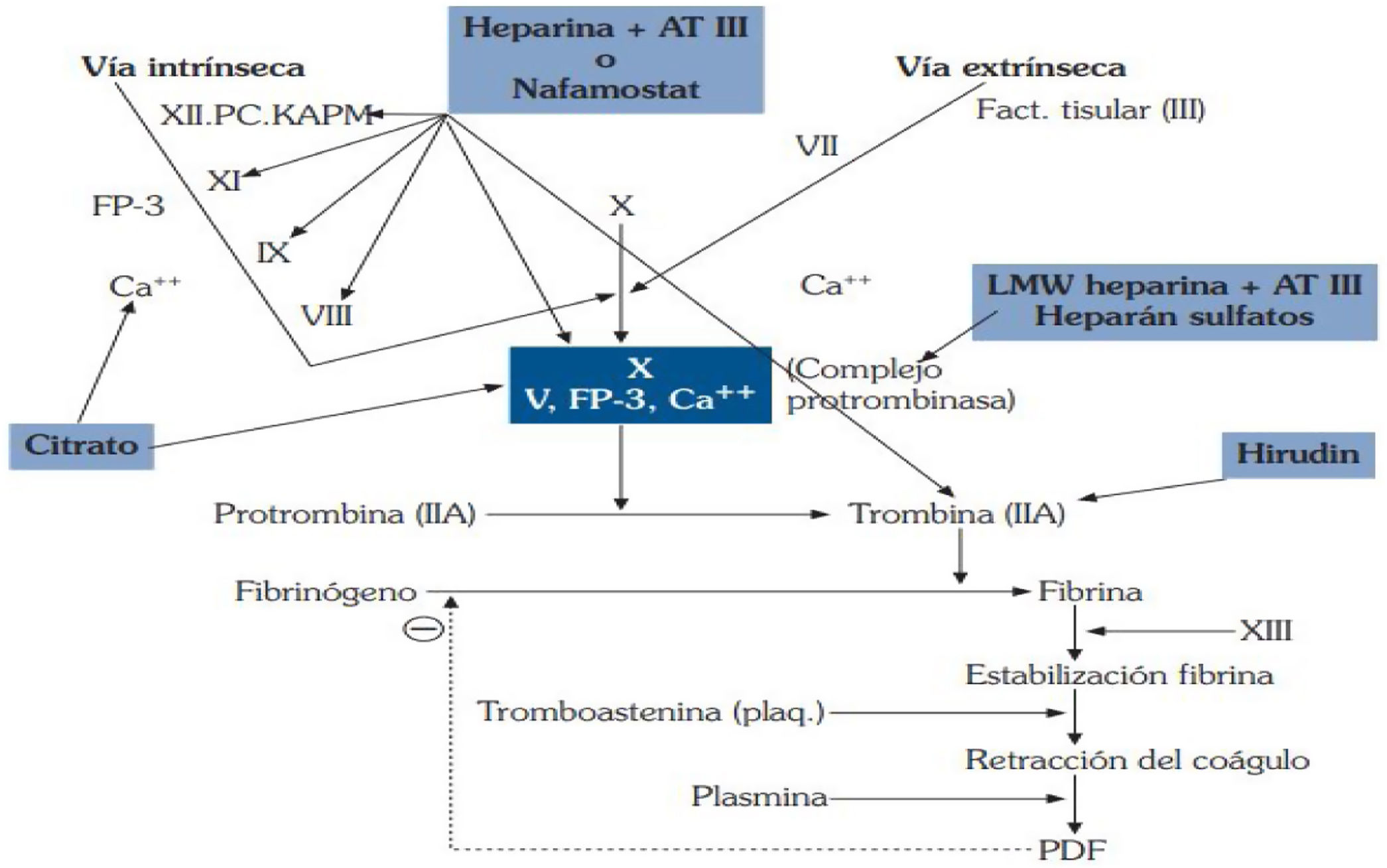
La coagulación depende del equilibrio entre dos tipos de sustancias: las que favorecen la coagulación o procoagulantes y las que la inhiben o anticoagulantes. Es un sistema de proteínas inactivas que circulan en el plasma y que, mediante un proceso de activación o proteólisis, transforma una proteína soluble como el fibrinógeno en una insoluble de fibrina o trombo. La coagulación tiene lugar en tres etapas11: (a) formación del activador de la protrombina (vía extrínseca e intrínseca); (b) conversión de la protrombina en trombina (vía común) y (c) conversión del fibrinógeno en fibrina (vía común). La cascada de reacciones de la coagulación termina en la formación de cadenas de fibrina. Pueden producirse por los siguientes mecanismos: mecanismos de contacto, activándose el factor XII o Hageman y desencadenando la vía intrínseca, o por la liberación de mediadores tisulares, dando lugar a la vía extrínseca. El proceso culmina con la formación de fibrina mediada por la plasmina. En todo este proceso se encuentran implicadas varias enzimas, manteniéndose un buen equilibrio. El calcio juega un papel muy importante como cofactor en diferentes fases (activación de los factores XI y IX y la acción de la trombina para el paso de protrombina a trombina) (fig. 1).
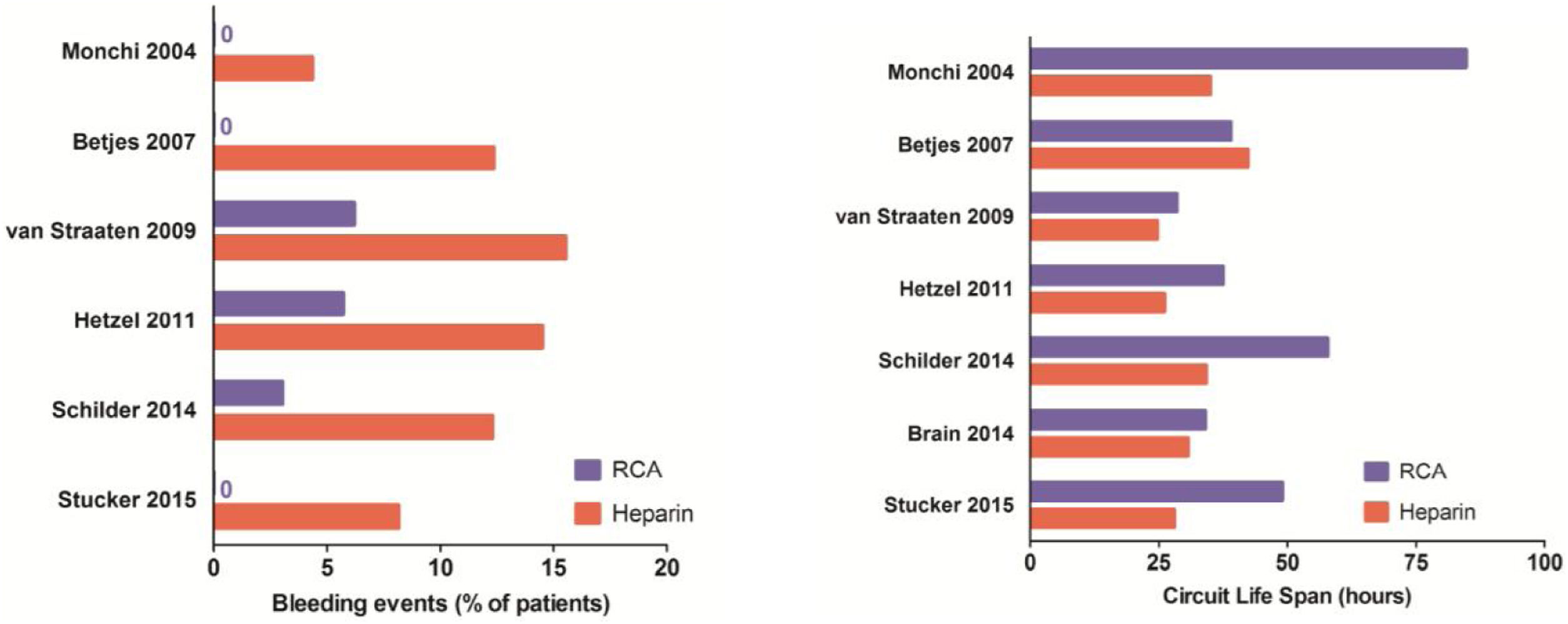
Metaanálisis de trabajos publicados sobre heparina vs. citrato. Diferencias entre vida media de los circuitos y los episodios de sangrado en los pacientes. Tomado de: Branderburger et al.14.
Las pruebas de laboratorio más significativas en este ámbito que conviene considerar son las siguientes:
a) Recuento plaquetar: los valores normales se encuentran entre 150.000 y 400.000 plaquetas por μL de sangre, con cierta variación según la edad, principalmente12.
b) Tiempo parcial de tromboplastina activado (APPT): evalúa la vía intrínseca de la coagulación. Esta prueba toma su nombre de la utilización de tromboplastina parcial o cefalina, que es un componente fosfolipídico que se añade a una muestra que ha sido activada por la exposición a una carga negativa (caolín, celita o ácido elágico). Su valor normal se sitúa entre 25 y 45 s. Mide el tiempo que tarda en formarse un coágulo en la sangre.
c) Tiempo o índice de protrombina y el INR: el International Normalized Ratio es el cociente entre el tiempo de protrombina del paciente y el del control del laboratorio. Su valor normal está entre 0,9 y 1,2. Evalúa la vía extrínseca de la cascada de coagulación.
d) Concentración de calcio: el ion calcio (rango de normalidad: 1,05-1,3 en adultos)12 juega un papel fundamental acelerando las reacciones tanto en la vía extrínseca como en la intrínseca. Participa de forma continua en la cascada de coagulación. Una reducción del ion calcio en sangre provocara que no se coagule de manera rápida o que la coagulación sea más dificultosa. El calcio total en sangre tiene un rango de normalidad entre 2,25 y 2,62 mmol/L.
e) Tiempo de coagulación activado (TCA): se trata de una prueba específica para medir la actividad o la inhibición de la cascada intrínseca de la coagulación. Su valor normal basal es de 70 a 120 s12.
Opciones de anticoagulación en TCRR. Heparina/citratoHeparina no fraccionadaLa heparina no fraccionada es un glucosaminoglucano con un peso molecular que varía entre 5 y 100 kDa. Tiene una vida media de 30 a 90 min y puede aumentar hasta 3 h en caso de fracaso renal. Su mecanismo de acción se basa en su capacidad de unión a la antitrombina III y la inactivación de factores de coagulación (IIa, IXa y Xa), que resultan en la inhibición de la formación de trombina potenciando la antitrombina y el factor inhibidor XIIa, con la consiguiente neutralización del efecto coagulante. La deficiencia de antitrombina III (AT III) conlleva una resistencia a la acción de la heparina, por lo tanto, es importante conocer el nivel sérico de AT III. Las heparinas no poseen una acción antitrombótica propia directa, sino que dependen de la AT para expresar su efecto. En presencia de heparina, la AT sufre un cambio estructural que hace más accesible su centro activo, acelerando así del orden de 1000 veces su actividad anticoagulante13.
Por otro lado, el uso de heparina en los pacientes críticos puede tener algunas complicaciones debido a su efecto sistémico que puede aumentar el riesgo de sangrado. En ocasiones pueden predisponer a cierta resistencia a la heparina por bajos niveles de antitrombina III. Nada despreciable resulta la trombocitopenia inducida por heparina (HIT) que, en pacientes médicos o quirúrgicos, puede llegar a ser del 1 al 17%, dependiendo del tipo y dosis de heparina14,15. Algunos autores proponen anticoagular con argatroban en los casos de HIT14 y otros proponen hacerlo con citrato16. Curiosamente, a pesar de estos riesgos mencionados, sigue siendo el anticoagulante más usado en algunos centros14,16–19. Idealmente la perfusión de heparina se debe administrar lo más cerca posible del acceso vascular y en forma diluida para disminuir su adsorción a las superficies plásticas y maximizar su mezcla con la sangre. Hoy en día, las máquinas de TCRR cuentan con una jeringa que infunde heparina en forma relativamente concentrada a un sitio entre la bomba de sangre y el filtro, dejando solo la parte del circuito proximal sin anticoagulación. Es aconsejable cambiarla cada 24 h para asegurar la máxima eficacia del fármaco. Se han desarrollado numerosos protocolos de heparina para las TCRR. La mayoría empiezan con bolos iniciales de 10-30 UI/kg, seguido de infusión continua entre 3-20 UI/kg/h. Esta dosis se puede monitorizar y ajustar según el tiempo de tromboplastina parcial (TTP) (valores entre 1,5 y 2,5 veces los normales) o el tiempo de coagulación activado (140-180 s). El bolo inicial de heparina es frecuentemente reducido a la mitad u omitido en pacientes que presentan alto riesgo de sangrado, aunque la eficacia de este régimen en prevenir sangrados no se ha podido demostrar. Las guías KDIGO aconsejan no utilizar heparina en el circuito extracorpóreo en pacientes que lleven anticoagulación sistémica de base5.
Hay autores que han optado por anticoagular con citrato y añadir heparina al circuito extracorpóreo en circunstancias concretas, como la infección por coronavirus asociada a fracaso renal19.
CitratoEl citrato se define como una sal del ácido cítrico. El citrato sódico Na3C6H5O7 forma complejos con cationes divalentes como el magnesio y el calcio, quelando ambos iones.
Dado que el calcio interviene en muchas fases de la cascada de coagulación (tanto en la vía intrínseca como en la extrínseca), el hecho de que el citrato quele el calcio iónico, dificulta la coagulación de la sangre.
IndicacionesParece ser un método eficaz de anticoagulación para TCRR en pacientes con contraindicación a la heparina e incluso como método de elección. Una característica muy importante del uso de citrato es que se trata de una anticoagulación regional, lo que disminuye el riesgo de sangrado del paciente Las últimas guías KDIGO, lo aconsejan como primera elección si hay disponibilidad de su uso y la experiencia del hospital es grande, ya que requiere una importante formación previa al personal, tanto médicos como enfermeras5,6. Se han evaluado en varios estudios la diferencia entre heparina y citrato en cuanto a episodios de sangrado y vida media de los filtros, principalmente. En la figura 2 podemos ver unos resultados muy representativos de un metaanálisis. De igual manera se han comparado en costos, en diferentes contextos, dando como resultado favorable la implementación de citrato frente a heparina por la propia duración de los circuitos a pesar de que los líquidos que usa el citrato son más caros20,21.
Cascada de la coagulación10.
Tomado de: Gainza FJ. ERGON, 2005.
El citrato está recomendado con una evidencia grado A para los pacientes sin fallo hepático22. La contraindicación más importante de anticoagular con citrato es la insuficiencia hepática severa, aunque algunos autores han obtenido buenos resultados en pacientes con fallo hepático, recomendando una vigilancia estrecha en la monitorización del estado ácido-base y el balance hidroelectrolítico23–25. Es importante recordar que el citrato es un éster del ácido cítrico de cuyo metabolismo resultan tres moléculas de bicarbonato. Gran parte de este metabolismo (ciclo de Krebs) tiene lugar en la mitocondria del hígado. Ante una disfunción hepática severa se podría producir una intolerancia al citrato, acumulándose el complejo citrato-calcio. Este hecho podría dar lugar a una disminución de calcio ionizado sistémico del paciente y a un aumento de la concentración de calcio total, porque la acumulación de complejo citrato-calcio contribuye al aumento del calcio total en sangre. De ahí que se establezca como dato indirecto de acumulación de citrato el cálculo de la ratio calcio total/calcio iónico, planteando como nivel máximo un valor de 2,5 en varios estudios22,26,27. Además, habrá una acidosis metabólica al no metabolizarse el citrato. Otro problema relacionado con el tratamiento con citrato sería la imposibilidad de realizar hemofiltración de alto volumen, por la alta cantidad de molécula que entraría al torrente sanguíneo al precisar aumento de velocidad en la bomba hemática. También hay que tener precaución en casos de transfusión de gran cantidad de hemoderivados por el citrato utilizado en las bolsas.
Manejo de la terapia con citratoConceptos claveEn el torrente sanguíneo, el calcio circula básicamente en forma libre o unido a proteínas. La forma libre, denominada calcio ionizado, es la que actúa en la cascada de coagulación. El citrato, al entrar en la línea aferente del circuito extracorpóreo, forma un complejo con el calcio ionizado de la sangre. Este proceso provoca una disminución de la concentración de calcio ionizado en el circuito, de tal forma que se interrumpe la coagulación dentro del set. Se debe recordar que también actúa quelando el magnesio, por lo que también se puede esperar una disminución de este ion en el paciente si no se repone adecuadamente.
Dependiendo del modo de tratamiento y de las velocidades de bombas, un porcentaje del complejo calcio-citrato de la sangre se elimina a través del hemofiltro y se pierde por el efluente. De esta manera, el paciente solo recibe una parte del citrato administrado al circuito. Con la participación de los riñones, músculos y principalmente por el hígado, 1 mmol de citrato se convierte en 3 mmol de bicarbonato. Esto da como resultado una alcalinización del pH. También el calcio iónico (liberado del calcio-citrato) está disponible para la cascada de la coagulación15.
La cantidad de calcio (fijada al complejo calcio-citrato) que se pierde a través del filtro y se elimina por el efluente, debe compensarse para evitar la hipocalcemia del paciente. Esto se hace en la parte distal del circuito extracorpóreo, o bien a través de una bomba de infusión a una vía venosa (preferiblemente central) del paciente. Es necesario monitorizar el nivel del calcio iónico sistémico para saber la cantidad de calcio que debemos infundir al paciente. La muestra puede ser arterial o venosa, pero preferiblemente obtenida fuera del circuito extracorpóreo, para aumentar su fiabilidad. Esta reposición de calcio se realiza mediante cloruro o gluconato cálcicos en la dilución que se acuerde con la casa comercial que fabrica el citrato, ya que debe introducirse en el software de cada monitor.
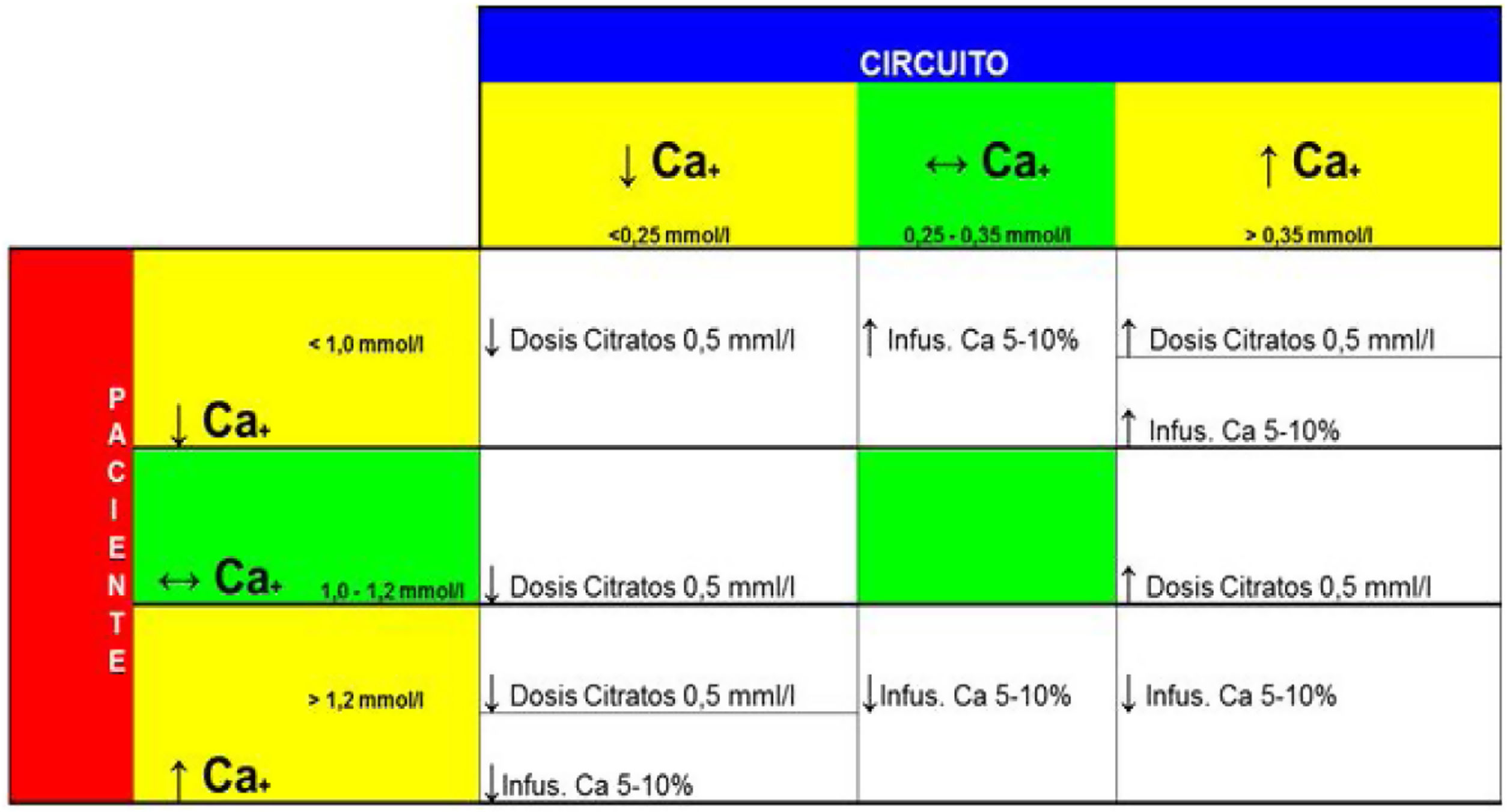
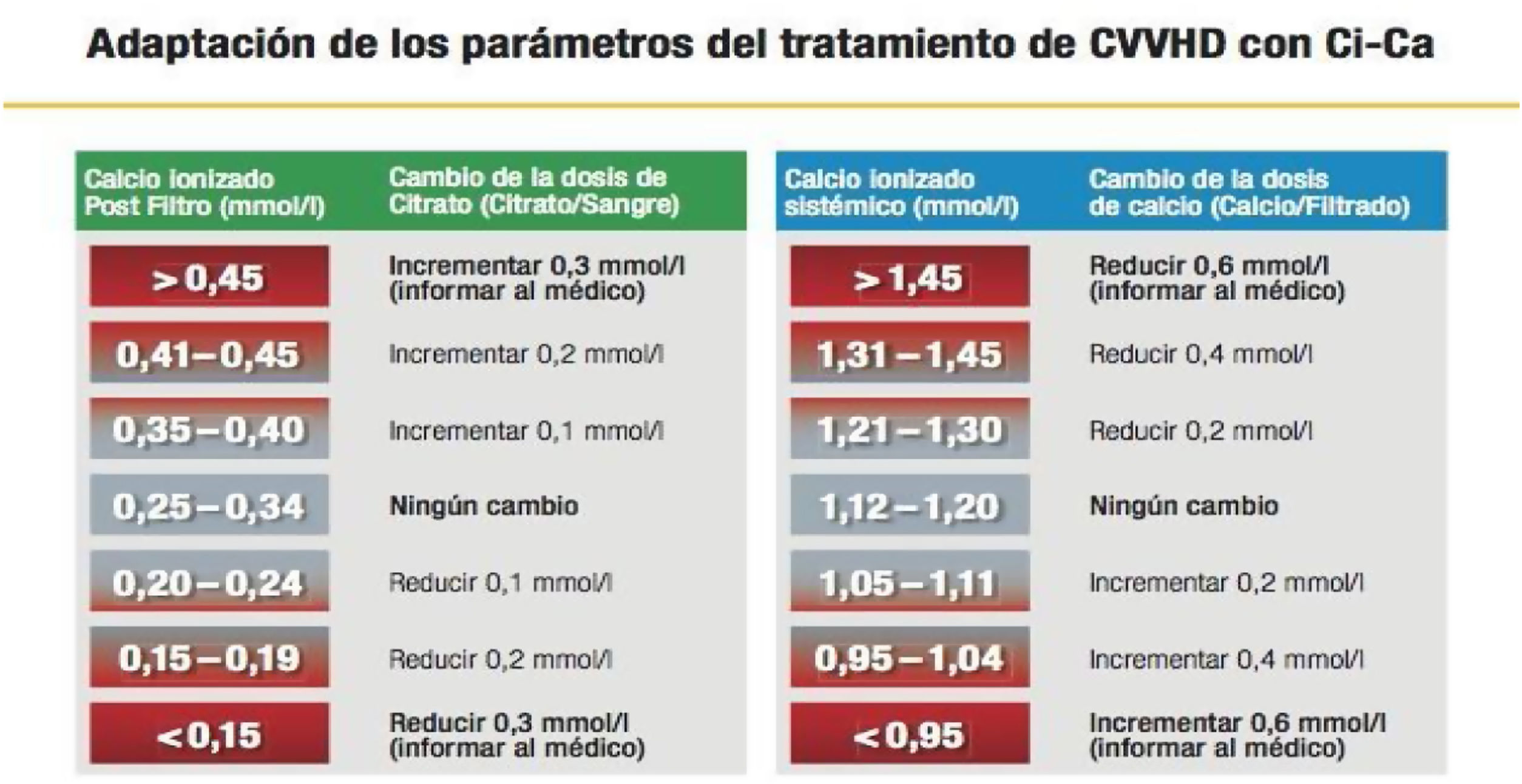
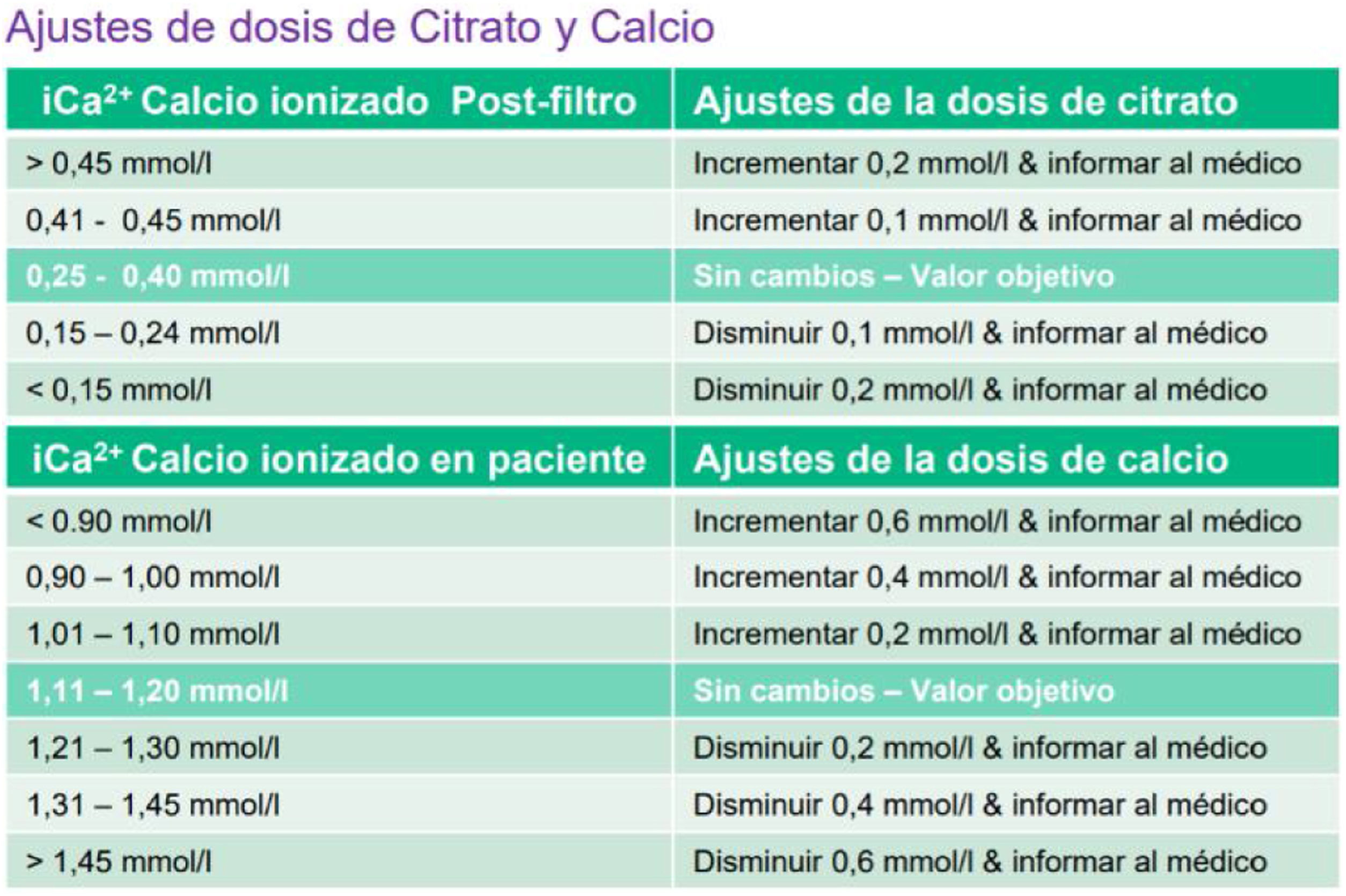
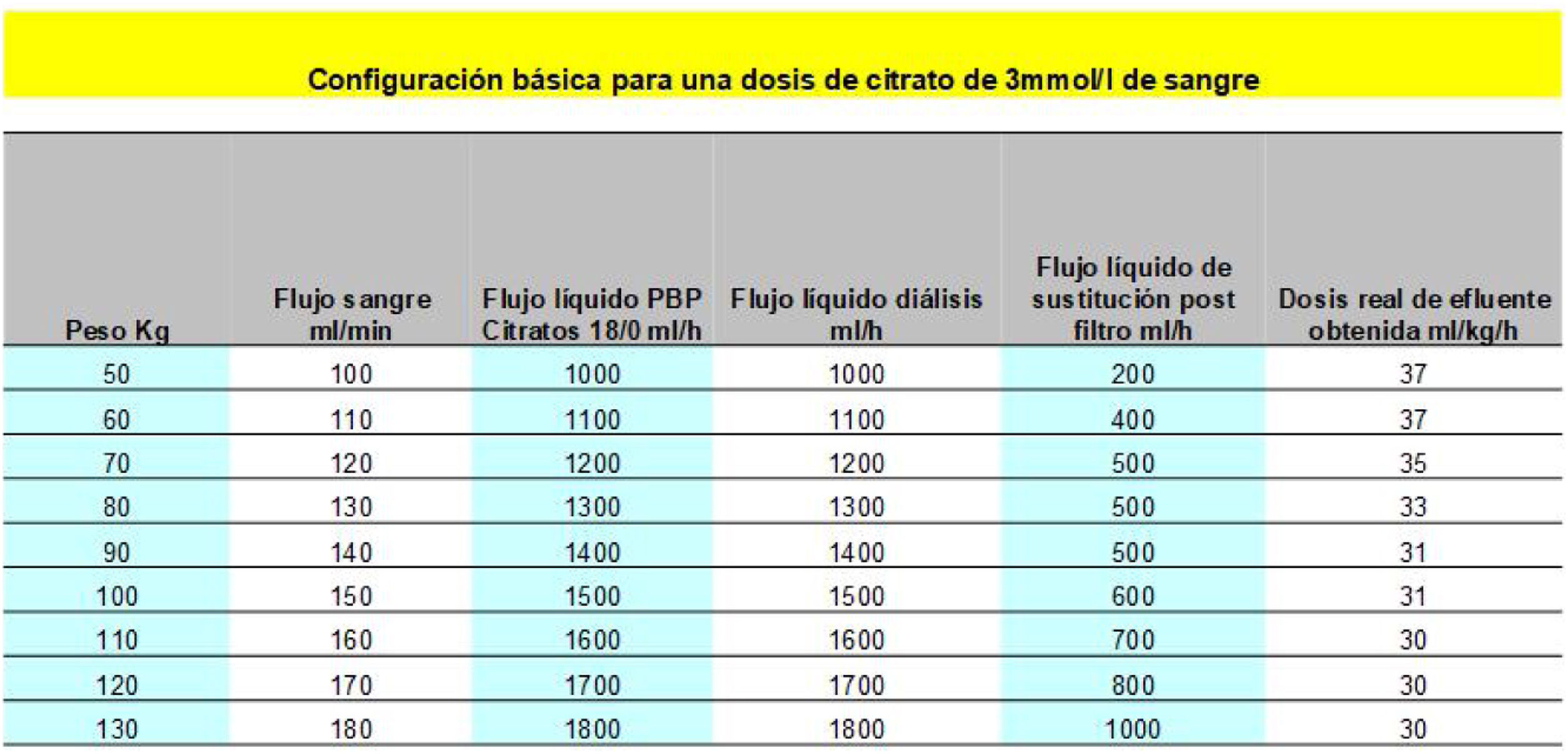
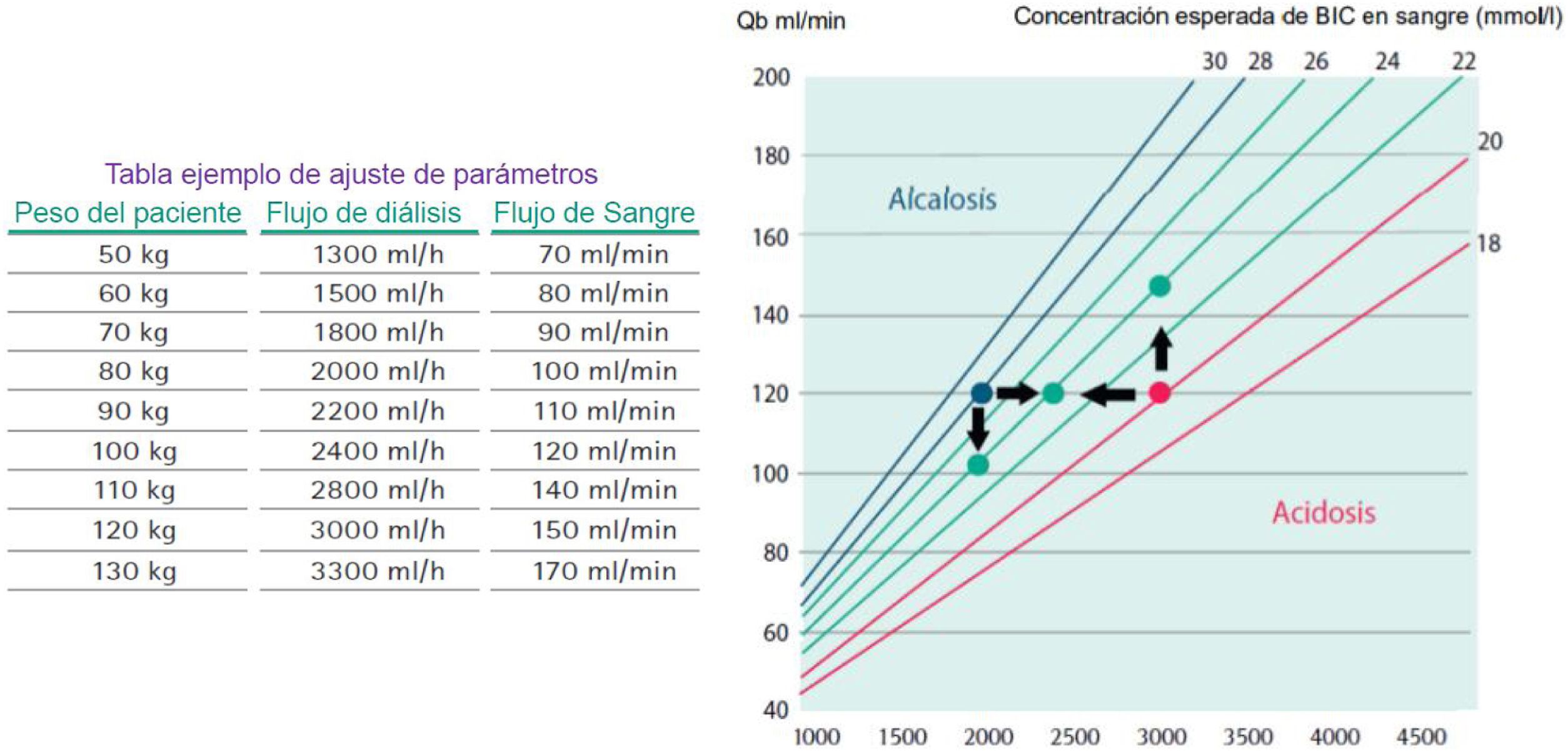
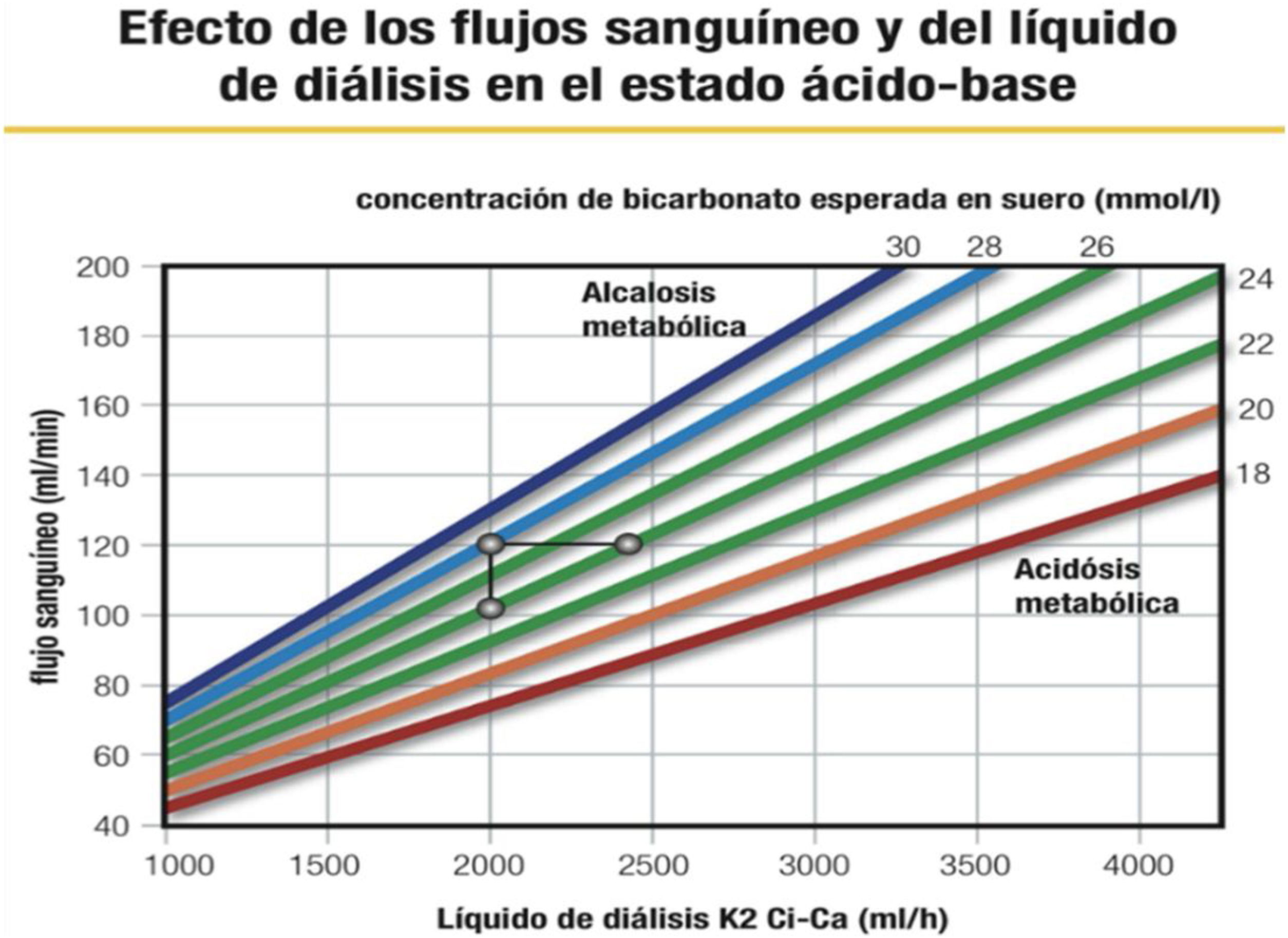
La solución de citrato se infunde en la línea arterial del set, antes de la bomba de sangre (figs. 3 y 4). La dosificación de citrato irá en relación con el flujo de sangre y se expresa en mmol de citrato/L de sangre. Esta dosis de citrato, para que tenga un efecto suficiente en la quelación del calcio en el circuito tendrá que estar entre 3,5 y 4,5 mmol/L. El objetivo de calcio en el circuito estaría entre 0,25-0,35 mmol/L28(figs. 5-8). Con estos valores se asegura que el calcio que hay dentro del filtro es insuficiente para llegar a coagular el sistema. Tampoco es necesario bajar de ese rango, para poder compensar adecuadamente lo que le llega al paciente20.
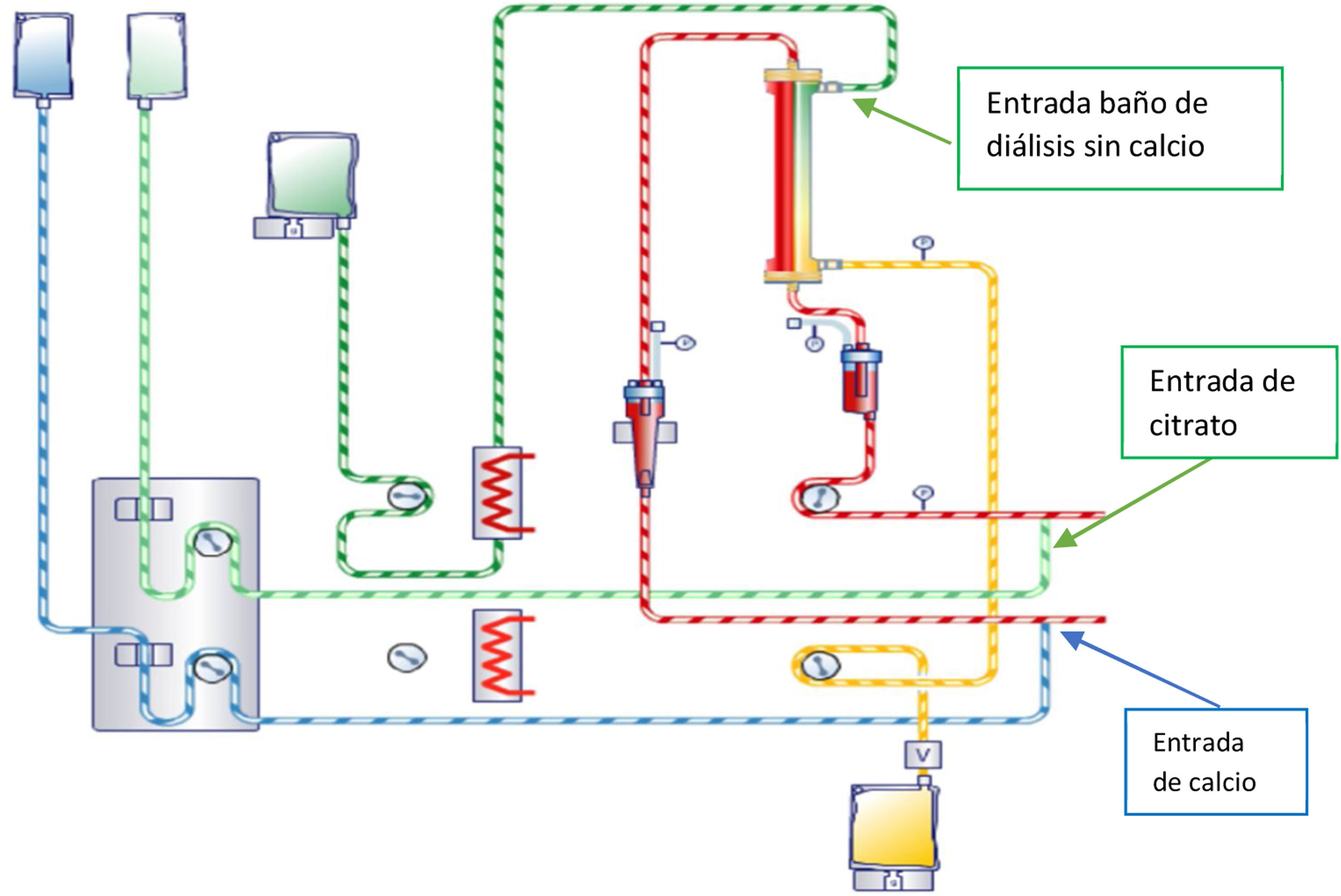
Montaje esquemático de Multifiltrate® (Fresenius Medical Care, Alemania). Adaptado del manual https://www.freseniusmedicalcare.com.ec/es-ec/profesionales-de-la-salud/terapias-agudas/multifiltrate.
Como se ve en la figura, las bombas de citrato (al 4%) y de calcio (97 mmol/L), entran en la línea de sangre aferente y eferente, respectivamente, con el objetivo de citratar el circuito y reponer luego el calcio al paciente. Puede realizarse hemodiálisis (líquido Dialysate®, sin calcio) o hemodiafiltración.
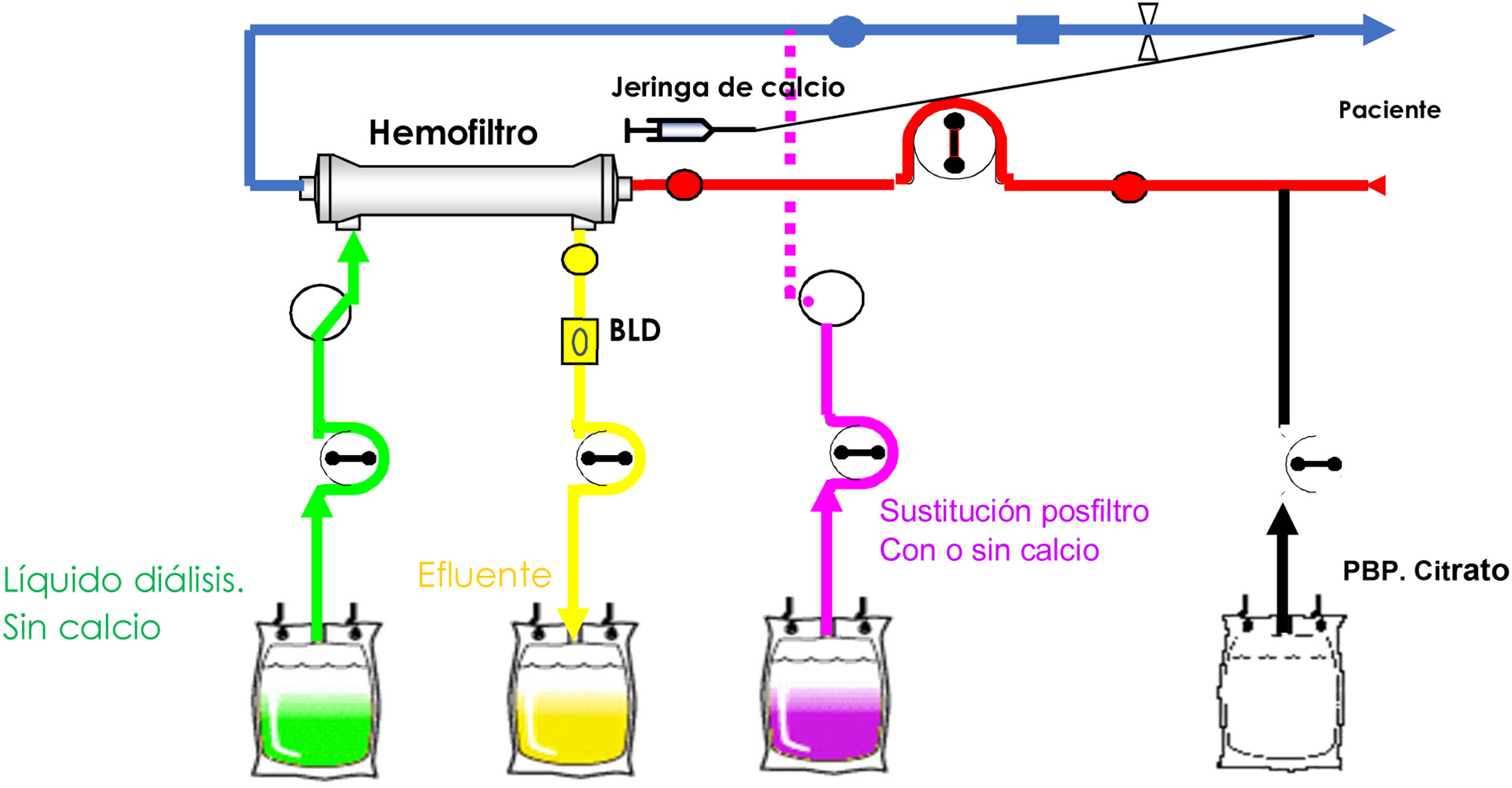
Montaje esquemático de Prismaflex® (Baxter, EE. UU.). Adaptado del manual https://www.sc.pages06.net/lp/20962/200500/CL_Manual_Usuario_Prismaflex_8xx_1.pdf. Se observa que la solución de citrato (Regiocit®) entra en la línea aferente a través de la bomba de previous blood perfusion (PBP) y la bomba de jeringa sirve de infusora de calcio con una alargadera hacia la zona eferente. Puede utilizarse el mismo líquido en diálisis y en sustitución, ya que no contiene calcio (actualmente Biphozyl®).
Tabla de seguimiento de calcio iónico. Prismaflex®. Tabla cedida por Baxter. El tratamiento se puede iniciar a 3 o 3,5 mmol/L de citrato y compensación de calcio del 100%. Las bombas de sangre y tratamiento seguirán la tabla adjunta en figura 6.
La solución de calcio se infunde en la parte más distal del circuito, posterior al cazaburbujas venoso, o bien directamente a una vía central que lleve el paciente, pero siempre controlado por el software del monitor. La dosis de calcio a infundir dependerá del balance negativo que se le esté haciendo al paciente y de la dosis de tratamiento (difusión/convección). Esta cantidad se expresa en mmol de calcio/L de efluente. El objetivo de calcio en el paciente será entre 1-1,3 mmol/L (figs. 5-8).
En cuanto a las soluciones de citrato, lo más habitual es usar soluciones de citrato concentrado al 4% (136 mmol/L), como es el caso de los monitores distribuidos en nuestro país por la empresa Fresenius Medical Care y B-Braun. o diluido al 0,5% (18 mmol/L), como en el caso de la empresa Baxter.
En cuanto a los líquidos de diálisis: a) Serán soluciones sin calcio, ya que lo que interesa es quelar este ion y no aportarlo en el líquido de tratamiento. b) Tendrán menos sodio de lo habitual, ya que el citrato infundido está en forma de citrato sódico. c) Tendrán un aporte mayor de magnesio para compensar el que se quela con el citrato. d) Por último, tendrá menos bicarbonato, ya que con el citrato (al metabolizarse) ya aportamos esta molécula al paciente. e) Si el software del monitor permite aporte de líquido en reposición, mientras este se haga en posfiltro, podrá tener cierta cantidad de calcio. Esto irá contemplado en el cálculo de la reposición de calcio al paciente. En el seguimiento del tratamiento, debemos disponer de las tablas oportunas ofrecidas por la casa comercial en las cuales se indique si son para hemodiálisis o para hemofiltración.
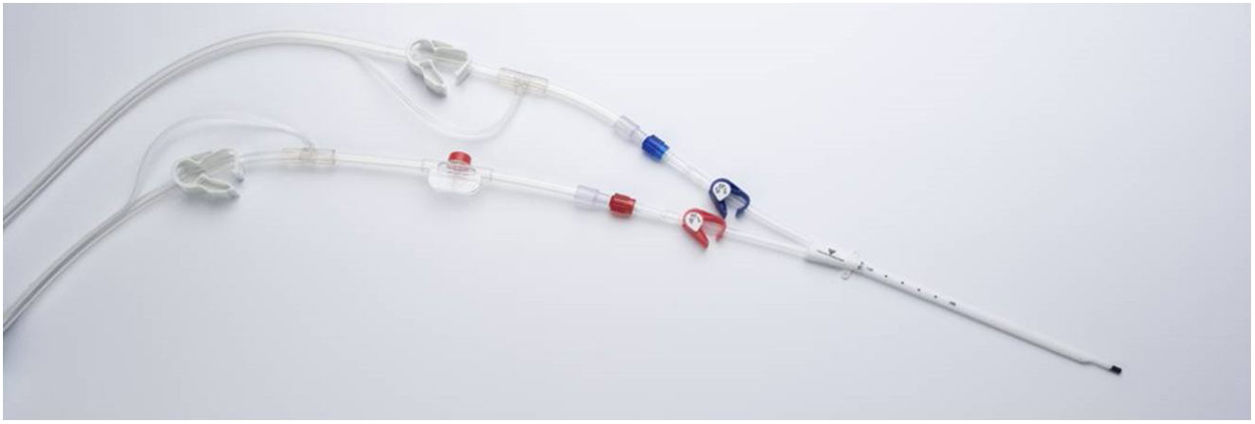
Conexión de las líneas al catéterEl catéter de doble luz será conectado en su línea roja a la conexión que lleve el citrato, para empezar a citratar la sangre cuanto antes. La línea azul de retorno se conectará con el tramo que lleve el calcio. En la figura 9 se muestra un ejemplo del fungible con conexiones a citrato y a calcio.
Purgado del set e inicio del tratamientoSe aconseja el purgado del set con suero fisiológico sin heparina. Recordemos que una indicación del citrato es en pacientes con riesgo de sangrado y la cantidad de heparina en el purgado la podemos evitar. Antes de iniciar el tratamiento se debe conocer la concentración de calcio iónico del paciente. Si los valores son bajos (menor de 1 mmol/L), se aconseja reponer calcio endovenoso, según prescripción médica, hasta tener valores normales en sangre (en un rango de 1,1 a 1,3 mmol/L). El motivo de esta indicación es que, si iniciamos la terapia con rangos bajos de calcio sistémico, se debe aumentar mucho la reposición de calcio para luego tener que bajarla.
Una vez iniciado el tratamiento según indicación de la casa comercial (ejemplo en figuras 6 y 9), suele aparecer un mensaje en el monitor para tomar una muestra venosa del circuito, en el posfiltro hemático. Esta muestra es solo para asegurar que hemos conectado la solución de citrato en la rama arterial y la solución de calcio en la parte venosa. El valor de calcio en este control tiene que ser bajo, pero no tiene por qué estar en rango correcto de anticoagulación según la tabla de seguimiento. De esta manera tan solo nos aseguramos de que la perfusión de citrato se está administrando en la rama de entrada al circuito y nos descarta cualquier error en el montaje. Es muy importante que cuando obtengamos este valor de calcio posfiltro, no se modifique la dosis de citrato que está recibiendo el filtro.
Controles de seguimientoSon importantísimos los controles analíticos a realizar durante la terapia. Debe haber un gasómetro a pie de cama que pueda utilizarse en el mismo momento de la extracción. Es importante evitar errores preanalíticos, como puede ser el utilizar una jeringa inapropiada, de diferente casa comercial respecto al gasómetro o que no tenga el anticoagulante apropiado respecto del cual el gasómetro hace el cálculo. Esto es fundamental en la medición del calcio posfiltro por tener rangos muy bajos y ser más difícil el ajustar el sesgo de error en el gasómetro. Es preciso homogeneizar muy bien la muestra con el anticoagulante que contiene, antes de proceder a hacer la medición. Se tendrá en cuenta la programación del gasómetro en las mismas unidades en que se tengan las tablas de seguimiento (mmol/L o bien mg/dL).
Cada 6 h se realizarán gasometrías de control, tanto de la sangre sistémica del paciente como de la parte posfiltro del circuito, sobre todo al inicio del tratamiento hasta que se vea la estabilidad del paciente. Los valores en sangre sistémica que se deben monitorizar principalmente son el pH, bicarbonato y calcio iónico. Al menos cada 24 h deben monitorizarse otros iones como son: sodio, magnesio, potasio, fósforo y calcio total. Este último se utilizará para calcular la ratio Cat/Cai que no debe sobrepasar de 2,5 mmol/L. Este valor es considerado como una medida indirecta de intoxicación por citrato26,29.
En sangre posfiltro debemos controlar (para corregir con las tablas) solamente el calcio iónico. El valor de calcio posfiltro nos indica si se anticoagula el sistema de manera adecuada, es decir, si la dosis de citrato que se está administrando es la correcta.
Es muy importante que si hacemos cualquier gasometría al paciente, por el motivo que sea, antes de estas seis horas, no se modifiquen las dosis de citrato y calcio. Este tratamiento requiere dejar actuar suficiente tiempo tanto la bomba de citrato como de calcio para que se estabilicen los rangos.
Cuando se aprecie una tendencia a la alcalosis metabólica, se deberán modificar los valores de líquido de diálisis o de la bomba hemática (figs. 10 y 11). Si se aumenta el líquido de diálisis, se conseguirá eliminar más complejo citrato-calcio por el filtro y entrará menos a la sangre sistémica disminuyendo así la alcalosis en el paciente (por cada mmol de citrato resultan tres de bicarbonato). Si se reduce la bomba hemática, se disminuirá la cantidad de citrato que se administra a la entrada del circuito, obteniendo el mismo efecto. La decisión de una opción u otra, la determinará el control del parámetro guía de depuración, es decir, si la urea, por ejemplo, está en niveles muy altos aún, optaremos por aumentar el líquido de diálisis. Esto se realizará mediante las tablas que facilitan las casas comerciales y bajo supervisión médica.
Si se tiene un calcio iónico posfiltro con un valor elevado, según la tabla de la casa comercial, esto indica que no está recibiendo la dosis de citrato suficiente para anticoagular el filtro, por lo que se deberá subir la dosis de citrato para intentar bajarlo. En cuanto al calcio del paciente, si en el control analítico se aprecia un calcio iónico bajo, se deberá incrementar la dosis de calcio a suplementar para evitar una hipocalcemia del paciente. Esto debe llevar a un registro exhaustivo en la gráfica de enfermería o en una hoja específica para ello. De esta forma se podrá ver la tendencia de cada uno y cómo se comporta el tratamiento a lo largo de las horas.
Posibles complicaciones derivadas del tratamiento con citratoAlcalosis metabólica: esta es la complicación con mayor incidencia. Se conoce que 1 mmol de citrato se metaboliza en 3 mmol de bicarbonato. La alcalosis se producirá si la carga de citrato es elevada en el tratamiento y no se corrige el aporte de citrato al filtro.
Acidosis metabólica: suele ser menos frecuente que la anterior, pero de mayor importancia en su diagnóstico. La causa más habitual es la disfunción hepática, acumulándose el citrato en el paciente y comportándose como ácido30. Se acompaña de una hipocalcemia sistémica, a pesar de aumentar la reposición de calcio. Esta hipocalcemia se debe a que el citrato-calcio al no metabolizarse en el hígado, no entrega el calcio iónico a la sangre sistémica.
Hipocalcemia/hipercalcemia: si el citrato se acumula sistémicamente o la pérdida de calcio en el efluente está aumentada, se produce una hipocalcemia sistémica. Es necesario aumentar entonces la reposición de calcio al paciente.
Si, por el contrario, aumenta el calcio iónico en el paciente podría ser por excesivo aporte de complejo citrato-calcio, con un metabolismo hepático conservado y sin ajuste de aporte de citrato al filtro. Podría existir un mal ajuste de bomba de reposición de calcio, infundiendo más cantidad de la adecuada.
Hipernatremia: el citrato sódico libera sodio al torrente sanguíneo al captar el calcio. La hipernatremia es poco frecuente, ya que las bolsas de diálisis que tenemos en este tratamiento tienen una concentración de sodio un poco menor para evitar esta complicación.
Otros problemas con el citrato: si nos encontramos ante una complicación durante el tratamiento con la cual no se consigue restaurar a la normalidad, existe la opción de suspender el tratamiento de anticoagulación regional con citrato y anticoagular con heparina sistémica o no anticoagular el circuito, dependiendo de la situación del paciente. Si se tuviera que hacer esto, algunas casas comerciales ofrecen la posibilidad de suspender el tratamiento con citrato e iniciar el nuevo, sin necesidad de retornar la sangre ni cambiar el circuito. Es muy importante que, en dicho caso, se cambien las bolsas de tratamiento de diálisis/sustitución y se coloquen bolsas con calcio.
Es necesario recordar la importancia de un buen funcionamiento del catéter para la realización de este tipo de terapias. Si durante el tratamiento con citrato existen problemas con algunas de las luces, que no podemos solventar, una opción temporal sería el intercambio de las luces del fungible. Se aconseja, en anticoagulación con citrato, no realizarla a no ser que no haya otra opción y cambiar el catéter lo antes posible. Si se intercambian las luces en este tipo de tratamiento, se producirá una entrada mayor de calcio al circuito (al infundir el calcio iónico por la parte arterial), lo que al principio nos obligará a subir más la dosis de citrato en los controles, hasta obtener un valor en rango. Es importante recordar que esta actuación provoca mayor recirculación, dependiendo de la ubicación y el tipo de catéter.
FinanciaciónEste estudio no ha recibido financiación.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de interés. En este documento se señalan esquemas ofrecidos por tres casas comerciales: Fresenius Medical Care (Alemania), Baxter (EEUU) y B-Braun (Alemania). Estos esquemas se aplican al funcionamiento de tres monitores diferentes distribuidos por estas empresas en nuestro país: Multifiltrate, Prismaflex y OMNI.