Describir la evolución de una paciente portadora del dispositivo. Conocer el efecto del Novalung® sobre la ventilación teniendo en cuenta la posición del paciente y la influencia de esta última sobre el flujo de sangre del dispositivo. Elaborar un protocolo de manejo y cuidados del paciente con Novalung®.
Material y métodosCaso clínico de un paciente ingresado en UCI polivalente de hospital terciario. Descripción de parámetros: hemodinámicos y respiratorios, farmacológicos, analíticos, nutricionales, de neuromonitorización, de manejo del Novalung® y duración ciclos decúbito prono. Test Anova, t de Student, Wilconxon-Mann Witney y correlación de Spearman para conocer comportamiento de variables estudiadas. Significación p<0,05.
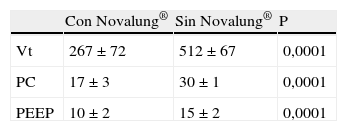
ResultadosMujer de 46 años con neumonía nosocomial e insuficiencia respiratoria aguda grave. Indicación del Novalung®: disminuir hipercapnia y optimizar manejo ventilatorio ante hipoxemia refractaria. Estancia UCI 26 días, TAM 82±9mmHg y FC 110±6lpm durante ingreso, monitorización PICCO 5 días con IC 3,2±0,8l/min/m2, ELWI 33±4ml, hemofiltración continua 13,2 días mediana extracción 50cc/h, noradrenalina 0,68±0,79μ/kg/min 15días. Parámetros respiratorios durante ingreso PO2 59±13mmHg, PCO2 68±35mmHg, SatO2 85±12%, PO2/FIO2 69±35, volumen corriente 389±141cc. Novalung® 13días, heparina 181,42±145mUI/kg/min, tiempo de cefalina 57,56±16,41sg, flujo O2 7±3l/min, flujo sangre mediana 1.030cc/h rango intercuartílico 1.447 - 612cc/h. Ciclos de prono 4, duración 53±27 h. Con Novalung® disminuyó PCO2 independientemente de posición 66±21:56±9;p=0,005. Volumen corriente 512±67:267±72;p=0,0001. Flujo sangre según posición supino-prono 1.053±82:113±112;p=0,001. No se observó asociación entre flujo sangre y PCO2 (p=0,2) y entre flujo O2 y PO2 (p=0,05). Cuidados específicos: monitorizar pulsos pedios y tibiales, mantener integro circuito, prevenir y detectar signos de hemorragia, cuidados del catéter arterial y venoso femoral, vigilar coagulación.
ComentariosDurante el uso del Novalung® se consiguió ventilación protectora con volúmenes corrientes bajos, descenso de presión meseta, PEEP e hipercapnia. El flujo de sangre descendió en decúbito prono, pero la PCO2 no se incrementó. El dispositivo no se coaguló.
To describe the course of a patient with the extracorporeal CO2 removal device and discover the effect of Novalung on ventilation, considering the patient's prone position and its influence on the device's blood flow. To develop a protocol of managing and specific care of a patient with Novalung.
Material and methodsA case report of a patient with Novalung in a tertiary hospital ICU unit is reported. Parameters considered are hemodynamic, respiratory, pharmacological, analytical, neuromonitoring, managing of the Novalung and length of decubitus prone cycles. Anova Test, Student's T test, Wilcoxon-Mann Whitney and Spearman correlation. Significance p <0.05.
ResultsA 46-year old women with nosocomial pneumonia and acute respiratory failure with indication of Novalung to decrease hypercapnia and optimize ventilatory management of refractory hypoxemia. ICU Stay 26days, MBP 82±9mmHg, HR 110±6lpm during the admission, monitoring PICCO 5 days CI 3.2±0.8 l/min/m2, ELWI 33±4ml, continuous hemofiltration 13.2days with a median removal 50cc/h. Norepinephrine dose 0.68±0.79μ/kg/min for 15days. Respiratory parameters during the admission: PO2 59±13mmHg, PCO2 68±35mmHg, SatO2 85±12%, PO2/FIO2 69±35, tidal volume 389±141cc. Novalung® 13days, heparin dose 181.42±145 mIU/Kg/min, Cephalin time 57.56±16.41sec, O2 flow 7±3l/min, median blood flow 1030cc/h, interquartile range 1447-612cc/h. Prone cycles 4, duration 53±27hours. With Novalung® PCO2 decreased regardless of position 66±21:56±9, p=0.005. Tidal volume 512±67:267±72, p=0.0001. Blood flow on supine-prone position 1053±82:113±112, p=0.001. There was no link between blood flow and PCO2 (p=0.2) and between O2 and PO2 flow (p=0.05). Specific care: pedal and tibial pulse monitoring, keep circuit safe to prevent and detect signs of bleeding, femoral arterial and venous catheter care, coagulation monitoring.
CommentsDuring the use of Novalung protective, ventilation, low tidal volumes, decreased pressure plateau, PEEP and hypercapnia were achieved. Blood flow decreased in prone position, but the PCO2 did not increase. The device did not coagulate.
El síndrome de distrés respiratorio del adulto (SDRA) es la forma de insuficiencia respiratoria aguda más grave y tiene una mortalidad entre el 30 y el 40%1–4. En ocasiones esta mortalidad se ve influida por las técnicas de ventilación mecánica que se aplican5. La utilización de volúmenes corrientes altos en los pacientes con SDRA provoca presiones excesivas con sobredistensión de las zonas pulmonares menos afectadas, lo que desencadena lesión de la membrana alveolocapilar, aumento de la permeabilidad capilar y favorece la aparición de barotrauma, volotrauma y biotrauma6–8. La lesión inducida por la ventilación mecánica puede prevenirse utilizando técnicas de ventilación mecánica protectora, caracterizada por el uso de volúmenes corrientes bajos 6ml/kg, presión plato inferior a 31cm H2O y PEEP elevada9–11, probablemente porque se reduce la lesión pulmonar por distensión y la liberación de mediadores de la inflamación12,13. La ventilación mecánica tiene un papel fundamental en el manejo de los pacientes con SDRA pero además se pueden aplicar otras medidas terapéuticas como son: control de líquidos con estrecha monitorización hemodinámica14, uso de técnicas de depuración extracorpórea15, administración de vasodilatadores inhalados (óxido nítrico, prostaciclinas)16 y colocar al paciente en decúbito prono17.
Para los pacientes con SDRA grave que no responden al tratamiento convencional existe la posibilidad de aplicar técnicas de asistencia respiratoria extracorpórea como último recurso1. La primera aplicación clínica con éxito de estas técnicas fue la oxigenación extracorpórea de membrana (ECMO) en 1972 por el doctor J. Donald Hill en un paciente con SDRA6,18. Durante los últimos 30 años la ECMO en sus 2 formas venoarterial y venovenosa se ha llegado a convertir en un estándar de cuidado para los neonatos con fracaso respiratorio severo y como soporte posquirúrgico tras cirugía reparadora de lesiones cardiacas congénitas19. Sin embargo, el uso del ECMO en adultos no ha tenido un claro desarrollo dado que presenta varios inconvenientes: requiere equipos sofisticados, personal entrenado, es complejo, caro, su tiempo de aplicación es limitado, aumenta el riesgo de infección, la necesidad de anticoagulación completa puede provocar complicaciones hemorrágicas, el uso de un circuito con una bomba extracorpórea produce hemólisis y esto asociado a la necesidad de transfusiones hace que aumente la respuesta inflamatoria sistémica20–23. A pesar de todo esto los resultados obtenidos en el último ensayo clínico aleatorizado multicéntrico, el estudio Cesar, son muy esperanzadores y muestran una mayor supervivencia para los pacientes tratados con ECMO frente a los que recibieron tratamiento convencional24.
Actualmente en el Hospital Universitario de Regensburg Alemania4,14 se ha desarrollado un nuevo dispositivo de asistencia respiratoria intervencionista (iLA) comercializado como Novalung®. Se trata de un dispositivo de extracción extracorpórea de CO2 sin bomba que se basa en el concepto ya propuesto en 1967 por Rashkind25. Este dispositivo consigue la eliminación pasiva de CO2 por medio de un shunt arteriovenoso periférico, habitualmente mediante canalización percutánea de arteria y vena femoral, que utiliza solo al corazón como fuerza conductora12. De forma que permite reducir los parámetros de ventilación mecánica hasta alcanzar niveles de ventilación protectora o estática, favoreciendo el descanso del pulmón y disminuyendo su daño. Para evitar el desrreclutamiento alveolar y proporcionar una difusión mínima de O2 durante su uso es necesario mantener un cierto nivel de PEEP26,27. Por todas estas razones el Novalung® se ha convertido en un nuevo recurso para pacientes difíciles de ventilar que presentan hipoxemia refractaria grave, hipercapnia severa y tienen una elevada mortalidad, como son los pacientes con SDRA. Se compone de una red de membranas de difusión de microfibra de polimetilpenteno constituida por múltiples fibras huecas con microporos para el intercambio de gas 22,28. La principal limitación de este dispositivo es su escasa capacidad de oxigenación, dado que la sangre que recibe es sangre arterial, rica en oxígeno, por este motivo solo en situaciones de hipoxemia severa podría conseguirse cierta oxigenación22,29.
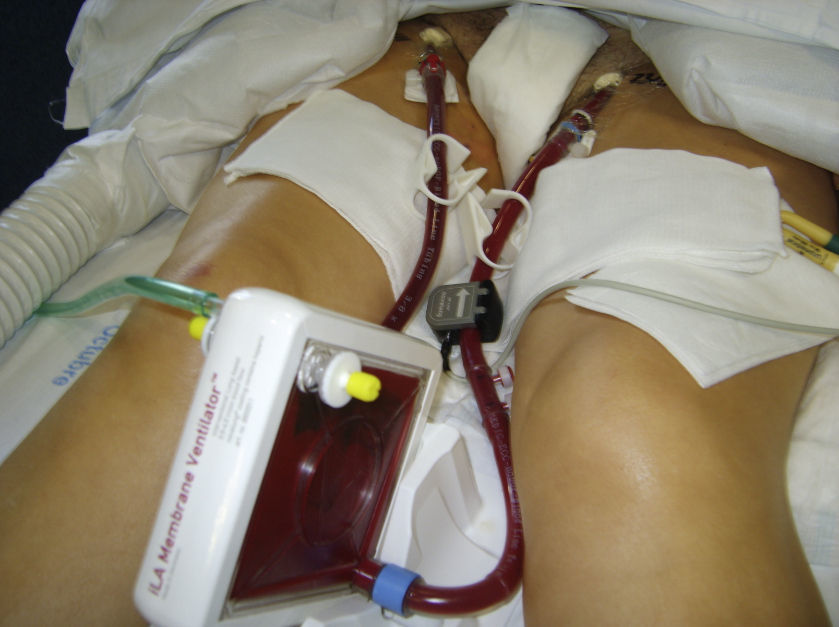
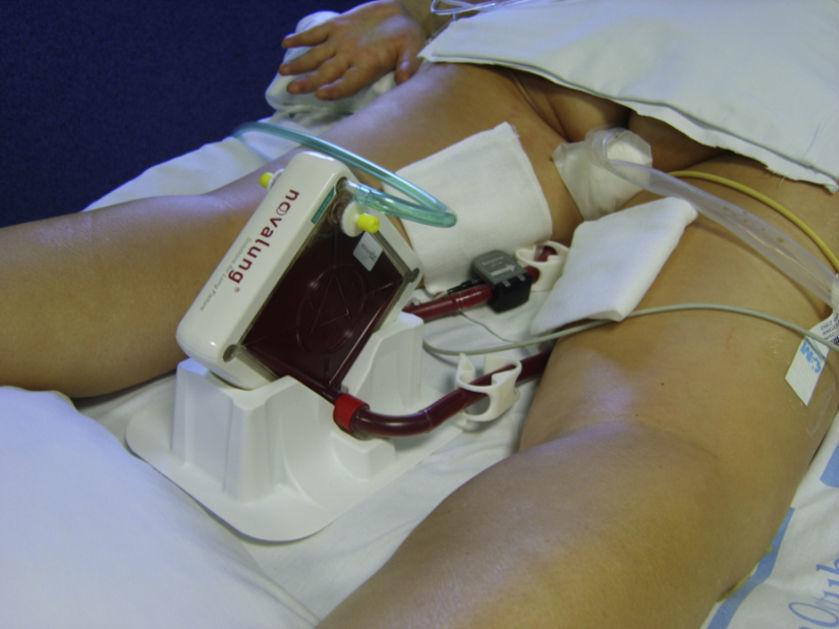
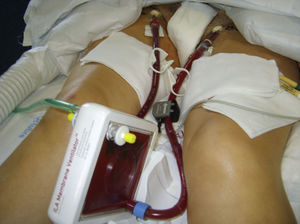
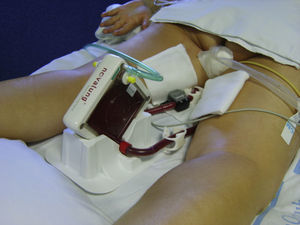
En nuestro estudio describimos el caso de una paciente con SDRA en la que se aplicó el Novalung® y durante su uso fue necesario ponerla en decúbito prono (figs. 1 y 2). Se trata de una situación muy poco usual, apenas hay descritos 3 casos en la bibliografía existente5,30,31. Además, la literatura científica enfermera publicada es muy escasa y no existe ninguna guía de cuidados de estos pacientes32. Por todas estas razones decidimos plantearnos los siguientes objetivos:
- -
Describir el caso de una paciente portadora del dispositivo.
- -
Conocer la influencia de la posición (decúbito supino versus prono) en la funcionalidad del dispositivo y la ventilación de la paciente.
- -
Elaborar un protocolo de manejo y cuidados del paciente con Novalung®.
En este caso clínico se describe la estancia en la UCI polivalente del Hospital Universitario 12 de Octubre de una paciente portadora de un circuito de extracción extracorpórea de CO2 Novalung®. Para realizar este estudio se obtuvo el consentimiento informado de su familia. Se valoró la evolución de la paciente analizando los siguientes parámetros hemodinámicos: tensión arterial media (TAM), frecuencia cardiaca (FC), índice cardiaco (IC), variabilidad del volumen sistólico (VVS), agua extravascular pulmonar indexada (ELWI), índice del volumen global al final de la diástole (GEDI), resistencias vasculares sistémicas (RVS) y extracción horaria del hemofiltro. Parámetros respiratorios: PaO2, PaCO2, PO2/FiO2, SatO2, volumen corriente espiratorio, presión control (PC) y presión positiva al final de la espiración (PEEP). Parámetros farmacológicos: días de administración y dosis de noradrenalina, midazolam, cloruro mórfico, cisatracurio y heparina. Parámetros analíticos: tiempo de cefalina. Parámetros de manejo del Novalung®: flujo de oxígeno y flujo de sangre del dispositivo. Parámetros nutricionales-metabólicos: días de soporte nutricional parenteral, enteral, glucemia y dosis de insulina. Parámetros de neuromonitorización: índice biespectral (BIS). Posición del paciente (decúbito supino y decúbito prono) y duración de los ciclos de decúbito prono.
Análisis de los datosLas variables se expresaron con medidas de centralización (media o mediana) y medidas de dispersión (desviación estándar o rango intercuartílico). Se recogieron los datos de la gráfica de registro horario contabilizando cada hoja como un día completo. El análisis estadístico se realizó con el programa SPSS versión 15.0 Se exploró y comprobó la normalidad de las muestras de las variables estudiadas mediante el test de Kolmogorov-Smirnov. Se utilizó un test Anova de 2 vías para conocer el efecto del Novalung sobre la PaCO2 teniendo en cuenta la posición del paciente. T de Student para identificar la influencia del Novalung® sobre el volumen corriente. Wilconxon-Mann Witney para estudiar la asociación entre el flujo de sangre del Novalung® y la posición del paciente, la PEEP y PC y la presencia del Novalung®. Spearman para correlacionar el flujo de sangre del Novalung® con la PaCO2 y el flujo de O2 del dispositivo con la PaO2 y la PaCO2. El nivel de significación estadística de p fue inferior a 0,05.
ResultadosLa paciente estudiada fue una mujer de 46 años, sin antecedentes de interés, que ingresó en UCI por insuficiencia respiratoria aguda hipoxémica grave, debido a la presencia de un infiltrado subagudo en lóbulo inferior derecho, neumonía nosocomial sobreañadida con empiema derecho y neumotórax anterior derecho yatrogénico tras fibrobroncoscopia con biopsia transbronquial.
Al ingreso en UCI se administró oxigenoterapia con mascarilla reservorio, pero el deterioro respiratorio progresivo hizo necesaria la aplicación de ventilación mecánica no invasiva durante 17 h, posteriormente intubación orotraqueal con conexión a ventilación mecánica (VM) y colocación en decúbito prono de forma precoz, en las primeras 24 h. Se inició cobertura antibiótica para neumonía nosocomial con meropenem, linezolid y levofloxacino, que posteriormente se amplió con fluconazol.
Todos los datos obtenidos durante la estancia en UCI se han estructurado por sistemas y cuidados, para facilitar su lectura.
CardiovascularA lo largo de su estancia se monitorizaron los parámetros hemodinámicos habituales y los proporcionados por el sistema PICCO durante 5 días, antes de la inserción de los catéteres femorales arterial y venoso del Novalung®. En la tabla 1 se pueden observar dichos parámetros. Precisó noradrenalina a 0,68±0,79μg/kg/min un total de 15 días de forma intermitente, por inestabilidad hemodinámica y dobutamina a 2,22μg/kg/min 3 días para mantener los flujos de sangre del Novalung®. Se inició hemofiltración veno-venosa continua a través de vena yugular derecha para tratar de disminuir el agua extravascular pulmonar y eliminar mediadores de la inflamación, con una mediana de extracción de 50 cc/h y rango intercuartílico de (150 - 25) cc/h en los 13,2 días de tratamiento, siendo el balance acumulado de 11 litros negativos. Los cuidados efectuados fueron los propios del paciente monitorizado y con técnicas de depuración extracorpórea, teniendo un preciso manejo y control de la administración de todos los fármacos y soluciones en perfusión continua o en bolo por vía endovenosa.
Parámetros hemodinámicos
| TAM mmHg | FC l/min | IC l/min/m2 | VVS unidad | RVS unidad | ELWI ml | GEDI Unidad |
| 82±9 | 110±6 | 3,2±0,8 | 14±1 | 1.627±264 | 33±4 | 658±142 |
ELWI: agua extravascular pulmonar indexada; FC: frecuencia cardiaca monitorizados durante ingreso. Parámetros del PICCO monitorizados durante los 5 días previos a inserción del Novalungâ; GEDI: índice del volumen global al final de la diástole; IC: índice cardiaco; RVS: resistencias vasculares sistémicas; TAM: tensión arterial media; VVS: variabilidad del volumen sistólico.
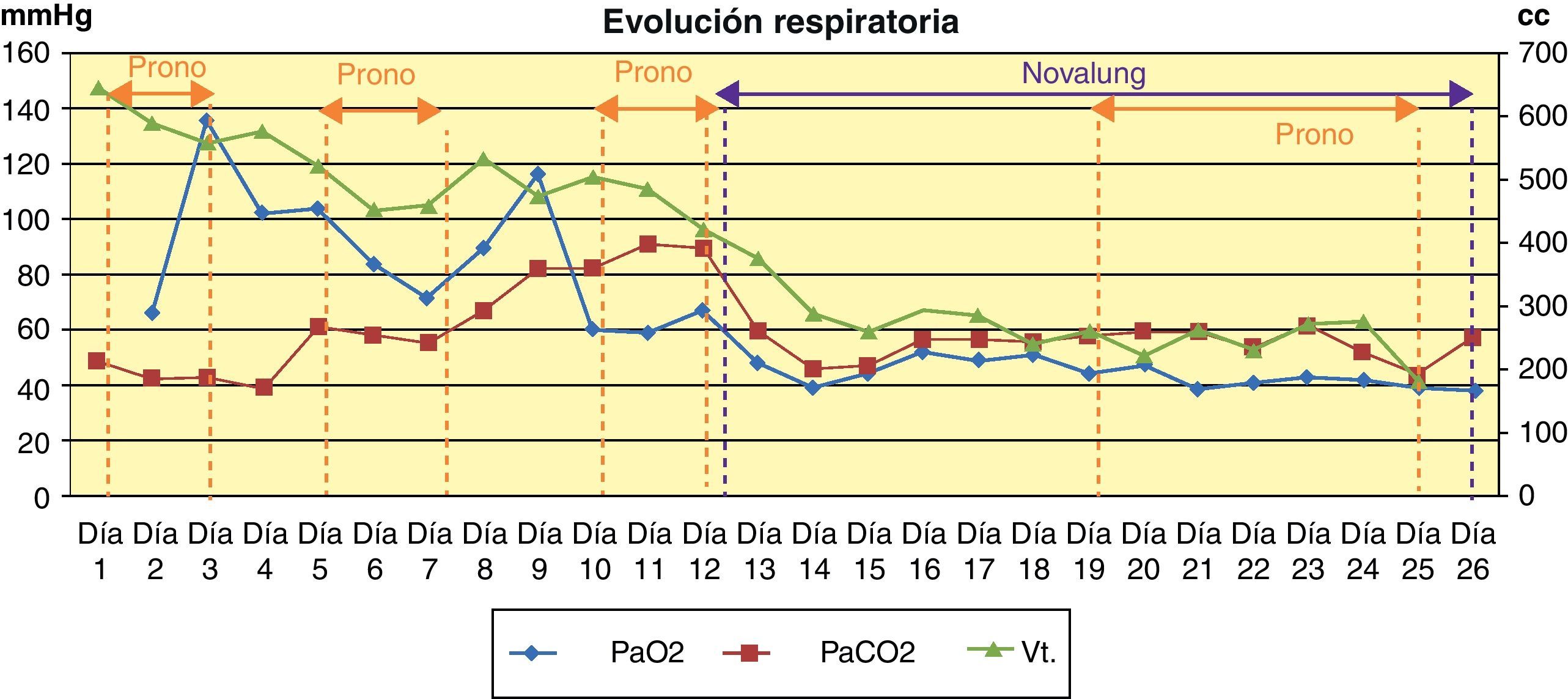
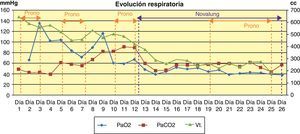
La paciente presentó insuficiencia respiratoria aguda grave con criterios de síndrome de distrés respiratorio del adulto (SDRA), manteniendo durante su ingreso una media de PaO2 de 59±13mmHg, PaCO2 68±35mmHg, PaO2/FIO2 69±35 y SatO2 85±12% obtenida mediante pulsioximetría (ver fig. 3). Por ello fue necesario pronar a la paciente en 4 ocasiones, el tiempo medio de los ciclos de prono fue de 53±27 h con un máximo de 93 h. La presencia de fístula broncopleural bilateral con fuga del 50% del volumen, siendo el volumen corriente espirado durante VM de 389±141cc y la consiguiente aparición de neumotórax, obligó a la inserción de un total de 8 drenajes torácicos, 2 del número 20 y 3 del número 24 y 28. La paciente portó simultáneamente 4 tubos de tórax y su tiempo medio de permanencia fue de 9,5±5 días. Al inicio de la VM se empleó ventilación controlada por volumen 4,63 días, a continuación volumen control regulado por presión 0,33 días y finalmente presión control 18,71 días. Previamente a la inserción del Novalung® se utilizaron parámetros ventilatorios elevados FiO2 95±11 (rango 60-100), PC 29±1 (rango 28-40) y PEEP 15±2 (rango 12-24). Pero a pesar de la ventilación agresiva y los ciclos de prono, la situación de hipoxemia refractaria (PaO2 53mmHg), hipercapnia severa (PaCO2 131mmHg), acidosis respiratoria (Ph 7,26) y la existencia de barotrauma importante (fistula broncopleural bilateral con fuga del 50%), hizo que se decidiera la inserción de un dispositivo de extracción extracorpórea de CO2 Novalung®, para eliminar CO2 y optimizar el manejo ventilatorio. La situación de hipoxemia refractaria persistió a pesar del uso del Novalung® incluso en decúbito prono, por lo que se decidió despronar a la paciente y se administró óxido nítrico inhalado 5 partes por millón durante 10 h. Los cuidados aplicados fueron los propios de un paciente con vía aérea artificial, ventilación mecánica y decúbito prono.
Nutricional-metabólicoDurante su ingreso la paciente recibió nutrición parenteral 3 días y nutrición enteral 22 días, con buena tolerancia incluso en decúbito prono y a pesar de recibir tratamiento con bloqueantes neuromusculares en infusión continua. Fue necesaria la administración de insulina en infusión continua para control glucémico a 0,71±0,20 UI/kg/min según el protocolo de la unidad. Probablemente debido a la administración de corticoides para tratar el SDRA, que se aumentaron tras biopsia pulmonar informada como neumonía eosinofílica. Se consiguió mantener unas cifras de glucemia de 144±30mg/dl. Se administraron laxantes para forzar eliminación fecal, tras realizar el último ciclo de prono en presencia del Novalung®, debido a la gravedad, compromiso respiratorio y dificultad para la movilización de la paciente, se colocó una sonda de incontinencia fecal permanente Flexiseal®. Los cuidados de la misma y del soporte nutricional se realizaron según los protocolos establecidos en la unidad.
Piel y mucosasSe aplicaron como medidas de prevención la utilización de colchón antiescaras, cambios posturales, aplicación de ácidos grasos hiperoxigenados o apósitos hidrocoloides y colocación de almohadas en zonas de riesgo. La paciente solo presentó una pequeña úlcera por decúbito del catéter del sistema PICCO insertado en arteria femoral derecha, después del segundo ciclo de decúbito prono, de 1cm de ancho por 2cm de largo. Los cuidados de los ojos incluyeron: limpieza por arrastre con suero fisiológico, humectación corneal con lubricante y protección ocular con gasas húmedas durante los ciclos de prono.
NeurológicoSe mantuvo a la paciente en un rango de sedación profunda con un índice biespectral (BIS) de 44±10, mediante la administración de dosis elevadas de sedoanalgesia con midazolam a 7,24±2,9μg/kg/min y cloruro mórfico en infusión a 0,71±0,27μg/kg/min 24 días, propofol a 22μg/kg/min 3 días y relajación neuromuscular con cisatracurio en infusión a 5,3±0,95μg/kg/min 23 días.
InfecciosoSolo se identificó la presencia de Cándida Albicans en un cultivo de secreciones bronquiales. Se mantuvo una escrupulosa asepsia en el manejo de todos los dispositivos invasivos.
Aspectos psicosocialesTras la llegada de la paciente a la UCI la enfermera responsable se presentó a la familia y le proporcionó un manual de acogida, donde se informa sobre: el equipo asistencial, el material de la habitación, la seguridad, aspectos generales del funcionamiento de la unidad, la visita de la familia y el final de la estancia en la UCI. El apoyo a la familia durante los 25 días de ingreso de la paciente incluyó múltiples intervenciones entre las que destacaron: identificar nivel de ansiedad y resolver miedos, dudas y temores, proporcionar información clara, sencilla, concisa y específica sobre las necesidades de la paciente, flexibilizar el horario de visitas, favorecer la intimidad con un ambiente adecuado y tranquilo, orientar sobre la actitud a seguir durante la ventilación no invasiva (transmitir tranquilidad y mensajes positivos, potenciar la comunicación no verbal, realizar preguntas cerradas…), motivar la participación e instruir en los cuidados básicos y ayudar a aceptar las malas noticias. La paciente no respondió a los esfuerzos terapéuticos por lo que se proporcionó apoyo y acompañamiento durante el duelo.
Se solicito estudio necrópsico que informó de la existencia de un adenocarcinoma pulmonar con patrón broncoalveolar.
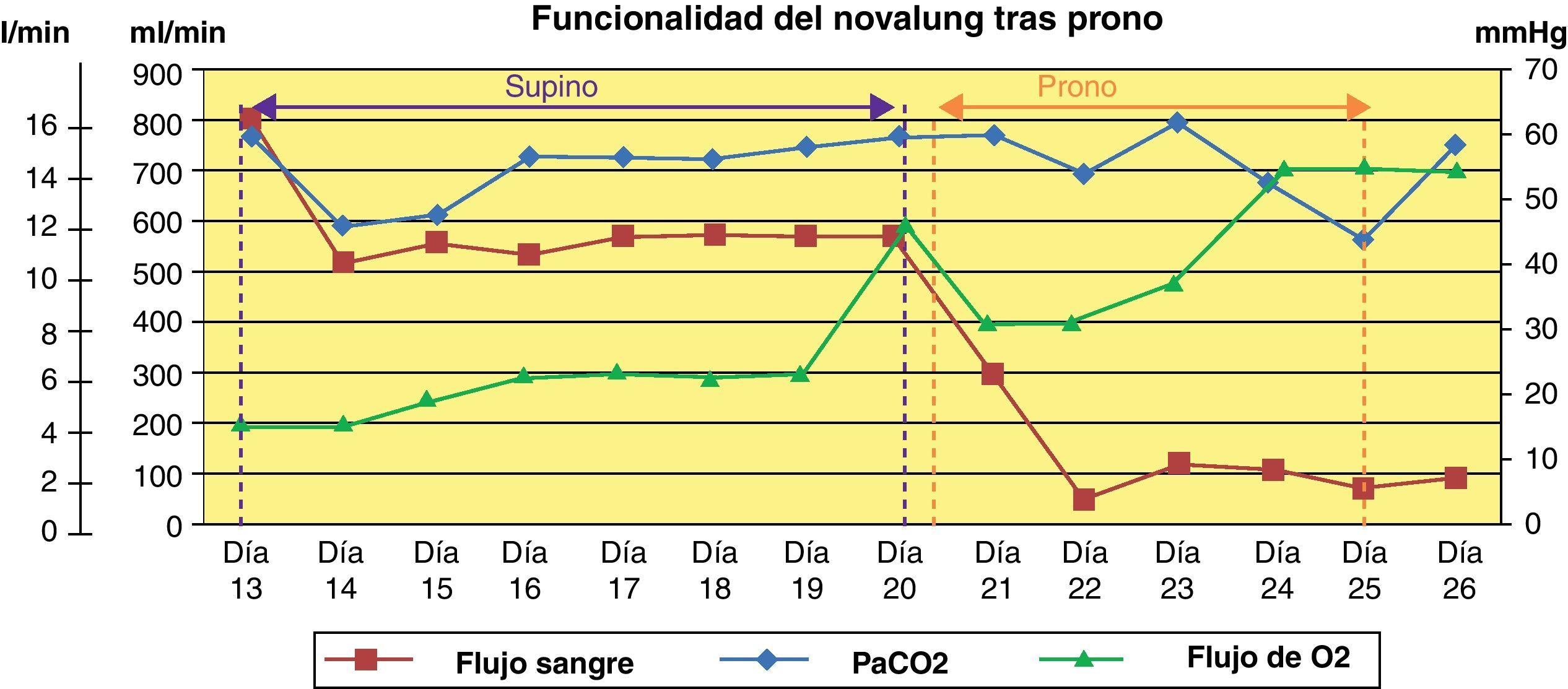
Manejo del Novalung®El Novalung® se colocó a los 13 días de ingreso y se mantuvo durante 12 días. Se canalizó arteria femoral derecha con cánula de 13 Fr y vena femoral izquierda con cánula de 15 Fr con técnica de Seldinger, según se describe más adelante en el protocolo de manejo y cuidados del paciente con Novalung®. Se incrementó progresivamente el Flujo de O2, según los requerimientos de la paciente, siendo el flujo máximo alcanzado de 14 l/min. Se anticoaguló a la paciente con heparina sódica en infusión continua a 0,18±0,14 UI/kg/min, manteniendo un tiempo parcial de tromboplastina activada (TTPA) de 57,56±16,41 s durante la terapia con el dispositivo. El Novalung® redujo la hipercapnia (ver fig. 3) y consecuentemente la acidosis respiratoria. La interacción entre la posición de la paciente y la presencia del Novalung® no influyó significativamente (p=0,34) sobre la PaCO2. Para conocer la influencia de ambos factores de forma individual se corrigió el modelo, observándose que la posición no influía significativamente (p=0,91) sobre la PaCO2, sin embargo el Novalung® disminuyó significativamente (p=0,005) la PaCO2 de 66±21mmHg a 56±9mmHg, como se puede observar en la figura 3. La influencia del Novalung® sobre los parámetros ventilatorios se muestra en la tabla 2. El flujo de sangre del dispositivo disminuyó significativamente (p=0,001) al cambiar a la paciente de supino a prono de 1.053±82ml/min a 113±112ml/min (ver fig. 4). No se observó asociación entre el flujo de sangre del dispositivo y la PaCO2 (p=0,2), ni entre el flujo de O2 del dispositivo la PaO2 (p=0,05) y la PaCO2 (p=0,13). La paciente no presentó complicaciones ni asociadas al dispositivo ni a los ciclos de decúbito prono.
El Novalung® es un dispositivo de asistencia respiratoria intervencionista (iLA) sin bomba con baja resistencia al flujo sanguíneo, que permite la eliminación pasiva de CO2 mediante un shunt arteriovenoso periférico, utilizando el corazón como fuerza conductora. El circuito del Novalung® tiene un volumen total de 240ml y se compone de un catéter arterial de un calibre de 13 a 19 french, una membrana de intercambio gaseoso de un solo uso y un catéter venoso de un calibre de 15 a 21 french para el retorno. El dispositivo está compuesto de una red de membranas de difusión de microfibra de polimetilpenteno con una superficie efectiva de 1,3m2. La red está diseñada geométricamente para ofrecer la menor resistencia al flujo de sangre y esta constituida por múltiples fibras huecas con microporos para el intercambio de gas. El oxígeno circula (como una línea de gas) dentro de los huecos de las fibras y el CO2 se mueve por una difusión selectiva a través del gradiente de concentración de la sangre. Los polipéptidos y la heparina no fraccionada están adheridas a la membrana expuesta a la circulación sanguínea para mejorar la biocompatibilidad y reducir la incidencia de trombosis. El flujo de sangre a través del dispositivo está determinado por la presión arterial media. Una presión arterial media de 70mmHg produce un flujo de 1 a 1,5 l/min y elimina 200ml/min de CO2. La limpieza de CO2 depende del flujo de sangre y del flujo de oxígeno. El flujo de O2 se debe ajustar según los requerimientos del paciente, el fabricante recomienda no superar un flujo de O2 de 12 l/min.
IndicacionesEl Novalung® está indicado en aquellos pacientes que presenten hipoxemia refractaria grave, hipercapnia severa, que no han respondido al tratamiento convencional.
- -
Para favorecer la recuperación de: neumonía severa, SDRA, broncoespasmo, obstrucción de la vía aérea, reagudización EPOC y trauma torácico.
- -
Para controlar hipertensión intracraneal en paciente neurocrítico con fracaso respiratorio asociado.
- -
En el postoperatorio de cirugía torácica: neumonectomía, reparación de fístulas y trasplante pulmonar.
- -
Como soporte hasta el trasplante pulmonar.
- -
Trombocitopenia inducida por heparina.
- -
Insuficiencia cardiaca, Shock cardiogénico y séptico.
- -
Enfermedad vascular de miembros inferiores.
- -
Niños con peso inferior a 20 kg por el diámetro de las cánulas (no hay calibres inferiores a 13 (fr) y el flujo de sangre requerido.
- -
Un médico canaliza arteria femoral y vena femoral contralateral, conecta el dispositivo, controla anticoagulación, indica flujo de O2, ajusta los parámetros del ventilador y supervisa el correcto funcionamiento.
- -
Una enfermera purga el dispositivo, ayuda al médico a conectarlo, garantiza la esterilidad de procedimiento, controla el estado general del paciente y realiza los cuidados de mantenimiento.
- -
Una auxiliar de enfermería prepara el material, asiste al médico, a la enfermera y garantiza esterilidad de procedimiento.
Médico, enfermera, auxiliar de enfermería y 2 celadores trasladan al paciente a quirófano para la retirada del dispositivo
Material necesario- -
Vestimenta estéril: gorro, mascarilla, bata y guantes estériles.
- -
Campo estéril: sábana, gasas, compresas y apósitos estériles.
- -
Set de Novalung®: membrana, línea arterial, línea venosa, conexión de purgado, suero fisiológico 0,9% de 250, sistema de suero, 2 clamps, 2 tapones de seguridad, alargadera de O2 y base de sujeción.
- -
Set de acceso vascular NovaPort®: aguja de punción, aguja de purgado, bisturí, dilatador, cánula de 13 a 19 fr, clamp y conector de seguridad Luer.
- -
Monitor y sensor de flujo.
- -
Bomba infusión y perfusión de heparina
- -
El purgado de la membrana del Novalung® se realizará conectando la línea arterial y venosa a la conexión de purgado y esta a su vez a un sistema de suero y un suero fisiológico 0,9% de 250 cc.
- -
Antes del purgado, se deben retirar y guardar los 2 tapones amarillos que se encuentran en el vértice superior de la membrana, para facilitar la eliminación de las burbujas de aire durante el purgado.
- -
El dispositivo debe estar en un punto alto durante su purgado.
- -
Dar suavemente con la palma de la mano en la base del dispositivo para purgar el posible aire del sistema.
- -
Una vez purgado y asegurado la eliminación del aire, conectar nuevamente los 2 tapones amarillos, colocar los clamps en las proximidades de las salidas de los tubos del dispositivo, cerrar la línea de la solución y retirar el sistema de llenado.
- -
Antes de insertar el Novalung® se debe realizar un eco-doppler para medir el diámetro interno de arteria femoral, descartando ateromatosis, calcificaciones anormales y anomalías venosas.
- -
Seleccionar tamaño de cánulas: el tamaño de la cánula arterial debe ser al menos un 20% menor que el diámetro interno de la arteria y la cánula venosa utilizada debe ser de un tamaño mayor que la arterial.
- -
Canalizar mediante técnica de Seldinger primero la arteria femoral y luego la vena con técnica estéril. Una vez canalizadas se aseguran con un punto. La inserción bilateral es la más recomendada.
- -
Conectar una jeringa de 20cm. con suero fisiológico heparinizado (10 UI/mL) al conector de seguridad Luer. Se retira el alambre guía y se conecta a la cánula el conector de seguridad Luer para lavarla.
- -
Retirar lentamente el conector de seguridad Luer mientras se lava la cánula y cuando se visualice la tercera marca del mismo se coloca en clamp.
- -
Humedecer con suero la silicona que se encuentra en el extremo de la cánula. Unir la cánula con la línea arterial del Novalung®, dando una ligera rotación hasta que suene un primer clip.
- -
A través del puerto Luer acabar de purgar rellenando con suero fisiológico estéril con la aguja de purgado que se encuentra en el set.
- -
Después de purgar el aire cerrar el puerto Luer. Retirar el clamp de la línea arterial del Novalung® (no el de la cánula), revisar que no haya aire residual (si hubiese, aire repetir paso anterior), y proceder a hacer el segundo clip.
- -
Luego repetir el procedimiento en el lado venoso.
- -
Colocar el dispositivo en la base de sujeción.
- -
Una vez realizado todo el proceso anterior conecte el tubo de oxigeno al puerto de entrada de gas. No obstruir la salida de gas.
- -
Para iniciar el tratamiento retirar el clamp de la cánula venosa, esperar unos minutos y muy lentamente retirar el clamp de la cánula arterial en 1-2 minutos para minimizar los efectos producidos por el shunt arteriovenoso.
- -
Encender monitor Novaflow y conectar sensor de flujo al monitor y a la línea venosa del Novalung®.
- -
Al inicio administrar un flujo de O2 de 1l/min e incrementarlo progresivamente 1 l/min cada 20min hasta alcanzar valores gasométricos adecuados. El flujo máximo recomendable es de 12 l/min.
- -
Tras conexión del dispositivo, monitorizar gasometría arterial cada 30min las primeras 2 h, cada hora las siguientes12 h, posteriormente cada 6 h y tras 24 h según criterio médico.
- -
Regular flujo de O2 según resultados gasométricos y disminuir parámetros ventilatorios simultáneamente en función de los requerimientos del paciente, hasta alcanzar parámetros de ventilación protectora: presión pico inspiratoria inferior a 20cm H2O, volumen corriente de 2-4ml/kg, y PEEP mayor de 10cm H2O.
- -
Monitorización del flujo de sangre existente a través del dispositivo, para conocer capacidad de funcionamiento del Novalung®.
- -
Vigilancia estrecha de monitorización hemodinámica, sobre todo tras la conexión del dispositivo. Mantener tensión arterial media mayor de 60mmHg, para garantizar un flujo adecuado de sangre al dispositivo. Sí es preciso administrar volumen o drogas vasoactivas.
- -
Monitorizar pulsos periféricos (pedio y tibial posterior) y temperatura de ambos miembros inferiores. Registrar calidad de pulsos y simetría mediante cruces cada 2 h, para detectar precozmente la presencia de isquemia especialmente en el lado de la cánula arterial.
- -
La anticoagulación debe adecuarse a la situación individual del paciente. Se recomienda al iniciar la terapia con el Novalung® administrar anticoagulación sistémica con heparina sódica en infusión continua a 5-10 UI/kg, para mantener un TTPA en torno a 50-55 s. En pacientes con riesgo de sangrado (como pacientes con hemorragia cerebral, hemorragia digestiva alta, rectorragia, traumaticos…etc.) se valorará la ausencia de anticoagulación.
- -
Si se administra heparina sódica, monitorizar TTPA cada 24 h o a demanda según resultados y ajuste de dosis.
- -
Para optimizar flujo sanguíneo a través del dispositivo mantener hematocrito por debajo del 30%.
- -
Vigilar que la salida de gas no se encuentre obstruida, para garantizar el descenso de los niveles de CO2.
- -
Vigilar correcto ajuste de conexiones, presencia de coágulos (especialmente en la superficie de la membrana de la línea venosa), funcionamiento e integridad del dispositivo.
- -
Mantener cerca del paciente 4 clamps para paliar precozmente hemorragia si se produjera desconexión del dispositivo.
- -
Evitar la administración de fenitoina, propofol y soluciones ricas en triglicéridos porque se depositan en la membrana.
- -
Realizar cura estéril de ambas cánulas según el Protocolo de Bacteriemia Cero y vigilar signos de infección.
- -
El dispositivo será retirado si se observa la presencia de aire o agua, si se coagula, si no funciona o si el paciente presenta mejoría clínica, radiológica y funcional (SatO2 ≥ 95% con FiO2 ≤ 50%).
- -
Para iniciar el destete del dispositivo reducir progresivamente el flujo de O2 con control gasométrico hasta detenerlo.
- -
Tras mantener detenido el flujo de O2 durante 3h realizar gasometría, si confirma normocapnia comenzar tramites de retirada del dispositivo. Suspender infusión de heparina sódica y avisar a cirujanos vasculares para programar retirada en quirófano.
- -
Después de que hayan transcurrido un mínimo de 4 h desde la suspensión de la infusión de heparina sódica y en coordinación con el equipo quirúrgico trasladar al paciente a quirófano.
La instauración del Novalung® en este caso permitió mantener una ventilación protectora, necesaria para favorecer la cicatrización de una importante fístula broncopleural bilateral y corrigió la hipercapnia y acidosis respiratoria. El dispositivo mejoró la ventilación pero no se observó un incremento de los parámetros de oxigenación, como en la mayoría de los casos descritos33–36. Este dispositivo no está diseñado para optimizar la oxigenación, porque al utilizar un shunt arteriovenoso la sangre que llega a la membrana es sangre arterial22,37. Probablemente los casos descritos en los que se incrementó la oxigenación se deba a la mejoría clínica de los pacientes27,38.
La ventilación protectora o estática se caracteriza por el uso de PEEP elevadas. El estudió experimental de Jungebluth et al.26. identifica las cifras de PEEP más recomendables, para optimizar el uso del Novalung®, entre 15-20 cmH2O. En este caso empleamos cifras algo más bajas, dado que la paciente presentaba fistula broncopleural bilateral con importante fuga y se ha demostrado experimentalmente que la PEEP influye en el volumen de la fistula y la perpetúa30,39.
La paciente no presentó complicaciones asociadas al dispositivo, como las descritas en la evidencia, fundamentalmente sangrado e isquemia del miembro inferior en el que se canaliza la arteria femoral12,22.
Los estudios experimentales de Zhou et al.23 e Iglesias et al.40 demuestran que la eliminación de CO2 depende directamente del flujo de O2 y del flujo de sangre del dispositivo, algo que en este caso no se observó, ya que se mantuvo el descenso de los niveles de CO2 a pesar de los cambios en ambos parámetros y no se evidenció asociación significativa. Cuando se puso a la paciente en decúbito prono se detectó un gran descenso del flujo de sangre sin que la paciente presentase deterioro hemodinámico, que mejoró ligeramente tras retirar la almohada de la cintura pélvica. A pesar de este descenso del flujo de sangre la PaCO2 no se incremento significativamente, pero fue necesario aumentar progresivamente el flujo de O2 de 8 hasta un máximo de 14 l/min. Probablemente el descenso del flujo de sangre se deba a que cuando la paciente fue pronada el dispositivo ya llevaba funcionando 8 días y al cambiar a la paciente de posición se movilizara, dentro de la membrana, algún coágulo que dificultó el flujo a través del dispositivo. Cuando la paciente fue despronada el flujo de sangre se incrementó ligeramente. Los casos descritos con Novalung® en prono5,30,31 no reflejan cambios en el flujo de sangre, ni la influencia de la posición del paciente sobre la funcionalidad del dispositivo. El flujo de O2 máximo recomendado es de 12 l/min, pero debido al importante descenso del flujo sanguíneo del dispositivo durante el prono y a la mala evolución clínica de la paciente se decidió aumentar hasta 14 l/min, sin obtenerse ninguna mejoría de la hipoxemia severa.
Para realizar el último ciclo de decúbito prono en presencia del Novalung® se retiró el dispositivo de su base de sujeción y una persona se encargó exclusivamente de controlarlo durante el procedimiento. Una vez efectuada la movilización a decúbito prono, siguiendo el protocolo existente en la unidad, se giró la membrana 180 grados sobre sí misma, de forma que el puerto de entrada del flujo de O2 quedara en la parte superior de esta y se volvió a dejar colocada sobre la base de sujeción. Para paliar rápidamente la hemorragia que podría producirse si se desconectara el dispositivo se mantuvieron 4 clamps cerca de la paciente en todo momento.
La principal limitación de este estudio es que el análisis de la influencia de la posición decúbito prono sobre la funcionalidad del dispositivo se reduzca a la experiencia obtenida en un solo caso. Al tratarse de un dispositivo novedoso, de elevado coste y aplicado en casos muy concretos poco frecuentes, sería interesante la obtención en distintos centros de series de casos más amplias.
Después de tener esta experiencia en el manejo y los cuidados de un paciente con Novalung® en decúbito prono, podemos decir que gracias a las dimensiones reducidas del dispositivo fue posible realizar la técnica de decúbito prono con éxito y sin complicaciones. Se pudo aplicar una ventilación protectora con normocapnia. El flujo de sangre del dispositivo disminuyó significativamente durante la posición decúbito prono, pero este descenso no influyó en la funcionalidad del Novalung®.
Conflicto de interesesLos autores declaran no tener ningún confclito de intereses.
Agradecemos la colaboración desinteresada de Juan Carlos Montejo González (Jefe del Departamento de Medicina Intensiva) Teodoro Grau Carmona y Susana Temprano Vázquez (médicos adjuntos del Servicio de Medicina Intensiva UCI Polivalente), Esteban Molano Álvarez (supervisor de enfermería de la UCI Polivalente) y a todo el equipo asistencial (enfermeros, médicos, auxiliares de enfermería y celadores) de la UCI-P del Hospital Universitario 12 de Octubre por la ayuda prestada.