Las técnicas de depuración extracorpórea (TCDE) gestionan elevados volúmenes de intercambio de fluidos y precisa control exhaustivo de su seguridad.
ObjetivoDetectar riesgos en TCDE y determinar su frecuencia por paciente.
Material y métodoEstudio observacional retrospectivo. Criterios de inclusión: pacientes ingresados desde enero a diciembre de 2009 con TCDE en la Unidad de Cuidados Intensivos (UCI) Polivalente del Hospital 12 de Octubre. Identificamos previamente diez riesgos detectables en historias clínicas. Analizamos variables demográficas y del tratamiento. Las variables cuantitativas se expresan como media±desviación estándar y cualitativas, como frecuencias absolutas y relativas. Análisis: SPSS 15.0®.
ResultadosSe incluyó a 54 pacientes (11,7%) con media de edad de 59,78±14,8 años; 42 (77,8%) eran varones. En el 81,4% la indicación fue fracaso renal agudo. Se trató al 80,3% con hemodiafiltración. La media de TCDE fue de 112,9±139,9 h, con una mediana [intervalo intercuartílico] de 2 [0-31] filtros por paciente. La frecuencia de riesgo/paciente fue: el 100% de los pacientes sin monitorización de Mg y P, y el 3,7% (n=2) urea; en 16 (29,6%) se produjo coagulación del circuito antes de 24 h y en 25 (46,3%) no se pudo devolver sangre; en 14 (29,3%) faltaba siempre pauta escrita en la orden de tratamiento; en gráfica del paciente no se reflejó las dosis en 2 (3,7%); en 3 pacientes (5,6%) con coagulopatía se pautó anticoagulante en el circuito; en 1 (1,9%) se evidenció sangrado y en 10 (18,5%), hipotermia leve (35-32°C).
ConclusionesSe precisa monitorización protocolizada de Mg y P. Se debe pautar la terapia en el tratamiento médico. Se precisa optimizar la técnica para prolongar su duración y evitar pérdidas hemáticas.
Continuous techniques of extracorporeal depuration (CTED) manage high volumes of fluid exchange and extensive control of its safety is required.
ObjectiveTo detect the risks of CTED and to determine its frequency per patient.
Material and methodsAn observational, retrospective study was performed. Inclusion criteria were patients admitted from January 2009 to December 2009, with CTED in the Polyvalent Intensive Care Unit (ICU) of the Hospital 12 de Octubre. We previously identified 10 risks that were detectable in the clinical records. We analyzed demographic and treatment variables. The quantitative variables were expressed as mean±SD and the qualitative ones as absolute and relative frequencies. Analysis: SPSS 15.0®.
ResultsA total of 54 patients (11.7%), with ages 59.78±14.8, 42 men (77.8%) were included. In 81.4%, the indication was acute kidney failure; 80.3% were treated with hemodiafiltration. Mean hours of CTED were 112.9±139.9 and the medium of 2 filters per patient (recommended intakes 0-31). Risk/patient rate was: 100% of patients without monitoring of the Mg and P, and 3.7% (n=2) urea; in 16 (29.6%), there was coagulation of the circuit prior to 24hours and in 25 (46.3%) the blood could not be returned; in 14 (29.3%), written regime was always lacking on the order for treatment. The dose was not reflected on the patient's chart in 2 (3.7%); in 3 patients (5.6%) with coagulation disorder, anticoagulants were prescribed in the circuit. In 1 (1.9%) bleeding was observed and in 10 (18.5%) there was mild hypothermia (35-32°C).
ConclusionsA standardized monitoring of the Mg and P is required. The therapy should be prescribed in the medical treatment. The technique needs to be improved in order to prolong its duration and avoid blood losses.
El tratamiento del fracaso renal agudo (FRA) mediante técnicas continuas de depuración extracorpórea (TCDE) es una práctica frecuente en las unidades de cuidados intensivos (UCI) españolas1. Las TCDE evitan algunas de las complicaciones potenciales de la hemodiálisis intermitente (HDI) cuando se aplican al paciente inestable con FRA2. Debido a su implementación lenta y continua, generan una eliminación gradual de agua y metabolitos tóxicos, evitan cambios bruscos en la volemia y en las concentraciones de electrolitos y urea y facilitan la administración intravenosa de fluidos de reposición, nutrientes y medicación. Además, diversos estudios han encontrado beneficios en la aplicación de estas terapias en otros cuadros clínicos como el shock séptico3, el síndrome de disfunción multiorgánica (SDMO)4 o el shock cardiogénico refractario5.
El desarrollo tecnológico y científico que han experimentado estas técnicas desde que Kramer describió la hemofiltración arteriovenosa continua (HFAVC) en 19776 nos ha proporcionado más eficiencia y seguridad en los tratamientos7. Sin embargo, algunas de las características consustanciales a la técnica precisan de una monitorización estrecha en las diferentes fases de su ejecución, con el fin de evitar posibles efectos adversos que pueden ser muy peligrosos. Algunas de estas características son: la necesidad de un acceso vascular central de grueso calibre, la existencia de un circuito sanguíneo extracorpóreo, el paso de sangre a través de una membrana sintética, la pauta de anticoagulación y el elevado volumen de reemplazo de fluidos y electrolitos necesario8. De ellas deriva la posibilidad de aparición de efectos adversos como bioincompatibilidad, coagulación del circuito sin posibilidad de retorno hemático, sangrado, consecuencias metabólicas, pérdidas de calor, complicaciones del acceso vascular y errores humanos.
La obligación de prevenir estos riesgos que la complejidad de la terapia conlleva hace que se precisen programas de formación en TCDE9,10, para todos los profesionales de las UCI implicados. En este sentido, la enfermería de cuidados intensivos ejerce un papel fundamental. En un estudio del año 2003 se objetivó que, en un 60% de las UCI de la red pública hospitalaria de la Comunidad de Madrid, se ocupa del purgado y el montaje del circuito para posteriormente controlar la monitorización del tratamiento11. En otros modelos es la enfermería nefrológica la que tiene este papel. Los facultativos, intensivistas o nefrólogos según la logística hospitalaria pautan la dosificación de la terapia.
El objetivo principal del siguiente estudio es detectar de forma retrospectiva diferentes riesgos y efectos adversos acecidos durante las TCDE pautadas en la UCI Polivalente del Hospital 12 de Octubre, con el fin de plantear acciones de mejora de la eficiencia y la seguridad de la terapia. Como objetivos secundarios, pretendemos describir cuál es nuestro estándar de tratamiento depurativo y fundamentar la necesidad de un análisis modal de fallos efectos (AMFE) de TCDE en nuestro servicio.
Material y MétodoDiseño y muestraEstudio retrospectivo observacional realizado en la UCI Polivalente del Servicio de Medicina Intensiva del Hospital 12 de Octubre. Se incluyó a todos los pacientes adultos (> 18 años) sometidos a TCDE en esta unidad desde el 1 enero al 31 de diciembre de 2009.
Instrumento y recogida de datosLa recogida de datos se llevó a cabo mediante revisión de historias clínicas. Para ello se confeccionó un registro de diferentes variables agrupables en tres categorías: demográficas, relacionadas con la pauta de los tratamientos y las que identifican posibles riesgos del paciente y complicaciones aparecidas durante su implementación.
Las variables definidas por la pauta de la terapia fueron: indicación terapéutica, tipo de tratamiento depurativo administrado, flujo sanguíneo, dosis de fluidos (reposición, diálisis y extracción), dosis de anticoagulantes (heparina y epoprostenol), fracción de filtración (considerando un valor constante del hematocrito del 30%), localización del catéter, horas de tratamiento y número de cambios de filtro.
Los riesgos y las complicaciones que detectar se consensuaron tras revisión bibliográfica y consulta a expertos: el Dr. Sánchez-Izquierdo, médico adjunto del Servicio de Medicina Intensiva del Hospital 12 de Octubre (Madrid) y el Dr. Maynar, jefe de sección del Servicio de Medicina Intensiva del Hospital Santiago Apostol (Vitoria). Ambos son miembros del Grupo de Trabajo de Cuidados Intensivos Nefrológicos de la SEMICYUC.
Se determinaron cinco posibles riesgos: paciente con coagulopatía severa (tiempo parcial de tromboplastina activada [TTPA]>1,5 veces el basal; actividad de protombina (AP) < 35%; plaquetas < 50.000 y fibrinógeno < 100) y pauta de anticoagulación en el circuito extracorpóreo, inexistencia de pauta médica escrita de las dosis de depuración en la orden de tratamiento, inexistencia de pauta escrita de las dosis de depuración en los registros de enfermería, inexistencia de determinaciones de Mg y P, inexistencia de petición de niveles de urea. Las cinco complicaciones que detectar fueron: evidencia de sangrado, duración de los filtros < 24 h, coagulación del circuito hemático sin posibilidad de retorno sanguíneo, hipotermia leve (35-32°C) e hipotermia moderada (< 32°C).
Todos los pacientes fueron tratados con el aparato de depuración extracorpórea Aquarius® de la empresa BAXTER®, y filtro de polisulfona Aquamax® con área de 1,2 m2. Como dializante y solución de hemofiltración, se utilizó Multibic® (3K+). Se utilizó un catéter de doble luz modelo GamCath (Gambro®) de 11 Fr y 20 cm de longitud.
Consideraciones éticasNo se efectuó ninguna modificación en el cuidado de los pacientes ni se realizaron procedimientos experimentales acordes a las normas internacionales estipuladas en la declaración de Helsinki; por lo tanto, no se requirió autorización del paciente o sus familiares.
Análisis de datosPara el análisis de datos, las variables cualitativas se expresaron como frecuencias absolutas y relativas; las variables cuantitativas, como media±desviación estándar o mediana [intervalo intercuartílico]. Las variables cuantitativas se analizaron con la prueba de la t de student y las variables cualitativas, con la de la χ2. El nivel de significación estadística se estableció en p < 0,05. Los cálculos se realizaron con el programa estadístico SPSS en su versión15.0.
ResultadosDurante 2009 se produjeron 461 ingresos en nuestra UCI; 54 de estos pacientes (11,7%) fueron tratados con TCDE. Su media de edad era 59,78±14,8 años y 42 eran varones (77,8%).
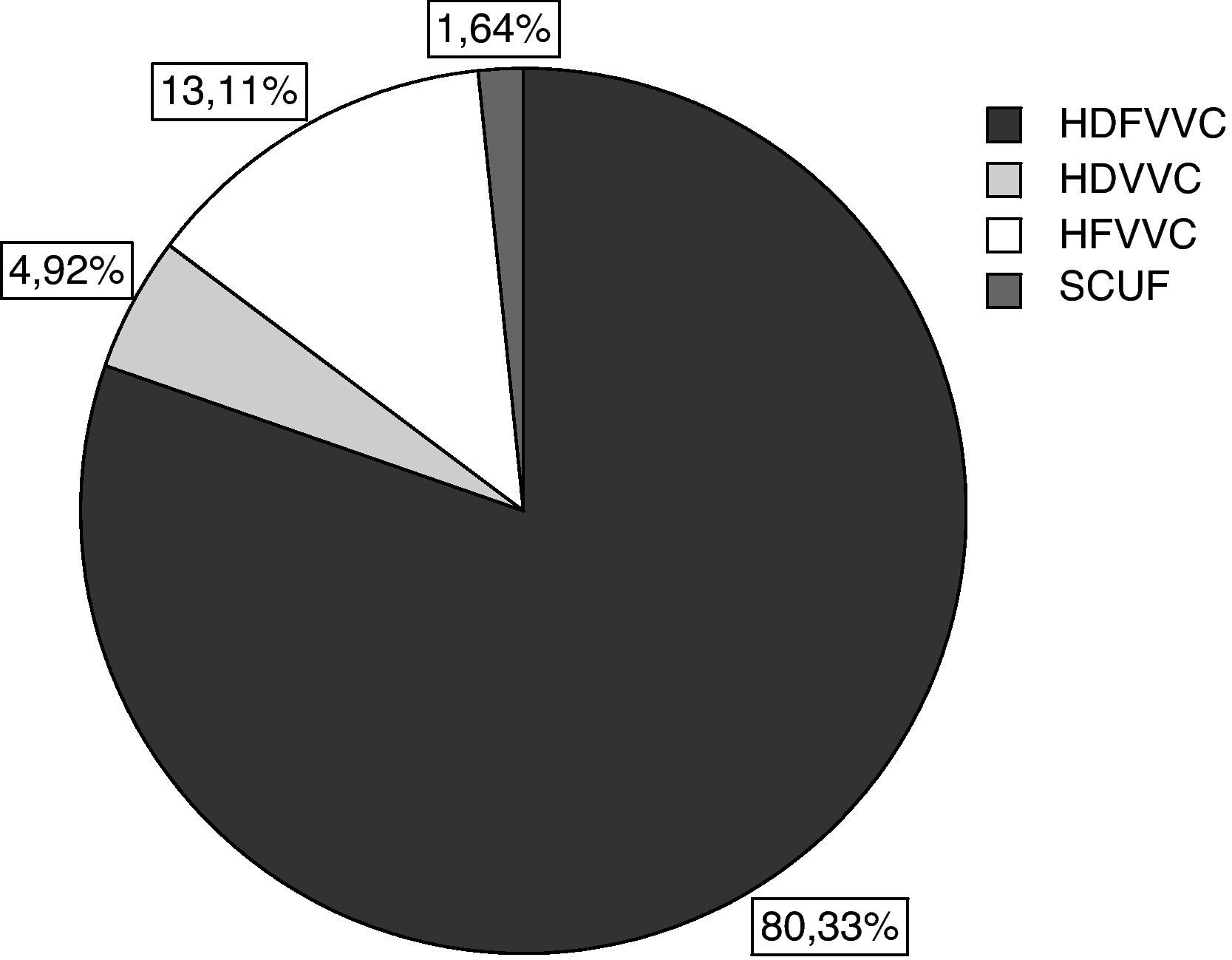
La indicación principal del tratamiento fue FRA (81,4%), y la modalidad de depuración más empleada fue la hemodiafiltración venovenosa continua (HDFVVC) (80,3%) (fig. 1). El tiempo de TCDE por paciente fue una media de 112,9±139,9 h –mediana, 62 [1-714] h—. Los accesos venosos del circuito se localizaron mayoritariamente en la femoral derecha (53,7%) (fig. 2). La mediana de cambios de filtros por paciente fue de 2 [0-31].
Frecuencia de implementación de las principales modalidades de depuración extracorpórea en la UCI Polivalente del Hospital 12 de Octubre. HDFVVC: hemodiafiltración venovenosa continua; HDVVC: hemodiálisis venovenosa continua; HFVVC: hemofiltración venovenosa continua; SCUF: ultrafiltración lenta continua.
Las dosis de tratamiento pautadas se recogen en la tabla 1. La fracción de filtración (FF) media fue del 20,7%±11,3% —mediana, 21,8% [6%-52%]. En el 66,7% de los pacientes (n=36) se emplearon fracciones de filtración mayores del 20% en los tratamientos depurativos. En relación con la anticoagulación, las dosis medias de heparina pautada fueron de 6,8±4,3 U/kg/h, asociándose con epoprostenol en 13 pacientes/tratamientos (28,3%).
La tabla 2 muestra la frecuencia con que aparecen los riesgos y las posibles complicaciones que pretendíamos detectar en nuestra muestra; 31 pacientes (57,4%) sufrieron alguna coagulación del circuito extracorpóreo antes de 24 h; en este subgrupo el total de circuitos coagulados fue de 97 —media, 3,13±5,1; mediana, 2 [0-26] circuitos por paciente—. En el 64,9% de estas coagulaciones (63 circuitos) no se pudo retornar la sangre al paciente (media de 2±2,1 circuitos por paciente).
Frecuencia de aparición de riesgos y complicaciones de las TCDE
| n | % | |
| Número total de pacientes con TCDE | 54 | 100 |
| Paciente con coagulopatía severa y uso de anticoagulación con heparina y/o epoprostenol | 3 | 5,6 |
| Inexistencia de pauta médica escrita de las dosis de depuración en la orden de tratamiento | 14 | 25,9 |
| Inexistencia de pauta escrita de las dosis de depuración en los registros de enfermería | 2 | 3,7 |
| Ausencia de determinación de Mg y P | 54 | 100 |
| Ausencia de determinación de urea | 2 | 3,7 |
| Duración de los filtros<24 h | 16 | 29,6 |
| Hipotermia leve (32-35°C) | 10 | 18,5 |
| Hipotermia moderada (< 32°C) | 0 | 0 |
| Sangrado | 1 | 1,9 |
| Coagulación del circuito sin posibilidad de retornar el contenido hemático | 25 | 46,3 |
En relación con las duraciones de los filtros (menos de 24 h vs. más de 24 h), encontramos diferencias estadísticamente significativas con la variable pauta de extracción, 129,3±58,7 vs. 93,6±41,3ml/h (p=0,03). No existen diferencias significativas con el flujo de sangre 153,2±26,3 vs. 167,9±33,4ml/min (p=0,09); el flujo de la reposición 1.393,3±626,3 vs. 1.611,1±792,8ml/h (p=0,31); el flujo de diálisis 1.640±391,8 vs. 1.607,2±448,3ml/h (p=0,79); la fracción de filtración, 21,3%±10,6% vs 20,5%±12,9% (p=0,81), y el flujo de heparina, 486,1±273,2 vs. 478,5±365,8 U/h (p=0,93). Tampoco encontramos asociación estadística entre la anticoagulación con heparina y epoprostenol y la duración de los filtros (p=0,56) ni entre mantener fracciones de filtración < 20% y la duración de los filtros (p=0,62). En los pacientes en que se habían producido coagulaciones del circuito sin posibilidad de retorno sanguíneo, los flujos de sangre eran inferiores, 148,5±17,2 vs. 173,9±37,9ml/min (p=0,03). No hubo diferencias significativas en función de las dosis de heparina 470,3±229,1 vs. 548,8±426,9 U/h, o el uso de heparina y epoprostenol como anticoagulantes (p=0,78).
En la aparición de hipotermia leve encontramos diferencias significativas en relación con el empleo de flujos más elevados de sangre, 175,6±27,5 vs. 153,3±28,3 (p=0,02) y de líquidos de reposición, 2.086,3±832,8 vs. 1.294,2±533,8 (p<0,01).
DiscusiónPara establecer una discusión sobre posibles efectos adversos y riesgos que han podido sufrir nuestros pacientes con las TCDE, es necesario describir el escenario en que se desarrollan. Para ello, hemos divido en dos epígrafes este apartado.
Panorama de las TCDE en la UCI Polivalente del 12 de OctubreEl porcentaje de pacientes críticos que recibieron TCDE en nuestra unidad durante el año 2009 (11,7%) es mayor que el de otros estudios multicéntricos12,13, que registran porcentajes en torno a un 5-6%. Este dato denota la relevancia que adquiere esta terapia en relación con aspectos formativos y de seguridad del paciente en nuestra sección. A este hecho se asocia un modelo de trabajo con las TCDE en el que los médicos intensivistas pautan la terapia y la enfermería de intensivos prepara el circuito extracorpóreo y monitoriza el tratamiento. Este modelo ha sido denominado como modelo de intensivos11,14, frente a otros, modelo nefrológico y mixto, en el que los protagonistas son los nefrólogos o intensivistas y las enfermeras nefrológicas.
Un 81% de las técnicas que se pautan en nuestra unidad tienen como principal indicación el FRA. Este porcentaje es superior al que se observa en el estudio multicéntrico del Grupo de Trabajo de Cuidados Intensivos Nefrológicos de la Sociedad Española de Medicina Intensiva y Unidades Coronarias (SEMICYUC)15, en el que las TCDE por oligoanuria suponen el 67% de los casos. Aunque parece que en la práctica clínica los tratamientos continuos del FRA en el paciente crítico prevalecen sobre la hemodiálisis intermitente, no existen todavía estudios concluyentes que corroboren una mejora de la supervivencia del paciente de una técnica frente a otra16-18.
La HFVVC es la variante técnica más empleada en nuestro país (79,6%)12; sin embargo, en nuestro estudio prevalece la HDFVVC (80,3%). En beneficio de nuestra opción, algunos estudios parecen apuntar a que añadir dosis de difusión (diálisis) a las dosis de convección (reposición) podría tener ventajas en caso de utilizar dosis de convección bajas19. Precisamente, en el análisis de las pautas depurativas, observamos que nuestras dosis convectivas de 1.500ml/h de ultrafiltrado de media (20 ml/kg/h) son sensiblemente inferiores a las propuestas en el estudio de referencia de Ronco et al20, en el que se establece un valor de 35 ml/kg/h como dosis mínima para el tratamiento del FRA. Sin embargo, este debate ha sido estimulado por la publicación del controvertido gran estudio multicéntrico «The Veterans Affairs/National Institutes of Health (VA/NIH) Acute Renal Failure Trial Network (ATN) study»21. En él se concluye que mayores dosis de depuración no se corresponden con mejoras evidentes en la disminución de la mortalidad, la recuperación de la función renal o la reducción de la tasa de fallo orgánico no renal en el FRA. Paralelamente un grupo de intensivistas españoles expertos en TCDE se inclinan por la razonable recomendación de una aproximación dinámica22 a la dosificación de la terapia, es decir, ajustable a la evolución clínica del paciente23. Este grupo ha acuñado el término dialytrauma24 para definir el conjunto de alteraciones metabólicas, hidroelectrolíticas y/o terapéuticas que se pueden presentar durante las TCDE por una mala dosificación de la terapia.
Riesgos y eventos adversos de las TCDE en la UCI Polivalente del 12 de OctubreLa limitación principal de nuestro trabajo ha sido la necesidad de establecer previamente posibles riesgos y complicaciones de las terapias para ordenar metodológicamente el estudio de las historias clínicas. En una primera aproximación a los resultados, se observa que dos posibles eventos adversos y un riesgo no han acaecido o lo han hecho en un porcentaje mínimo.
En la gran mayoría de nuestros pacientes sometidos a las terapias se determinaron diariamente la urea y la creatinina. En los 2 casos en que no se realizaron estas determinaciones, los pacientes fallecieron poco después de iniciar el tratamiento. En relación con la posibilidad de sangrado, referido en diferentes publicaciones que recogen complicaciones de las TCDE8,23, sólo se produjo en 1 paciente de nuestra serie. En el estudio epidemiológico, multicéntrico y multinacional del grupo BEST Kidney25, que describe la situación de la práctica de las TCDE en 55 UCI de 23 países, se incluyó a 1.006 pacientes con este tratamiento. El sangrado ocurrió en un 3,3% de los pacientes, y la zona más habitual era el punto de inserción de los catéteres intravenosos (1,3%).
La pérdida de calor producida por el circuito extracorpóreo y el intercambio con grandes volúmenes de líquidos puede producir una leve hipotermia, que en algunos casos puede resultar beneficiosa desde el punto de vista hemodinámico26. Sin embargo, debemos tener en cuenta potenciales efectos adversos como pérdida de energía, escalofríos, incremento de demanda de oxígeno, vasoconstricción, inmunosupresión y alteraciones de la coagulación9. En nuestros pacientes no se produjo ninguna hipotermia moderada (< 32°C), aunque sí se produjeron 10 hipotermias leves. Estas pueden evitarse con el ajuste del calentador de fluidos del monitor de TCDE y, especialmente, con el calentamiento directo del paciente antes y durante la terapia si fuera necesario.
Otros dos efectos adversos relacionados con la coagulación de los filtros fueron su duración < 24 h (en el 29,6% de los pacientes) y su coagulación sin posibilidad de retorno hemático (46,3%). Respecto al primero de los eventos, es la complicación más frecuente en las TCDE27. La monitorización y el registro de las presiones del circuito, sobre todo su tendencia, nos describen la situación del sistema. Por ejemplo, el aumento progresivo de la presión transmembrana (PTM) se relaciona con un aumento del estrés del filtro para obtener el rendimiento pautado28. Algunas de las medidas propuestas para prolongar la vida media de los filtros27 son: mejorar el diseño de los circuitos, utilizar catéteres apropiados, utilizar membranas de alta biocompatilbilidad, modificar la fracción de filtración para mantenerla por debajo del 20% o realizar reposición prefiltro (para reducir la fracción de filtración). Nuestros resultados encuentran asociación estadística entre un mayor flujo de extracción y una menor duración de los filtros. Este flujo se genera gracias a la PTM, y lógicamente su aumento se acompaña de una elevación de dicha presión (sin modificación del flujo de sangre). El acceso vascular del circuito extracorpóreo es un elemento fundamental que determinará el rendimiento de las terapias en relación con la posibilidad de flujos de sangre que proporcione. Nuestros catéteres son de pequeño calibre (11 Fr) para proporcionar flujos de sangre de 200 ml/min, que precisarían diámetros>12 Fr. La longitud de los catéteres dependerá del acceso vascular seleccionado, de 15 a 16 cm en subclavia y yugular derechas y algo más largos en localizaciones del lado izquierdo. Los accesos femorales deberían ser de 20 a 24 cm29.
Cada vez que el circuito se coagula sin posibilidad de retorno, el paciente pierde 175 ml de sangre (según las especificaciones del fabricante). En nuestra muestra, en los pacientes en que se producía este evento, teniendo en cuenta una media de dos ocasiones por paciente, estimamos una pérdida hemática asociada de 350 ml.
Una de las complicaciones que se produce durante la depuración extrarrenal es la depleción de Mg y P, y en especial la hipofosfatemia. El fosfato se pierde con la hemofiltración en una proporción 3-4 veces mayor que en una filtración glomerular de 100 ml/min8. En el estudio ATN21, el principal problema hidroelectrolítico fue la hipofosfatemia, especialmente en las dosis más altas (el 17,6 frente al 10,9%; p<0,001). La nula monitorización de los niveles de P es un riesgo muy elevado que precisará de una esencial y urgente acción de mejora en nuestro medio.
Como ya hemos reseñado, la dosificación del tratamiento condiciona el pronóstico del paciente20,21,24 y una pauta equivocada podría producirle importantes eventos adversos. Con el fin de disminuir riesgos de prescripción, algunos autores30 recomiendan incluir los siguientes parámetros en los tratamientos prescritos: duración, tipo de membrana, flujo de sangre o fracción de filtración máxima, tipo de anticoagulación, extracción horaria o total, flujo del líquido de reposición o fracción de filtración máxima, el flujo de diálisis, la composición del líquido de reposición y diálisis, el sitio de administración de la reposición (prefiltro o posfiltro), la temperatura de los líquidos o la utilización del calentador en el circuito extracorpóreo. La prescripción detallada de la terapia es además una necesidad expresada por muchos expertos en las TCDE31. En nuestra unidad se acostumbra pautar el tipo de terapia, sus flujos y la dosis de anticoagulación. Sin embargo, durante el mantenimiento del tratamiento dicha pauta puede olvidarse por error o sustituirse por una frase genérica como: hemofiltración según parámetros. Este error podría subsanarse con la normalización de la prescripción.
Aunque en nuestro estudio el número de pacientes implicados en este riesgo es muy bajo (n=3), debe evitarse la anticoagulación de los circuitos en pacientes con coagulopatía severa. De hecho, hay diferentes estudios32,33 en los que se implementan tratamientos sin anticoagulación que registran datos de duración de circuitos similares a aquellos que sí la utilizan.
ConclusionesLos principales riesgos detectados en nuestra unidad en relación con las TCDE son la nula monitorización de los niveles de fosforo y el defecto en la cumplimentación de la pauta terapéutica en las órdenes de tratamiento. Los principales eventos adversos se relacionan con el mantenimiento de la permeabilidad del circuito y la imposibilidad del retorno hemático cuando se produce coagulación del mismo.
Nuestros estándares de TCDE precisan adecuarse más a la evidencia y a un manejo más dinámico de las dosis en relación con la situación clínica del paciente. Este trabajo, a pesar de sus limitaciones, aportará información a una herramienta de seguridad de aplicación posterior, el AMFE.
Premio Baxter-SEEIUC a la mejor comunicación oral o póster sobre Técnicas Continuas de Depuración Extrarenal presentado al XXXVI Congreso Nacional de la Sociedad Española de Enfermería Intensiva y Unidades Coronarias. Málaga, 13-16 Junio de 2010.