Introducción
La infección nosocomial (IN) en las Unidades de Cuidados Intensivos (UCI) está fundamentalmente relacionada con la utilización de dispositivos externos invasivos, por ello las más frecuentes son las relacionadas con la ventilación mecánica, con catéteres vasculares (catéteres venosos centrales, periféricos, arteriales) y con los catéteres vesicales1,2.
Según los Centres for Disease Control and Prevention(CDC), la IN es aquella que se adquiere durante el ingreso hospitalario, tras 48-72 horas, y no estaba presente ni en período de incubación al ingreso3.
Es cada vez más frecuente la identificación de bacterias patógenas multirresistentes en los pacientes críticos. Una bacteria se define como multirresistente cuando al menos cumple dos condiciones: que exista resistencia a más de una familia o grupo de antimicrobianos de uso habitual y que esa resistencia tenga relevancia clínica y epidemiológica; esto es, que pueda suponer una dificultad para el tratamiento y la posibilidad de presentarse en forma de brotes4.
Los principales vectores de transmisión de estos microorganismos son a través de las manos del personal sanitario y/o de objetos contaminados, al encontrarse éstos frecuentemente en reservorios inanimados como superficies (ventiladores mecánicos, mesillas, monitores de cabecera, bombas de infusión, barandillas de camas, termómetros, fonendoscopios, etc.), reservorios húmedos (nebulizadores, soluciones, etc.) o en personas, ya sean éstos pacientes infectados y pacientes o profesionales colonizados.
En la actualidad, las bacterias emergentes multirresistentes más frecuentes son el Staphylococcus aureus resistente a meticilina (SAMR), el Enterococcus resistente a vancomicina y las enterobacterias productoras de betalactamasas de espectro extendido (BLEE), sobre todo Escherichia coli y Klebsiella pneumoniae, así como la Pseudomonas aeruginosa, Stenotrophomonas maltophilia y Acinetobacter baumannii.
El Acinetobacter baumannii multirresistente (ABMR), cocobacilo gramnegativo, aerobio, se está convirtiendo en los últimos años, por su ubicuidad y multirresistencia a antibióticos, en uno de los patógenos que cada vez con mayor incidencia es aislado en infecciones nosocomiales en las UCI5-9. Su capacidad de supervivencia es cuatro veces mayor que la de otros bacilos gram negativos y lo hace a diferentes temperaturas y condiciones de pH10. Es muy importante la contaminación ambiental, hasta tal punto que los brotes epidémicos están relacionados con la presencia de este germen en reservorios inanimados11-13.
En diciembre de 2006 en las UCI de nuestro hospital se declaró un brote de ABMR que afectó a 8 pacientes. Con el fin de controlarlo y erradicar probables reservorios ambienγtales se procedió al vaciado, limpieza y desinfección de las UCI.
El objetivo de nuestro estudio ha sido evaluar el efecto de esta intervención, limpieza/desinfección, sobre la incidencia de infecciones nosocomiales causadas por microorganismos multirresistentes.
Material y métodos
Tipo de estudio
Se trata de un estudio cuasi experimental antes-después de una intervención de limpieza y desinfección de todas las superficies, realizada como medida de control de un brote de ABMR ocurrido del 22-12-06 al 12-02-07, en las UCI del Hospital Clínico San Carlos, hospital de tercer nivel, referente en el área asistencial 7 de Madrid, con 934 camas funcionantes.
Ámbito del estudio
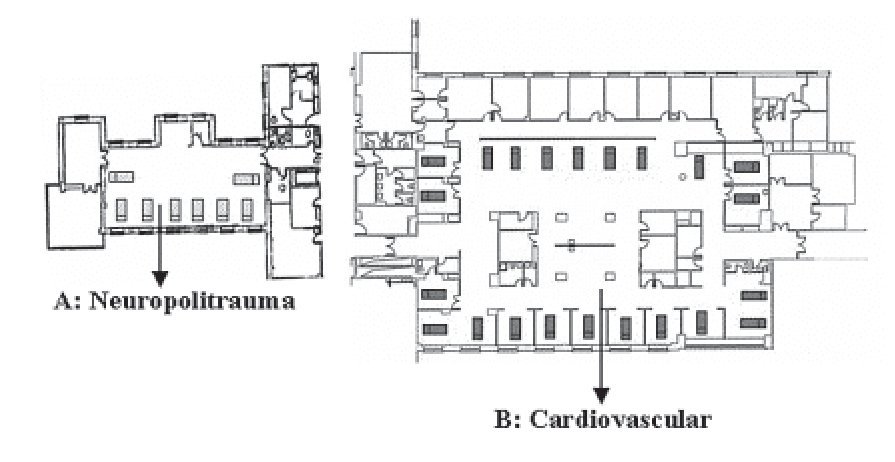
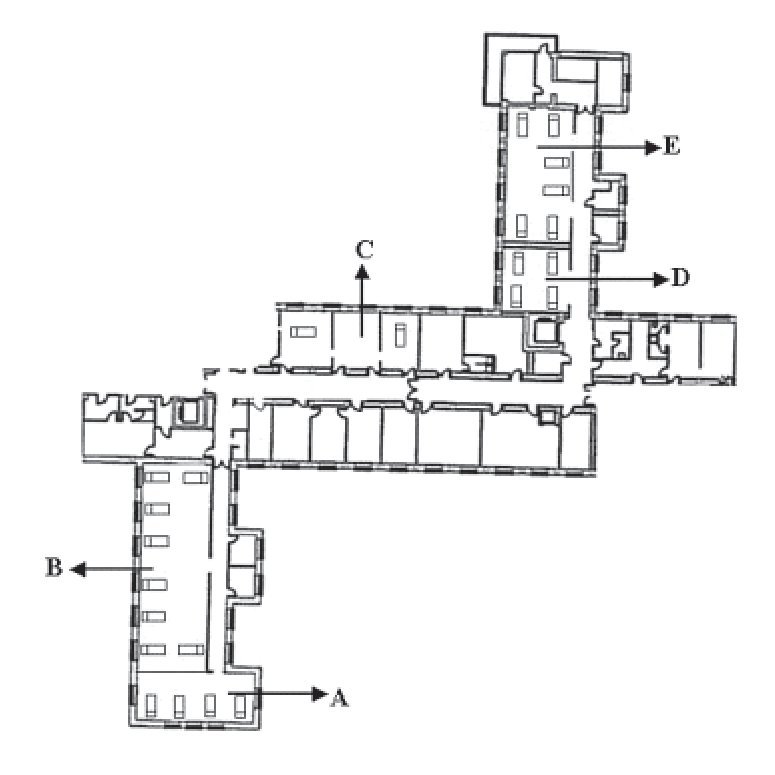
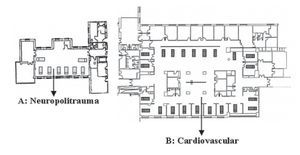
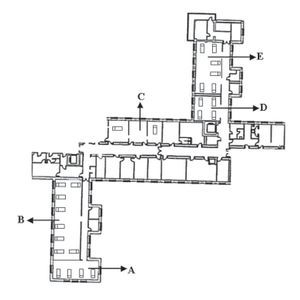
Existen dos UCI denominadas Críticos I (CI) y Críticos II (CII) en tres áreas arquitectónicas diferentes, con un total de 54 camas (figs. 1 y 2).
Figura 1 Unidad de Críticos I.
Figura 2 Unidad de Críticos II.
Críticos I
La CI está en la segunda planta del ala sur del hospital y su construcción es moderna. Consta de 30 camas en dos espacios arquitectónicos diferentes:
A. Neuropolitrauma, tiene 8 camas separadas por tabiques en grupos de 2 y 3 camas. En ella se da cobertura a pacientes politraumatizados, de neurocirugía, cirugía maxilofacial y trauma-ortopedia.
B. Unidad cardiovascular, consta de 22 camas, en ellas se da cobertura a pacientes con patología coronaria, cirugía cardíaca y cirugía vascular. Esta unidad tiene 11 camas individuales, 2 habitaciones dobles y 7 camas corridas separadas por biombos plegables fijos.
Críticos II
La CII está localizada en la segunda planta del ala norte del hospital y es de arquitectura antigua. Consta de 24 camas repartidas en 5 áreas diferentes, dos de 4 camas (A y D), otra de 8 (B), una cuarta con 2 habitaciones de aislamiento (C) y por último una área de 6 camas (E). Salvo las camas de aislamiento, en el resto de las áreas la separación entre camas se realiza mediante biombos móviles. Es ésta una unidad polivalente que da cobertura fundamentalmente a pacientes médicos, de cirugía digestiva y torácica.
Intervención
Vaciado de las unidades
Con el objetivo de eliminar reservorios ambientales mediante la limpieza y desinfección integral de todas las superficies y espacios clínicos de las unidades, se procedió al cierre secuencial y vaciado de las mismas. Para ello se constituyó un grupo de trabajo compuesto de tres preventivistas, un representante de la dirección médica y uno de la dirección de enfermería, el jefe de servicio en funciones de la UCI y la supervisora del área de críticos. El grupo se reunía diariamente para valorar los nuevos casos, tanto de nuevos infectados como portadores, y en función de las necesidades asistenciales, quirófanos, urgencias, etc. se organizaba el flujo de pacientes. Una de las primeras acciones que se llevó a cabo fue reducir la actividad quirúrgica programada y limitar los ingresos politramautizados procedentes de Urgencias con el objeto de disminuir la presión asistencial de las UCI y proceder a su cierre.
Se comenzó el cierre por la unidad de neuropolitrauma de CI, por ser ésta una unidad pequeña e independiente. Para ello se trasladó a los pacientes de esta unidad a la unidad de cardiovascular y a CII.
Para limitar la diseminación del microorganismo a los otros pacientes hospitalizados, los pacientes infectados con ABMR y portadores fueron aislados en habitaciones individuales, aplicando las medidas estándar y las precauciones específicas del aislamiento de contacto siguiendo las indicaciones de los CDC8. A continuación se cerró la unidad de cardiovascular de CI, para lo cual en CII, en el área de 8 y 4 camas (A y B), se reagruparon todos los pacientes con ABMR y portadores, dejando camas libres por si aumentaba el número de infectados o portadores. Esta área estaba perfectamente señalizada y los pacientes eran atendidos por personal exclusivo, además de seguir aplicando las medidas estándar y las precauciones específicas del aislamiento de contacto. En las áreas D y E, al otro extremo, se reagruparon los pacientes expuestos, no colonizados ni infectados.
En último lugar se cerró la unidad de CII, para ello se habilitó y acondicionó una antigua unidad, que llamaremos "unidad de apoyo", con dos áreas diferenciadas, una para los pacientes infectados y otra para los expuestos. Esta unidad se mantuvo abierta hasta el alta de todos los pacientes relacionados con el brote de ABMR.
De igual manera que el cierre, las unidades ya limpias y desinfectadas se fueron abriendo de forma secuencial a como se habían cerrado. Los pacientes que en ellas ingresaban eran pacientes nuevos, todos ellos procedentes de Urgencias, quirófano o de otras áreas del hospital, con evidencia de no tener o haber tenido relación con el brote de ABMR, en ningún caso los pacientes portadores, infectados o expuestos. Aquellos dados de alta de la unidad de apoyo que precisaron reingreso en la UCI volvieron a la unidad de apoyo.
Muestreo microbiológico ambiental e impronta de manos
Se realizó un muestreo microbiológico ambiental antes y después de la intervención. Se tomaron muestras aleatorias de superficies: mobiliario, equipo clínico y material administrativo y de las manos de los trabajadores sanitarios en todas sus categorías profesionales.
Las muestras se recogieron con hisopos estériles humedecidos en suero salino. Se sembraron en medios sólidos y se introdujeron en 5 ml de caldo nutritivo. Se incubaron a 36 +/- 1 °C durante 48 horas y se procedió al recuento e identificación de la flora. Los resultados se expresan como total de muestras incorrectas, considerando como tal aquellas que mostraron presencia de microorganismos patógenos, o recuentos microbianos superiores a 100 unidades formadoras de colonias por muestra (ufc/muestra).
Limpieza y desinfección de las unidades
El mobiliario y los equipos clínicos (ventiladores, monitores, bombas, grúas de movilización, carros, camas, etc.) se limpiaron con agua y jabón, desinfectándose con un producto a base de amonio cuaternario. Los suelos y paredes se limpiaron igual y se desinfectaron con lejía al 5% diluida al 1/100. Los comprimidos se desecharon, las ampollas y sueros, de manera individualizada, se limpiaron y desinfectaron de igual forma que los equipos clínicos.
Información a los profesionales
Se recordó a todo el personal de la unidad sobre la importancia de mantener las medidas universales de precaución de transmisión de infecciones, las precauciones específicas del aislamiento de contacto y el correcto cumplimiento del protocolo de lavado de manos.
Evaluación del efecto de la intervención
Se establecieron dos períodos, el de preintervención, del 1 de marzo al 15 de diciembre de 2006, y el de posintervención, del 1 de marzo al 15 de diciembre de 2007. En estos períodos no se registraron otros cambios o incidencias en las medidas de control de la IN (personal, procedimientos, equipamiento, organización, etc.).
Se estratificó por unidad (CI y CII), por tipo de microorganismo: SAMR, Pseudomonas aeruginosa multirresistente (PAMR), BLEE Stenotrophomonas maltophilia (SMMR) y ABMR; y por localización de la infección (urinaria, bacteriemia, respiratoria y herida quirúrgica).
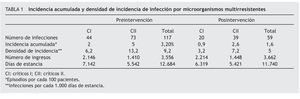
Se calculó la incidencia acumulada (IA) y la densidad de incidencia (DI) de infecciones nosocomiales por microorganismos multirresistentes y para la localización de la infección.
La IA se determinó dividiendo el número de infecciones por el total de pacientes en riesgo. El resultado se expresa en frecuencias y porcentajes. La DI se obtuvo dividiendo el número de infecciones por el número total de pacientes-día y se expresó en infecciones por 1.000 días.
Para comprobar si existían diferencias estadísticamente significativas se obtuvo la razón de tasas (RT) y su intervalo de confianza (IC) al 95%. La RT se calculó dividiendo las tasas de incidencia de los dos períodos. El nivel de significación estadística se estableció en p < 0,05.
Resultados
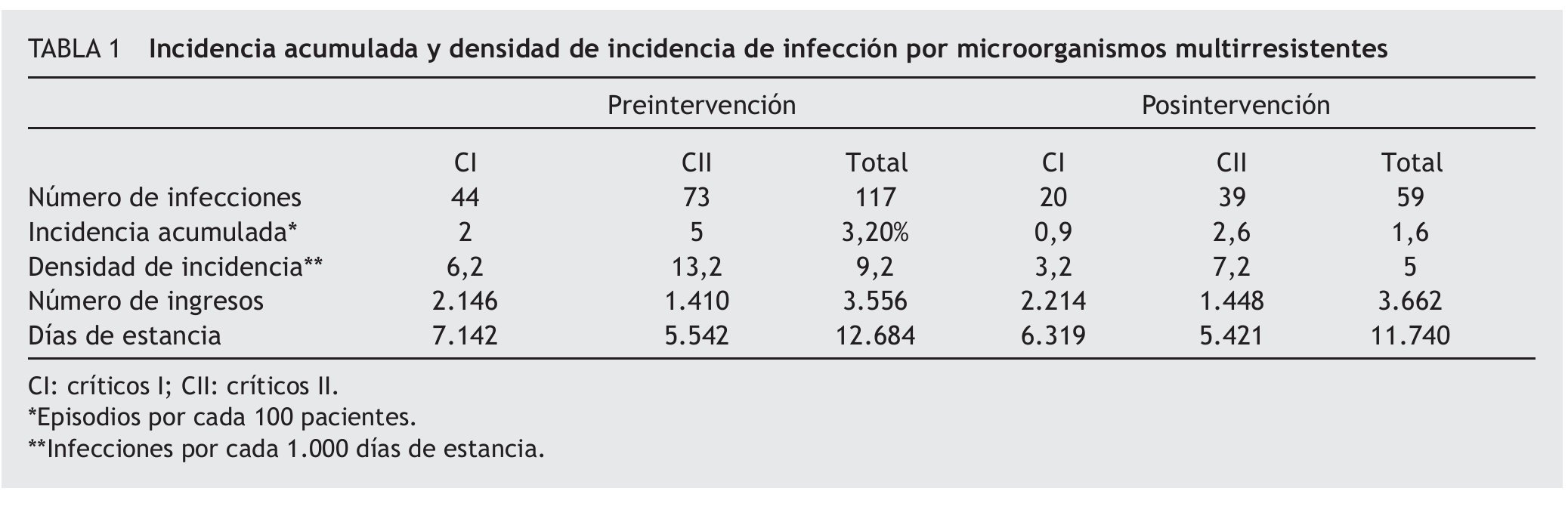
En el período de preintervención se controlaron 3.556 pacientes que generaron 12.684 estancias. Hubo un número de IN por microorganismos multirresistentes de 117. Siendo los casos detectados 44 en CI y 73 en CII.
La incidencia global de infección de las dos unidades fue de 3,2 episodios por cada 100 pacientes y la DI, de 9,2 infecciones por cada 1.000 días de estancia. La IA y la DI de cada una de las unidades se muestra en la tabla 1.
En el período posintervención se estudiaron 3.662 pacientes que generaron 11.740 estancias. El número de IN por microorganismos multirresistentes fue de 59; de éstos 20 fueron en CI y 39, en CII.
La incidencia global de infección de las dos unidades fue de 1,6 episodios por cada 100 pacientes y la DI, de 5 infecciones por cada 1.000 días de estancia. La IA y la DI de cada una de las unidades se muestra en la tabla 1.
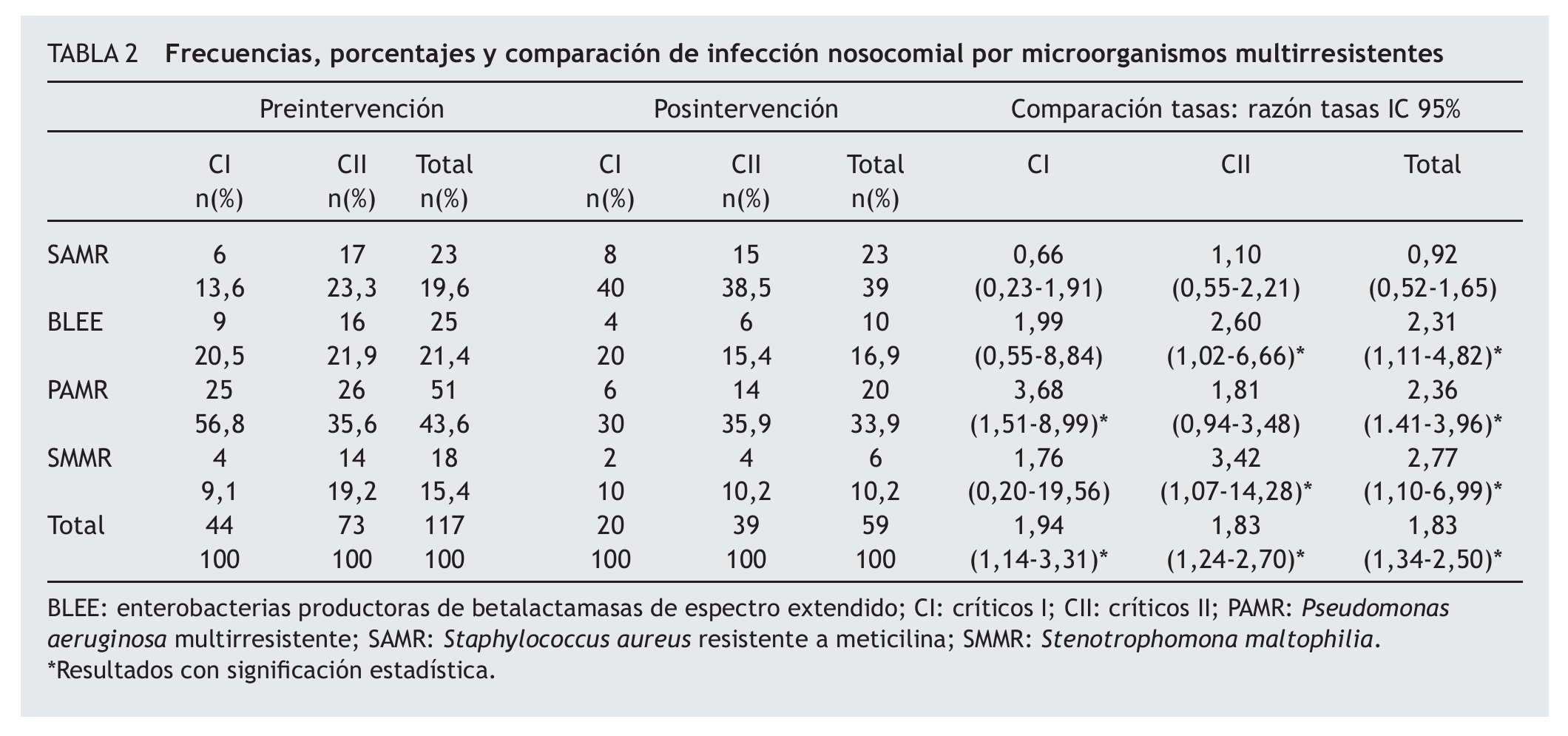
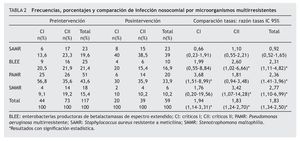
El microorganismo aislado más frecuentemente en el período de preintervención, tanto en el global de las dos UCI como en cada una de ellas por separado, fue la PAMR. Sin embargo, en el período posintervención fue el SAMR. Los resultados de las frecuencias y porcentajes de los diferentes microorganismos multirresistentes, tanto globales como en cada una de las UCI, se presentan en la tabla 2.
La tasa de incidencia global de IN por microorganismos multirresistentes disminuyó significativamente en el período posintervención para el conjunto de las 2 UCI (RT: 1,83; IC 95% 1,34-2,50) y para cada UCI por separado, CI (RT: 1,94; IC 95% 1,14-3,31 y CII (RT: 1,83; IC 95% 1,24-2,70), p < 0,005.
También se encontró en el período posintervención una disminución significativa en la tasa de incidencia global de IN por los microorganismos no endémicos: Pseudomonas aeruginosa (RT: 2,36; IC 95% 1,41-3,96), enterobacterias BLEE (RT: 2,31; IC 95% 1,11-4,82) y SMMR (RT: 2,77; IC 95% 1,10-6,99). No así para SAMR (RT: 0,92; IC 95% 0,52-1,65).
Los resultados de la comparación de los diferentes micro-organismos multirresistentes en cada una de las UCI y en los dos períodos, con su RT correspondiente, se presentan en la tabla 2.
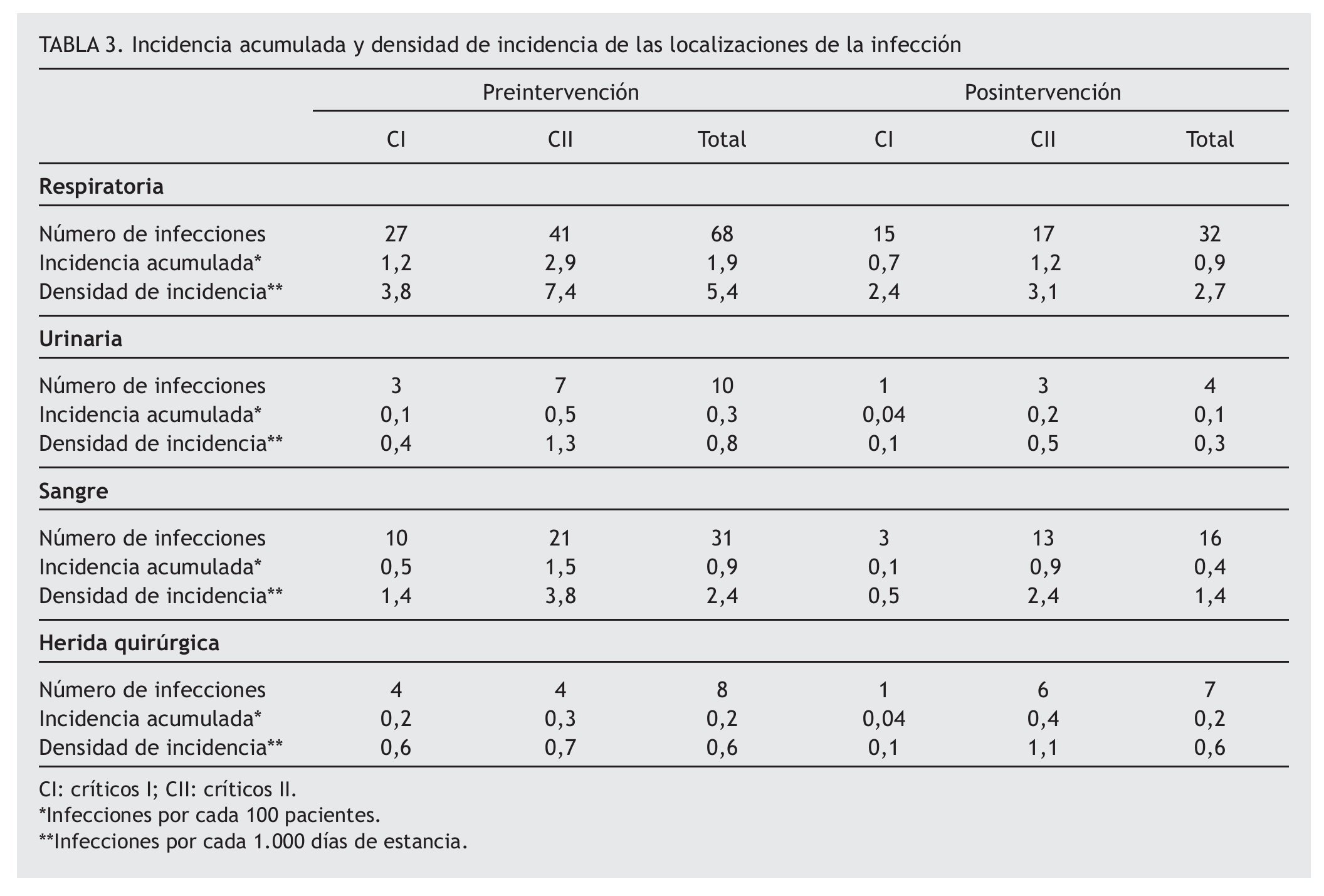
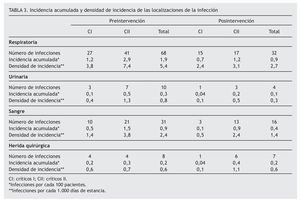
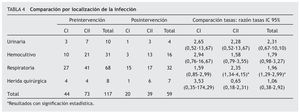
Con respecto a la localización de la infección, en ambos períodos la de mayor incidencia fue la respiratoria, tanto en el global de las dos UCI, como para cada una de ellas por separado. La IA y la DI de cada una de las localizaciones se muestran en la tabla 3.
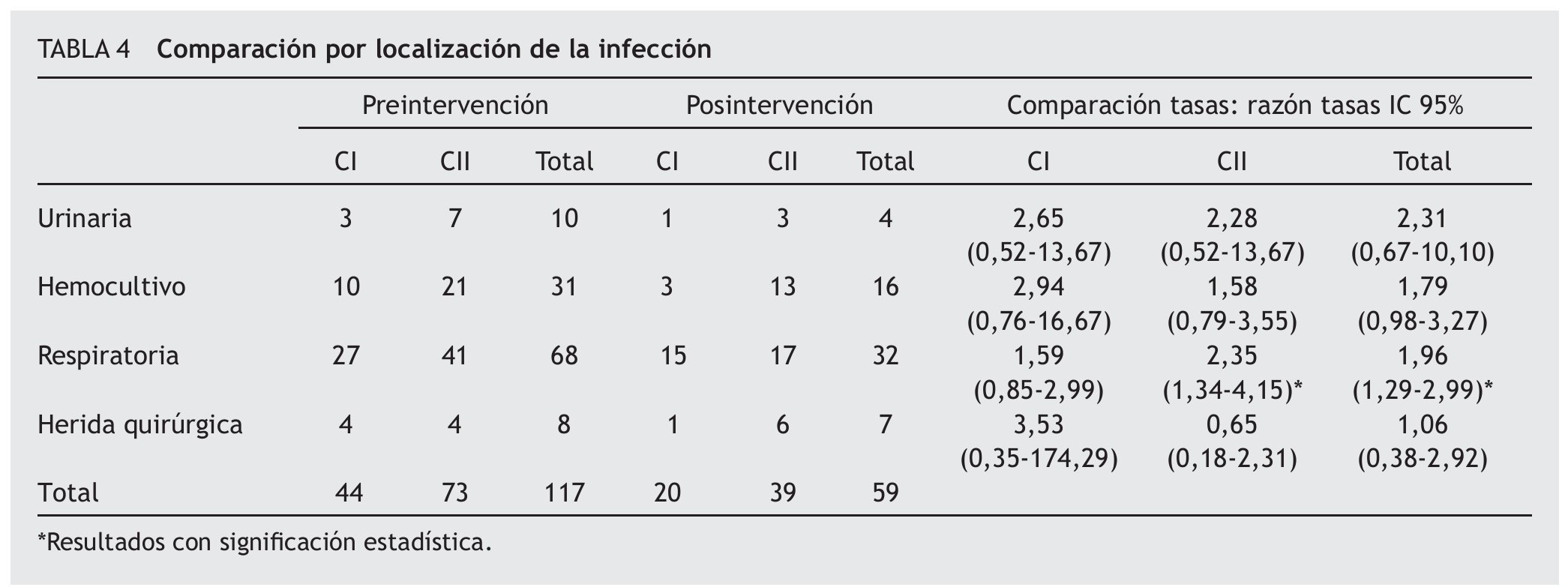
Solamente resultó significativa la disminución en la tasa global de infecciones respiratorias (RT: 1,96; IC 95% 1,29-2,99) y para CII (RT: 2,35; IC 95% 1,34-4,15), no así en CI (RT: 1,59; IC 95% 0,85-2,99). Los resultados de comparación de la localización de la infección urinaria, bacteriemia y de herida quirúrgica, tanto global como de cada una de las UCI, se muestran en la tabla 4.
Muestreo microbiológico
Muestreo ambiental
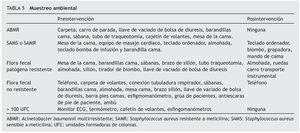
En el período preintervención se obtuvieron un total de 144 muestras ambientales, de éstas fueron incorrectas el 32% (n = 46), de las cuales un 28,5% (n = 41) mostraron flora patógena, y el 3,5% (n = 5), elevados recuentos bacterianos. En el período posintervención el total de muestras fue de 146, siendo incorrectas el 4,8% (n = 7), presentaron flora patógena el 4,8% (n = 7) y no se obtuvo ninguna con elevados recuentos bacterianos. Los patógenos y su ubicación se recogen en la tabla 5.
Muestreo de manos
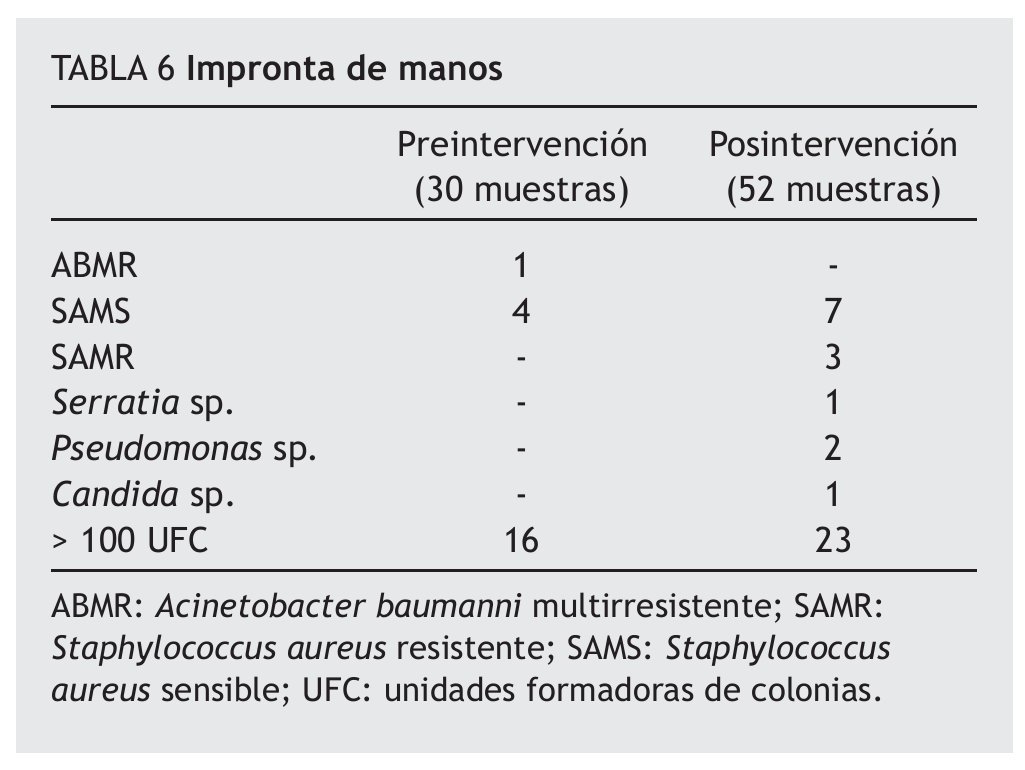
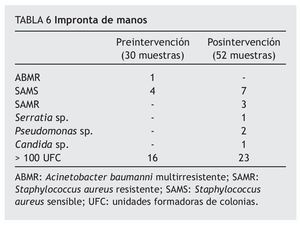
Se realizaron 30 improntas de manos en el período preintervención y 52 en el de posintervención. En el período preintervención se encontraron muestras con flora patógena en el 16,6% (n = 5) de los casos y en el 53,3% (n = 16) presentaron elevados recuentos bacterianos. Con respecto al período posintervención se encontró flora patógena en el 21,1% (n = 11) de los casos y recuentos elevados en el 44,2% (n = 23) de las muestras. La flora encontrada se muestra en la tabla 6.
Discusión
Los resultados obtenidos indican que la limpieza-desinfección de las unidades fue efectiva. No se aisló Acinetobacter baumannii en ninguna muestra ambiental posterior a la intervención, controlándose por tanto su diseminación y asentamiento, y se consiguió reducir el porcentaje de muestras con flora patógena. Tampoco se aisló Acinetobacter baumanni en ningún cultivo de paciente tras la intervención, no pasando a ser, de momento, un microorganismo endémico en nuestra UCI, como sí lo es en algunas UCI de España14,15
Sin embargo, hemos de decir que la ausencia de ABMR en las muestras posintervención no asegura que se hayan eliminado todos los reservorios, por ello es importante seguir incidiendo en el cumplimiento de los protocolos de limpieza y desinfección, tanto de material clínico como del mobiliario, y en la correcta aplicación de las medidas estándar y las precauciones específicas del aislamiento de contacto8,9,16,17.
En nuestro estudio, se pone de manifiesto la relación entre la existencia de reservorios ambientales y la aparición del brote, como se apunta en múltiples estudios12,13,18.
Cefai C et al12 hallaron el reservorio en el interior del ventilador mecánico por una inadecuada desinfección de los equipos de ventilación. Pillay T et al13 lo detectaron en los catéteres de aspiración de secreciones. Nosotros encontramos ABMR en el carro de paradas, en el tubo de traqueotomía, en la cama, en las sábanas, en una carpeta, en la llave de vaciado de bolsa de diuresis y en un cajetín de volantes.
De igual forma, la intervención pudo ser efectiva para disminuir la incidencia de IN debida a otros microorganismos multirrresistentes, ya que tras la misma se observó una disminución de estos microorganismos de 1,8 veces. Previo a la intervención, en las unidades había un ambiente densamente colonizado, como lo demuestra el hecho de que el 28,5% de las muestras presentaran flora patógena, esto favorece la existencia y permanencia de reservorios. Al disminuir la contaminación de las muestras ambientales con flora patógena al 4,8% tras la intervención, creemos que probablemente la infección cruzada debida al contacto directo con material clínico y/o mobiliario contaminado con flora patógena, termómetros, ventiladores, manguitos de tensión, bombas de infusión superficies, etc. disminuyó, haciendo que la IN consecuentemente también lo hiciera.
La presencia de patógenos en las manos de los profesionales evidencian su papel como vehículo para la transmisión de microorganismos desde reservorios ambientales, o desde enfermos infectados o colonizados18,19 Los resultados no mejoraron en el período posintervención, ya que se mantuvo un elevado porcentaje de manos con presencia de patógenos, lo que indica que no se cumplió con el protocolo de lavado de manos. Levin Anna S et al20, en un estudio ambiental, encontraron cultivos positivos en el 2,1% de las muestras de alrededor del paciente y sólo en un 0,3% en áreas comunes, sugiriendo en su caso que la vía de transmisión se debe más a fallos de los profesionales, al no seguir las recomendaciones universales de control de infecciones y de aislamiento de contacto, que a la contaminación ambiental.
En nuestro estudio obtuvimos que el 16,6% de las manos de los trabajadores muestreadas presentaron flora patógena, siendo el 3,3% la correspondiente a Acinetobacter baumannii, este resultado es similar a los encontrados por otros autores. Martínez-Pellús et al15, en su estudio realizado para establecer la incidencia de colonización por Acinetobacter baumannii y analizar los factores de riesgo y su relación con la colonización ambiental, obtuvieron que en su serie el 5% de las manos de los trabajadores muestreadas tuvieron crecimiento de Acinetobacter y El Shafie SS et al19, el 3%.
Con relación a las unidades, se obtuvieron siempre valores más altos de microorganismos multirresistentes en CII que en CI, estas diferencias pudieran deberse a deficiencias estructurales. CII es una unidad antigua con espacio insuficiente entre los pacientes, ausencia de barreras físicas entre las camas e insuficientes camas de aislamiento, lo que puede favorecer la infección cruzada y, por otro lado, también al tipo de pacientes, recordemos que fundamentalγmente son pacientes médicos y de cirugía digestiva.
Con respecto a los microorganismos multirresistentes, el más frecuentemente aislado en el período preintervención ha sido Pseudomonas aeruginosa al igual que en la mayoría de los estudios. En el estudio realizado por Álvarez-Lerma F et all21 comprobaron que los gérmenes multirresistentes motivo de aislamiento fueron en primer lugar Pseudomonas aeruginosa, seguida de SAMR, Stenotrophomonas y Acinetobacter.
Staphylococcus aureus es el único microorganismo que no disminuye en el período posintervención, coincidiendo, curiosamente, con el aumento de este germen en las improntas de manos de los trabajadores, en este mismo período. Probablemente, este hecho se relaciona con la falta de seguimiento del protocolo de lavado de manos por parte de los profesionales y la mayor probabilidad de este microorganismo para formar parte de la flora transitoria que la de otros.
En nuestra serie, la localización más frecuente ha sido la respiratoria, lo que coincide con los resultados del informe del año 2000 del estudio nacional de vigilancia de IN en UCI14. En este estudio, la IN se distribuye de la siguiente manera, neumonías 43,7%, bacteriemias 33,8% e infecciones urinarias 22,5%.
En todas las localizaciones hubo una disminución en el número de infecciones, que probablemente por su escaso número no alcanzaron significación estadística, pero que claramente tienen relevancia clínica.
En conclusión, el control de una infección emergente por microorganismos multirresistentes, en nuestro caso ABMR, de forma decidida, adecuada y coordinada, ha determinado la reducción de otros microorganismos multirresistentes, así como de la IN. Por otro lado, la persistencia de SAMR indica la necesidad de mayor concienciación por parte del personal sanitario en el cumplimiento estricto del protocolo de lavado de manos.
2.o Premio SEEIUC-Hospira a la mejor comunicación presentada al XXXIV Congreso Nacional de la Sociedad Española de Enfermería Intensiva y Unidades Coronarias. Valencia 8-11 de junio de 2008.
Aceptado para su publicación el 27 de octubre de 2008.
*Autor para correspondencia.
Correo electrónico: msimon.hcsc@salud.madrid.org (M.J. Simón García)