Evaluar la evolución de la fuerza muscular en pacientes críticos con ventilación mecánica (VM) tras la retirada de la sedación y hasta el alta hospitalaria.
Material y métodoEstudio de cohortes desarrollado en 2 unidades de cuidados intensivos (UCI) del Hospital Universitari de Bellvitge, de noviembre del 2011 a marzo del 2012. Se incluyó a pacientes consecutivos con VM > 72h. Variable dependiente: fuerza muscular mediante la escala Medical Research Council (MRC), el primer día que el paciente fue capaz de responder a 3 de 5 órdenes (día 1), cada semana, al alta de la UCI y al alta hospitalaria o 60 días. Variables independientes: factores asociados a la pérdida de fuerza, días libres de VM, días de estancia en la UCI y estancia hospitalaria. Los pacientes se distribuyeron en 2 grupos (MRC < 48, MRC ≥ 48) tras la primera medición.
ResultadosSe evaluó a 34 pacientes. Variables independientes asociadas a pérdida de fuerza: días con SOFA cardiovascular > 2 (p < 0,001) y días con corticoides (p < 0,001). MRC inicial para el grupo MRC < 48: 38 (27-43) y 52 (50-54) para el grupo MRC ≥ 48. La mayor ganancia de fuerza se obtuvo la primera semana (31% versus 52%). Un MRC < 48 se asoció a más días de VM (p < 0,007) y mayor estancia en la UCI (p < 0,003).
ConclusionesLa mayor ganancia de fuerza tras retirar la sedación se consigue la primera semana. La pérdida de fuerza se asocia a un valor de SOFA cardiovascular > 2 y al uso de corticoides. Los pacientes con MRC < 48 presentan mayor duración de la VM y mayor estancia en UCI.
To assess the evolution of muscle strength in critically ill patients with mechanical ventilation (MV) from withdrawal of sedatives to hospital discharge.
Material and methodA cohort study was conducted in two intensive care units in the Hospital Universitari de Bellvitge from November 2011 to March 2012. Inclusion criteria: Consecutive patients with MV > 72h. Dependent outcome: Muscle strength measured with the Medical Research Council (MRC) scale beginning on the first day the patient was able to answer 3 out of 5 simple orders (day 1), every week, at ICU discharge and at hospital discharge or at day 60 Independent outcomes: factors associated with muscle strength loss, ventilator-free days, ICU length of stay and hospital length of stay. The patients were distributed into two groups (MRC< 48, MRC ≥ 48) after the first measurement.
ResultsThirty-four patients were assessed. Independent outcomes associated with muscle strength weakness were: days with cardiovascular SOFA >2 (P<.001) and days with costicosteroids (P<.001). Initial MRC in MRC<48 group was 38 (27-43), and 52 (50-54) in MRC ≥ 48. The largest muscle strength gain was obtained the first week (31% versus 52%). A MRC < 48 value was associated with more MV days (P<.007) and a longer ICU stay. (P<.003).
ConclusionThe greatest muscle strength gain after withdrawing of the sedatives was achieved in the first week. Muscle strength loss was associated with a cardiovascular SOFA > 2 and costicosteroids. Patients with a MRC < 48 required more days with MV and a longer ICU stay.
El paciente ingresado en una UCI conectado a ventilación mecánica (VM) y sometido a sedación e inmovilidad prolongada presenta debilidad muscular con pérdida de fuerza, disfunción y atrofia por el desuso, que se evidencia en cambios histológicos y electrofisiológicos ya en las primeras 24 h de conexión a la VM1,2. Se calcula que los pacientes en la UCI pueden llegar a perder un 2% de masa muscular diaria y de un 4-5% de fuerza muscular contráctil a la semana del ingreso3,4. Las consecuencias de esta debilidad adquirida en la UCI (ICU-AW) se manifiestan a largo plazo en profundas discapacidades funcionales y trastornos neurocognitivos que dificultan la realización de actividades de la vida diaria y que pueden persistir incluso hasta 5 años tras el alta hospitalaria5–9.
Los escenarios más habituales en los que puede identificarse un cuadro de ICU-AW se presentan en pacientes que, tras la retirada de la sedación y la recuperación de la consciencia, presentan una profunda debilidad generalizada con tetraplejía, o en aquellos pacientes con fracasos repetidos en la retirada de la VM que presentan mayor dificultad y retraso en el destete10. Todas estas situaciones se asocian a más días de VM, mayor estancia en la UCI y en el hospital, y, en consecuencia, a un incremento del coste económico final11,12.
La prevalencia de ICU-AW varía sustancialmente en función de la elección de pacientes, el método diagnóstico utilizado y el tiempo de seguimiento, oscilando entre el 25% en pacientes de más de 7 días de VM13 y del 50 al 70% en cohortes seleccionadas de pacientes sépticos14.
Se han descrito diversos factores de riesgo implicados en la aparición y el desarrollo de ICU-AW. La presencia de síndrome de respuesta inflamatoria sistémica, sepsis e hiperglucemia son los que un mayor número de estudios han demostrado su asociación15,16. Su relación con otros factores, como la edad, la inmovilidad prolongada, la duración de la VM, la existencia de disfunción orgánica, la malnutrición y el uso de corticoides, bloqueadores neuromusculares o aminoglucósidos, aunque se acepta como relevante, todavía no está claramente demostrada4,14–21.
Para la prevención de la ICU-AW, se han propuesto medidas como el tratamiento intensivo de la sepsis con objetivos de resucitación estandarizados, la nutrición precoz, la creación de protocolos de sedación, el control estricto de la glucemia y los programas de fisioterapia y rehabilitación motora precoz22–27. No obstante, algunas de estas medidas no están exentas de controversia o dificultad en su implementación, ya sea por falta de evidencia o por todo lo que conlleva respecto a un cambio de cultura en relación con la movilidad del enfermo crítico o la disponibilidad de recursos humanos y materiales28,29.
En este apartado es donde merece especial atención la importancia del papel de enfermería en la prevención de ICU-AW, participando e implicándose en potenciar un cambio de cultura hacia la movilidad de los pacientes en la UCI con garantías de seguridad y efectividad28,30. El objetivo final de las intervenciones enfermeras debe dirigirse a evaluar su repercusión sobre la autonomía de la persona a corto y largo plazo.
Existen numerosas pruebas diagnósticas, tanto invasivas como no invasivas, que permiten conocer el grado de fuerza muscular de los enfermos en la UCI31. Entre ellas, los test de fuerza a pie de cama han demostrado su utilidad y fiabilidad a la hora de establecer la sospecha de ICU-AW, determinar la severidad del déficit motor y monitorizar cambios en la fuerza muscular a lo largo del tiempo, aunque no son adecuados para confirmar un diagnóstico concreto. No obstante, este tipo de exámenes rutinarios son difíciles de implementar en pacientes críticos, ya que requieren de la cooperación y la comprensión de la persona, y se ven afectados por la presencia de sedación, delirio, encefalopatía y lesiones corticales cerebrales, variables que deben conocerse y controlarse en el uso de estas escalas4,13,32. A partir de los resultados de estos test, y con el objetivo de establecer un diagnóstico final diferencial, son necesarias pruebas diagnósticas mucho más precisas, así como invasivas, de más difícil disponibilidad en el contexto de la UCI, con más riesgos asociados y mucho mayor coste, como la electromiografía, los estudios electrofisiológicos o la biopsia muscular.
Se ha demostrado que existe una pérdida de fuerza efectiva en pacientes con más de 7 días de VM13. No obstante, se desconoce exactamente cómo evoluciona el perfil de recuperación de fuerza de estos enfermos tras la retirada de la sedación y hasta el alta hospitalaria. La hipótesis del presente trabajo es que el porcentaje de mejora y recuperación de la fuerza muscular tras la retirada de la sedación en pacientes adultos críticos con VM es mayor en la primera semana que en semanas posteriores.
Como objetivo principal, nos propusimos evaluar la evolución de la fuerza muscular en pacientes adultos críticos con VM tras la retirada de la sedación y hasta el alta hospitalaria o como máximo a los 60 días. Los objetivos secundarios fueron determinar los factores de riesgo asociados a la pérdida de fuerza en pacientes adultos críticos con VM y evaluar la relación entre el valor de fuerza, la duración de la VM, el tiempo de estancia en la UCI y el tiempo de estancia hospitalaria.
Material y métodosEstudio de cohortes analítico, observacional y prospectivo, realizado en 2 UCI polivalentes del Hospital Universitario de Bellvitge (HUB)-IDIBELL, de noviembre del 2011 a marzo del 2012. El proyecto fue aprobado por el Comité de Ética e Investigación Clínica del HUB y se solicitó consentimiento informado de todos los participantes a sus familiares más directos. En todo momento, se respetaron el anonimato y la confidencialidad de los datos, según la Ley Orgánica 15/1999 de 13 de diciembre de Protección de Datos de Carácter Personal (BOE de 14 de diciembre de 1999).
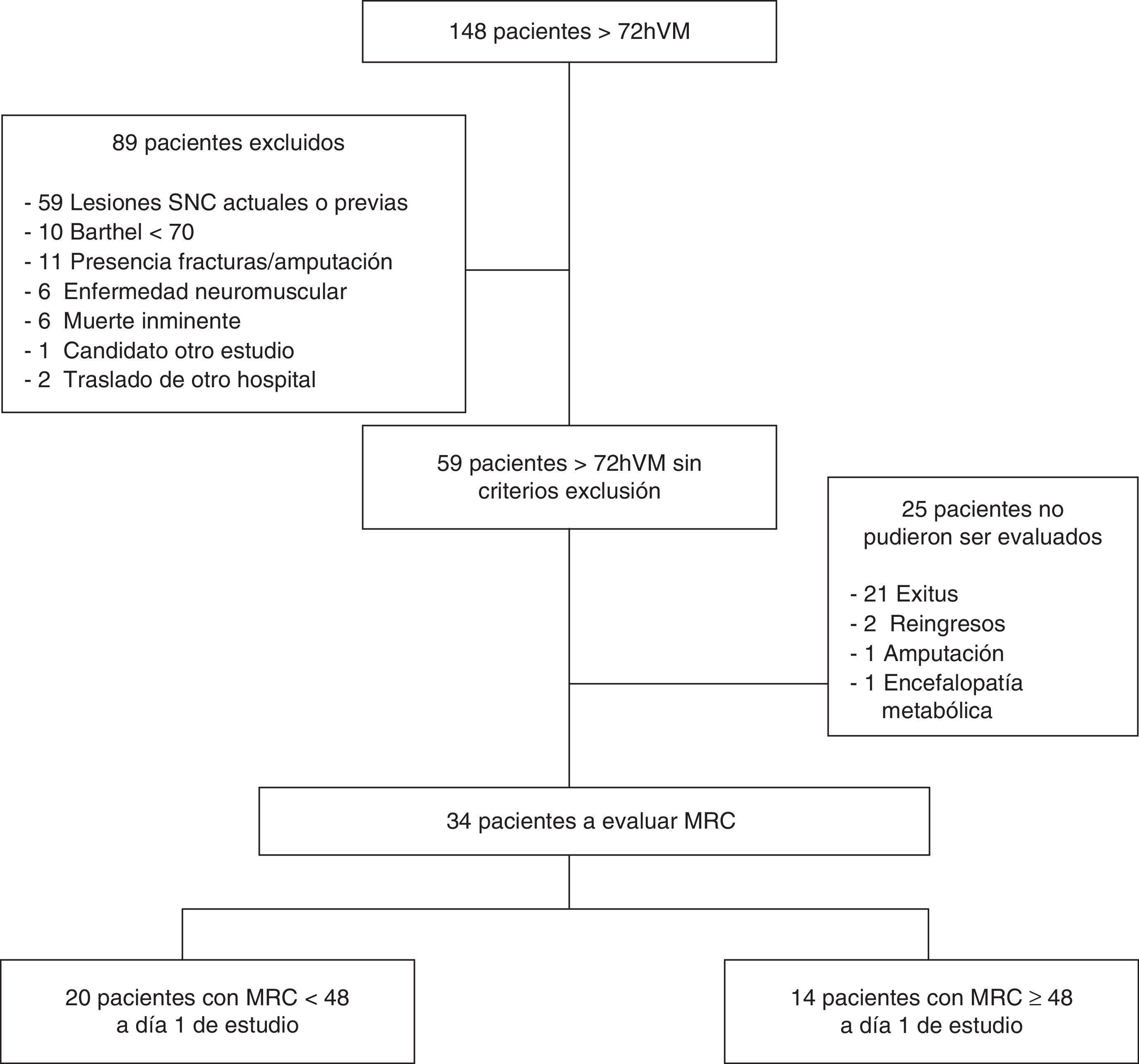
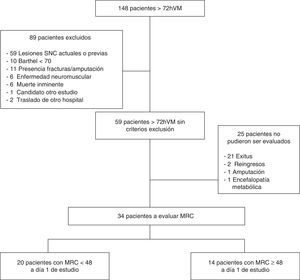
MuestraLos pacientes se seleccionaron consecutivamente de acuerdo con los criterios de inclusión de necesidad de VM > 72h, con predicción de continuar conectado como mínimo 24 h o más y aceptación a participar en el estudio por parte de los familiares mediante la firma del consentimiento informado. Se excluyó del estudio a aquellos pacientes con edad inferior a 18 años, Barthel inferior a 70 valorado por la familia en función de la situación de salud del paciente 2 semanas anteriores al ingreso, pacientes con predicción médica de fallecer antes de 48h, pacientes con órdenes de limitación de medidas de soporte vital, pacientes con diagnóstico de enfermedad neuromuscular al ingreso en la UCI (p. ej., Guillain-Barré, miastenia gravis), con amputación o fractura en extremidades, enfermos con procesos intracraneales agudos (hemorragia intracraneana) o asociados a hemiplejías (accidente vascular cerebral), ya fueran actuales o anteriores con lesiones establecidas, ausencia de consentimiento informado, participantes en otros estudios y pacientes que fueron trasladados a otro hospital antes de finalizar el estudio.
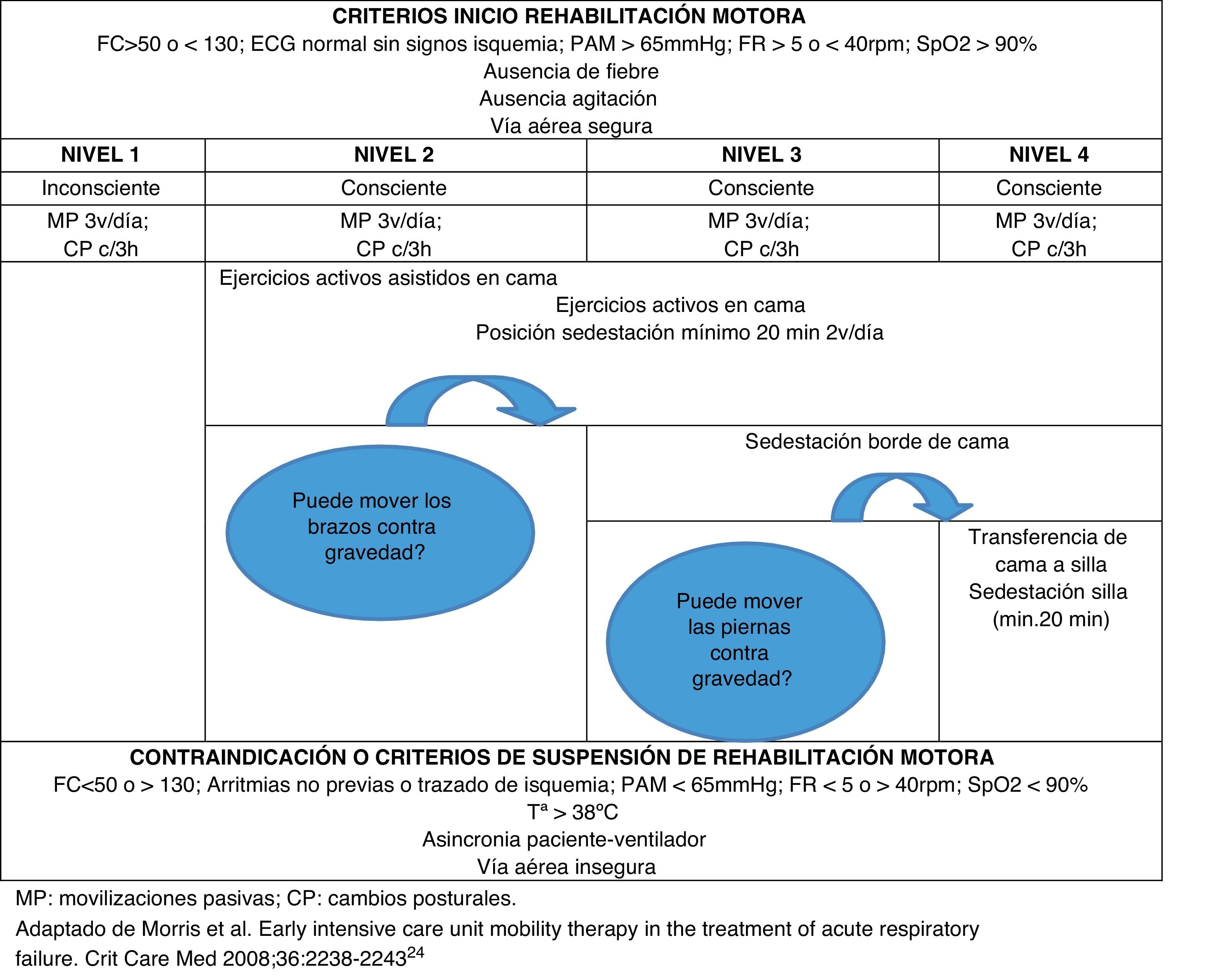
ProcedimientoEn todos los pacientes se inició la rehabilitación motora a las 72h tal y cómo se muestra en el anexo 1. Este programa de movilidad progresiva se fue adaptando a la situación clínica del enfermo, modificándose su intensidad y tipo de movimientos en función de su estabilidad hemodinámica y respiratoria, nivel de sedación y tolerancia a la movilización.
Medical Research CouncilCoincidiendo con el inicio de la retirada de la sedación, se evaluó diariamente el nivel de consciencia de cada paciente y su capacidad de responder a una serie de órdenes sencillas como: «Abra o cierre los ojos», «Míreme», «Saque la lengua», «Haga un gesto de asentir con la cabeza» y «Levante los párpados cuando yo cuente hasta 5». El primer día que el paciente fue capaz de responder correctamente a 3 de estas 5 órdenes se consideró día 1 de estudio y se inició la medición del valor de la fuerza muscular mediante la escala Medical Research Council (MRC). La escala MRC es una escala validada y fácil de utilizar a nivel clínico a pie de cama, que permite evaluar la fuerza muscular en 3 grupos musculares de cada extremidad superior e inferior, en un rango de 0 (parálisis) a 5 (fuerza normal) para cada grupo muscular. El resultado final obtenido oscila entre 0 (parálisis total) y 60 (fuerza muscular normal en las 4 extremidades). Un valor por debajo de 48 se considera definitorio de debilidad adquirida en la UCI33 (tabla 1).
Escala de fuerza muscular Medical Research Council
| Valor para cada movimiento | Escala Medical Research Council. Examen muscular |
| 0 | Contracción no visible |
| 1 | Contracción muscular visible pero sin movimiento de la extremidad |
| 2 | Movimiento activo pero no contra gravedad |
| 3 | Movimiento activo contra gravedad |
| 4 | Movimiento activo contra gravedad y resistencia |
| 5 | Movimiento activo contra total resistencia |
Funciones evaluadas: extremidad superior: extensión de muñeca, flexión del codo, abducción del hombro; extremidad inferior: dorsiflexión de tobillo, extensión de rodilla, flexión de cadera; valor máximo: 60 (4 extremidades, máximo 15 puntos por cada extremidad); valor mínimo: 0 (tetraplejía).
Cada semana, el paciente recibió la visita de la misma persona del equipo investigador, que solicitó al enfermo la realización de ejercicios de movimiento articular y fuerza de las 4 extremidades, de acuerdo con la escala MRC. Además, el paciente recibió otra visita antes del alta de la UCI y el alta hospitalaria en las que se evaluaron los mismos ejercicios.
VariablesSe recogieron datos basales desde la fecha de ingreso en la UCI y hasta el día 1 de estudio para controlar los factores clínicos que podían influir en la aparición de ICU-AW. Se incluyeron variables demográficas, índices de gravedad al ingreso, variables metabólicas, variables relacionadas con disfunción orgánica en uno o más órganos, tipo de nutrición, pacientes con técnicas de depuración extrarrenal, variables relacionadas con la VM y días de estancia en la UCI anteriores al día 1. Se recogieron también los datos relacionados con la administración de fármacos sedantes, opiáceos, bloqueadores neuromusculares, corticoides y aminoglucósidos.
La variable principal dependiente del estudio fue la fuerza muscular medida mediante la escala MRC desde el día 1 de estudio, cada 7 días, al alta de la UCI, al alta hospitalaria o como máximo a los 60 días, con el objetivo de determinar el porcentaje de recuperación de fuerza semanal. Como variables secundarias independientes, se determinaron la tasa de incidencia de ICU-AW, las variables clínicas asociadas a ICU-AW, los días libres sin ventilación mecánica, los días de estancia en UCI y los días de estancia hospitalaria.
Análisis estadísticoEl análisis incluyó estadística descriptiva e inferencia estadística. Una vez obtenida la primera medición de la fuerza muscular, los pacientes se distribuyeron en 2 grupos: MRC < a 48 o MRC ≥ 48. Para el análisis univariante de las variables demográficas, las variables cualitativas se expresaron en porcentaje y las cuantitativas mediante la media ± desviación estándar o mediana más rango intercuartílico para variables que no seguían una distribución normal. Para el análisis bivariante, se utilizaron el test U de Mann-Whitney para variables cuantitativas y el test de Fisher para la comparación de variables categóricas. Se consideraron estadísticamente significativos valores de p < 0,05.
Para el análisis multivariante se consideraron modelos de regresión lineal simple y por pasos para explorar el efecto de las condiciones del paciente sobre la respuesta de interés (fuerza muscular a día 1 de estudio). Se analizó, por un lado, el efecto de dichas condiciones en la primera medición de la fuerza cuando el paciente despertó, incluyendo como variable el tiempo que tardaba en despertar. En el modelo inicial, se incluyeron además aquellas variables que resultaron significativas en el análisis bivariante con un p valor por debajo de 0,1.
Posteriormente, se evaluó, mediante medidas repetidas semanales, la evolución en el tiempo de la ganancia o la mejora de fuerza comparando los resultados en ambos grupos.
El análisis estadístico se realizó con el paquete estadístico R-Commander versión 2.15.2.
ResultadosSe identificó a 148 pacientes consecutivos que cumplieron criterios de inclusión, de los cuales solo 59 fueron seleccionados para el seguimiento debido a que no cumplían ningún criterio de exclusión. De ellos, 25 pacientes no pudieron ser finalmente evaluados, tal y como muestra el diagrama de flujo. En total, a día 1 de estudio pudieron ser evaluados 34 pacientes, de los cuales 20 presentaron MRC < 48 y 14 con MRC ≥ 48 (fig. 1).
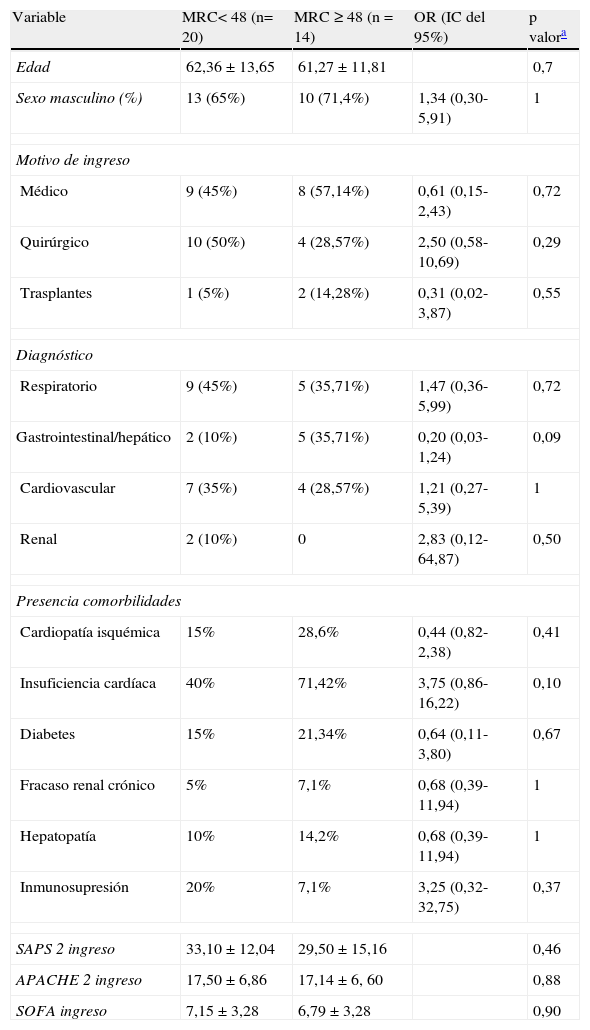
En la tabla 2 se muestran las características basales de ambos grupos al ingreso.
Comparación de las características basales al ingreso en ambos grupos
| Variable | MRC< 48 (n= 20) | MRC ≥ 48 (n = 14) | OR (IC del 95%) | p valora |
| Edad | 62,36 ± 13,65 | 61,27 ± 11,81 | 0,7 | |
| Sexo masculino (%) | 13 (65%) | 10 (71,4%) | 1,34 (0,30-5,91) | 1 |
| Motivo de ingreso | ||||
| Médico | 9 (45%) | 8 (57,14%) | 0,61 (0,15-2,43) | 0,72 |
| Quirúrgico | 10 (50%) | 4 (28,57%) | 2,50 (0,58-10,69) | 0,29 |
| Trasplantes | 1 (5%) | 2 (14,28%) | 0,31 (0,02-3,87) | 0,55 |
| Diagnóstico | ||||
| Respiratorio | 9 (45%) | 5 (35,71%) | 1,47 (0,36-5,99) | 0,72 |
| Gastrointestinal/hepático | 2 (10%) | 5 (35,71%) | 0,20 (0,03-1,24) | 0,09 |
| Cardiovascular | 7 (35%) | 4 (28,57%) | 1,21 (0,27-5,39) | 1 |
| Renal | 2 (10%) | 0 | 2,83 (0,12-64,87) | 0,50 |
| Presencia comorbilidades | ||||
| Cardiopatía isquémica | 15% | 28,6% | 0,44 (0,82-2,38) | 0,41 |
| Insuficiencia cardíaca | 40% | 71,42% | 3,75 (0,86-16,22) | 0,10 |
| Diabetes | 15% | 21,34% | 0,64 (0,11-3,80) | 0,67 |
| Fracaso renal crónico | 5% | 7,1% | 0,68 (0,39-11,94) | 1 |
| Hepatopatía | 10% | 14,2% | 0,68 (0,39-11,94) | 1 |
| Inmunosupresión | 20% | 7,1% | 3,25 (0,32-32,75) | 0,37 |
| SAPS 2 ingreso | 33,10 ± 12,04 | 29,50 ± 15,16 | 0,46 | |
| APACHE 2 ingreso | 17,50 ± 6,86 | 17,14 ± 6, 60 | 0,88 | |
| SOFA ingreso | 7,15 ± 3,28 | 6,79 ± 3,28 | 0,90 | |
Los valores numéricos se expresaron como media ± desviación estándar. En aquellas variables que presentaron mucha dispersión, los datos se expresan como mediana más rango intercuartílico.
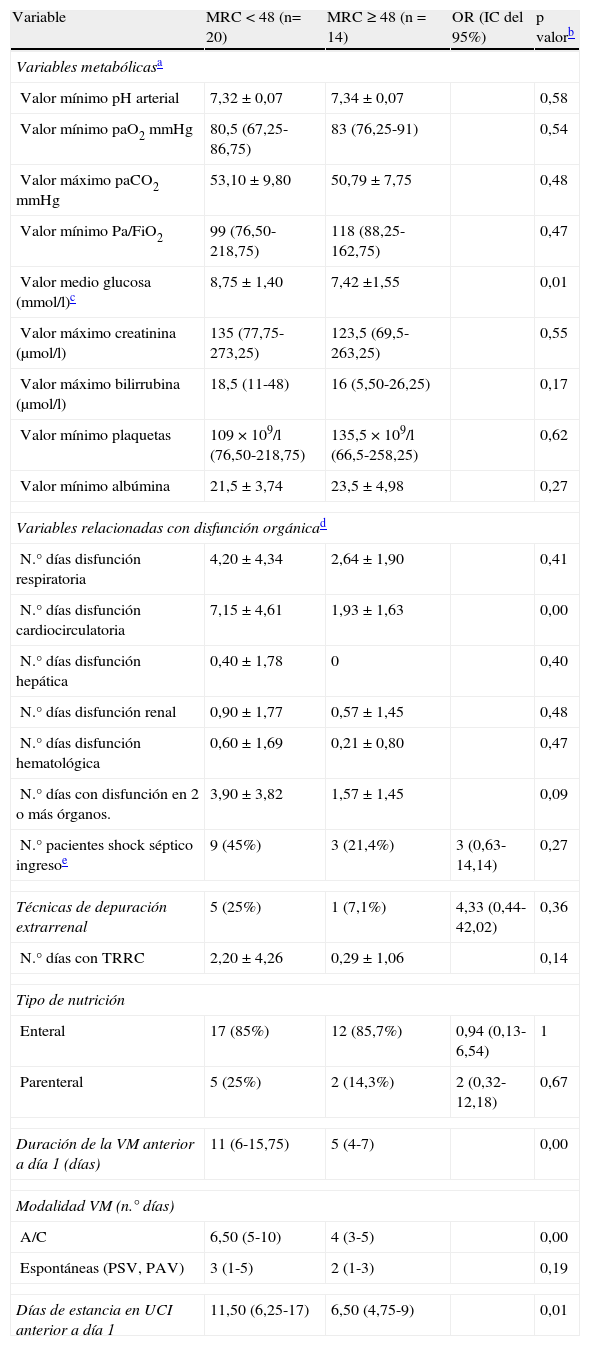
La tabla 3 recoge las variables clínicas diarias desde el día de ingreso y hasta día 1 de estudio para ambos grupos.
Comparación de las variables clínicas diarias en ambos grupos recogidas desde el día de ingreso y hasta el día 1 de estudio
| Variable | MRC < 48 (n= 20) | MRC ≥ 48 (n = 14) | OR (IC del 95%) | p valorb |
| Variables metabólicasa | ||||
| Valor mínimo pH arterial | 7,32 ± 0,07 | 7,34 ± 0,07 | 0,58 | |
| Valor mínimo paO2 mmHg | 80,5 (67,25-86,75) | 83 (76,25-91) | 0,54 | |
| Valor máximo paCO2 mmHg | 53,10 ± 9,80 | 50,79 ± 7,75 | 0,48 | |
| Valor mínimo Pa/FiO2 | 99 (76,50-218,75) | 118 (88,25-162,75) | 0,47 | |
| Valor medio glucosa (mmol/l)c | 8,75 ± 1,40 | 7,42 ±1,55 | 0,01 | |
| Valor máximo creatinina (μmol/l) | 135 (77,75-273,25) | 123,5 (69,5-263,25) | 0,55 | |
| Valor máximo bilirrubina (μmol/l) | 18,5 (11-48) | 16 (5,50-26,25) | 0,17 | |
| Valor mínimo plaquetas | 109 × 109/l (76,50-218,75) | 135,5 × 109/l (66,5-258,25) | 0,62 | |
| Valor mínimo albúmina | 21,5 ± 3,74 | 23,5 ± 4,98 | 0,27 | |
| Variables relacionadas con disfunción orgánicad | ||||
| N.° días disfunción respiratoria | 4,20 ± 4,34 | 2,64 ± 1,90 | 0,41 | |
| N.° días disfunción cardiocirculatoria | 7,15 ± 4,61 | 1,93 ± 1,63 | 0,00 | |
| N.° días disfunción hepática | 0,40 ± 1,78 | 0 | 0,40 | |
| N.° días disfunción renal | 0,90 ± 1,77 | 0,57 ± 1,45 | 0,48 | |
| N.° días disfunción hematológica | 0,60 ± 1,69 | 0,21 ± 0,80 | 0,47 | |
| N.° días con disfunción en 2 o más órganos. | 3,90 ± 3,82 | 1,57 ± 1,45 | 0,09 | |
| N.° pacientes shock séptico ingresoe | 9 (45%) | 3 (21,4%) | 3 (0,63-14,14) | 0,27 |
| Técnicas de depuración extrarrenal | 5 (25%) | 1 (7,1%) | 4,33 (0,44-42,02) | 0,36 |
| N.° días con TRRC | 2,20 ± 4,26 | 0,29 ± 1,06 | 0,14 | |
| Tipo de nutrición | ||||
| Enteral | 17 (85%) | 12 (85,7%) | 0,94 (0,13-6,54) | 1 |
| Parenteral | 5 (25%) | 2 (14,3%) | 2 (0,32-12,18) | 0,67 |
| Duración de la VM anterior a día 1 (días) | 11 (6-15,75) | 5 (4-7) | 0,00 | |
| Modalidad VM (n.° días) | ||||
| A/C | 6,50 (5-10) | 4 (3-5) | 0,00 | |
| Espontáneas (PSV, PAV) | 3 (1-5) | 2 (1-3) | 0,19 | |
| Días de estancia en UCI anterior a día 1 | 11,50 (6,25-17) | 6,50 (4,75-9) | 0,01 | |
A/C: asistida/controlada; PAV: ventilación asistida proporcional; PSV: ventilación con presión de soporte; TRRC: técnicas reemplazo renal continuo; VM: ventilación mecánica.
Los valores numéricos se expresaron como media ± desviación estándar. En aquellas variables que presentaron mucha dispersión los datos se expresan como mediana más rango intercuartílico.
Los valores de p se definieron mediante el test de Fisher para variables categóricas y el test U de Mann-Whitney para variables numéricas.
La hiperglucemia se trató de acuerdo con el protocolo establecido mediante pauta de insulina para mantener cifras de glucemia entre 6 y 10 mmol/l.
El fallo orgánico se definió de acuerdo a la escala SOFA.
El fallo respiratorio se definió como un cociente pO2/FiO2 inferior a 300.
El fallo circulatorio como presión arterial sistólica (PAS) igual o inferior a 90mmHg o la necesidad de vasopresores superior a dopamina > 5 μg/kg/min o noradrenalina > 0,1 μg/kg/min.
El fallo hematológico, como el recuento plaquetar igual o inferior a 100 plaquetas × 109/l.
El fallo hepático, como un nivel de bilirrubina en sangre igual o superior a 33μmol/l (2 mg/dl).
El fallo renal como un nivel de creatinina en sangre igual o superior a 170μmol/l (2 mg/dl).
El diagnóstico de shock séptico se definió, de acuerdo con la Conferencia de consenso sobre sepsis (American College of Chest Physicians/Society of Critical Care Medicine), como la administración de catecolaminas con hipotensión refractaria a la administración de fluidos asociada a infección documentada microbiológicamente tras la exclusión de otras causas posibles de shock.
En la tabla 4 se muestran los datos relacionados con la utilización de fármacos sedantes, opiáceos, bloqueadores neuromusculares, corticoides y aminoglucósidos para ambos grupos recogidos desde el día de ingreso y hasta día 1 de estudio.
Medicación relacionada con ICU-AW en ambos grupos recogida desde el día de ingreso y hasta el día 1 de estudio
| Variable | MRC < 48 (n= 20) | MRC ≥ 48 (n= 14) | (IC del 95%) | p valora |
| Sedantes | ||||
| Midazolam | ||||
| N.° de pacientes | 17 (85%) | 10 (71,4%) | 2,26 (0,41-12,26) | 0,41 |
| N.° días | 8,65 ± 5,38 | 4,30 ± 3,26 | 0,00 | |
| Dosis acumulada (mg) | 1.240 (981-2.870) | 586 (431-970) | 1,33 (0,33-5,27) | 0,00 |
| Propofol | ||||
| N.° de pacientes | 10 (50%) | 6 (42,9%) | 0,73 | |
| N.° días | 4,40 ± 3,50 | 2,67 ± 1,21 | 0,47 | |
| Dosis acumulada (mg) | 3.655 (2.280-12.230) | 2.700 (720-4.310) | 0,38 | |
| Opiáceos | ||||
| Fentanilo | ||||
| N.° de pacientes | 11 (55%) | 7 (50%) | 1,22 (0,31-4,80) | 1,00 |
| N.° días | 8 ± 5,7 | 5,43 ± 4,39 | 1,27 | |
| Dosis acumulada (μg) | 4.500 (1.950-8.004) | 3.738 (2.700-5.600) | 2 (0,50-7,99) | 0,82 |
| Remifentanilo | ||||
| N.° de pacientes | 12 (60%) | 6 (42,9%) | 5,83 (1,29-26,22) | 0,48 |
| N.° días | 3,42 ± 2,15 | 3,67 ± 2,33 | 0,88 | |
| Dosis acumulada (mg) | 17 (7,5-25) | 26 (5-73) | 0,37 | |
| Cloruro mórfico | ||||
| N.° de pacientes | 14 (70%) | 4 (28,57%) | 0,03 | |
| N.° días | 6,50 ± 5,91 | 4,25 ± 2,50 | 0,55 | |
| Dosis acumulada (mg) | 208 (60-350) | 172 (105-187) | 0,48 | |
| Cisatracurio | ||||
| N.° de pacientes | 7 (35%) | 2 (14,3%) | 3,23 (0,55-18,71) | 0,25 |
| N.° días | 4,71 ± 2,49 | 2,00 ± 1,41 | 0,13 | |
| Dosis acumulada (mg) | 750 (210-1.200) | 245 (100-390) | 0,14 | |
| Corticoides | ||||
| N.° de pacientes | 18 (90%) | 7 (50%) | 9,00 (1,49-54,32) | 0,01 |
| N.° días | 5,55 ± 5,77 | 1,71 ± 2,64 | 0,00 | |
| Dosis acumulada (mg) | 610 (200-1.500) | 400 (100-1.200) | 0,41 | |
| Aminoglucósidos | ||||
| N.° de pacientes | 4 (20%) | 0 (0%) | 0,53 (0,38-0,74) | 0,12 |
| N.° días | 0,45 ± 1,19 | 0 | 0,08 | |
| Dosis acumulada (mg) | 1.000 (1.000-2.250) | |||
Los resultados correspondientes al n.° de pacientes para cada fármaco se calculó sobre la base de la media entre los pacientes que habían recibido dicho fármaco. El número de días se expresa como media±desviación estándar. Las dosis acumuladas se expresan como mediana más rango intercuartílico. Se recogieron solo los bloqueadores neuromusculares administrados en infusión continua. Para los corticoides la dosis acumulada se expresa como hidrocortisona-dosis equivalente. El único aminoglucósido administrado fue amikacina.
a Los valores de p se definieron mediante el test de Fisher para variables categóricas y el test U de Mann-Whitney para variables numéricas.
A día 1 de estudio, la tasa de incidencia de ICU-AW (MRC < 48) fue del 58,82%. El análisis univariante de los factores de riesgo asociados a ICU-AW muestra que, en general, ambos grupos eran homogéneos, a excepción de los días con disfunción orgánica cardiovascular (por encima de un valor de 2 en la escala SOFA), la hiperglucemia, los días de VM, los días en modalidades de ventilación asistida/controlada anteriores a la primera medición de fuerza y los días de estancia en la UCI anterior a la primera medición de fuerza. En relación con los fármacos administrados, se encontraron diferencias estadísticamente significativas en el número de días y dosis acumulada de midazolam (solamente teniendo en cuenta a los pacientes que recibieron dicho fármaco), el número de pacientes con morfina y el número de pacientes y los días de tratamiento con corticoides.
Todas las variables que resultaron significativas en el análisis univariante más la edad, que «a priori» podría tener influencia sobre la movilidad y la fuerza muscular, se incluyeron como candidatas para la regresión lineal con el primer valor de MRC como respuesta. Todas ellas, a excepción de la edad, resultaron significativas (p valor < 0,001). Posteriormente, realizando un modelo de selección de variables por pasos, se identificaron los días de tratamiento con corticoides (p valor < 0,001) y el número de días con disfunción orgánica cardiovascular por encima de 2 mediante la escala SOFA (p valor < 0,001) como variables más influyentes en el resultado del primer valor de fuerza tras la retirada de la sedación (MRC1).
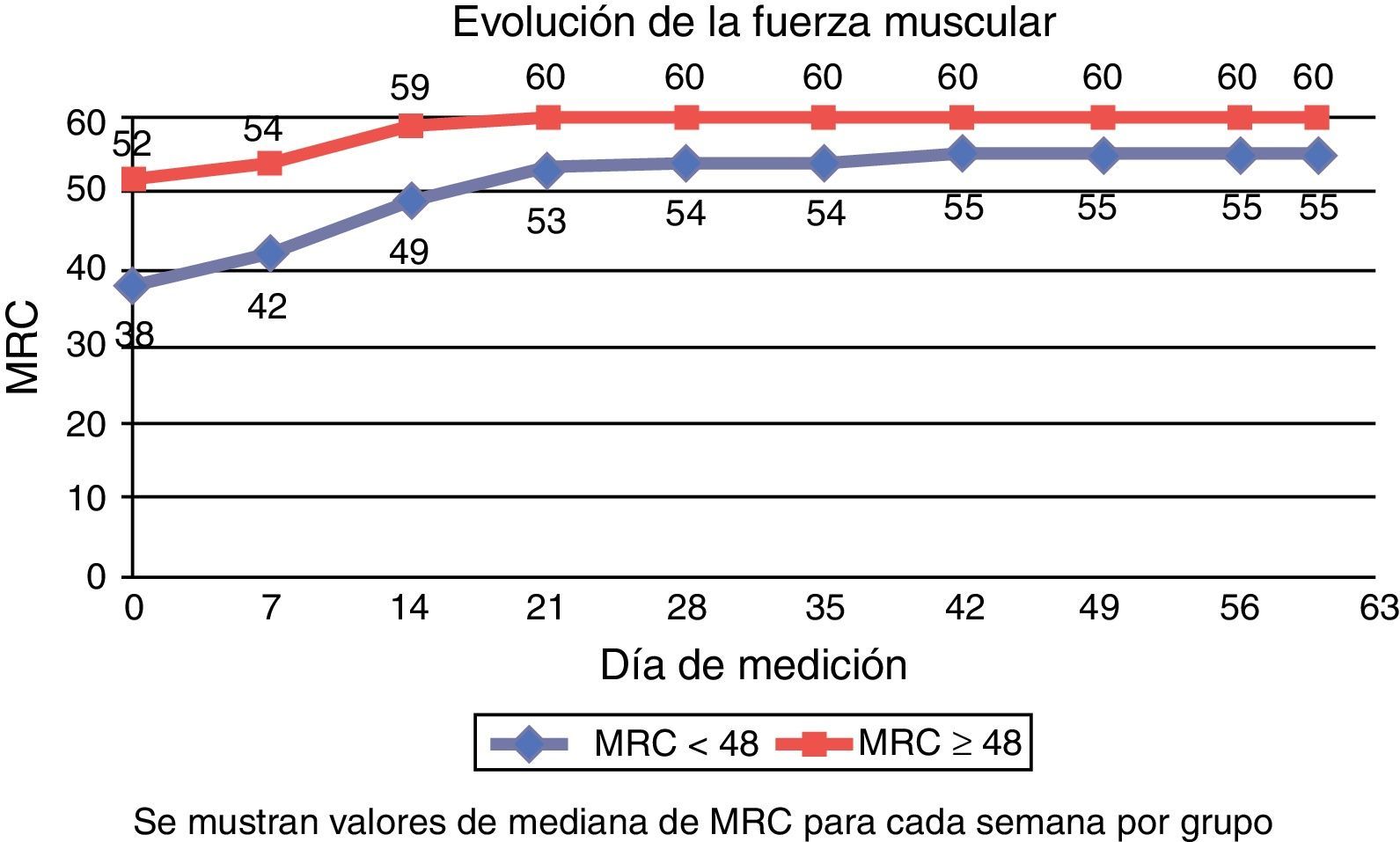
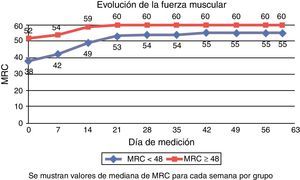
Evolución de la fuerza muscular semanalEn la figura 2 se muestra la evolución semanal en la medición de fuerza mediante la escala MRC. En el grupo con ICU-AW (MRC1 < 48), la mediana de la primera medición realizada a los 11,50 días de mediana de ingreso en la UCI fue de 38 (27-43), mientras que en el grupo sin ICU-AW (MRC1 ≥ 48) fue de 52 (50-54) a los 6,50 días de mediana de ingreso.
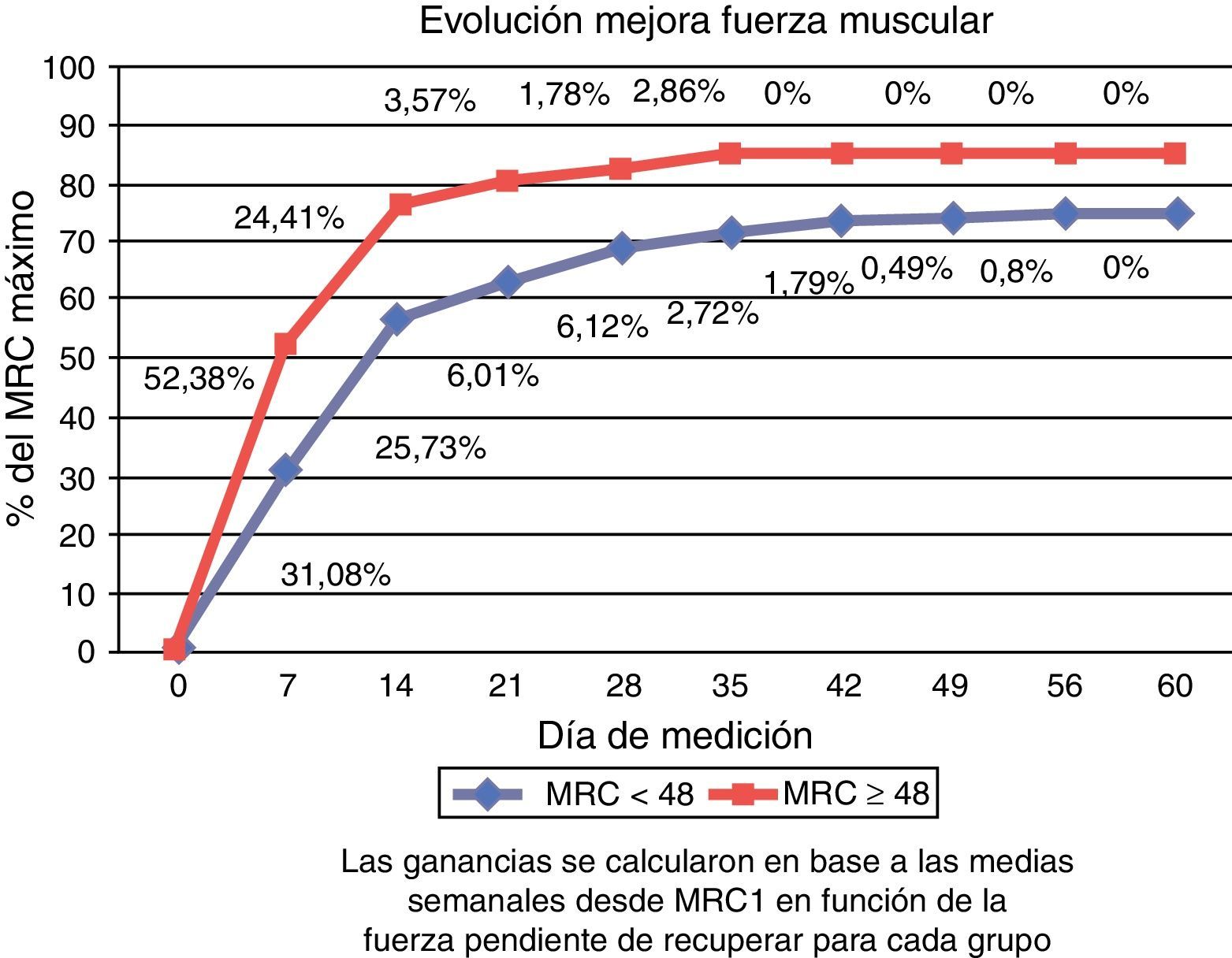
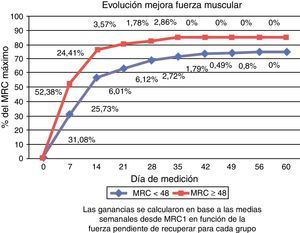
En la figura 3 se muestra el porcentaje o la evolución de mejora de la fuerza muscular respecto al total pendiente de recuperar en cada grupo.
Teniendo en cuenta la fuerza pendiente de recuperar, en ambos grupos la mayor ganancia de fuerza se registró en la primera semana (31,08% en el grupo con ICU-AW versus 52,38% en el grupo MRC ≥ 48) y se mantuvo en ascenso hasta el decimocuarto día (25,73% versus 24,41%). Al alcanzar la segunda semana, el grupo con ICU-AW había recuperado el 56,81% de la fuerza pendiente de recuperar y el grupo sin ICU-AW el 76,79%. Posteriormente, la recuperación se estabilizó en ambos grupos. A 60 días, ningún grupo alcanzó de promedio la recuperación total, siendo del 74,74% en el grupo con MRC < 48 y del 85% en el grupo MRC ≥ 48.
La mediana del MRC al alta de la UCI fue de 44 (40-50) en el grupo con ICU-AW y 54 (51-60) en el grupo sin ICU-AW, a los 17, 50 y 12,50 días de mediana de estancia en la UCI, respectivamente. La mediana de MRC al alta hospitalaria fue de 56 (52-60) para el grupo inicialmente con ICU-AW y 60 (56-60) en el grupo sin ICU-AW.
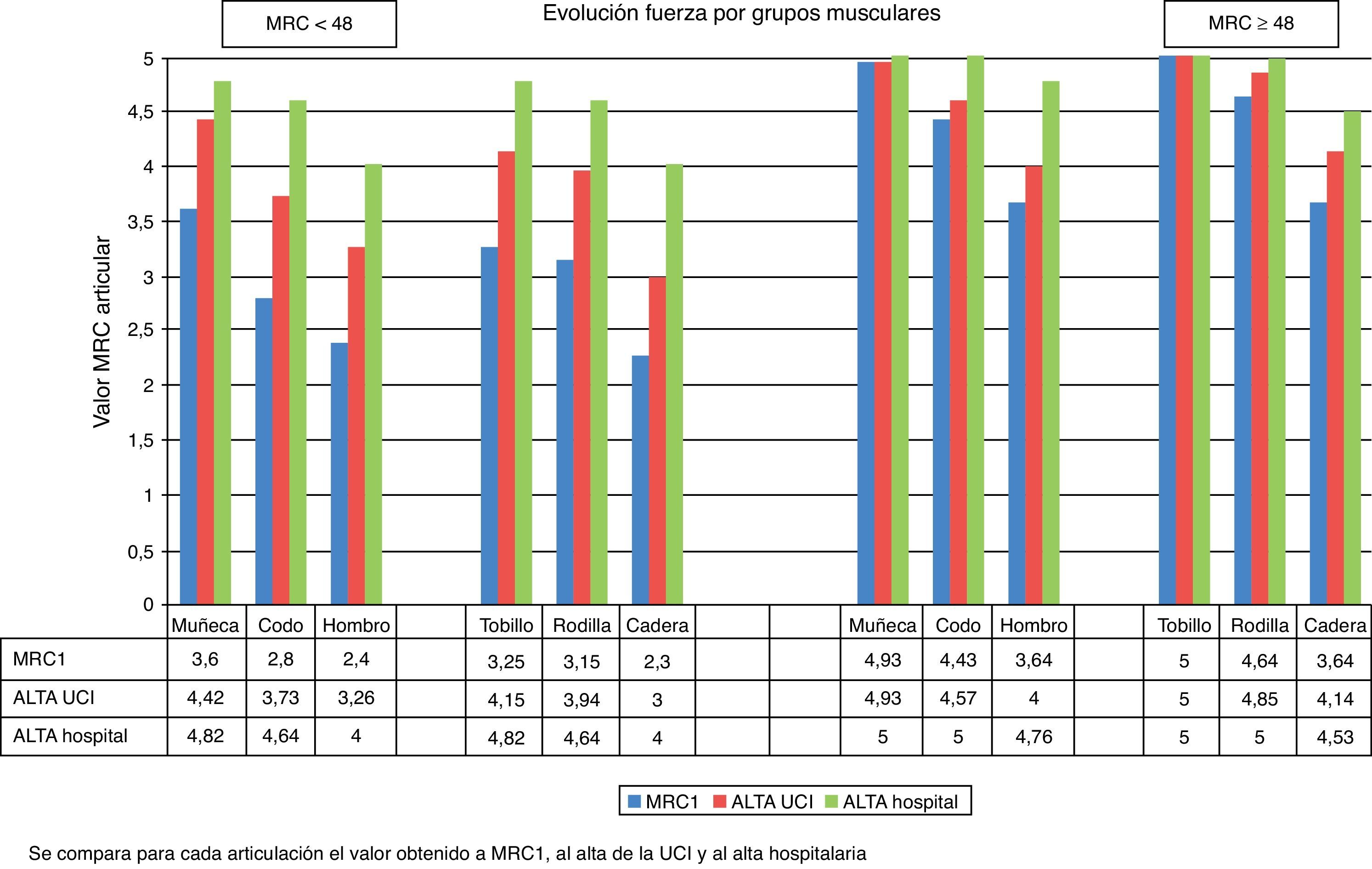
Evolución por grupos muscularesLas articulaciones que perdieron mayor grado de fuerza en ambos grupos fueron las articulaciones más proximales (hombro, cadera). No hubo diferencias entre extremidades derechas e izquierdas. En la primera medición, en el grupo con MRC < 48 todos los grupos musculares experimentaron pérdida de fuerza, mientras que en el grupo con MRC ≥ 48 el tobillo mantuvo la fuerza total. Al alta hospitalaria, en el grupo con MRC < 48 ningún grupo muscular alcanzó de media el máximo de fuerza para ninguna articulación, mientras que en el grupo con MRC ≥ 48 solo quedaban por recuperarse mínimamente las articulaciones proximales, tal y como muestra la figura 4.
Duración media de debilidad adquirida en la UCIA los 21 días de la primera medición, el 70% de los pacientes que inicialmente habían obtenido una valor inferior a 48 ya presentaban valores de fuerza a pie de cama superiores a 48. Solo un 30% persistía con debilidad. La duración media de ICU-AW, es decir, cuánto tiempo pasa desde que los pacientes con MRC inicial < 48 obtienen un valor de MRC ≥ 48, fue de 2,75 semanas de media, con una mediana de 2,5 semanas (17,5 días). No se encontró correlación significativa entre el valor inicial de MRC y la duración de la ICU-AW (rho de Spearman 0,034, p = 0,89). A los 60 días, solo un paciente que seguía ingresado en la UCI mantenía valores de fuerza inferiores a 48.
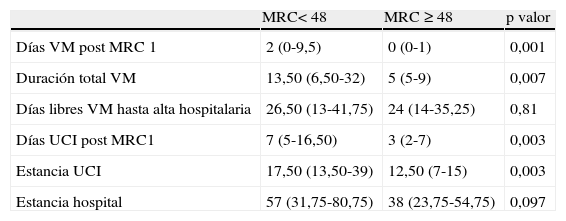
Duración de la ventilación mecánica y días de estanciaEn relación con la VM, hubo significación estadística en la duración de la VM tras la primera medición de fuerza (p valor < 0,001) y en los días totales de VM (p valor < 0,007). No hubo diferencias en cuanto a los días libres de VM. Respecto a la estancia en la UCI y la estancia hospitalaria, el grupo de pacientes con MRC < 48 presentó una mediana de estancia en la UCI significativamente mayor que en el grupo con MRC ≥ 48 (p valor < 0,003). En relación con la estancia hospitalaria, el grupo con MRC < 48 también obtuvo un valor mayor que en el grupo con MRC ≥ 48 pero sin llegar al umbral de significación (p valor < 0,097) (tabla 5).
Variables relacionados con la VM y días de estancia en UCI y el hospital para ambos grupos
| MRC< 48 | MRC ≥ 48 | p valor | |
| Días VM post MRC 1 | 2 (0-9,5) | 0 (0-1) | 0,001 |
| Duración total VM | 13,50 (6,50-32) | 5 (5-9) | 0,007 |
| Días libres VM hasta alta hospitalaria | 26,50 (13-41,75) | 24 (14-35,25) | 0,81 |
| Días UCI post MRC1 | 7 (5-16,50) | 3 (2-7) | 0,003 |
| Estancia UCI | 17,50 (13,50-39) | 12,50 (7-15) | 0,003 |
| Estancia hospital | 57 (31,75-80,75) | 38 (23,75-54,75) | 0,097 |
Este estudio evalúa la evolución de la fuerza muscular en pacientes críticos con VM. Tras la retirada de la sedación, los pacientes recuperan el mayor grado de fuerza la primera semana tras el despertar, independientemente de si el valor de fuerza inicial es inferior o superior a 48, si bien en el grupo con mayor fuerza esta recuperación es más rápida respecto al grupo con ICU-AW, en el que la ganancia es más lenta y progresiva. A partir de la segunda semana, la progresión se estabiliza sin llegar a alcanzar la recuperación total de fuerza de promedio en ambos grupos. La pérdida de fuerza se asocia al uso de corticoides y la necesidad de fármacos vasoactivos. Los pacientes con MRC < 48 presentan mayor duración de la VM y mayor estancia en la UCI.
Ningún estudio hasta la fecha había evaluado cómo evolucionaba el perfil de recuperación de la fuerza en pacientes críticos con VM, tras ser seleccionados a partir del tercer día de VM. La mayoría de los estudios centran sus resultados en pacientes con más de 7 días de VM y evalúan únicamente la evolución de pacientes con ICU-AW13. Aunque la movilización precoz de los enfermos en la UCI es una recomendación aceptada, actualmente su inicio suele demorarse al momento en el que se plantea el despertar y una vez superada la fase crítica. Además, teniendo en cuenta los resultados por grupos musculares, las intervenciones de rehabilitación deberían poner especial énfasis en los grupos musculares proximales que son los que más fuerza pierden y los que, posteriormente, más tardan en recuperar. En concreto, estos músculos son los que están más relacionados con movimientos fuera de la cama, dirigidos a mantener la postura, hacer transferencia de cama a silla y deambular.
En nuestro estudio, ningún grupo alcanzó de promedio la recuperación total de fuerza que quedaba pendiente de recuperar a 60 días. Según afirma Herridge, en su trabajo centrado en supervivientes de SDRA al año del alta en la UCI la principal causa de la persistente discapacidad funcional de estos enfermos se asocia a la debilidad muscular, especialmente en aquellos pacientes tratados con corticoides y que presentaron ICU-AW5. Son los mismos pacientes los que manifiestan, incluso a los 5 años del alta, que la persistente reducción en su capacidad para el ejercicio o para llevar a cabo actividades de la vida diaria se debe a debilidad muscular y fatiga9.
Esto lleva a plantearse la necesidad de implementar medidas de prevención de esta complicación potencial, proponiendo objetivos para detectar precozmente la pérdida de fuerza y evitar los factores de riesgo desde el ingreso en la UCI. Debemos demostrar con evidencia la efectividad de intervenciones como el manejo de los protocolos de sedación y los destetes guiados por enfermería, el control de la glucemia, la modificación y la adaptación del entorno de la UCI para hacerlo más apropiado a la movilización precoz y la colaboración en los programas de fisioterapia. Todas estas intervenciones enfermeras tienen que ir dirigidas a evaluar su repercusión sobre la autonomía de la persona para realizar actividades de la vida diaria, como alimentarse, ir al baño, vestirse, realizar transferencias de la silla a la cama, caminar e incluso subir o bajar escaleras.
Schweickert, en un ensayo clínico aleatorizado que combinaba interrupción diaria de la sedación con un programa de rehabilitación ocupacional precoz, demuestra una reducción en los días de VM, así como una reducción en los episodios de delirio y una mejora en los resultados a nivel funcional al alta26.
Son muchas las barreras que se identifican para demorar el inicio precoz de los programas de movilización, como la inestabilidad del paciente, su capacidad respiratoria, el nivel de consciencia, el peso del paciente, la falta de seguridad debida a ausencia de recursos humanos o materiales, y el hecho de plantearlo como una intervención no habitual29,34. No obstante, también se han identificado factores facilitadores, como el hecho de disponer de protocolos de movilización precoz, el entrenamiento en la evaluación diaria a pie de cama de la capacidad del paciente a iniciar una movilización fuera de la cama, el tipo de cama y la percepción del equipo de enfermería respecto al beneficio del movimiento planificado sobre un determinado paciente en riesgo35,36.
En nuestro estudio, las variables independientes anteriores al despertar que se asocian significativamente a la pérdida de fuerza son el número de días con disfunción orgánica cardiovascular > 2 y el número de días en tratamiento con corticoides. Ambas ya se habían identificado previamente como factores de riesgo de ICU-AW por otros autores. Van den Bergue, en su estudio sobre el efecto del estricto control de glucemia, identifica el uso de vasopresores superior a 3 días como factor independiente de riesgo de polineuropatía en el grupo de enfermos tratados con terapia de insulina convencional37.
En cuanto al tratamiento con corticoides, los efectos de estos fármacos sobre la función neuromuscular han sido definidos en varios trabajos no sin controversias. Aunque varios autores han identificado esta terapia como factor de riesgo independiente13, incluso en los efectos que causan su administración en la recuperación funcional al año del alta de la UCI en enfermos con SDRA5; en otros, esta asociación no ha podido demostrarse14 e incluso en una serie se identifican como factor de protección independiente para la aparición de polineuromiopatía asociada al enfermo crítico15. Por otra parte, no hemos encontrado significativa la dosis total acumulada de corticoides. Esto nos lleva a pensar que el efecto de los corticoides sobre la función muscular se asocia más a su presencia, días de tratamiento y efectos secundarios, como la hiperglucemia, que no a su cantidad.
En nuestra serie, se observa que un valor inicial de fuerza inferior a 48 se asocia a mayor duración total de la VM. Este resultado coincide con varios autores que han establecido la relación entre la polineuromiopatía del enfermo crítico y el retraso o el fracaso en el weaning con necesidad de más días de soporte ventilatorio y que puede llegar a incrementarse desde 2 a 7 veces más respecto a pacientes sin polineuromiopatía11,12,38. Por otra parte, a pesar de que la debilidad medida mediante el MRC se localiza a nivel periférico, varios autores han focalizado la asociación que existe entre los factores de riesgo de ICU-AW y el desarrollo de atrofia diafragmática, no sin menospreciar que el mantenimiento en el tiempo de la VM y el uso de modalidades de ventilación asistidas controladas incrementa el riesgo de desarrollo de disfunción diafragmática inducida por el ventilador39,40. En nuestra serie, el uso de estas modalidades es significativamente mayor en el grupo con ICU-AW respecto al grupo sin ICU-AW, así como los días de VM anteriores a día 1.
Las principales limitaciones del estudio se relacionan con el tamaño de la muestra y la limitación del tiempo de estudio, hecho que ha dificultado el análisis de algunos factores de riesgo asociados a ICU-AW. En segundo lugar, cabe destacar las limitaciones relacionadas con la escala de medida. La escala MRC solo puede implementarse en poblaciones de enfermos que sean capaces de responder a órdenes sencillas y no presenten lesiones en el sistema nervioso central, agitación, confusión o delirio y, por tanto, requiere de la cooperación y la comprensión de los ejercicios por parte del paciente, por lo que los resultados de este estudio no son extrapolables a pacientes no colaboradores. Además, su resultado solo permite establecer un diagnóstico de sospecha a pie de cama actuando como predictor en el desarrollo de ICU-AW, por lo que faltaría determinar la confirmación del diagnóstico mediante pruebas diagnósticas mucho más precisas e invasivas, como electromiografía o biopsia muscular, para, de esta forma, corroborar el resultado obtenido e identificar la causa de la debilidad. Por último, el hecho de tratarse de una escala manual a pie de cama está supeditado a la subjetividad del observador. Aunque el test ha sido contrastado como un test que presenta una buena correlación interobservador en enfermos críticos32, para minimizar la posible subjetividad se recomienda que los evaluadores previamente hayan recibido formación en la aplicación de la escala o que se reserve la observación a un único evaluador, como establecimos en el presente trabajo.
Conocer cuál es la evolución de la fuerza muscular en una cohorte seleccionada de pacientes críticos permitirá en un futuro poder determinar la efectividad y el impacto de intervenciones más específicas de rehabilitación, como la aplicación de electroestimulación muscular. La electroestimulación muscular estaría centrada especialmente en los grupos musculares proximales, que son los que presentan mayor pérdida de fuerza y una más lenta recuperación.
De cara a futuras investigaciones, también sería interesante establecer la asociación entre la recuperación de la fuerza y la independencia funcional para realizar actividades concretas de la vida diaria.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Manuscrito galardonado con el primer premio a Mejor comunicación oral presentada en el XXXIX Congreso Nacional de la Sociedad de Enfermería Intensiva y Unidades Coronarias (SEEIUC) celebrado en Tenerife, 9-12 de junio del 2013.