Los eventos adversos más frecuentes de la administración subcutánea de heparina de bajo peso molecular son la equimosis y/o el hematoma. No existe una fuerte recomendación sobre la zona de punción.
ObjetivoEvaluar los eventos adversos, equimosis y/o hematoma, tras administración de enoxaparina subcutánea profiláctica en abdomen vs. brazo, en pacientes críticos.
MetodologíaEnsayo clínico aleatorizado en dos ramas (inyección abdomen vs. brazo), entre julio de 2014 y enero de 2017, en una unidad de cuidados intensivos polivalente de 18 camas. Incluidos pacientes con enoxaparina profiláctica, ingreso >72h, sin hepatopatías o enfermedades hematológicas, con índice de masa corporal (IMC)>18,5, no embarazadas, mayores de edad y sin lesiones cutáneas que impidan la valoración. Excluidos fallecimientos o traslados de hospital antes de finalizar la valoración. Recogidas variables demográficas, clínicas y aparición de equimosis y/o hematoma en lugar de inyección a las 12, 24, 48 y 72h. Análisis descriptivo, comparación de grupos y regresión logística. Aprobado por la comité de ética, con consentimiento firmado de pacientes/familiares.
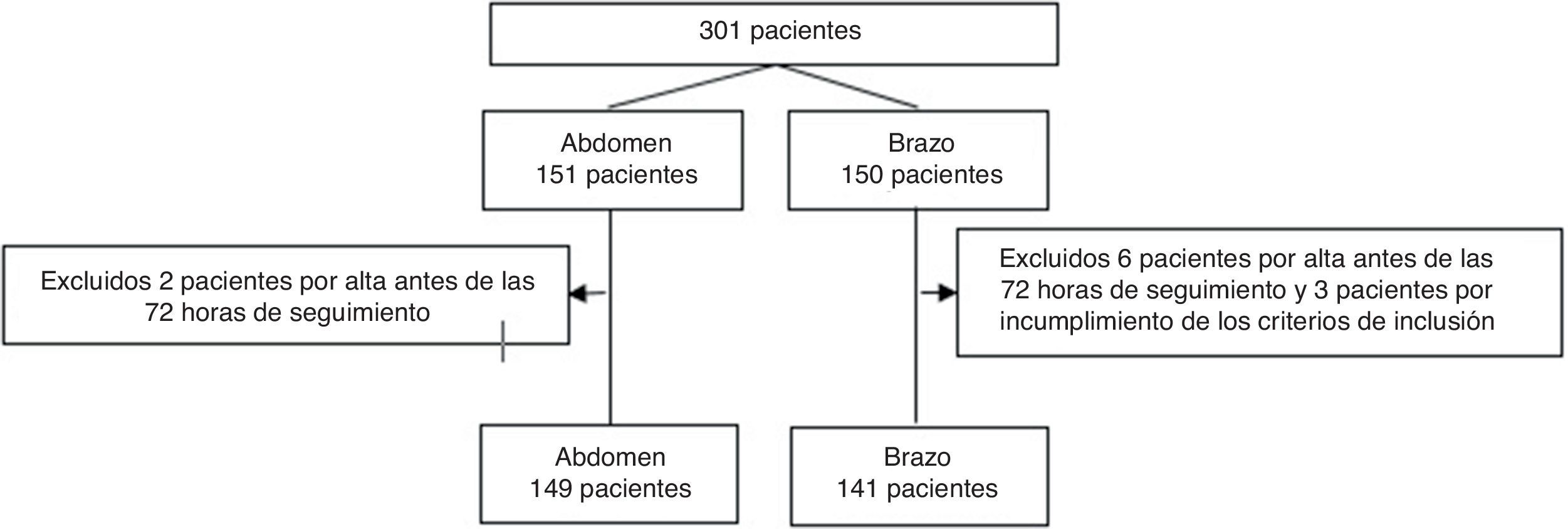
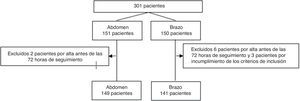
ResultadosUn total de 301 casos (11 excluidos): 149 en abdomen vs. 141 en brazo. Sin diferencias significativas en variables demográficas, clínicas, IMC, dosis de enoxaparina y administración de antiagregantes. Equimosis en el 48% de los pacientes y hematoma en el 8%, sin diferencias estadísticas abdomen vs. brazo [equimosis, abdomen vs. brazo, n(%): 66(44) vs. 72(51), p=0,25] [hematoma abdomen vs. brazo, n(%):9(6) vs. 14(10), p=0,2]. Se halla significación estadística en el tamaño del hematoma a las 72h: [área de hematoma (mm2) abdomen vs. brazo, mediana (RIC): 2(1-5,25) vs. 20(5,25-156), p=0,027].
ConclusionesEn nuestra cohorte de pacientes, la enoxaparina subcutánea profiláctica administrada en el abdomen produce menos hematomas, a las 72h, que administrada en el brazo. La tasa de incidencia de equimosis y hematomas es menor a la publicada en pacientes críticos, advirtiéndose que pacientes con antiagregantes presentan mayor riesgo de presentar lesiones, no observándose relación de su aparición con el IMC.
Ecchymosis and/or haematoma are the most common adverse events after subcutaneous administration of low molecular weight heparin. There is no strong recommendation as to the puncture site.
ObjectiveTo evaluate the adverse events, ecchymosis and/or haematoma after the administration of prophylactic subcutaneous enoxaparin in the abdomen vs the arm in the critically ill patient.
MethodologyA randomised, two-arm clinical trial (injection in the abdomen vs the arm), performed between July 2014 and January 2017, in an 18-bed, polyvalent intensive care unit. Patients receiving prophylactic enoxaparin, admitted >72h, with no liver or haematological disorders, a body mass index (BMI) >18.5, not pregnant, of legal age and with no skin lesions which would impede assessment were included. We excluded patients who died or who were transferred to another hospital before completing the evaluation. We gathered demographic and clinical variables, and the onset of ecchymosis and/or haematomas at the injection site after 12, 24, 48 and 72hours. A descriptive analysis was undertaken, with group comparison and logistic regression. The study was approved by the ethics committee with the signed consent of patients/families.
Results301 cases (11 excluded): 149 were injected in the abdomen vs 141 in the arm. There were no significant differences in demographic and clinical variables, BMI, enoxaparin dose or antiplatelet administration [ecchymosis, abdomen vs arm, n(%): 66(44) vs 72(51), P=.25] [haematoma abdomen vs arm, n(%): 9(6) vs 14(10), P=.2]. Statistical significance was found in the size of the haematomas after 72h: [area of haematoma (mm2) abdomen vs arm, median (IQR): 2(1-5.25) vs 20(5.25-156), P=.027].
ConclusionsIn our patient cohort, prophylactic subcutaneous enoxaparin administered in the abdomen causes fewer haematomas after 72hours, than when administered in the arm. The incidence rate of ecchymosis and haematoma was lower than the published incidence in critically ill patients, although patients receiving anti-platelet agents present a higher risk of injury. No relationship was observed in relation to BMI.
La administración subcutánea de heparina de bajo peso molecular a dosis profilácticas es una práctica habitual en las unidades de cuidados intensivos, pero no existe suficiente evidencia científica en lo relacionado a su técnica de administración y aparición de equimosis y hematoma en el paciente crítico, efectos adversos que alteran la imagen corporal y la seguridad del paciente.
Este estudio aborda el problema proponiendo una técnica de administración basada en la mejor evidencia hallada, normas del fabricante del fármaco y consenso de expertos, así como los resultados tras su aplicación.
Implicaciones del estudioEste estudio relaciona la aparición de equimosis y/o hematomas en el paciente crítico con la zona de inyección, según la técnica descrita. Estudios como este proporcionan las bases teóricas para el desarrollo de la actividad asistencial de enfermería basada en la evidencia.
Desde que en 1980 se desarrolla la heparina de bajo peso molecular (HBPM), la utilidad y la frecuencia de su uso se ha optimizado, reemplazando al compuesto original1 y generalizándose en el uso clínico, tanto en atención primaria como en especializada.
La amplia progresión en su utilización frente a la heparina no fraccionada se debe a sus ventajas, tales como su alta biodisponibilidad y su farmacocinética predecible2. Aunque las HBPM contienen anti-Xa, principio activo que inhibe el factorXa de la coagulación, son efectivas y seguras sin necesidad de ser monitorizadas1,3,4. Las dosis empleadas para la profilaxis de la trombosis venosa profunda no modifican de forma significativa las pruebas de tiempo de sangrado y coagulación sanguínea global, ni afectan a la agregación plaquetaria o la unión de fibrinógeno a plaquetas5. Sin embargo, el College of American Pathologists6 recomienda monitorizar a pacientes con extremado bajo peso o sobrepeso, embarazadas, niños y pacientes con insuficiencia renal.
Como tratamiento activo, la enoxaparina es utilizada en la trombosis, la angina inestable y el infarto de miocardio sin ondaQ, entre otras patologías5,7, y profilácticamente se prescribe para la prevención de tromboembolismos, trombosis venosas profundas y en la prevención de la formación de coágulos en la hemodiálisis en pacientes con insuficiencia renal crónica mediante una dosis cada 24h8.
Al precisar una absorción lenta del medicamento, la vía de elección para administrar la enoxaparina es la subcutánea. La medicación es inyectada debajo de la epidermis, entre la grasa y el tejido conectivo subyacente a la dermis, donde el flujo de sangre es menor y, por tanto, la absorción es más lenta. Un escaso conocimiento de la técnica puede llevar a la administración accidental del medicamento en el tejido muscular, afectando a la absorción y causando daño al paciente9.
Entre los eventos adversos en la administración de la enoxaparina subcutánea se encuentran las complicaciones hemorrágicas, hematomas graves de pared abdominal, necrosis de piel y tejido subcutáneo10 y, a más largo plazo, osteoporosis y trombocitopenia1,5,7. La aparición de equimosis y/o hematoma es el evento adverso más frecuente, con incidencias que van del 10 al 90%8,10-22 según la técnica empleada. Aunque la aparición del hematoma no debería ocasionar una situación clínica grave, sí puede determinar la percepción del paciente, produciéndole ansiedad, trastorno de la imagen corporal y pérdida de confianza en la enfermera que le proporciona los cuidados16.
Es escasa la bibliografía que contextualiza la presencia de equimosis y/o hematoma en el paciente crítico10,13-15,17, pues la mayoría de los estudios se refieren a cuidados posquirúrgicos en unidades de hospitalización8,11,12,16,18-23.
La enoxaparina se presenta en unidosis, con jeringa precargada8 con 0,2ml por cada 2.000 unidades de enoxaparina sódica y con aguja tipo Hypak de calibre 2924. Esta forma de presentación limita poder intervenir en la longitud y el calibre de la aguja14, el tamaño de la jeringa18 o el volumen de inyección, aspectos que pueden influir en la aparición de hematomas o equimosis. Sin embargo, podemos intervenir en la técnica de inyección para evaluar su influencia sobre la aparición de lesiones.
Aguilera et al.8 reportan que en pacientes no obesos (pliegue cutáneo abdominal <4cm) la formación del pliegue se comportaría como un factor protector en la aparición del hematoma, mientras que en los obesos (pliegue cutáneo abdominal >4cm) la formación del pliegue podría ser un factor de riesgo para la aparición del hematoma. El mantenimiento o no del pliegue durante la inyección también es estudiado por Vanbree et al.13, que no encontraron resultados concluyentes.
El aspirado previo a la inyección es estudiado por varios autores10,12,13,15,22. Garrido et al.12 demuestran que se producen menos hematomas y de menor tamaño al suprimir el proceso de aspirado en la técnica de administración, y en el estudio de Avşar y Kaşikçi22 la incidencia y el tamaño de las equimosis son igualmente menores aplicando una técnica sin aspiración.
Con respecto al purgado de la burbuja de aire previa a la inyección, Wooldridge y Jackson18 aseguran en su estudio que no se debe purgar el aire y, por tanto, sí introducirlo al final de la inyección.
Son varios los estudios11,16,17,20,21,25 hallados que investigan la relación entre el tiempo de administración de la inyección y la aparición de equimosis/hematoma. Akpinar y Celebioglu16 encuentran en su estudio que inyectando el fármaco en 30segundos (s) o inyectándolo en 10s y esperando otros 10s para retirar la aguja se reduce el tamaño y la cantidad de equimosis en la zona de administración. En los estudios de Zaybak y Khorshid11 y de Chan20 se observa una reducción de la incidencia y del tamaño de la equimosis cuando la duración de la inyección es de 30s. Pourghaznein et al.17 administran la inyección en 15s y esperan 5s para retirar la aguja, reduciendo así la incidencia de equimosis en su estudio, y Palese et al.21 concluyen que el tiempo de inyección debe ser superior a 30s para disminuir la equimosis en el lugar de inyección.
En la mayoría de los estudios revisados se utiliza una técnica de administración que se denomina estándar, en la que algunos de sus pasos están basados en el consenso pero no tienen evidencia científica, con una alta variabilidad entre unos autores y otros. Es el caso de aspectos como el mantenimiento del pliegue durante la inyección4,5,7,10-12,14,20-22,26-28, el pliegue solo para inyectar sin discriminar entre obesos y no obesos18, no frotar sobre el lugar de inyección4,7-9,13,14,16-19,21,23,26-28, ángulo de 90° para la inyección7,9,11-14,16,18,19,21-23,26-28, ángulo de 45° para pacientes caquécticos27 y la extracción de la aguja en la misma dirección de entrada13,14,16,18-21,26-28.
Otro de los aspectos de la técnica a estudiar es la elección del lugar de inyección. Tradicionalmente se ha considerado la cintura abdominal anterolateral y posterolateral como lugar idóneo de administración, intentando no inyectar la heparina en un área de 5cm alrededor del ombligo para evitar las venas umbilicales23,28. Diversos autores analizan los efectos de la inyección en abdomen4,5,7,8,10-13,16,18,20,22,23,26,28, pero en ocasiones este no es accesible por heridas, cicatrices u otras lesiones, debiéndose considerar otro lugar de inyección. Fahs y Kinney19 estudiaron a 101 pacientes medicoquirúrgicos distribuidos al azar en tres grupos. Cada grupo recibió inyecciones de heparina con la misma técnica en distintas localizaciones (abdomen, parte posterior del brazo y muslo) y midieron la equimosis a las 48, 60 y 72h. No hallaron diferencias en cuanto a la aparición de equimosis, con una incidencia global del 30%.
La práctica enfermera de administrar HBPM en el abdomen parece estar basada más en la tradición que en la evidencia científica19. Annersten y Willman29 llevaron a cabo una revisión de la técnica de inyección subcutánea y concluyeron que deben realizarse más estudios, ya que los existentes son heterogéneos en diseño y descripción de los diferentes aspectos de la técnica y, por lo tanto, el fundamento científico para el desempeño técnico es débil.
La variabilidad observada en la bibliografía revisada ha hecho plantearnos un estudio cuyo objetivo principal fue evaluar los eventos adversos, equimosis y/o hematoma, tras la administración de enoxaparina subcutánea profiláctica en abdomen vs. brazo, aplicando una técnica de inyección basada en la mejor evidencia disponible, en las normas del fabricante y en el consenso de expertos.
Los objetivos secundarios fueron determinar la incidencia de las lesiones, observar la evolución temporal del área de las mismas y valorar si la administración de antiagregantes/fibrinolíticos y el índice de masa corporal (IMC) influyen en la aparición o tamaño de las lesiones.
MetodologíaEnsayo clínico aleatorizado, prospectivo y ciego, que se realizó en una unidad de cuidados intensivos polivalente, comparando la administración de enoxaparina profiláctica en el abdomen vs. brazo.
Dadas las características del estudio, fue imposible mantener el aspecto ciego del estudio en referencia a la enfermera que administraba el fármaco. Debido a ello, la ceguera se mantuvo únicamente en el miembro del equipo investigador que analizó los datos.
La administración de la enoxaparina se realizó siguiendo la mejor evidencia proporcionada por la bibliografía y las normas del fabricante. En los casos en que no hemos hallado evidencia en la literatura se han seguido criterios de consenso profesional (Anexo 1).
Pacientes incluidosSe incluyeron a todos los pacientes a los que se prescribió administración de enoxaparina de forma profiláctica (una dosis comprendida entre 20 y 60mg, según peso, cada 24h) y se previera una estancia igual o mayor a 72h desde su inclusión en el estudio, tras la firma del consentimiento informado por el representante legal o por el propio paciente.
No se incluyeron pacientes con patología hematológica, hepatopatías diagnosticadas en el momento del ingreso, mujeres embarazadas, menores de 18años, pacientes grandes quemados, pacientes con IMC≤18,50 ni los pacientes que presentaban lesiones (herida quirúrgica, cicatriz, equimosis/hematoma, drenajes, etc.) en alguna de las zonas seleccionadas para el estudio.
Pacientes excluidosUna vez incluidos en el estudio, fueron excluidos los pacientes que fueron trasladados fuera del servicio, o fallecieron, antes de finalizar el periodo de observación (72h).
También se excluyeron aquellos pacientes a los que, por cualquier motivo, no se les pudo hacer seguimiento (cirugía posterior en la zona de inyección o pacientes en decúbito prono, entre otras).
Tamaño muestralAceptando un riesgo alfa de 0,05 y un riesgo beta de 0,2 en un contraste bilateral, se estimaron 147pacientes en cada grupo para detectar como estadísticamente significativa la diferencia entre dos proporciones, que para el grupo1 se esperaba que fuera del 52% y para el grupo2 del 35%. Se estimó una tasa de pérdidas de seguimiento del 10%.
AleatorizaciónLa aleatorización a uno u otro brazo del estudio se realizó en bloques de 40, con una lista generada por ordenador, manteniéndolo oculto en sobres cerrados numerados correlativamente. Esta aleatorización fue realizada por el miembro del equipo investigador que posteriormente realizó el análisis y que no participó en la selección de pacientes.
Variables del estudioVariable independienteLugar de inyección asignado aleatoriamente (cintura abdominal anterolateral y posterolateral vs. cara posterior del brazo).
Variables dependientesAparición de equimosis y/o hematoma en la zona de inyección a las 12, 24, 48 y 72h tras la administración de la enoxaparina subcutánea profiláctica y área de la lesión.
Equimosis: coloración de la piel producida por la infiltración de sangre en los tejidos subcutáneos o por la rotura de vasos capilares subcutáneos10.
Hematoma: tumoración o endurecimiento anormal, causado por la acumulación de sangre (hay hematoma cuando hay endurecimiento, haya o no coloración de la pie)10.
Área de la lesión (mm2): máxima altura por máxima anchura de la lesión.
Variables relacionadas con el pacienteDemográficas (edad, sexo, IMC), Simplified Acute Physiologic Score-II (SAPS II) como indicador de gravedad, dosis de enoxaparina prescrita, administración de antiagregantes y/o fibrinolíticos.
ProcedimientoEn el momento de ingreso de un paciente, tras confirmar que cumplía criterios de inclusión y tras obtener el consentimiento firmado, se aleatorizó la zona de punción (abdomen vs. brazo). A efectos de seguimiento del estudio, solo se consideró una inyección por paciente.
La inyección de enoxaparina fue realizada por una de las 12 enfermeras de la unidad que formaban el equipo investigador, siguiendo la técnica descrita en el Anexo 1.
La zona de inyección se identificó, para su posterior seguimiento, con un círculo realizado con rotulador resistente al agua en un perímetro de 5cm. Las inyecciones posteriores, que no fueron motivo de seguimiento en el presente estudio, se realizaron en localizaciones diferentes a la aleatorizada.
Una enfermera del equipo valoró la presencia de equimosis y/o hematoma a las 12, 24, 48 y 72h de la inyección. Cuando apareció lesión, se midió y registró su máxima altura y anchura mediante un papel milimetrado.
Análisis estadísticoSe realizó una estadística descriptiva básica, expresándose los datos cuantitativos como media (desviación estándar) o mediana (rango intercuartílico), según correspondiera y los datos cualitativos como proporciones.
La comparación de grupos se realizó con el test de la t de Student para variables cuantitativas o pruebas no paramétricas, según proceda, y Fischer o chi cuadrado para variables cualitativas.
El análisis de la aparición de equimosis y/o hematoma se realizó mediante una regresión logística, donde se introdujeron las variables que resultaron significativas individualmente. Se realizó una regresión lineal para determinar la correlación entre las diferentes variables y el mayor tamaño de las lesiones.
Se utilizó el paquete estadístico SPSS Statistics 21.0 para Windows (SPSS Inc., Chicago IL, EE.UU.).
Consideraciones éticasEl estudio fue aprobado por el comité de ética e investigación clínica del hospital de referencia y se obtuvo el consentimiento informado en todos los casos, bien por el paciente o por un familiar directo.
El procedimiento seguido fue conforme a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki30.
Los autores declaran no haber recibido ningún tipo de ayuda económica para su realización, no existiendo ningún conflicto de interés económico o personal que pueda sesgar o influir inadecuadamente en sus actuaciones.
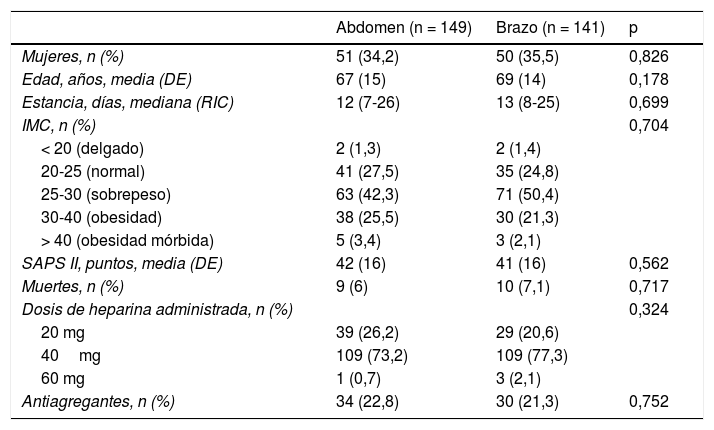
ResultadosSe realizó el seguimiento de 301 pacientes desde julio de 2014 hasta enero de 2017. Se aleatorizaron 151 en abdomen y 150 en brazo. Fueron excluidos 11 pacientes (fig. 1). No se han hallado diferencias estadísticamente significativas entre grupos. La dosis de enoxaparina administrada con mayor frecuencia fue de 40mg (tabla 1).
Descriptivos de los pacientes
| Abdomen (n = 149) | Brazo (n = 141) | p | |
|---|---|---|---|
| Mujeres, n (%) | 51 (34,2) | 50 (35,5) | 0,826 |
| Edad, años, media (DE) | 67 (15) | 69 (14) | 0,178 |
| Estancia, días, mediana (RIC) | 12 (7-26) | 13 (8-25) | 0,699 |
| IMC, n (%) | 0,704 | ||
| < 20 (delgado) | 2 (1,3) | 2 (1,4) | |
| 20-25 (normal) | 41 (27,5) | 35 (24,8) | |
| 25-30 (sobrepeso) | 63 (42,3) | 71 (50,4) | |
| 30-40 (obesidad) | 38 (25,5) | 30 (21,3) | |
| > 40 (obesidad mórbida) | 5 (3,4) | 3 (2,1) | |
| SAPS II, puntos, media (DE) | 42 (16) | 41 (16) | 0,562 |
| Muertes, n (%) | 9 (6) | 10 (7,1) | 0,717 |
| Dosis de heparina administrada, n (%) | 0,324 | ||
| 20 mg | 39 (26,2) | 29 (20,6) | |
| 40mg | 109 (73,2) | 109 (77,3) | |
| 60 mg | 1 (0,7) | 3 (2,1) | |
| Antiagregantes, n (%) | 34 (22,8) | 30 (21,3) | 0,752 |
DE: desviación estándar; IMC: índice de masa corporal; RIC: rango intercuartílico; SAPS: Simplified Acute Physiologic Score-II.
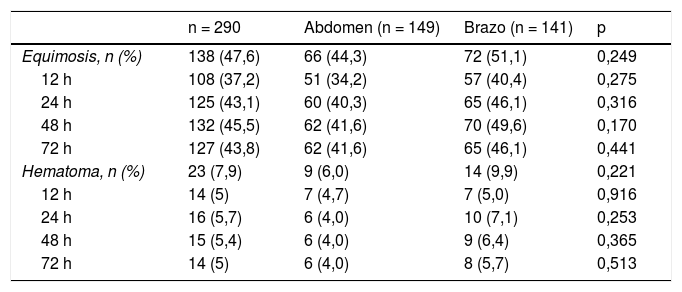
La incidencia global de aparición de equimosis observada fue del 47,6%, y la del hematoma, del 7,9%. Hemos hallado una menor incidencia de estas lesiones en el abdomen frente al brazo, que no llega a ser significativa (equimosis 44,3% vs. 51,1%, p=0,249; hematoma 6% vs. 9,9%, p=0,221). A las 12, 24, 48 y 72h el comportamiento es similar, con menor incidencia en el abdomen, pero sin llegar a la significación estadística (tabla 2).
Incidencia de equimosis/hematoma global y abdomen vs. brazo a las 12, 24, 48 y 72h tras la administración de enoxaparina
| n = 290 | Abdomen (n = 149) | Brazo (n = 141) | p | |
|---|---|---|---|---|
| Equimosis, n (%) | 138 (47,6) | 66 (44,3) | 72 (51,1) | 0,249 |
| 12 h | 108 (37,2) | 51 (34,2) | 57 (40,4) | 0,275 |
| 24 h | 125 (43,1) | 60 (40,3) | 65 (46,1) | 0,316 |
| 48 h | 132 (45,5) | 62 (41,6) | 70 (49,6) | 0,170 |
| 72 h | 127 (43,8) | 62 (41,6) | 65 (46,1) | 0,441 |
| Hematoma, n (%) | 23 (7,9) | 9 (6,0) | 14 (9,9) | 0,221 |
| 12 h | 14 (5) | 7 (4,7) | 7 (5,0) | 0,916 |
| 24 h | 16 (5,7) | 6 (4,0) | 10 (7,1) | 0,253 |
| 48 h | 15 (5,4) | 6 (4,0) | 9 (6,4) | 0,365 |
| 72 h | 14 (5) | 6 (4,0) | 8 (5,7) | 0,513 |
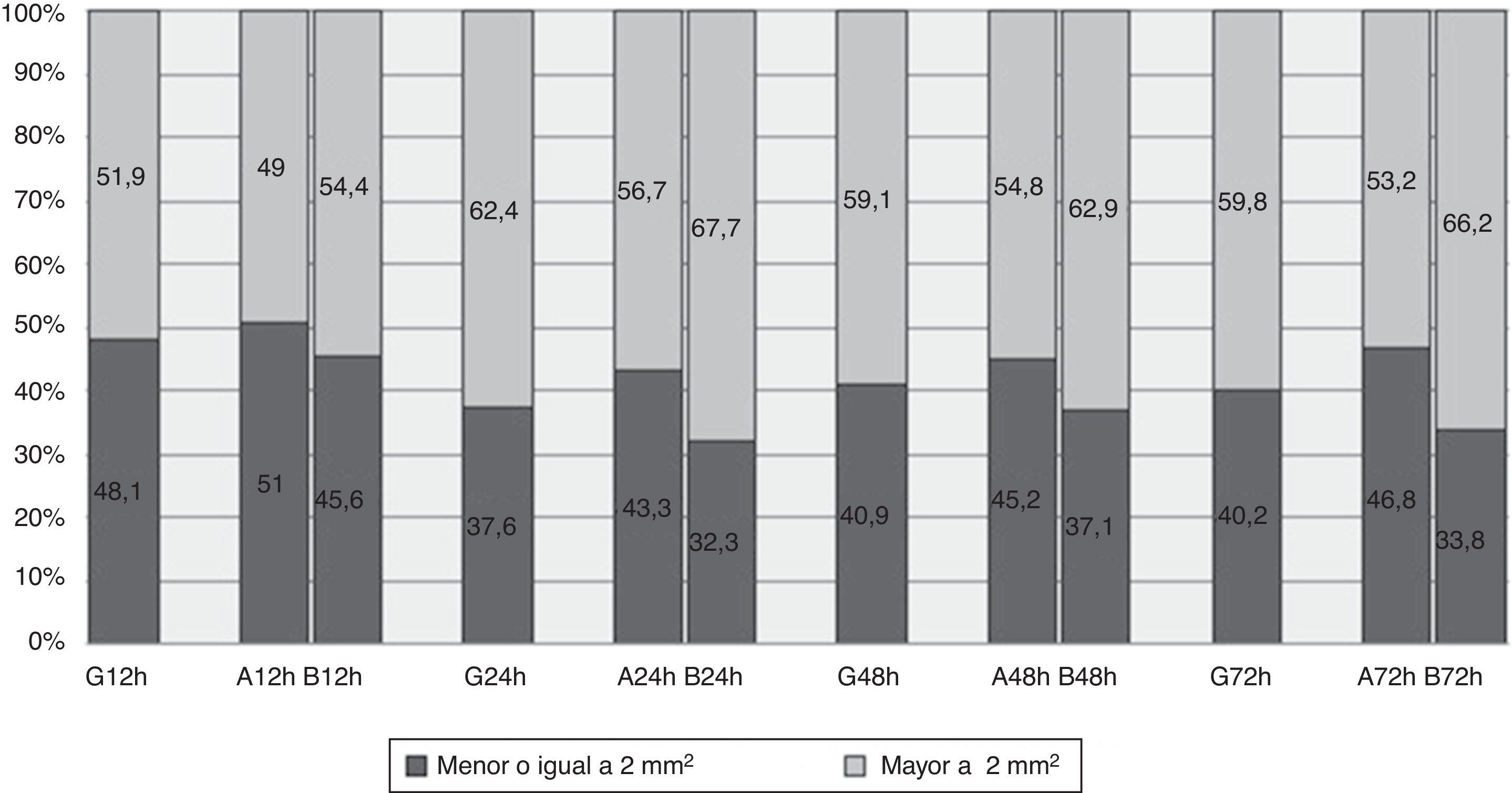
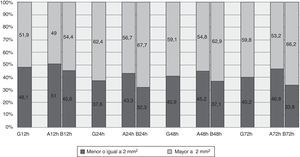
La mediana del área de todas las equimosis observadas está comprendida entre 3mm2 a las 12h de la administración de la enoxaparina y 9mm2 a las 72h (tabla 3). No obstante, el 48,1% tenían un área inferior o igual a 2mm2 a las 12h de la administración, manteniéndose en torno al 40% a las 24, 48 y 72h (fig. 2).
Área de equimosis/hematoma global y abdomen vs. brazo a las 12, 24, 48 y 72h tras la administración de enoxaparina
| Global | Abdomen | Brazo | p | |
|---|---|---|---|---|
| Equimosis (mm2), mediana (RIC) | ||||
| 12 h | 3 (1-6) | 2 (1-6) | 4 (1-5) | 0,663 |
| 24 h | 4 (1-12) | 4 (1-11,75) | 4 (1-12) | 0,375 |
| 48 h | 6 (1,13-16) | 5 (1-12,75) | 7,5 (1,9-21) | 0,225 |
| 72 h | 9 (4-25) | 6 (2-17,25) | 12 (4-33,5) | 0,066 |
| Hematoma (mm2), mediana (RIC) | ||||
| 12 h | 1 (1-4) | 1 (1-1) | 4 (1-9) | 0,128 |
| 24 h | 4 (1,25-14,25) | 2 (1-5,25) | 6,5 (3,25-300) | 0,118 |
| 48 h | 4 (1-16) | 2 (1-5,25) | 16 (2,5-62,5) | 0,073 |
| 72 h | 6,5 (1,75-24,25) | 2 (1-5,25) | 20 (5,25-156,23) | 0,027 |
RIC: rango intercuartílico.
Si observamos la evolución en el tiempo entre grupos, vemos como la lesión es prácticamente igual a las 24horas, empieza a diferenciarse a las 48h, y a las 72h el área observada en el brazo duplica a la del abdomen (tabla 3). A pesar de encontrar diferencias entre zonas, estas no alcanzan la significación estadística.
La comparación entre grupos nos muestra un mayor porcentaje de lesiones menores o iguales a 2mm2 en abdomen vs. brazo, siendo a las 12h el 51% vs. el 45,6%. Esta diferencia se ve incrementada en el tiempo, pudiendo observar porcentajes en torno al 45% en el abdomen y del 34% en el brazo (fig. 2).
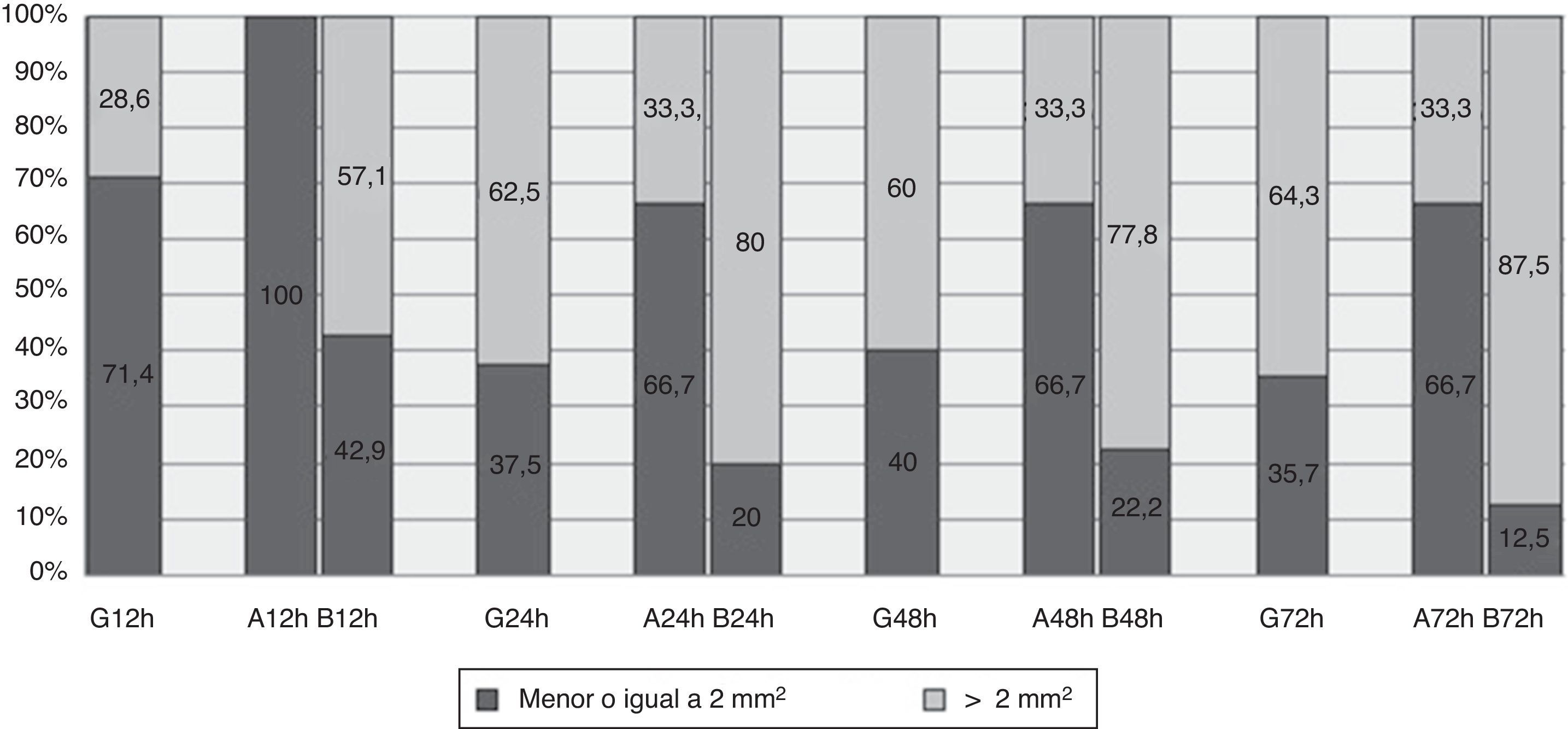
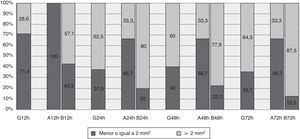
HematomaCon respecto al hematoma en global, la máxima área alcanzada fue de 6,5mm2 a las 72h (tabla 3). A las 12h el 71,4% de los hematomas observados tenían una mediana de área inferior o igual a 2mm2, manteniéndose en torno al 37% en las siguientes mediciones (fig. 3).
El área del abdomen se mantiene estable en el tiempo, pero en el brazo aumenta significativamente, llegando a los 20mm2 a las 72h (tabla 3). En la figura 3 podemos observar como a las 12h todos los hematomas localizados en abdomen tenían un área igual o inferior a 2mm2, pasando a ser del 66,7% en el resto de las mediciones. De los hematomas localizados en brazo a las 12h observamos un 42,9% con un área menor o igual a 2mm2, pasando a las 72h al 12,5%.
A ningún paciente se le prescribieron fibrinolíticos y la prescripción de antiagregantes fue similar en ambos grupos (abdomen 22,8% vs. 21,3% en brazo; p=0,752).
En un modelo de regresión logística en el que se introdujeron como variables relacionadas con la aparición de equimosis, la edad, el IMC y la administración de antiagregantes, observamos que aquellos pacientes a los que se estaba administrando antiagregantes tuvieron dos veces más riesgo de desarrollar equimosis (OR: 2,177; IC95%: 1,231-3,851; p=0,008), no resultando significativas el resto de variables.
El mismo resultado obtenemos en el análisis de la aparición de hematomas. En este caso, los pacientes con administración de antiagregantes tuvieron 4 veces más riesgo que aquellos pacientes a los que no se les administró antiagregantes (OR: 4,329; IC95%: 1,755-10,679; p=0,001).
El tamaño de la equimosis y del hematoma a las 72h también obtuvo una correlación lineal significativa con la administración de antiagregantes (equimosis p=0,009; hematoma p=0,023).
DiscusiónHemos observado, en nuestra cohorte de pacientes, que tanto las equimosis como los hematomas aparecieron con mayor frecuencia y tamaño en el brazo vs. abdomen. La incidencia global ha sido mayor en la aparición de equimosis que de hematomas. Los pacientes que recibieron antiagregantes presentaron mayor riesgo de desarrollar estas lesiones y el IMC no estuvo relacionado con la aparición de las lesiones.
La gran heterogeneidad encontrada en los estudios que valoraron la administración de enoxaparina profiláctica hace complicado comparar y extrapolar nuestros resultados. Esta variabilidad se debe fundamentalmente al tipo de paciente, ya que hay pocos estudios realizados en el entorno del paciente crítico, a la técnica de inyección, al uso de jeringa precargada o no de fármaco, al uso indistinto de equimosis y hematoma como equivalentes y a la zona de administración.
Si bien es cierto que el objetivo de nuestro estudio no fue evaluar la técnica de administración, nuestros resultados podrían indicar que la técnica utilizada ha podido influir en los mismos. Pero sería necesario un estudio que específicamente contemplara este aspecto, debido a la diversidad encontrada en la bibliografía.
Comparando nuestros resultados con los de estudios realizados en el contexto del paciente crítico10,13-15,17, tres de ellos se realizaron en la década de los ochenta13-15. Brenner et al.15 compararon dos técnicas de inyección sin jeringas precargadas y, considerando el hematoma como «decoloración», observaron un 50% de lesiones tras la inyección del fármaco. Coley et al.14, sin jeringas precargadas y no diferenciando entre equimosis y hematoma, observaron un 14% de lesiones tras la administración de HBPM, aunque no tuvieron en consideración las lesiones inferiores a 1mm2. Vanbree et al.13 valoraron la aparición de equimosis en pacientes sometidos a cirugía cardíaca con administración de HBPM cada 12h, comparando tres técnicas de inyección, sin obtener diferencias entre ellas y con aparición de equimosis medible del 56%.
Estudios más recientes son los de Gómez et al.10 y Pourghaznein et al17. Gómez et al.10 valoraron la incidencia de hematoma en pared abdominal tras la administración del fármaco en pacientes ingresados en una unidad de cuidados intensivos cardiológicos, comparando cuatro técnicas de administración diferentes que incluían jeringas precargadas/no precargadas y aspiración/no aspiración. Obtuvieron un resultado global del 26,3% de equimosis y del 52% de hematomas. En la cohorte que más se asemejaba a nuestra metodología, con enoxaparina precargada y sin aspirar, el resultado fue del 15% de equimosis y del 38% de hematomas. En nuestro estudio la prevalencia está invertida, pues observamos una equimosis del 49% y el 8% de hematomas, pero con tamaños llamativamente menores, aun considerando los peores resultados de nuestro estudio. Gómez et al.10 presentan un área de equimosis de 2,61cm2 frente a los 9mm2 observados en nuestro estudio, hallándose la misma tendencia en el tamaño del hematoma (11,11cm2 vs. 20mm2).
Pourghaznein et al.17, observaron la aparición de equimosis utilizando cuatro métodos diferentes de administración de HBPM cada 12h en abdomen y muslos, con medición de la lesión a las 48h. De los cuatro métodos utilizados en este estudio, los más semejantes al nuestro (10s de inyección y 5s de tiempo de espera de retirada de la aguja) eran el métodoB —que incluía inyección durante 10s y tiempo de espera de 10s antes de retirar la aguja— y el métodoC —inyección de 15s, con tiempo de espera de 5s. Aplicados ambos métodos en abdomen, obtuvieron un porcentaje de equimosis del 71% para el métodoB y del 53% para elC, ambos valores superiores al nuestro, que para abdomen fue del 46%.
Respecto a las áreas de equimosis, para el métodoB obtuvieron una media de 38mm2 (0-49) y para el métodoC, de 6mm2 (0-14), valores no extrapolables porque incluyen en el cálculo del área las inyecciones sin lesión (valores «cero»).
Por último, no hemos hallado ningún artículo que considere la administración de antiagregantes, en el paciente crítico, como factor de riesgo para la aparición de equimosis y/o hematoma.
ConclusionesSegún lo observado en nuestra cohorte de pacientes, podemos decir que la enoxaparina subcutánea profiláctica administrada en el abdomen produce menos hematomas, a las 72h, que la administrada en el brazo.
Hemos obtenido una tasa de incidencia de equimosis y hematomas menor a la publicada, en pacientes críticos, utilizando la técnica propuesta en nuestro estudio.
Los pacientes con administración concomitante de antiagregantes presentan mayor riesgo de presentar lesiones; no hay relación de su aparición con el IMC, y el tamaño de las lesiones es inferior en el abdomen vs. brazo.
En base a los resultados, sería recomendable la administración subcutánea de enoxaparina profiláctica en abdomen vs. brazo en el paciente crítico.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses.
- -
El paciente deberá estar acostado en el momento de la inyección.
- -
Correcta higiene de manos y colocación de guantes limpios.
- -
Desinfección con alcohol de 70° del lugar asignado de inyección.
- -
Retirar el tapón de la aguja precargada de enoxaparina.
- -
No extraer burbuja de aire de la jeringa precargada.
- -
Podría aparecer una gota en el extremo de la aguja; si esto sucede, hay que eliminar la gota antes de administrar la inyección. Para ello se deben dar golpecitos suaves con el dedo a la jeringa, siempre con la aguja apuntando hacia abajo, hasta que se desprenda la gota.
- -
Tomar un pliegue de piel entre los dedos pulgar e índice; este debe hacerse con la mano no dominante y debe ser amplio y sin presión en la zona de punción7 y mantenerlo durante toda la inyección.
- -
Insertar la aguja completamente en un ángulo de 90°.
- -
No aspirar antes de inyectar.
- -
Inyectar el fármaco durante 10s manteniendo la aguja tras la inyección completa durante 5s más.
- -
Retirar la aguja en la misma dirección de entrada.
- -
Relajar el pliegue de piel.
- -
Presionar ligeramente 2-3s el punto de punción sin masajear ni frotar.
- -
Orientar la jeringa hacia abajo, alejada de sí mismo y de otras personas, y presionar firmemente el émbolo para activar el sistema de seguridad. La funda protectora cubrirá la aguja automáticamente a la vez que se escuchará un clic que confirma la activación del sistema de seguridad.
- -
Depositar la jeringa en un contenedor adecuado.
- -
Rotular la zona con un rotulador resistente al agua en un perímetro de 5cm.
Primer premio SEEIUC 2017 a la mejor comunicación oral presentada en el XLIII Congreso Nacional de la SEEIUC celebrado en Madrid del 18-21 de junio de 2017.