Evaluar el nivel de implementación de los protocolos asociados a la prevención de la debilidad muscular adquirida en la unidad de cuidados intensivos (UCI), así como la presencia del fisioterapeuta en distintas UCI de España.
MétodoEstudio descriptivo, transversal realizado en 86 UCI de adultos de España entre los meses de marzo a junio de 2017. Se excluyeron UCI neuroquirúrgicas y de grandes quemados. Se utilizó encuesta multirrespuesta que incluía preguntas sobre los protocolos de: control de glucemia, sedación, valoración del dolor, prevención del delirium, manejo del delirium y movilización precoz. La encuesta fue rellenada a través de un aplicativo protegido por usuario y contraseña. Análisis inferencial con t de Student o U de Mann-Whitney y de correlación con Pearson o Rho de Spearman.
ResultadosEl 89,5% de las UCI tenían protocolo de control de glucemia, con rango predominante de 110-140mg/dl. El 74,4% evaluaban el nivel de sedación, si bien solo tenían protocolos de sedación el 36% de ellas. Con relación a la valoración del dolor se realizaba en el 73,7% de los pacientes comunicativos, mientras que en los no comunicativos solo era del 47,5%. Solo el 37,2% realizaban screening diario para detectar el delirium, y disponían de protocolos de prevención del delirium el 31,4% de las UCI, del manejo del delirium el 26,7% y de movilización precoz el 14% de las UCI. En el 34,9% de los casos se solicita interconsulta al servicio de rehabilitación.
ConclusionesLa implementación de los diferentes protocolos asociados a la prevención de la debilidad muscular adquirida ha sido elevada en relación con los protocolos de control de glucemia, valoración del nivel de sedación y del dolor de pacientes comunicativos, mientras que baja en los de movilización precoz y screening y prevención del delirio. Asimismo, es poco frecuente la presencia del fisioterapeuta en la UCI.
To evaluate the degree of implementation of protocols associated with the prevention of intensive-care-unit (ICU) acquired muscle weakness, and the presence of the physiotherapist in various ICU in Spain.
MethodA descriptive, cross-sectional study performed in 86 adult ICU in Spain between March and June 2017. Neurosurgical and major burns ICU were excluded. A multiple-choice survey was used that included questions on protocols for glycaemia control, sedation, pain assessment, delirium prevention, delirium management and early mobilisation. The survey was completed using a user-protected application and password. The Student's t-test or Mann-Whitney U test and Pearson's correlation or Spearman's Rho test were used for the inferential analysis.
ResultsEighty-nine point five percent of the ICU had a glycaemia control protocol, with a predominating range of 110-140mg/dl. Seventy-four point four percent evaluated sedation levels, although only 36% had sedation protocols. Pain assessment was carried out on communicative patients in 73.7%, and on uncommunicative patients in only 47.5%. Only 37.2% performed daily screening to detect delirium and 31.4% of the ICU had delirium prevention protocols, 26.7% had delirium management protocols and 14% had protocols for early mobilisation. Thirty-four point nine percent requested cross consultation with the rehabilitation department.
ConclusionsThe implementation of the different protocols associated with the prevention of ICU-acquired muscle weakness was high in relation to glycaemia control protocols, sedation level and pain assessment in communicative patients, and was low for early mobilisation and delirium screening and prevention. Similarly, the physiotherapist was seldom present in the ICU.
Los beneficios de la movilización precoz (entre el 2.° y 5.° día de ingreso en UCI) para disminuir la incidencia y secuelas de la debilidad adquirida (DAU) en UCI tiene poca aplicabilidad en la práctica diaria debido, entre otros aspectos, a prácticas de sedación y analgesia que no siguen las recomendaciones actuales. Además, existe una alta variabilidad entre países con respecto a las funciones del fisioterapeuta y el tiempo de dedicación de este profesional.
El presente estudio muestra que en las UCI de España hay una escasa implementación de los protocolos de analgosedación guiada por algoritmos y de detección precoz del delirium, que están relacionados con la movilización precoz de los pacientes. Sin embargo, sí se observa una mejor implementación del control de la hiperglucemia, factor de riesgo de DAU. El fisioterapeuta está presente en las UCI mediante interconsulta al servicio de rehabilitación, dado que en pocas UCI es un profesional más del equipo, lo que puede retrasar el inicio de la movilización, dejando de ser precoz.
¿Implicaciones del estudio?No es recomendable implementar protocolos de movilización en las UCI sin antes haber consensuado entre el equipo interprofesional (añadiendo la figura del fisioterapeuta, aunque sea como consultor al inicio), protocolos de analgosedación y prevención del delirium para conseguir que el paciente esté despierto, colaborador y sin dolor para movilizarse activamente, en la cama inicialmente (cicloergómetro por ejemplo) hasta tener control del tronco para mantenerse de pie y andar.
Los avances en el tratamiento y cuidado del paciente crítico, han incrementado la supervivencia tras el alta de la unidad de cuidados intensivos (UCI)1, reorientando nuestros objetivos de cuidados hacia un fin más exigente, conseguir una mejora de la calidad de vida posthospitalaria2.
El síndrome post-UCI se define como la pérdida física, funcional y cognitiva que presentan los pacientes que han estado ingresados en UCI y que afecta a su reincorporación en la vida laboral. El 47% de ellos reingresa durante el primer año y el 17% fallece3,4.
Uno de los aspectos más estudiados de este síndrome es la debilidad muscular adquirida (DAU), denominada comúnmente por su acrónimo en inglés (Intensive Care Unit Acquired Weakness [ICUAW]), que puede diagnosticarse entre el 26 y 65% de los pacientes tratados con ventilación mecánica a los 5 y 7 días de su inicio, respectivamente5,6. DAU consiste en la atrofia y/o pérdida de masa muscular, como consecuencia de una miopatía, polineuropatía o ambas a la vez, sin otra etiología explicativa que la propia patología crítica. Son factores de riesgo para el desarrollo de DAU el grado de comorbilidad, días de ventilación mecánica y estancia en UCI, diagnóstico al ingreso por sepsis, administración de relajantes musculares y corticoides, hiperglucemia y el fallo multiorgánico, existiendo diferentes niveles de evidencia entre ellos7,8.
Diversos estudios publicados en la última década y analizados en una revisión sistemática recientemente publicada9, han identificado la eficacia de la movilización precoz para prevenir y/o disminuir las secuelas relacionadas con el síndrome post-UCI. A partir de dichos estudios la movilización precoz se ha definido como aquella actividad física que se realiza entre el 2.° y 5.° día de ingreso en UCI o durante los 3 primeros días de ingreso. Los citados estudios experimentales se basan en la combinación de ejercicios activos al paciente crítico, de menor a mayor grado de movilidad, así como en la implementación de protocolos de analgosedación o interrupción diaria de la sedación, que promueven una sedación ligera y consciente, condición necesaria para que el paciente esté cooperativo y se movilice activamente.
Por otro lado algunos estudios también añaden al grupo intervención control de la glucemia10 pues como se ha comentado previamente, la hiperglucemia se relaciona con un riesgo mayor de DAU11,12.
De forma más reciente, estudios han demostrado la efectividad de la movilización precoz para disminuir la incidencia de delirio en el paciente crítico, que se cuantifica de entre el 32 y 44%13,14. Finalmente, en un documento de consenso entre expertos en rehabilitación del paciente crítico15, se concluyó que es imprescindible el control del dolor para conseguir una óptima movilización y con ello disminuir los efectos adversos vinculados al encamamiento8, más acusados con la edad, un factor importante a tener en cuenta en la actualidad, cuando se ha documentado un envejecimiento notable de la población que ingresa en las UCI16.
Precisamente este cambio, la mayor edad de los pacientes críticos, es la causa de la principal debilidad metodológica de los estudios que fomentan la movilización precoz: la existencia de unos criterios de inclusión y exclusión muy restrictivos en cuanto a capacidad funcional basal previa al ingreso en UCI. Esto limita gravemente la validez externa de los estudios experimentales sobre los beneficios de la movilización precoz, dado el alto porcentaje de pacientes que no pueden participar en los estudios porque generalmente a mayor edad menor capacidad funcional. Schweickert10, quién marcó un hito en el tema de la movilización, excluyó el 87% de los pacientes.
Si tenemos en cuenta el envejecimiento del paciente crítico que ingresa actualmente en las UCI y por tanto, su mayor comorbilidad y fragilidad16, ese porcentaje aportado por Schweickert10 podría ser todavía mayor en nuestra década actual. De ahí que esté cobrando más importancia evaluar en los ensayos clínicos la comorbilidad que la gravedad pues es un buen predictor del riesgo de reingreso en UCI3 y se relaciona mejor con la incidencia de DAU15,17.
La mayoría de los ensayos clínicos sobre movilización precoz se han llevado a término en poblaciones de pacientes críticos relativamente sanas10,18, hay pocos estudios en pacientes quirúrgicos18,19, predominan los unicéntricos respecto los multicéntricos9 y el número de pacientes con sepsis incluidos es variable, siendo esta subpoblación de pacientes críticos la que presenta más controversia respecto los beneficios de la movilización precoz20.
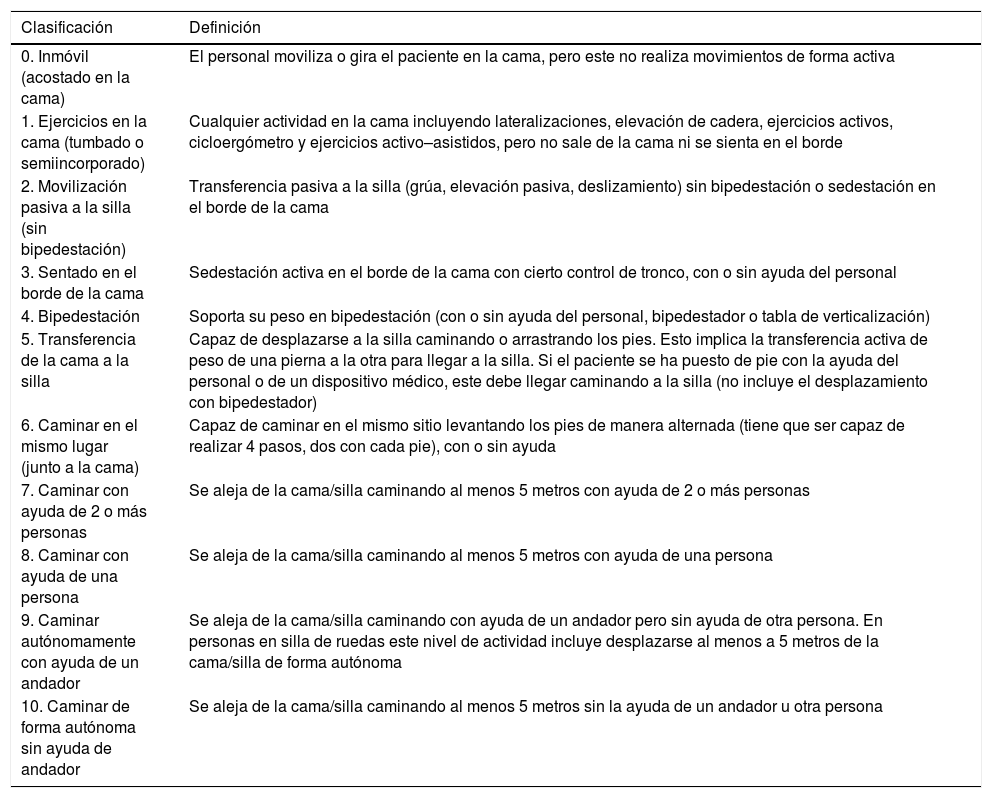
Otra de las deficiencias, esta vez en cuando a validez interna, es la falta de información sobre los protocolos de sedación y weaning que se aplican al grupo control: entre el 88-96% no los detallan8,9. Los autores del Team Study Investigators21, observaron que de los 192 pacientes analizados, solo se pudo realizar movilización precoz (valores del 1 al 10 de la Escala de Movilidad de UCI, tabla 1) en 70 (36,5%) de los pacientes, porque el resto estaban demasiado sedados para poder colaborar en la movilización los días 1.° y 2.° de ingreso en UCI y siguieron así el 30% de ellos los días 3.° y 4.°.
Escala de movilidad de UCI (EMUCI)
| Clasificación | Definición |
|---|---|
| 0. Inmóvil (acostado en la cama) | El personal moviliza o gira el paciente en la cama, pero este no realiza movimientos de forma activa |
| 1. Ejercicios en la cama (tumbado o semiincorporado) | Cualquier actividad en la cama incluyendo lateralizaciones, elevación de cadera, ejercicios activos, cicloergómetro y ejercicios activo–asistidos, pero no sale de la cama ni se sienta en el borde |
| 2. Movilización pasiva a la silla (sin bipedestación) | Transferencia pasiva a la silla (grúa, elevación pasiva, deslizamiento) sin bipedestación o sedestación en el borde de la cama |
| 3. Sentado en el borde de la cama | Sedestación activa en el borde de la cama con cierto control de tronco, con o sin ayuda del personal |
| 4. Bipedestación | Soporta su peso en bipedestación (con o sin ayuda del personal, bipedestador o tabla de verticalización) |
| 5. Transferencia de la cama a la silla | Capaz de desplazarse a la silla caminando o arrastrando los pies. Esto implica la transferencia activa de peso de una pierna a la otra para llegar a la silla. Si el paciente se ha puesto de pie con la ayuda del personal o de un dispositivo médico, este debe llegar caminando a la silla (no incluye el desplazamiento con bipedestador) |
| 6. Caminar en el mismo lugar (junto a la cama) | Capaz de caminar en el mismo sitio levantando los pies de manera alternada (tiene que ser capaz de realizar 4 pasos, dos con cada pie), con o sin ayuda |
| 7. Caminar con ayuda de 2 o más personas | Se aleja de la cama/silla caminando al menos 5 metros con ayuda de 2 o más personas |
| 8. Caminar con ayuda de una persona | Se aleja de la cama/silla caminando al menos 5 metros con ayuda de una persona |
| 9. Caminar autónomamente con ayuda de un andador | Se aleja de la cama/silla caminando con ayuda de un andador pero sin ayuda de otra persona. En personas en silla de ruedas este nivel de actividad incluye desplazarse al menos a 5 metros de la cama/silla de forma autónoma |
| 10. Caminar de forma autónoma sin ayuda de andador | Se aleja de la cama/silla caminando al menos 5 metros sin la ayuda de un andador u otra persona |
Escala traducida de la original de Hodgson et al.49, con permiso de la autora, siguiendo las recomendaciones de expertos para que el instrumento sea equivalente a nivel semántico, conceptual, de contenido técnico y de criterio en distintos idiomas. En proceso de validación y adaptación transcultural por el equipo investigador de este manuscrito.
Tampoco queda muy definido en los protocolos de dichos estudios, en qué variables se basan los equipos interprofesionales para decidir el grado de movilización que se puede aplicar al paciente9.
Por todo ello, tiene poco sentido implementar un protocolo de movilización precoz en una UCI que no tenga integrada en su práctica diaria el manejo protocolizado de la sedación, dolor y delirio, así como protocolos de control de la hiperglucemia actualizados según las últimas recomendaciones22,23.
ObjetivoEvaluar el nivel de implementación de los protocolos asociados a la prevención de la DAU así como la presencia de la fisioterapia en distintas UCI de España.
MetodologíaEstudio descriptivo, transversal realizado en UCI de adultos de España entre los meses de marzo a junio de 2017. Se incluyeron 86 UCI de las 229 UCI (37,5%) que habitualmente participan en el registro ENVIN-HELICS (proyectos bacteriemia Zero y/o neumonía Zero), programa de referencia a nivel nacional para evaluar acciones implementadas en las UCI, habiendo excluido de este censo las UCI de grandes quemados y neuroquirúrgicas por no considerarlas en el presente estudio ya que la indicación de movilización en estos pacientes difiere notoriamente dadas sus características clínicas específicas.
Con el fin de evaluar la variabilidad en la implementación de los protocolos entre las UCI, la Sociedad Española de Enfermería Intensiva y Unidades Coronarias (SEEIUC) promovió el proyecto para que se incluyeran el máximo número de autonomías, así como diferentes tipos de hospitales y unidades. Se registraron datos relacionados con recursos humanos disponibles para movilizar pacientes (ratios enfermera/paciente y h con/de fisioterapia en la unidad) y variables cualitativas para analizar cómo se implementan las recomendaciones de las últimas guías clínicas para el manejo de la sedoanalgesia y delirio24,25. Se diseñó un aplicativo online, al que tenía acceso el investigador principal de cada unidad participante en el estudio mediante usuario y contraseña (una enfermera por UCI) con preguntas de opción multirrespuesta y, en algunas, posibilidad de texto abierto (tabla 2). Previamente, se realizó una prueba piloto para evaluar su viabilidad, validez facial y fiabilidad intraobservador mediante test-retest.
Variables del estudio relacionadas con la prevención del síndrome post-UCI
| Tipo de protocolo | Tipo de respuesta |
|---|---|
| Análisis de glucemia | |
| Implementado | Sí/no |
| Incluye rango objetivo glucémico | Sí/no |
| Rango objetivo glucémico | 80-110 mg/dl |
| 110-140 mg/dl | |
| 140-180 mg/dl | |
| Tipo de muestra para análisis de la glucemia | Venosa |
| Capilar | |
| Arterial | |
| Medio para analizar glucemia | Glucómetro pie de cama (marca comercial) |
| Analizador de gases | |
| Evaluación de la sedación | |
| Implementado | Sí/no |
| Incluye rango objetivo de sedación | Sí/no |
| Con rangos de sedación | Una vez al día |
| Según necesidad del paciente | |
| Protocolo multidisciplinar (con algoritmos para dosificar analgésicos y sedantes dirigidos de forma autónoma por la enfermera) | Sí/no |
| Protocolo interrupción diaria de la sedación | Sí/no |
| Frecuencia de evaluación de la sedación | No se evalúa |
| Cada 24h | |
| Cada 8h | |
| Cada 6 h | |
| Cada 4h (respetando descanso nocturno) | |
| Otros (texto abierto) | |
| Profesional que monitoriza / registra grado de sedación | Enfermera |
| Médico | |
| Ambos | |
| Escala utilizada para monitorizar el grado de sedación | Ninguna |
| RASS | |
| SAS | |
| Ramsay | |
| Otras (texto abierto) | |
| Valoración del dolor | |
| Escala para monitorizar el grado de dolor | EVN |
| ESCID | |
| Otras (texto abierto) | |
| Evaluación del delirio | |
| Implementación del protocolo para la prevención del síndrome confusional agudo (SCA) | Sí/no/no se aplica |
| Implementación del protocolo para el manejo del SCA | Sí/no/no se aplica |
| Implementación protocolo para promover descanso y sueño | Sí/no/no se aplica |
| Descripción de medidas no farmacológicas implementadas (opción multirrespuesta) | Reorientación en tiempo, persona y espacio |
| Manejo de las condiciones medioambientales | |
| Acercamiento y participación familiar | |
| Combinación de ellas | |
| En caso de no disponer de protocolos, se realiza evaluación rutinaria del delirio | Sí/no |
| Si se realiza evaluación rutinaria, en qué se basa | Según signos y síntomas |
| Escala validada (por ejemplo CAM-ICU o ICDSC) | |
| Datos que se registran en la historia clínica del paciente relacionados con el delirio | Fármacos administrados |
| Actividades enfermeras para prevenir/manejar delirio | |
| Fármacos y actividades | |
| Resultado CAM-ICU | |
| Resultado CAM-ICU y fármacos | |
| Resultado CAM-ICU, fármacos y actividades | |
| Movilización precoz | |
| Implementado | Sí/no |
| Incluye movilización precoz del 2.° al 5.° día | Sí/no |
Las variables categóricas se expresaron en frecuencia y porcentaje, utilizándose el test de Fisher o ji cuadrado para la comparación entre los grupos. Los resultados de las variables cuantitativas se expresaron con media y desviación estándar (DE) o mediana y rango intercuartílico, dependiendo de la normalidad, y los grupos se compararon mediante el test t de Student o la prueba U de Mann-Whitney, respectivamente. La correlación entre variables cuantitativas se analizó mediante el coeficiente de Pearson o Rho de Spearman, en función de la distribución de los datos. Un P-valor inferior a 0,05 fue considerado estadísticamente significativo. El análisis se efectuó con el software SAS1 9.2 (SAS Institute, Cary, NC, EE. UU.).
Aspectos éticosSe siguieron las recomendaciones recogidas en la Declaración de Helsinki de 1964 y el Convenio de Oviedo de 1997, la Ley de 15/1999 regulación del tratamiento automatizado de los datos de carácter personal. Se asignó un código a cada hospital, generado por el investigador coordinador del estudio, que fue puesto en conocimiento solo del investigador principal del centro asegurando la confidencialidad y anonimato de los datos. Para la realización del estudio se obtuvo la aprobación por parte de todos los Comités de Ética de Investigación Clínica de los centros participantes.
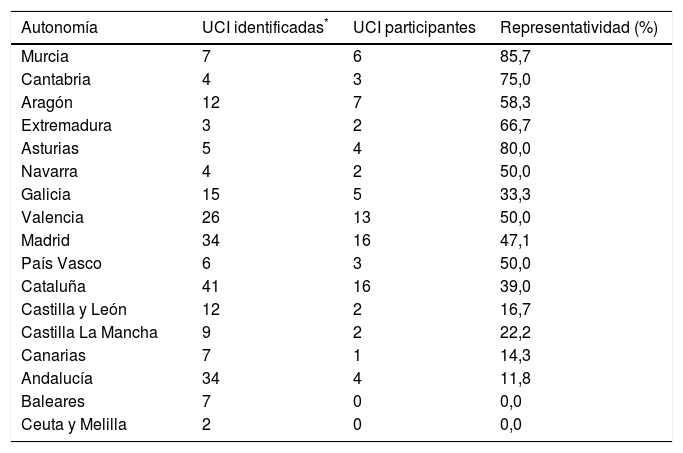
ResultadosLas autonomías más representadas fueron la región de Murcia, Asturias y Cantabria y las menos Canarias y Andalucía, sin representación en Baleares, Ceuta y Melilla (tabla 3).
Representatividad de las unidades encuestadas según autonomía
| Autonomía | UCI identificadas* | UCI participantes | Representatividad (%) |
|---|---|---|---|
| Murcia | 7 | 6 | 85,7 |
| Cantabria | 4 | 3 | 75,0 |
| Aragón | 12 | 7 | 58,3 |
| Extremadura | 3 | 2 | 66,7 |
| Asturias | 5 | 4 | 80,0 |
| Navarra | 4 | 2 | 50,0 |
| Galicia | 15 | 5 | 33,3 |
| Valencia | 26 | 13 | 50,0 |
| Madrid | 34 | 16 | 47,1 |
| País Vasco | 6 | 3 | 50,0 |
| Cataluña | 41 | 16 | 39,0 |
| Castilla y León | 12 | 2 | 16,7 |
| Castilla La Mancha | 9 | 2 | 22,2 |
| Canarias | 7 | 1 | 14,3 |
| Andalucía | 34 | 4 | 11,8 |
| Baleares | 7 | 0 | 0,0 |
| Ceuta y Melilla | 2 | 0 | 0,0 |
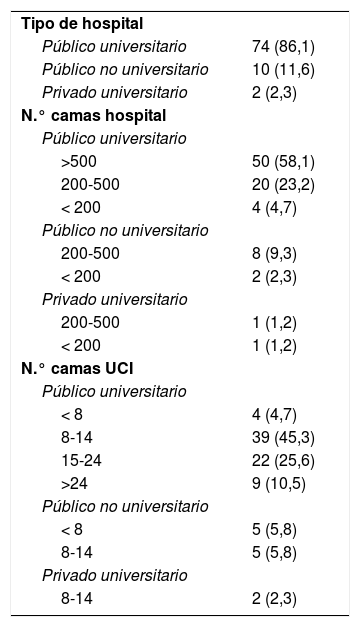
De las 86 UCI participantes en el estudio, 84 (97,7%) pertenecían a hospitales públicos, 76 (88,4%) estaban ubicadas en hospitales universitarios de los cuales 50 disponían de más de 500 camas (tabla 4). Predominaron las UCI de tipo polivalente (75,6%), con solo 7% de UCI quirúrgicas-reanimación, 5,8% exclusivamente médicas y 4,7% coronarias y de cirugía cardíaca, respectivamente. Las UCI especializadas en traumatología fueron las que tuvieron menor representación (2,3%). El tamaño de UCI más frecuente fue entre 8 y 14 camas, tratándose en un 36,1% de UCI con más de 14 camas (tabla 4).
Características de los hospitales y unidades incluidas en el estudio (n, %)
| Tipo de hospital | |
| Público universitario | 74 (86,1) |
| Público no universitario | 10 (11,6) |
| Privado universitario | 2 (2,3) |
| N.° camas hospital | |
| Público universitario | |
| >500 | 50 (58,1) |
| 200-500 | 20 (23,2) |
| < 200 | 4 (4,7) |
| Público no universitario | |
| 200-500 | 8 (9,3) |
| < 200 | 2 (2,3) |
| Privado universitario | |
| 200-500 | 1 (1,2) |
| < 200 | 1 (1,2) |
| N.° camas UCI | |
| Público universitario | |
| < 8 | 4 (4,7) |
| 8-14 | 39 (45,3) |
| 15-24 | 22 (25,6) |
| >24 | 9 (10,5) |
| Público no universitario | |
| < 8 | 5 (5,8) |
| 8-14 | 5 (5,8) |
| Privado universitario | |
| 8-14 | 2 (2,3) |
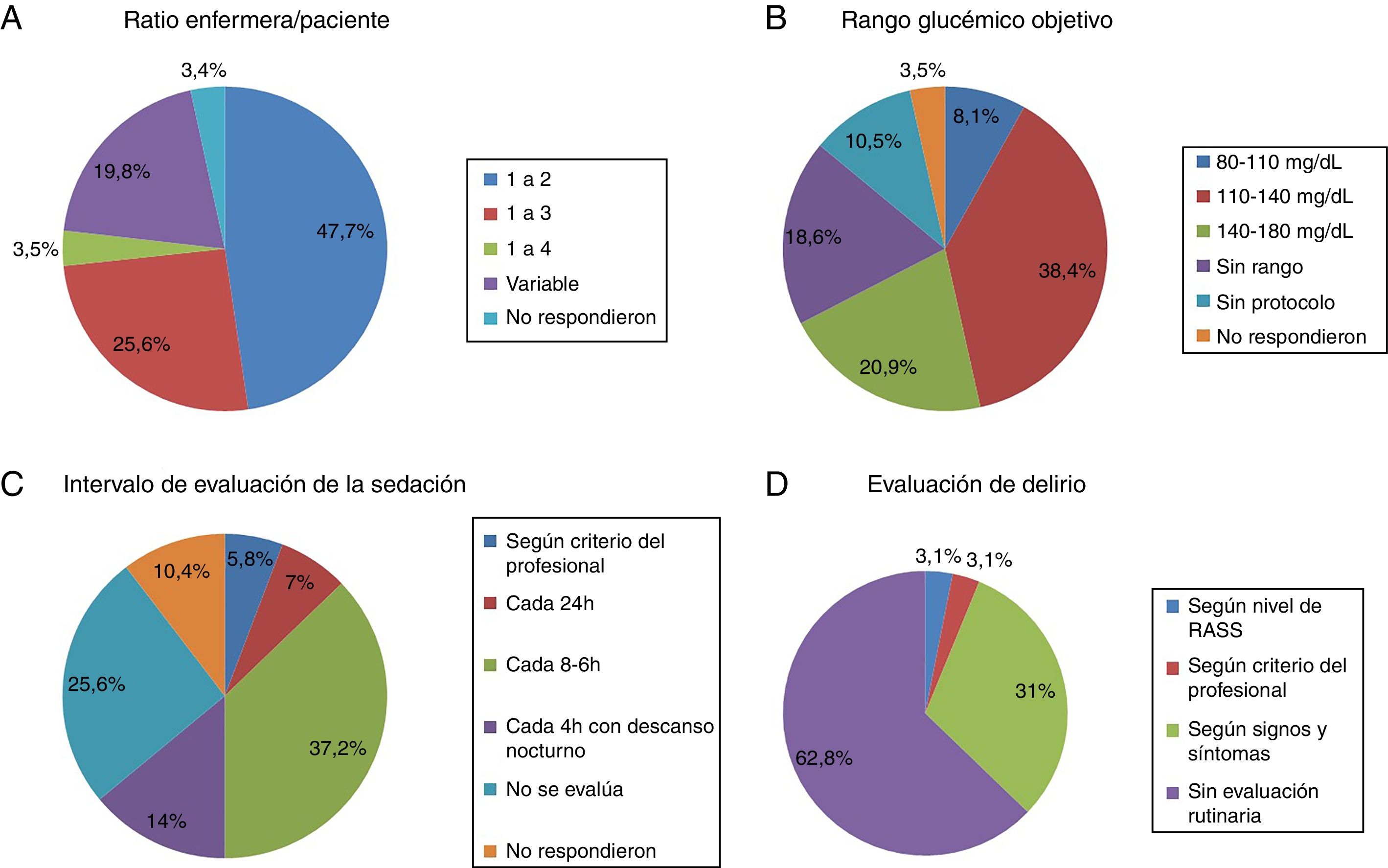
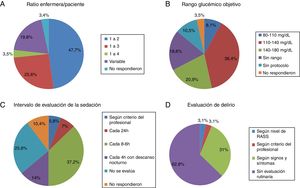
El ratio enfermera-paciente más común fue de 1:2 en el 47,7% de las UCI (fig. 1A). En otras varía en función del turno (día, noche y fin de semana) o de la zona de la UCI en la que se ubican las enfermeras, principalmente en unidades con cuidados semicríticos. El ratio 1:3 es más habitual en hospitales no universitarios que universitarios pero sin diferencia significativa (18 [24%] vs.4 [50%], p=0,2).
Servicio de fisioterapiaEl 18,6% de las UCI no disponían de un fisioterapeuta como parte del equipo de UCI, 10,5% disponían de menos de 5h fisioterapeuta a la semana, 12,8% lo tenían entre 5 y 10 h, 10,5% entre 10 y 15 h, 8,1% 20 h y solo 4,6% más de 24 h. El 34,9% restante tenían fisioterapeuta mediante interconsulta con el servicio de rehabilitación.
Aunque el tiempo disponible de fisioterapia en unidades ubicadas en hospitales no universitarios era menor respecto a los universitarios, esta diferencia no resultó significativa (8,75h vs. 3,20h, diferencia de la media 5,5h IC 95% [-3,8-14,9]). El mayor número de h de fisioterapia en algunas unidades no se relaciona con un mayor número de camas (r = 0,2, p= 0,08).
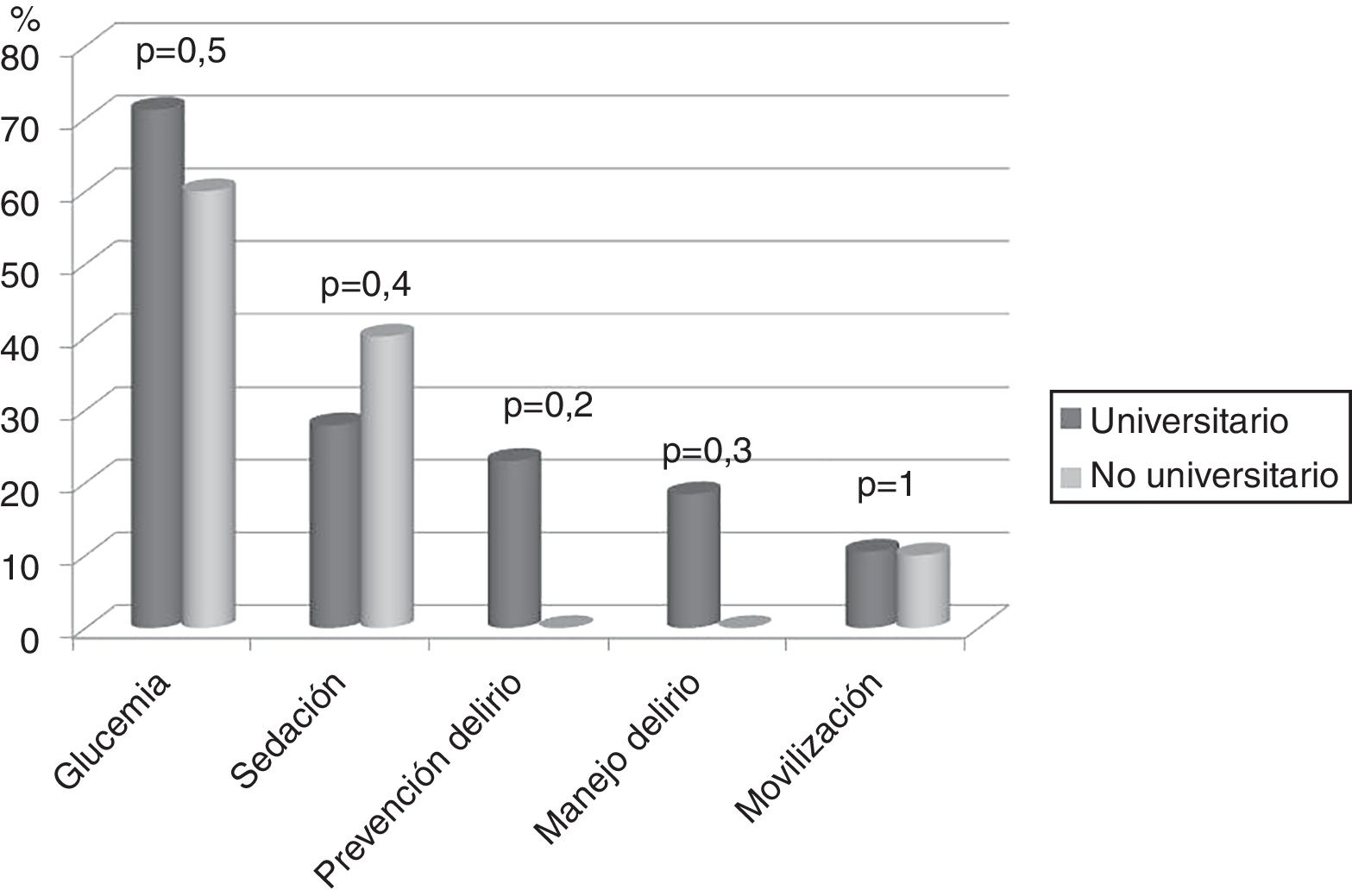
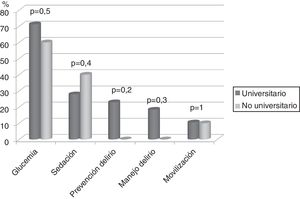
En 74 (86%) UCI no se disponía de un protocolo de movilización, sin diferencias entre hospitales universitarios respecto a los no universitarios. Además en 3 (3,5%) de las UCI con protocolo, ese no contemplaba la movilización precoz, es decir, durante los 5 primeros días de ingreso en UCI. Tampoco hay diferencias entre tipo de hospital en relación con el resto de los protocolos analizados (fig. 2).
- Análisis de la glucemiaEn cuanto al control de la glucemia, 9 (10,5%) UCI no disponían de protocolo y de las que lo tenían, predominaba el rango objetivo de 110-140mg/dl (fig. 1B).
En 74 (86%) de las unidades analizan la glucemia mediante muestra de sangre capilar y el 80 (93%) con glucómetro a pie de cama, siendo las marcas comerciales más habituales Accu-Chek® (23,3%), Freestyle® de Abott (12,8%), True Result® de Medical (7%) y Nova Pro® de Menarini (5,8%). Un 3,5% usaba StataStrip® de Novabiomedical.
Evaluación de la sedaciónEn 55 (64%) de las UCI no se disponía de ningún protocolo de sedación y, entre estas, 22 (81,5%) unidades no prescribían un rango óptimo de sedación. Entre las UCI que aplicaban protocolos de sedación, solo en 13 unidades (15%) era multidisciplinar y disponía de algoritmos para guiar la analgosedación de forma autónoma por las enfermeras, mientras que 10 unidades (11,6%) aplicaban interrupción diaria de la sedación.
En 22 UCI (25,6%) no se controlaba el nivel de sedación. En las UCI que evaluaban regularmente la sedación había mucha variabilidad en el intervalo de valoración (fig. 1C). La escala más usada para evaluar la sedación es Richmond Agitation-Sedation Scale (RASS) (56 UCI, 65,1%), seguido con diferencia por Ramsay (10, 11,6%) y Sedation-Agitation Scale (SAS) (2, 2,3%). En 11(12,8%) UCI no usan ningún tipo de escala para evaluar la sedación.
En la mayoría de las UCI la valoración de la sedación la hace la enfermera, siendo significativa la comparación con las UCI en las que lo hace el médico (45 [52,3%] vs. 9 [10,5%], p<0,001). En 15 (17,4%) unidades la comparten indistintamente ambos profesionales.
Valoración del dolorLa valoración del dolor se aplicaba mediante la Escala Visual Numérica (EVN) para pacientes comunicativos en 59 (73,7%) de las unidades, mientras que la monitorización del dolor en pacientes no comunicativos se hacía solo en 38 (47,5%) unidades, mediante la Escala de Conductas Indicadoras de Dolor (ESCID).
Evaluación del delirioRelacionado con el screening del delirio, solo en 32 (37,2%) unidades se evaluaba a todos los pacientes, aunque con bastante disparidad en el criterio (fig. 1D).
En 22 (68,8%) unidades utilizaban una escala validada, Confusion Assessment Method for the Intensive Care Unit o Intensive Care Delirium Screening Checklist (ICDSC), aunque solo 7 (31,8%) de las unidades respondieron que registraban los resultados de la evaluación.
En 59 (68,6%) unidades no disponían de protocolos para prevenir el delirio ni, tampoco para manejarlo una vez instaurado en 63 (73,3%) UCI. De las unidades con protocolos de prevención y manejo del delirio, 5 (7,8%) y 3 (4,6%), respectivamente, reconocieron no aplicarlo. Independientemente de si se disponía o no de protocolos para prevención y/o manejo del delirio, se aplicaban intervenciones no farmacológicas por parte de las enfermeras en 29 (33,7%) de las UCI.
De ellas, predominan (56 unidades, 65,1%) la combinación de reorientación en tiempo, persona y espacio junto al manejo de las condiciones medioambientales estresantes (luces, alarmas, ruidos, etc.) y/o acercamiento y participación familiar (p. ej. más tiempo con el paciente). En 9 (10,5%) de las unidades se potencia más la presencia de la familia junto al paciente que otras medidas no farmacológicas.
En 61 (70,9%) de las unidades no se disponía de un protocolo para fomentar el descanso y sueño de los pacientes y, entre las que sí lo tenían, una UCI reconoció no aplicarlo.
DiscusiónLa representatividad de las UCI encuestadas en el estudio es óptima, tal y como aporta el intervalo de confianza. La aplicación de protocolos para promover la movilización precoz y el tiempo de fisioterapeuta disponible en la unidad no depende de si el hospital es universitario o no, aspecto que difiere de los resultados de la reciente encuesta internacional de Morandi et al. sobre la implementación del bucle ABCDEF26 (A y B: despierto y respirando, C: elección de sedantes y analgésicos; D prevención del delirio; E: movilización precoz; F: empoderamiento de la familia) en la que se aplicaba más en hospitales no universitarios.
Recursos humanosRelacionado con el principal factor de riesgo para el desarrollo de DAU, el encamamiento8, los recursos humanos para movilizar son dependientes de la organización interna del servicio y del equipo interprofesional. Según Morandi26, aunque preguntó exclusivamente a médicos, ninguna UCI en España aportó una ratio de 1:1, mientras que a nivel internacional había un 11% de UCI con esta ratio, y durante el día predominaba la ratio 1:2 con un aumento notable del 1:3 y 1:4 durante la noche. En España la ratio solo es variable en el 20% de las unidades, en función del turno de trabajo o si incluyen pacientes semicríticos, en el resto es fijo. Eso implica que la gestión de las cargas de trabajo puede promover la movilización si es equilibrada y dinámica siempre dependiendo de cómo se adjudiquen las responsabilidades. Cuando más aumenta la ratio enfermera-paciente menores son los cuidados que se prestan a los pacientes, por ejemplo en la ventilación mecánica no invasiva27, relación que no se ha estudiado en los ensayos clínicos sobre la movilización precoz y que es dependiente de qué profesional se responsabiliza de liderar la movilización. En algunos estudios el fisioterapeuta evalúa el paciente y guía la movilización en función de esta valoración pero cuentan con personal suplementario (celadores o auxiliares de enfermería) para llevar a término los ejercicios activos28,29. En otros, son los fisioterapeutas que movilizan conjuntamente con la enfermera responsable del paciente, sin recursos añadidos, pues el fisioterapeuta y/o terapeuta ocupacional forman parte del staff habitual de la unidad y su presencia en ella es a tiempo completo21,30,31. En la encuesta de Morandi26 preguntaban si la unidad disponía de un equipo de movilización, y los médicos encuestados en Europa respondieron que disponían del mismo en un 34% de las unidades. Esa definición de equipo incluía tres modalidades distintas: fisioterapeuta, fisioterapeuta y enfermeras, fisioterapeuta junto a fisioterapeuta respiratorio y enfermeras. Como pusieron de relieve Garzón-Serrano et al.32, los fisioterapeutas consiguen grados más elevados de movilización que las enfermeras, más conservadoras en cuanto a las capacidades funcionales de los pacientes. Esa diferencia se debe a las responsabilidades inherentes a cada profesional, pues la enfermera valora globalmente al paciente y le preocupa la posible inestabilidad hemodinámica mientras que el fisioterapeuta se focaliza más en la valoración musculoesquelética y el riesgo de contracturas.
Claramente como describieron McWilliams28, Stiller33 y Hodgin34, las funciones y presencia del fisioterapeuta es altamente variable entre países. En España el 65,1% de las unidades disponen de fisioterapeuta mediante interconsulta al médico rehabilitador, lo que puede retrasar el inicio de la movilización, dejando de ser pues, precoz, dentro los 5 primeros días de ingreso en UCI, y más cuando el 86% de las UCI encuestadas no han implementado un protocolo de movilización.
Control de la glucemiaEn relación a la hiperglucemia, otro factor de riesgo de DAU identificado en diversos estudios sobre la movilización precoz11,12, destacar que en España la aplicación de protocolos de control de la glucemia es evidentemente más óptima comparado con los de movilización, pues disponen de ellos casi el 60% de las UCI con un rango glucémico adecuado según las últimas recomendaciones35,36, entre 110 y 180mg/dl. Diversos estudios coinciden en no recomendar un rango estricto de glucemia, 80-110mg/dl37, como ya hizo en su día el estudio pionero NICE SUGAR38 que no consiguió replicar los buenos resultados obtenidos por Van den Berghe39 en cuanto a disminución de infecciones, requerimientos de transfusión, incidencia de insuficiencia renal y polineuropatía. Precisamente se atribuyó esta poca reproducibilidad a la falta de estandarización en la medida de la glucemia. Actualmente los expertos desaconsejan usar la sangre capilar para el análisis de la glucemia en el paciente crítico porque sobrestima la glucemia en la mayoría de los casos debido a la insuficiente circulación periférica relacionada con administración de vasopresores22,40,41, además de los microhematomas que causa la punción repetida en las falanges distales, una fuente más de dolor para el paciente crítico. Aun así, en España la utilizan el 86% de las unidades, lo cual es preocupante porque además se analiza con glucómetros a pie de cama en el 93% de ellas, a pesar de la evidencia actual de que los glucómetros habituales para el control de la glucemia en el paciente no hospitalizado no son fiables para monitorizar la glucemia en el paciente crítico42. En pacientes anémicos tienen poca fiabilidad dichos glucómetros, porque no corrigen automáticamente el sesgo en la glucemia causado por el hematocrito, siendo la anemia una condición común en el paciente crítico, con incidencia del 90% en pacientes con solo 72h de estancia en UCI, aumentando al 98% el octavo día de ingreso43. Si tenemos en cuenta que actualmente se recomienda no trasfundir hasta niveles de hemoglobina inferiores a 7g/dl44 podríamos afirmar que la anemia convive sin duda con el paciente crítico. StatStrip® (Nova Biomedical, Waltham, MA) es el único glucómetro reconocido por la agencia de calidad de los Estados Unidos23 como apto para evaluar la glucemia en el paciente crítico y en nuestro estudio indicaron usarlo solo el 3,5% de las UCI. En segunda opción, serían de elección los glucómetros que usan deshidrogenasa glucosa, Accu-Chek® (Roche) y Hemocue® (HemoCue Inc) porque interfieren con menos sustancias, que tiene ya un uso más prevalente, en el 23,3% de las unidades.
Control de la analgosedaciónEn cuanto a los protocolos que se aplican en las UCI relacionados con la movilización, el de sedación es imprescindible dado que condiciona el grado de cooperación del paciente con el ejercicio. Es necesaria la sedación moderada, definida en la bibliografía mediante un rango óptimo de RASS entre -2 a 024 por lo que se deduce que deben aplicarse escalas para monitorizar el nivel de sedación, siendo inexistentes todavía en el 12,8% de las unidades, y en el 11,6% usan una escala no recomendada, la escala de Ramsay, que no permite evaluar el nivel de ansiedad-agitación, la otra cara de la sedación subóptima. A pesar de ello, nuestra práctica es mejor comparado con la media europea26 (RASS 65 vs. 48%, Ramsay 12 vs. 31%) y Bélgica45 en particular, donde el uso de la escala Ramsay en el año 2014 era del 64%.
Evidentemente, un protocolo debe regular la frecuencia de valoración y en consecuencia, el ajuste de dosis de fármacos analgésicos y sedantes pero el 64% de las UCI en España no tienen protocolo de sedación (el 51% en Europa) y de las unidades que lo aplican, solo el 15% es multidisciplinar con algoritmos, es decir, dinámico, y en el 11,6% mediante interrupción diaria de la sedación, siendo este último porcentaje una cuarta parte respecto Europa26. Por el momento no se ha demostrado que una práctica sea superior a la otra ni tampoco que se aplique más una que otra24 pero analizando los resultados de este estudio, en el que, con diferencia claramente significativa, la valoración de la sedación la lleva a término la enfermera, es de suponer que sería más dinámico un protocolo dirigido por enfermeras que una interrupción diaria de la sedación bajo prescripción médica. El estudio de Sneyers et al.45 realizado en Bélgica, usaba protocolos de sedación dinámicos en el 33% de los pacientes comparado, según datos de su estudio, con Inglaterra (80%) y Estados Unidos (71%). Los autores de este estudio concluyeron que es incoherente el uso de escalas si no se aplican protocolos dinámicos, pues aumenta el riesgo de demora en el tratamiento óptimo del nivel de sedación. Además, si los protocolos de sedación no empoderan a las enfermeras (mayor autonomía para el manejo de fármacos en función de los valores aportados por las escalas de sedación) con el tiempo se aplican menos dichas escalas. Es comparable a pedir que se mida la glucemia de forma horaria sin disponer de un protocolo de glucemia para regular la dosis de insulina.
Además, los protocolos dinámicos regulan la administración de analgésicos, no siendo siempre así en la interrupción diaria de la sedación, pues tal y como aportó el estudio belga45, solo el 42% de los profesionales encuestados evaluaban el dolor durante la ventana de sedación y lo hacían principalmente guiándose por los cambios en las constantes vitales o en el comportamiento. Solo usaban escala el 11% de las unidades, porcentaje claramente superior en nuestro estudio, tanto en pacientes comunicativos como no comunicativos, aunque debería mejorarse principalmente en estos últimos, a pesar de que ambas están por encima de la media europea aportada en el estudio de Morandi26 (74 vs. 58% y 47 vs. 10%, respectivamente).
Control del riesgo de delirioComo bien expone Latronico46 «el dolor persistente es el mayor problema para los pacientes que sobreviven a la patología crítica, por lo que evaluar el dolor en estos pacientes es fundamental», y así lo han consensuado los expertos en rehabilitación del paciente crítico15, y más cuando el dolor es uno de los factores de riesgo de desarrollo de delirium13,14, el otro gran enemigo de la movilización, a su vez relacionado con los tipos de fármacos sedantes que se administran (las benzodiacepinas se relacionan con más incidencia de delirio comparado con la dexmedetomidina o el propofol) y el tipo de analgésico (a mayor dosis de opiáceos mayor incidencia de delirio comparado con los antiinflamatorios no esteroideos o paracetamol) así como el nivel de implementación de medidas no farmacológicas (reloj visible, luz natural, uso de audífonos y gafas, presencia de la familia, tapones para oídos y antifaz para facilitar el sueño)14,24.
El RASS ha demostrado una buena correlación con la escala Confusion Assessment Method for the Intensive Care Unit por lo que debería guiar a qué pacientes es necesario evaluar por posible delirio24. Debería monitorizarse una vez por turno y/o cuando RASS +1 a +4, práctica que solo se realiza en una de las 86 UCI encuestadas, otras (31%) se guían por la presencia de signos y síntomas de delirio, poco específica porque las constantes vitales no determinan diferencias entre niveles de sedación47, lo que podría enmascarar el delirio hipoactivo.
La ausencia de protocolos tanto para la prevención como el manejo del delirio, alrededor del 70%, es similar a la media europea26, hecho que no fomenta el uso de escalas validadas para evaluar la presencia del delirio, sorprendentemente infrautilizadas en España comparado con Europa (26 versus 90%) a pesar de la misma falta de protocolos. En cambio, dicha ausencia no impide la aplicación de las medidas no farmacológicas (34 versus 20-30%), a pesar de que según la evidencia actual no está demostrada su efectividad14 pero que son básicas para conciliar el sueño y más teniendo en cuenta que, a pesar de no encontrar diferencias entre el día y la noche en cuanto a episodios de agitación, Burk et al.48 sí observaron que el primer episodio suele darse entre las 20-24 h.
LimitacionesNo se ha podido contrastar las respuestas efectuadas por las enfermeras comparando con una recogida de datos en pacientes. En algunos casos se puede afirmar que se evalúa una escala y realmente no aplicarla en el día a día. Se podría haber profundizado en el papel del fisioterapeuta en la UCI (tiempo para cada paciente, tareas de las que se responsabiliza) pero el objetivo del estudio se centró más en evaluar los cuidados enfermeros relacionados con la DAU. Para evitar la duplicidad de respuestas de la misma unidad, situación probable en la difusión de encuestas online siendo causa de sesgo de selección, se limitó el acceso a una enfermera por unidad mediante contraseña. En consecuencia, esto provocó poca representatividad de algunas autonomías, en las que no conseguimos contactar con investigadores interesados.
Las decisiones e intervenciones clínicas para prevenir la DAU deben ir acompañadas del empoderamiento de las enfermeras en el buen control de los factores de riesgo asociados a la misma, como son: el control glucémico, la adecuación de las dosis analgosedantes, la prevención y tratamiento precoz del delirio, mediante la implementación de protocolos multidisciplinares, que permitan contar con un fisioterapeuta en el equipo para guiar el grado de movilización acorde a las capacidades funcionales del paciente.
ConclusionesLa implementación de los diferentes protocolos asociados a la prevención de la debilidad muscular adquirida ha sido elevada en relación con los protocolos de control de glucemia, valoración del nivel de sedación y del dolor de pacientes comunicativos, mientras que baja en los de movilización precoz y screening y prevención del delirio. Asimismo, es poco frecuente la presencia del fisioterapeuta en la UCI.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A la Sociedad Española de Enfermería Intensiva y Unidades Coronarias (SEEIUC) que ha actuado como promotora del estudio a nivel nacional.
Este manuscrito ha recibido el Premio a Trabajo de Investigación IX Certamen de Fisioterapia de San Juan de Dios, Universidad Pontificia de Comillas, Madrid.