La debilidad adquirida en la unidad de cuidados intensivos (DAU) es desarrollada por el 40-46% de los pacientes ingresados en UCI. Diferentes estudios han mostrado que la movilización temprana (MT) es segura, factible, costo-efectiva y mejora los resultados del paciente a corto y largo plazo.
ObjetivoDiseñar un algoritmo de MT para el paciente crítico en general y enumerar unas recomendaciones para la MT en subpoblaciones específicas de paciente crítico con más riesgo para la movilización: neurocrítico, traumático, sometido a terapias continuas de depuración renal (TCDR) y con dispositivos de asistencia ventricular (DAV) o membrana de oxigenación extracorpórea (ECMO).
MetodologíaRevisión en las bases de datos Medline, CINAHL, Cochrane y PEDro de estudios publicados en los últimos 10 años, que aporten protocolos/intervenciones de MT.
ResultadosSe incluyeron 30 artículos. De ellos, 21 eran para guiar la MT en el paciente crítico en general, 7 en pacientes neurocríticos y/o traumáticos, uno en pacientes portadores de TCDR y uno en pacientes portadores de ECMO y/o DVA. Se diseñan 2 figuras: una para la toma de decisiones teniendo en cuenta el bundle ABCDEF y la otra con los criterios de seguridad y objetivo de movilidad para cada uno.
ConclusionesLos algoritmos de MT aportados pueden promover la movilización precoz (entre el 1.er y 5.o día de ingreso en UCI), junto a aspectos a tener en cuenta antes de la movilización y criterios de seguridad para suspenderla.
Intensive care unit (ICU)-acquired weakness is developed by 40%-46% of patients admitted to ICU. Different studies have shown that Early Mobilisation (EM) is safe, feasible, cost-effective and improves patient outcomes in the short and long term.
ObjectiveTo design an EM algorithm for the critical patient in general and to list recommendations for EM in specific subpopulations of the critical patient most at risk for mobilisation: neurocritical, traumatic, undergoing continuous renal replacement therapy (CRRT) and with ventricular assist devices (VAD) or extracorporeal membrane oxygenation (ECMO).
MethodologyReview undertaken in the Medline, CINAHL, Cochrane and PEDro databases of studies published in the last 10 years, providing EM protocols/interventions.
Results30 articles were included. Of these, 21 were on guiding EM in critical patients in general, 7 in neurocritical and/or traumatic patients, 1 on patients undergoing CRRT and 1 on patients with ECMO and/or VAD. Two figures were designed: one for decision-making, taking the ABCDEF bundle into account and the other with the safety criteria and mobility objective for each.
ConclusionsThe EM algorithms provided can promote early mobilisation (between the 1st and 5th day from admission to ICU), along with aspects to consider before mobilisation and safety criteria for discontinuing it.
La debilidad adquirida en la unidad de cuidados intensivos (DAU) es común en los supervivientes de enfermedades críticas. Este síndrome consiste en la atrofia y/o pérdida de masa muscular como consecuencia de una miopatía, polineuropatía o ambas a la vez, sin otra etiología explicativa que la propia patología crítica, y que empieza a las 24h de ingreso en UCI para seguir progresando1. Entre sus factores de riesgo destacan: sepsis, fallo multiorgánico, ventilación mecánica (VM), inmovilización e hiperglucemia2,3. Varios estudios muestran que la DAU es desarrollada en el 40-46% de los pacientes ingresados en la UCI4,5. El desarrollo de DAU se asocia con peores resultados a corto y largo plazo, incluyendo dificultad o fallo en el destete, aumento de días de ingreso en UCI y hospital, aumento de la mortalidad y un peor estado funcional con discapacidad persistente en las actividades de la vida diaria, que puede incluso llegar a permanecer 5 años después del ingreso. Además, este hecho aumenta los costos de atención sanitaria y deteriora la calidad de vida de los pacientes6,7.
Por otro lado, para su prevención y tratamiento, numerosas investigaciones han descrito el beneficio de los programas de movilización precoz en los pacientes ingresados en las UCI8–16.
Aunque no hay consenso en la definición de movilización temprana (MT)17, se considera aquella actividad física de aplicación intensa y precoz, entre el 2.o y 5.o día de ingreso en UCI18,19, y así lo han considerado la mitad de los estudios que la han definido20. Dichos estudios han mostrado que la MT es segura, factible, costo-efectiva y mejora los resultados del paciente a corto y largo plazo10,16,21–25. Además, la más reciente guía clínica que aborda la MT26 indica que esta fortalece los músculos al alta de UCI y disminuye los días de VM, y recomienda implementar la MT en un paquete o conjunto de medidas, conocidas como el ABCDEF bundle (acrónimo en inglés de A y B: despierto y respirando; C: elección de sedantes y analgésicos; D prevención del delirio; E: movilización precoz; F: empoderamiento de la familia) el cual constituye una guía basada en la evidencia para implementar algoritmos de sedación, prevención-manejo del delirio y MT26.
Justificación de la necesidad de elaborar una guía de movilización temprana (MT)A pesar del conocimiento de los efectos nocivos de la inmovilidad y de los amplios beneficios de la MT, como se ha comentado previamente, esta no es una práctica integrada en el cuidado diario. Solo un 14% de las 86 UCI de España encuestadas tenían implementados protocolos o algoritmos de MT27. Esto puede estar condicionado por la existencia de diferentes barreras entre las que destacan el déficit de conocimientos por parte del personal y la variabilidad en los cuidados, miedo a las caídas, dolor durante la movilización, la inestabilidad fisiológica del paciente, la sobresedación, la falta de recursos humanos y técnicos y la escasez de tiempo, la insuficiente colaboración entre el equipo interprofesional y la ausencia de protocolos específicos23,28–32.
Además, en nuestro entorno hay poca presencia del fisioterapeuta en las UCI27,33 y a nivel geográfico la formación y competencias de los fisioterapeutas son muy variables33–37.
En este sentido, la European Respiratory Society y la European Society of Intensive Care Medicine Task Force on Physiotherapy for Critically Ill Patients recomiendan desarrollar guías clínicas de fisioterapia, identificar las características de los pacientes que son susceptibles de este tratamiento y aumentar la conciencia entre los profesionales de los efectos nocivos de la inmovilidad y de los beneficios de la MT14.
De acuerdo con todo lo anterior, el objetivo general de este trabajo es elaborar una guía de MT para ser implementada en la práctica diaria de las UCI, con la finalidad de incrementar la actividad física de los pacientes: levantarse y salir de la cama.
Como objetivos específicos se plantean:
- 1.
Proponer instrumentos validados para medir el grado de movilización conseguido por el paciente y evaluar su capacidad funcional.
- 2.
Identificar los pacientes con más riesgo de DAU.
- 3.
Diseñar un algoritmo de MT para el paciente crítico en general.
- 4.
Enumerar unas recomendaciones para la MT en subpoblaciones específicas de paciente crítico con más riesgo para la movilización: neurocrítico, traumático, sometido a terapias continuas de depuración renal (TCDR) y con dispositivos de asistencia ventricular (DAV) o membrana de oxigenación extracorpórea (ECMO).
Profesionales que atienden al paciente crítico: enfermeras, médicos (intensivistas, anestesistas, rehabilitadores), fisioterapeutas y terapeutas ocupacionales.
Población de estudioPacientes ingresados en UCI polivalentes, médicas, de cirugía cardiaca y/o coronarias, quirúrgicas, traumáticas, reanimación posquirúrgica y unidades de semicríticos.
No se consideran en esta guía los pacientes en fase de rehabilitación, ingresados en unidades de larga estancia o en hospitalización, aunque provengan de la UCI.
Recursos utilizadosSe llevó a cabo una revisión bibliográfica, que se completó en fecha 1 de diciembre de 2019. Se tuvieron en cuenta los siguientes criterios:
- -
de inclusión: paciente crítico, ingresado en UCI de agudos, estudios que aporten un algoritmo/guía/protocolo/intervenciones de MT;
- -
de exclusión: estudios centrados únicamente en terapias de rehabilitación como el uso de la electroestimulación o intervenciones de movilización en pacientes al final de la vida.
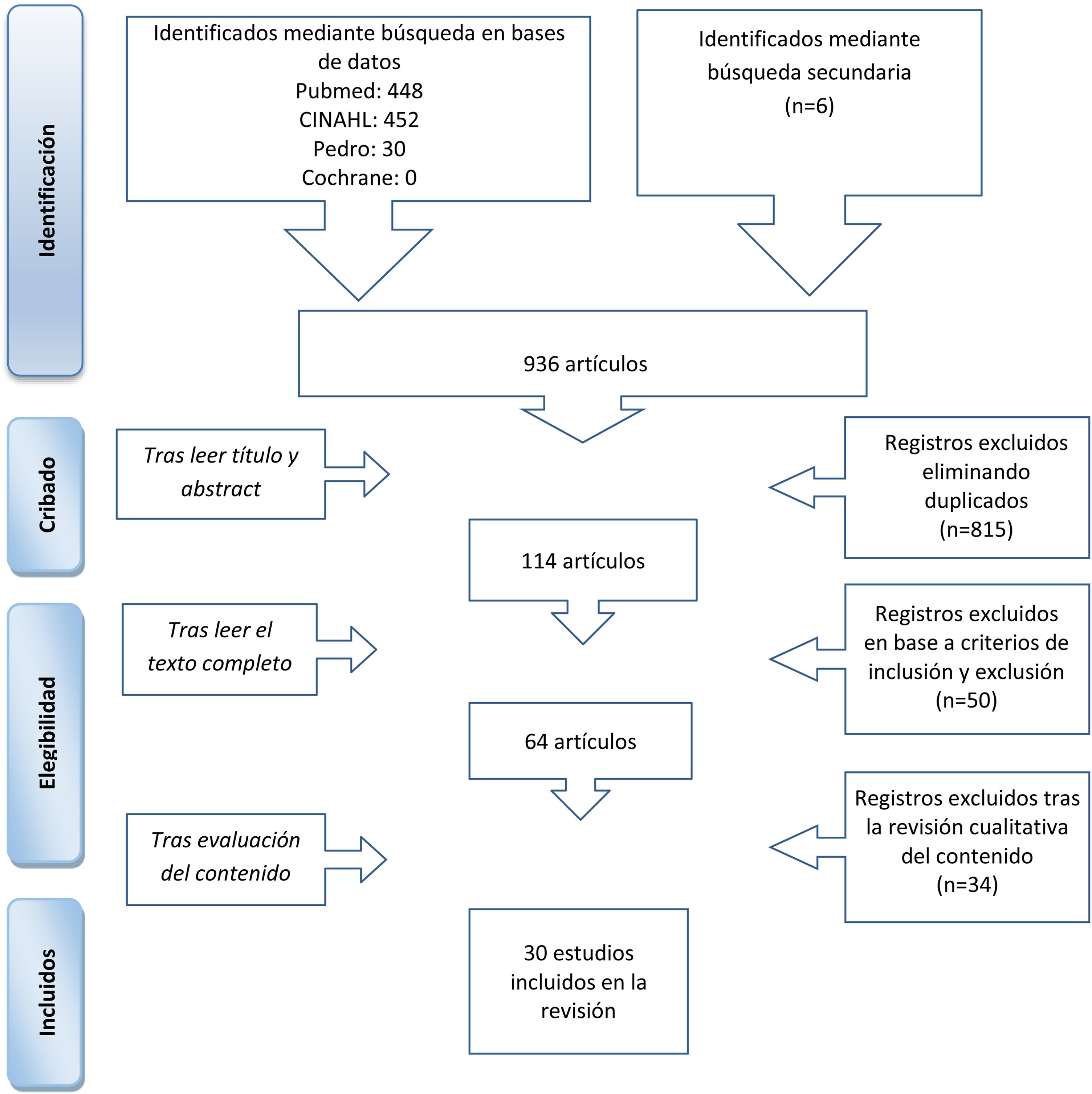
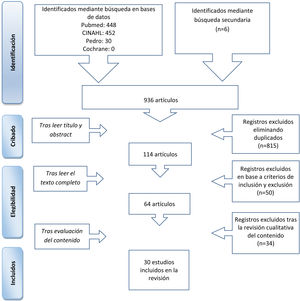
Las bases de datos consultadas fueron Medline (vía PubMed), CINAHL, PEDro y la Cochrane Library. El proceso de selección de artículos se muestra en el diagrama de flujo (fig. 1).
Los límites utilizados fueron artículos publicados los últimos 10 años (2009-2019), el idioma (inglés y español), seleccionando para adultos de 19 años o más.
Los siguientes términos MeSH fueron utilizados para la búsqueda de literatura científica relacionada en las bases de datos Medline (PubMed), CINAHL y la Cochrane Library: «rehabilitation», «exercise therapy», «early ambulation», «intensive care units», «critical care». En la base de datos PEDro los términos fueron los siguientes: «rehabilitation», «exercise therapy», «early ambulation», «early mobilizationͭ», «intensive care units», «critical care». En ambos casos se combinaron con los booleanos AND y OR.
Adicionalmente, se realizó una búsqueda inversa a partir de las referencias bibliográficas de los estudios seleccionados que, junto con otras fuentes no identificadas a partir de la revisión, constituyen los artículos citados como revisión secundaria en la figura 1.
Análisis de los resultadosLos resultados obtenidos fueron analizados de forma independiente por 5 de los autores de esta revisión (MRT, ERM, BPP, JDM y GZE), teniendo en cuenta los objetivos del estudio y los criterios de inclusión y exclusión.
Además, se realizó una revisión cualitativa del algoritmo/protocolos/intervenciones de MT o precoz que aportaban los estudios seleccionados, con los siguientes criterios:
- -
Variables recomendadas para guiar el nivel movilización: consciencia y función física.
- -
Uso de aparatos de soporte a la movilización.
- -
Tiempos recomendados para cada actividad de fisioterapia.
Se incluyeron 30 artículos que aportaban algún algoritmo, protocolo o intervenciones de MT, que dieran respuesta al objetivo de este trabajo. De ellos, 21 eran para guiar la MT en el paciente crítico en general, 7 en pacientes neurocríticos y/o traumáticos, uno en pacientes portadores de terapia continua de remplazo renal (TCDR) y uno en pacientes portadores de ECMO y/o dispositivo de asistencia ventricular (DAV) (tabla 1 del material adicional).
Niveles de evidencia de los estudios seleccionadosDe los 30 estudios incluidos, como se muestra en la tabla 1 del material adicional, 10 generan evidencia niveles 1A y 1B (ensayos clínicos aleatorizados), 17 proporcionan evidencia niveles 2B, 2C y 2D (estudios de cohortes, de casos y controles o estudios pre-post), 2 nivel 3D (informes de casos) y uno nivel 4D (opinión de expertos).
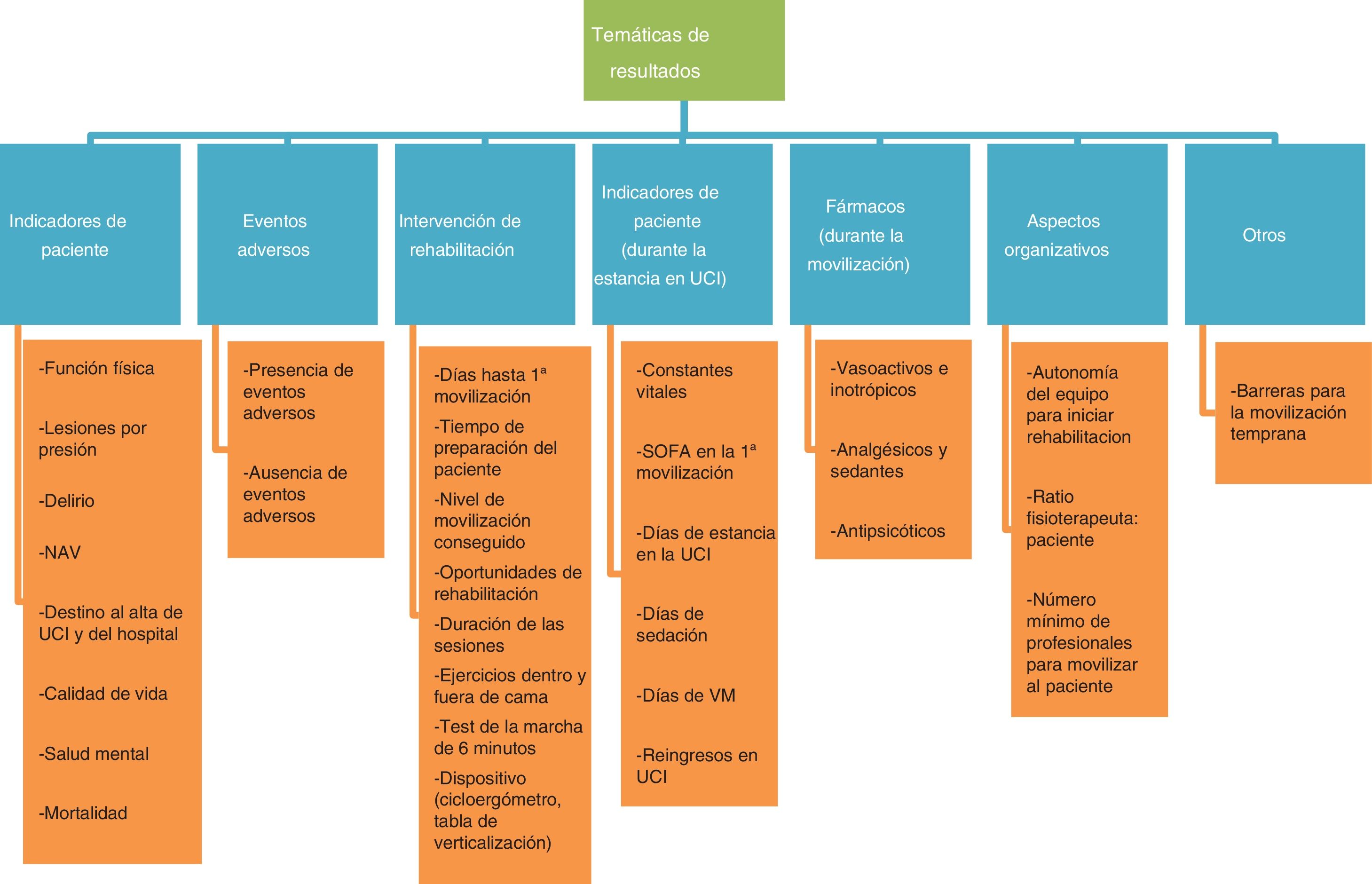
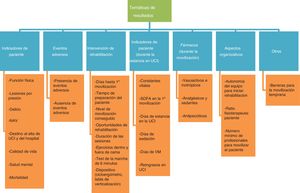
Variabilidad de los resultadosLa heterogeneidad de los resultados encontrados en la literatura actual impide la comparación de los estudios. La figura 2 muestra dicha variabilidad, agrupada en 7 temáticas distintas.
Por otra parte, a pesar de las ventajas de la MT descritas anteriormente, según la evidencia disponible, no implica cambios en la calidad de vida, mortalidad en el hospital o cambios en la salud física. No se puede evaluar si tiene efectos en la función cognitiva, salud mental o capacidad para retorno al trabajo, por insuficiencia de datos26. Así mismo, la última revisión Cochrane aporta resultados similares: falta de evidencia para determinar si la MT mejora las actividades de la vida diaria, fortaleza muscular o calidad de vida38.
Instrumentos validados para medir el grado de movilización conseguido por el paciente y evaluación de su capacidad funcionalLos instrumentos se clasifican en los que miden la masa muscular (antropometría, bioimpedancia, ultrasonografía), la debilidad muscular (testado manual del músculo con Medical Research Council-Sum score [MRC-SS] o dinamómetro) y la función física, siendo esta dimensión la que tiene más instrumentos desarrollados, pero pocos adecuadamente validados. Destacan como mejores por sus cualidades psicométricas la Chelsea critical care physiotherapy (CPAx), Physical Function in Intensive Care Test (PFIT) y la ICU Mobility Scale (IMS)39.
Por un lado, para evaluar la debilidad muscular, tanto el testado manual del músculo como el dinamómetro requieren de la cooperación del paciente. La escala más usada para el testado manual es la MRC-SS. Se evalúa la fuerza muscular de 0 (sin contracción muscular) a 5 (máxima contracción). Se examinan 3 grupos musculares en cada una de las extremidades superiores e inferiores, y la puntuación total es sobre 60. Consultar el protocolo de evaluación accesible en https://seeiuc.org/estudio-movipre/, adaptado de Hermans et al.40.
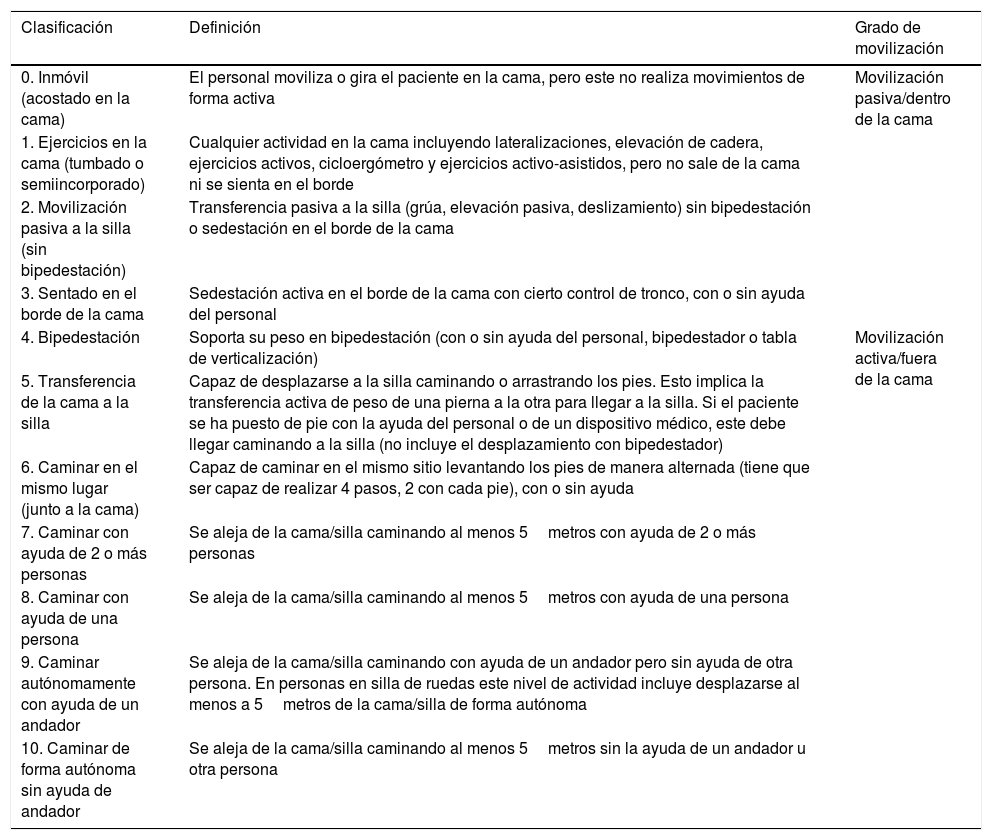
Por otro lado, con relación a la función física, la IMS fue creada para sustituir el test de marcha a los 6 minutos41,42, no aplicable en el paciente crítico, y es la única escala de movilidad diseñada para estandarizar el lenguaje de enfermeras y fisioterapeutas cuando describen la movilización del paciente durante la estancia en UCI43,44.
Es una limitación de muchos estudios que han evaluado la efectividad de la movilización precoz en UCI, no haber usado una escala de movilidad validada para definir los distintos grados de actividad que conseguían los pacientes. En este sentido, la IMS se ha validado a nuestro contexto cultural, siguiendo las recomendaciones de expertos para que el instrumento sea equivalente a nivel semántico, conceptual, de contenido técnico y de criterio en distintos idiomas45 (ver tabla 1).
Escala de Movilidad (IMS-Spain)
| Clasificación | Definición | Grado de movilización |
|---|---|---|
| 0. Inmóvil (acostado en la cama) | El personal moviliza o gira el paciente en la cama, pero este no realiza movimientos de forma activa | Movilización pasiva/dentro de la cama |
| 1. Ejercicios en la cama (tumbado o semiincorporado) | Cualquier actividad en la cama incluyendo lateralizaciones, elevación de cadera, ejercicios activos, cicloergómetro y ejercicios activo-asistidos, pero no sale de la cama ni se sienta en el borde | |
| 2. Movilización pasiva a la silla (sin bipedestación) | Transferencia pasiva a la silla (grúa, elevación pasiva, deslizamiento) sin bipedestación o sedestación en el borde de la cama | |
| 3. Sentado en el borde de la cama | Sedestación activa en el borde de la cama con cierto control de tronco, con o sin ayuda del personal | |
| 4. Bipedestación | Soporta su peso en bipedestación (con o sin ayuda del personal, bipedestador o tabla de verticalización) | Movilización activa/fuera de la cama |
| 5. Transferencia de la cama a la silla | Capaz de desplazarse a la silla caminando o arrastrando los pies. Esto implica la transferencia activa de peso de una pierna a la otra para llegar a la silla. Si el paciente se ha puesto de pie con la ayuda del personal o de un dispositivo médico, este debe llegar caminando a la silla (no incluye el desplazamiento con bipedestador) | |
| 6. Caminar en el mismo lugar (junto a la cama) | Capaz de caminar en el mismo sitio levantando los pies de manera alternada (tiene que ser capaz de realizar 4 pasos, 2 con cada pie), con o sin ayuda | |
| 7. Caminar con ayuda de 2 o más personas | Se aleja de la cama/silla caminando al menos 5metros con ayuda de 2 o más personas | |
| 8. Caminar con ayuda de una persona | Se aleja de la cama/silla caminando al menos 5metros con ayuda de una persona | |
| 9. Caminar autónomamente con ayuda de un andador | Se aleja de la cama/silla caminando con ayuda de un andador pero sin ayuda de otra persona. En personas en silla de ruedas este nivel de actividad incluye desplazarse al menos a 5metros de la cama/silla de forma autónoma | |
| 10. Caminar de forma autónoma sin ayuda de andador | Se aleja de la cama/silla caminando al menos 5metros sin la ayuda de un andador u otra persona |
Como se ha comentado en la introducción, desde el año 2014 se identificaron distintos factores de riesgo asociados a la DAU, como la edad19,46, mayor nivel de dependencia en las actividades de la vida diaria1,19, la hiperglucemia3,46 y la administración de corticoides3,46, pero ninguno de ellos se ha realizado en España, con lo cual se desconoce si existen características específicas de las UCI que puedan repercutir en la incidencia de estos factores, o añadir algunos nuevos, teniendo en cuenta nuestro entorno organizativo y cultural.
Autores del presente manuscrito llevaron a cabo un estudio multicéntrico nacional (MoviPre, Movilización Precoz)47 realizado en 80 UCI de España durante los meses de marzo a julio de 2017. Se incluyeron 642 pacientes (62,1% pacientes médicos, 32,4% pacientes quirúrgicos y 5,5% traumatológicos). Mediante el análisis de regresión logística (para el periodo comprendido entre los días 3.o y 5.o de ingreso, cuando debería llevarse a cabo la MT) se identificaron los siguientes factores de riesgo de desarrollar DAU: mayor edad (OR 1,01 IC 95% [1,00-1,03]) y más días con terapia continua de remplazo renal (TCDR) (OR 1,01 IC 95% [1,00-1,02]). En cambio, protege del desarrollo de DAU ser varón (OR 0,58 IC 95% [0,38-0,89]), mayor puntuación en la escala de Barthel (OR 0,97 IC 95% [0,95-0,99]), más días colaborador para la evaluación de la MRC (OR 0,98 IC 95% [0,97-0,99]) o bien desarrollar delirio hiperactivo (OR 0,98 IC 95% [0,97-0,99]) y más días con movilización activa (IMS≥4) (OR 0,98 IC 95% [0,97-0,99]).
Aspectos a tener en cuenta antes de la movilización (adaptado de Nydahl48)- -
Disponer de un respirador y un monitor portátil, dispositivo de aspiración, oxígeno, balón de resucitación manual (si IMS≥7).
- -
Anticiparse: pensar qué riesgos de seguridad pueden aparecer durante la movilización de este paciente y qué estrategias se deberían tener en cuenta.
- -
Considerar normas de asepsia, en especial con la desconexión de las vías invasivas.
- -
Es recomendable que un intensivista esté cerca.
- -
Comprobar la longitud de los tubos y sistemas de infusión, de acuerdo con el nivel de movilización que se persigue.
- -
Considerar fijaciones para los tubos y sistemas de infusión.
- -
Valorar que las presiones en la vía aérea no sean demasiado altas para tener un margen en caso de que puedan aumentar durante la movilización.
- -
Disponer de una silla cercana para que el paciente se pueda sentar si lo necesita (silla de ruedas).
- -
Considerar los riesgos de seguridad laboral de los profesionales y las estrategias apropiadas para mitigarlas.
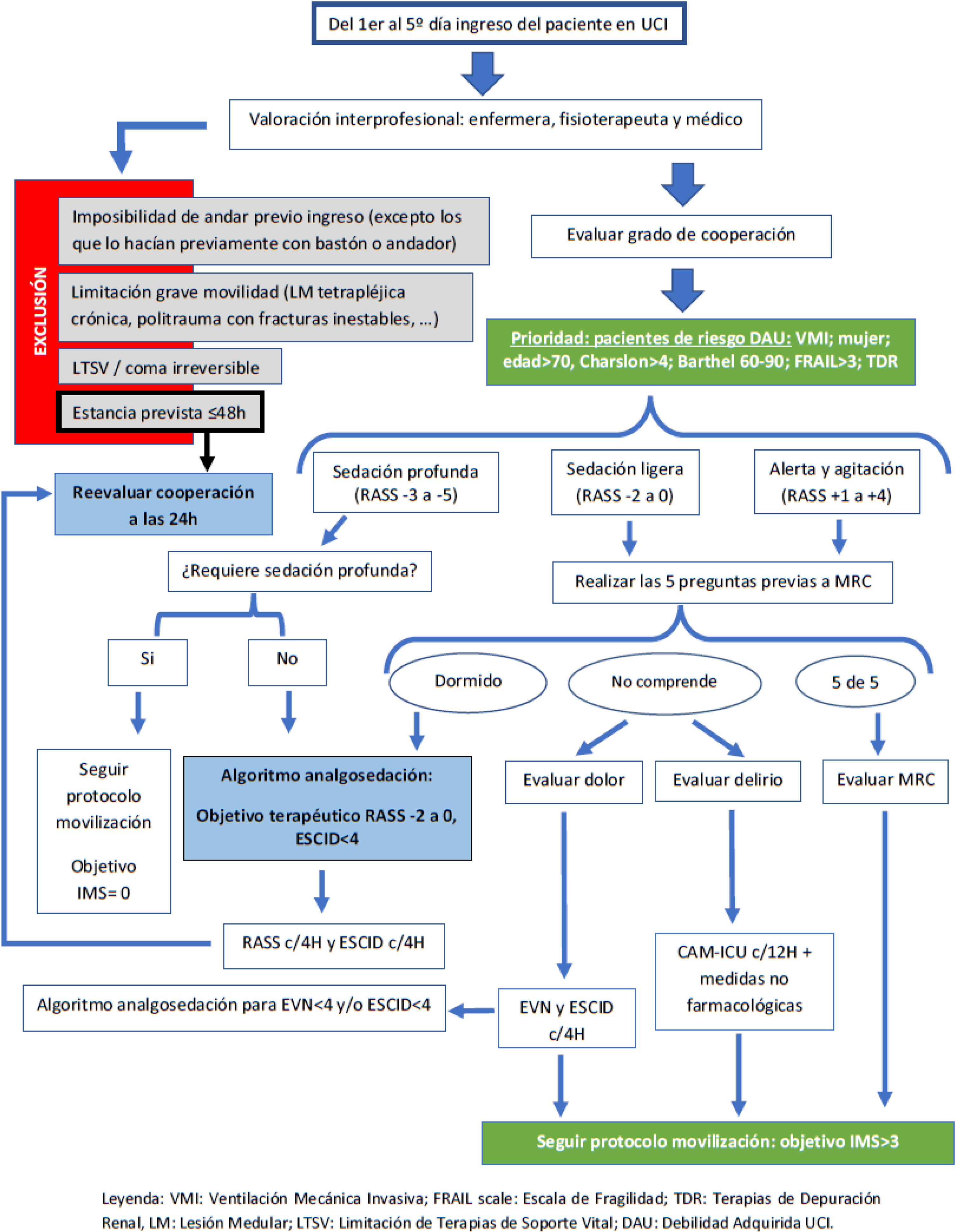
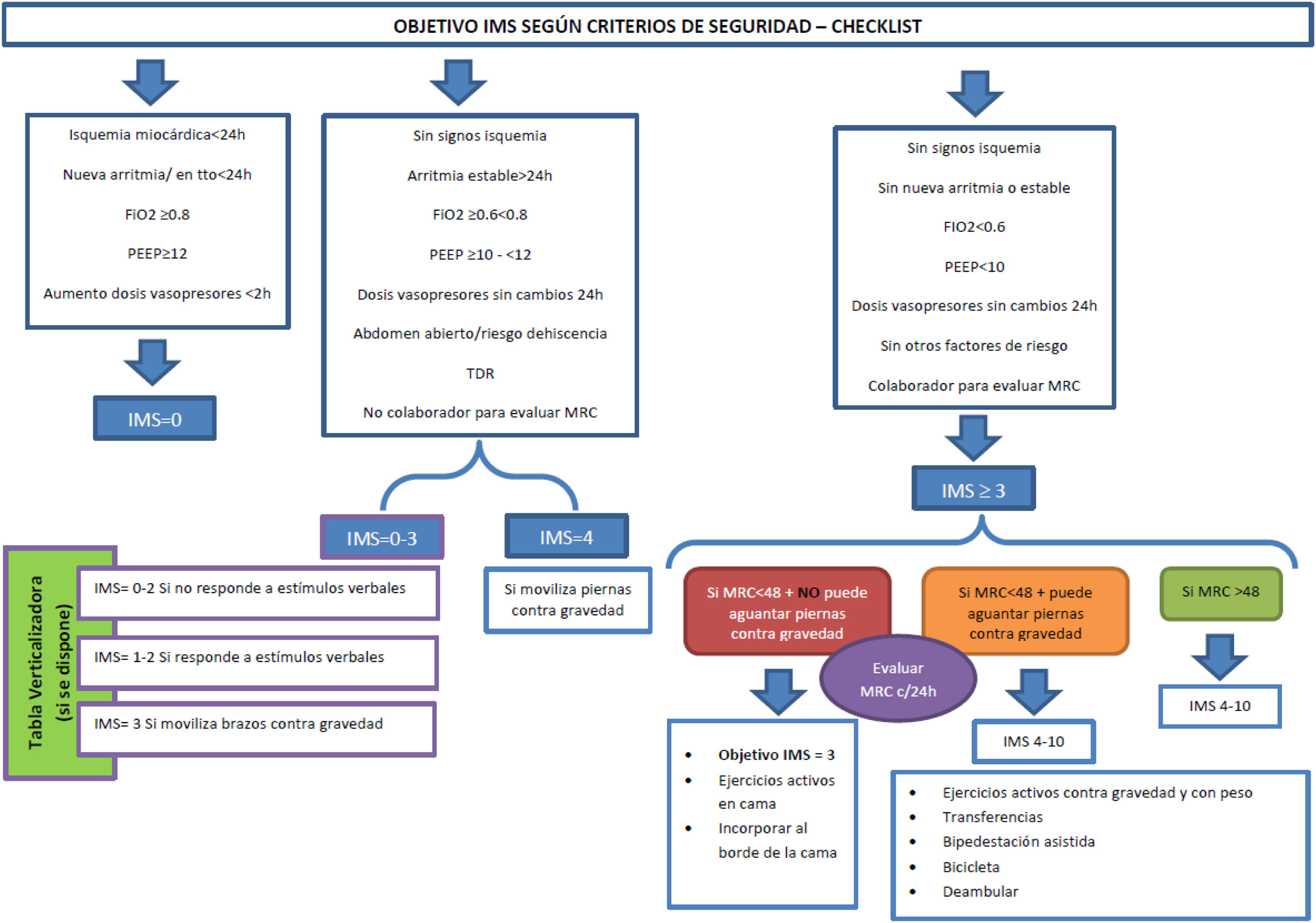
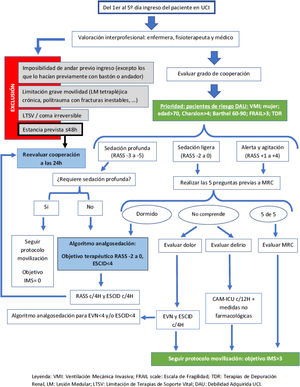
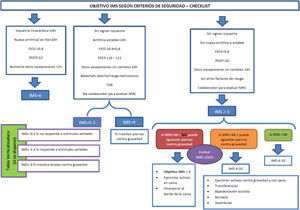
Se aportan la figura 3 (toma de decisiones) y la figura 4 (objetivo IMS conforme a checklist de seguridad).
Criterios de seguridad para suspender la movilización temprana (adaptado de Nydahl48)- -
Desviación de la presión arterial sistólica (PAS)>20%, respecto al basal en reposo.
- -
Frecuencia cardiaca (FC)>200-(edad en años).
- -
Descenso de la saturación de oxígeno>5%, respecto al basal en reposo.
- -
Esfuerzo respiratorio según escala de Borg ≥7 (0=muy fácil, 10=máximo esfuerzo). Primero, tratar de incrementar la presión respiratoria en el ventilador en 4mbar y revalorar; en ausencia de mejora, detener la movilización.
- -
Esfuerzo entrenamiento físico según escala de Borg ≥7 (0=muy fácil, 10=máximo esfuerzo). Primero, intentar reposo corto (p. ej.: sentarse en una silla durante un minuto) y revalorar; en ausencia de mejora, detener la movilización.
Se recomienda que si la terapia es hemodiálisis intermitente se realice la movilización antes o después de la misma. En caso de terapia continua de depuración renal (TCDR) solo puede movilizarse el paciente dentro de la habitación (IMS máxima de 6), por la dificultad de alargar líneas de tratamiento (arterial y venosa) y cables de alimentación del sistema49.
Además, es recomendable no sobrepasar los 90° de flexión de cadera en presencia de catéteres femorales50.
Para pacientes neurocríticos y/o traumáticosSe contraindica IMS>3 en presencia de fracturas inestables y se recomienda IMS<3 si hay inestabilidad de raquis51.
Solo movilizar pacientes neurocríticos que presenten una presión intracraneal<20mmHg de forma mantenida ante la estimulación del paciente52,53 o un Glasgow a la respuesta motora>428.
Son criterios de exclusión para la movilización del paciente neurocrítico: no tolerar el pinzamiento del drenaje ventricular durante un mínimo de 30minutos, presión intracraneal sostenida mayor de 20mmHg o presentar fluctuaciones neurológicas durante el examen previo a la movilización53.
Se proponen las siguientes actividades en función del criterio de restricción de elevar la cabecera28:
Para pacientes neurocríticos con hemorragia subaracnoideaOlkowsky et al.54 proponen los siguientes criterios de inclusión para la movilización temprana en estos pacientes:
- -
Aneurisma resuelto o sin ningún aneurisma subyacente identificado.
- -
Lindegaard ratio ≤3,0 o velocidad media de flujo en arteria cerebral media ≤120cm/s.
- -
Presión arterial media (PAM) entre 80 y 110mmHg.
- -
Frecuencia cardiaca (FC) entre 40 y 130lpm.
- -
Frecuencia respiratoria (FR) ≤40rpm.
- -
Saturación de O2≥88%.
- -
Presión intracraneal (PIC) ≤15mmHg.
- -
Sin evidencia de convulsiones.
- -
Con evaluación neurológica estable.
- -
Con apertura ocular al estímulo verbal.
- -
Con capacidad de movilizar una extremidad ante la orden verbal.
Se modifican los criterios del checklist de seguridad antes de la movilización, conforme a los siguientes criterios de inclusión55:
- -
PaO2/FiO2≥200.
- -
PEEP≤7cmH2O.
- -
Saturación O2<90%.
- -
2 o menos agentes vasoactivos o disminución de las dosis.
- -
Frecuencia cardiaca (FC) entre 60 y 120lpm.
- -
Presión arterial media (PAM) entre 55 y 120mmHg.
- -
Presión arterial sistólica (PAS) entre 90 y 180mmHg.
- -
Frecuencia respiratoria (FR) entre 10 y 30rpm.
Los autores declaran no tener ningún conflicto de intereses.
Este manuscrito ha sido avalado por las siguientes sociedades científicas: Sociedad Española de Enfermería Intensiva y Unidades Coronarias (SEEIUC), Sociedad Española de Medicina Crítica Intensiva y Unidades Coronarias (SEMICYUC) y Sociedad Española de Neumología y Cirugía Torácica (SEPAR).