Se revisan algunos aspectos de la alergia alimentaria y se exponen los problemas que causa la reactividad cruzada entre las proteínas de diferentes alimentos, así como diversas preguntas y sus posibles respuestas.
We review some features of food allergy and discuss the problems caused by cross-reactivity between proteins from distinct foods, as well as common questions and their possible answers.
Elikaduragatiko alergiaren hainbat alderdi aztertzen dira, eta elikagai desberdinen proteinen arteko erreaktibotasun gurutzatuak sortutako arazoak azaltzen dira; era berean, zenbait galdera egiten dira, eta horien erantzun posibleak aztertzen.
La lista de alimentos incriminados en diferentes síndromes clínicos es muy amplia. Sin embargo, la mayoría de las reacciones de hipersensibilidad alérgica alimentarias comprobadas provocaron únicamente síntomas gastrointestinales, cutáneos y respiratorios. El estudio de la hipersensibilidad alimentaria ha estado repleto de confusiones, restricciones dietéticas innecesarias y de errores diagnósticos. La última clasificación de la hipersensibilidad a alimentos respaldada por la WAO en 2003 es la de la Comisión de Nomenclatura de la Academia Europea de Alergia e Inmunología Clínica. Se propone que cualquier reacción adversa a alimentos se defina como hipersensibilidad alimentaria; dentro de estas, las reacciones mediadas por mecanismos inmunológicos se definen como alergia a alimentos (mediadas o no por IgE) y las reacciones no inmunológicas se definen como hipersensibilidad no alérgica a alimentos (previamente conocidas como intolerancia). Esta última puede deberse a1–3: a) intolerancia por deficiencias enzimáticas, como la deficiencia de lactasa (causa más frecuente de reacciones adversas alimentarias), b) reacciones farmacológicas debidas a los constituyentes naturales de los alimentos (aminas vasoactivas, tiraminas de quesos) o a los compuestos añadidos durante su procesamiento o a los contaminantes adquiridos durante su almacenamiento, y c) a que existan reacciones de mediación bioquímica todavía no descubiertas.
Una persona come lo largo de su vida unas 3 toneladas de alimentos diferentes. En condiciones normales el sistema inmune tolera los alimentos y reacciona frente a patógenos, pero puede responder de una forma exagerada frente a antígenos alimentarios. El tracto gastrointestinal es el mayor órgano linfático del organismo. Hasta los 2 años, en que se desarrolla totalmente la barrera intestinal, es posible la absorción de macromoléculas enteras y el sistema linfático puede reconocer epítopos conformacionales. Las barreras inespecíficas son el ácido gástrico, el moco, las enzimas digestivas y el peristaltismo. Las inmunológicas son la IgA e IgM secretoras. Los linfocitos T y B reconocen los antígenos, pero no son capaces de distinguir entre los elementos nocivos y los que no lo son. La clave está en las placas de Peyer. Tienen un centro germinal con células B productoras de IgA. Están rodeadas de células M que transportan los antígenos a las células dendríticas internas que los procesan para presentarlos a las células B. Estas son inducidas a producir IgA por el influjo del TGF-beta producido por las células T y se produce un estado de tolerancia oral. Las células dendríticas son capaces de regular la producción de IgA secretora en el tracto gastrointestinal y suprimir las células T, provocando la tolerancia. Las células epiteliales del intestino realizan la misma función y son capaces de hacer tolerantes a las células dendríticas anulando su capacidad inflamatoria y haciéndolas liberar IL-10 e IL-6, pero no IL-12, provocando una respuesta Th2 de tolerancia. Estas células están muy unidas, pero en caso de inflamación se abren estos espacios y permiten el paso de gran cantidad de antígenos4–7.
La exposición transmucosa con el antígeno da lugar a una respuesta IgE y riesgo de alergia, facilitada por la IL-4. Sin embargo, la IL6 es la crítica en la producción de IgA8.
Epidemiología de la hipersensibilidad alérgicaLa prevalencia de la alergia a alimentos es más alta en la infancia (6-8%) que en la edad adulta, que se estima en un 2% de la población3. El motivo es que es durante los primeros años de vida cuando se introducen la mayoría de alimentos potencialmente alergénicos en la dieta y cuando se establecen los mecanismos de tolerancia inmunológica. Según los datos del estudio multicéntrico español Alergológica3, los principales alérgenos alimentarios en niños son la leche (82%), el huevo (76%) y el pescado (50%). En los adultos, los frutos secos (35%), las frutas frescas (31%), los pescados, los mariscos y el huevo (10%). Sin embargo, estos porcentajes varían según las áreas geográficas determinadas y las costumbres dietéticas. La alta prevalencia de alergia a pescado en España solo es igualada por Japón. En Israel, el tercer alérgeno alimentario más importante es el sésamo, que se incluye tempranamente en la dieta del lactante, y en Italia, los cereales. El cacahuete es el alérgeno más importante en EE. UU., aunque el consumo es igual que en China. Esto es debido a que en China se consume hervido o muy fritos y en EE. UU. tostados, lo que aumenta su alergenicidad. En España son muy importantes las frutas, y sus alérgenos tienen relación con los de los pólenes más predominantes en cada zona.
Métodos diagnósticos en la hipersensibilidad alérgicaEn la alergia alimentaria los datos de la anamnesis, que son tan fundamentales en otras enfermedades para establecer el diagnóstico, se han de confirmar mediante pruebas de provocación alimentaria5. Además deben registrarse los síntomas objetivados, el intervalo transcurrido entre la ingesta del alimento y el inicio de los síntomas, la cantidad de alimento necesaria para producir síntomas y la frecuencia con que esta reacción se ha presentado en el pasado (tablas 1 y 2). Tras la eliminación de la dieta del alimento sospechoso, si los síntomas persisten puede quedar descartado. Si al reinstaurar el alimento en la dieta se repiten los síntomas, es preciso efectuar una prueba de provocación. Las dietas de eliminación no son muy útiles para el diagnóstico si los síntomas son ocasionales o esporádicos. Es mejor que el paciente anote diariamente los alimentos que consume y los relacione con los síntomas, aunque esto es muy tedioso.
En la exploración hay que poner especial cuidado en el estado de la piel y también explorar los aparatos respiratorio y digestivo.
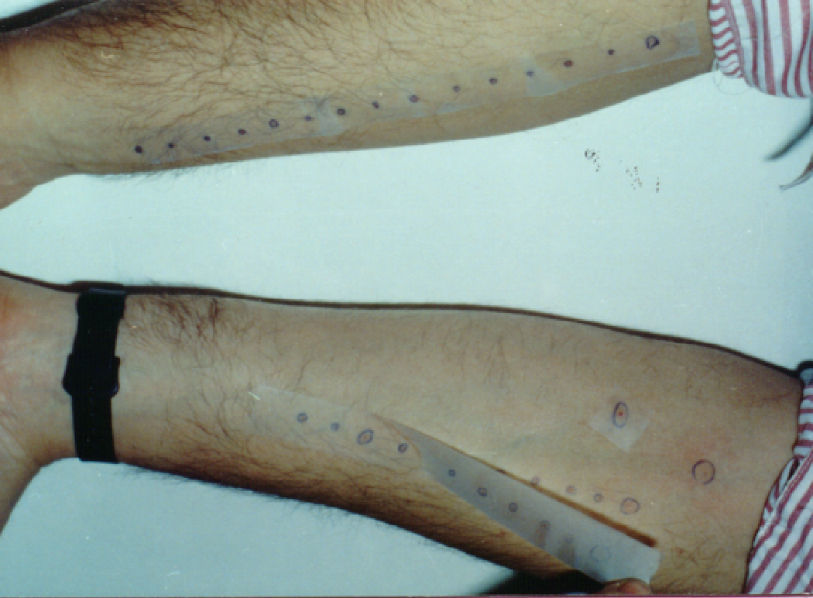
Las pruebas cutáneas son seguras y específicas, con un alto valor predictivo negativo. Miden la activación de los mastocitos cutáneos. Una prueba cutánea negativa prácticamente excluye la sensibilización al alimento, pero una positiva debe supeditarse a los resultados de la provocación. Se pueden realizar en niños menores de 2 años; aunque su sensibilidad es menor, tienen una gran especificidad. La elaboración de los extractos diagnósticos con alimentos complica el diagnóstico. Los alérgenos purificados son mejores que los recombinantes, obtenidos por recombinación de ácidos nucleicos in vitro. Sin embargo estos últimos son reproducibles y fácilmente estandarizables. Además no existen todas las isoformas naturales. Con frutas y vegetales es mejor el prick, teniendo en cuenta que la piel es más alergénica que la pulpa, y que hay diferente alergenicidad entre variedades de la misma especie. También hay que tener en cuenta el procesado del alimento: la manzana, la avellana y el apio pierden su alergenicidad tras calentamiento, pero en el caso del cacahuete, la lenteja o la lapa, la aumentan por la aparición de neoantígenos. Es precisa una correcta caracterización y cuantificación de la actividad biológica de los alérgenos principales. Si la reacción fue de anafilaxia, mejor es evitar las pruebas y medir la IgE específica. La triptasa se eleva a los 60-90 minutos del inicio de la anafilaxia y se mantiene 6h6,7.
Otras pruebas cutáneas son las de parche con alérgenos. No tienen utilidad en la alergia a alimentos mediada por IgE, pero se han utilizado en el diagnóstico de dermatitis tópica por leche, huevo y trigo, en las reacciones tardías a alimentos, sobre todo a trigo, y en esofagitis eosinofílicas. Se pueden encontrar respuestas irritantes8.
Determinación de IgE específicaExiste correlación entre la gravedad de la clínica y la presencia de IgE frente a gran diversidad de epítopos. Es un test altamente sensible y muy rentable con alimentos como leche, huevo, cacahuete y pescado, y más baja para frutas y otros vegetales. .Se han establecido puntos de corte de valores de IgE que se correlacionarían con una positividad en la prueba de provocación y la obviarían. En cuanto a otras técnicas in vitro, no hay ningún análisis que haya logrado sustituir a las pruebas de provocación aunque la detección de IgE específica por CAP es altamente fiable. No sirve de nada la determinación de IgG, IgA o IgM específica. El tests citotóxico (ALCAT) no es reproducible ni avalado por la literatura científica. Otros tests como kinesiología, neutralización, pulso, electrotérmico, no tienen valor3.
Pruebas de provocación controlada con alimentosRecientemente la EAACI ha publicado la guía de la provocación con alimentos, prueba altamente diagnóstica, pero con riesgo. No se debe hacer en caso de anafilaxia o reacción sistémica grave o si la historia es altamente sugestiva, repetida y reciente con estudio alergológico previo concordante. Tampoco se debe hacer en pacientes que no puedan recibir adrenalina, tratados con beta-bloqueantes, IECA, etc. Se precisa dieta de eliminación previa, ingreso y vía.
Prueba labialSe aplica una gota del alimento en la parte interna del labio y se observa lo que pasa a los 15 minutos.
Diagnóstico desglosado por componentes: alérgenos purificadosSon más estables, estandarizables y pueden ser producidos en grandes cantidades. Se han sintetizado más de 40 alérgenos recombinantes. Al probar diferentes proteínas de un alimento, nos ayuda a investigar diferencias geográficas de sensibilización y las reactividades cruzadas, como la alergia tipo ii a alimentos debida a un sensibilizante primario polínico. También descartan sensibilizaciones subclínicas por IgE de baja afinidad debido a reactividades cruzadas.
Diagnóstico desglosado por componentes: epítopos de alérgenosLos pacientes que poseen anticuerpos IgE frente a epítopos secuenciales padecen con más frecuencia alergia persistente al alimento y es más grave que los que responden a epítopos conformacionales que evolucionan a la tolerancia en menos tiempo. Por ejemplo, la presencia de IgE frente a epítopos AA 123-132 de la alfa1 caseína es marcador de persistencia de la hipersensibilidad a la leche.
Paneles dianósticos de alérgenos o epítoposLa aplicación de los ensayos de hibridación de ácidos nucleicos a gran escala (micromatrices o microarrays) ha hecho posible que podamos disponer de chips o paneles de alérgenos o epítopos pegados a una placa de sílice, pudiéndose utilizar miles en un solo ensayo. Esto nos permitiría saber el mapa de sensibilización de un paciente, su relevancia clínica, las posibles reactividades cruzadas y el pronóstico de su enfermedad9–14.
Inmunopatología de la alergia alimentariaEl tracto gastrointestinal forma parte de un sistema inmunológico de musosas (MALT) del que forman parte también los tejidos bronquial, nasofaríngeo, mamario, lagrimal, genitourinario, es decir, todas las vías por donde puede entrar un Ag. En el MALT hay zonas inductoras de facilitación de entrada y procesamiento del Ag y zonas efectoras donde residen los linfocitos B y T.
La entrada normal de macromoléculas está regulada por las células M que cubren las placas de Peyer y muestran el Ag al tejido linfático subyacente. Esta absorción de macromoléculas permite en los recién nacidos el paso de proteínas maternas como las inmunoglobulinas y factores de crecimiento beneficiosos. Pero si en un adulto la barrera se deteriora, el paso de estas proteínas puede tener consecuencias clínicas. Se ha visto un aumento de permeabilidad del MALT en asmáticos, por ello se considera que en la alergia alimentaria unida a asma hay un fallo general del MALT. La mayoría de las macromoléculas son absorbidas en el intestino delgado y presentadas a los linfocitos T y B en ausencia de células dendríticas, siendo inhibida la activación del linfocito T y produciéndose una tolerancia. Pero si las proteínas escapan a la digestión y alcanzan el íleo terminal, son procesadas por las células dendríticas tras su paso a través de las células M, con lo que el linfocito T recibe señales de activación, se activan en las placas de Peyer y viajan a través de los folículos linfoides a la circulación general. De ahí, los linfocitos migran a los órganos diana del MALT, donde reciben un trofismo específico determinado genéticamente por el que se van a asentar en los órganos efectores correspondientes a las zonas inductoras donde inicialmente respondieron al antígeno, dando lugar a las diferentes formas clínicas. Una vez allí, cada vez que se produzca la llegada del Ag, los linfocitos T y B asentados liberarán sus mediadores inflamatorios15–20.
Panalérgenos vegetales: aplicación clínica de la caracterización y purificación de alérgenos vegetalesLas proteínas de plantas presentes en alimentos se pueden clasificar en 3 grupos21–25:
- 1.
Proteínas de reserva: se acumulan sobre todo en las semillas de plantas superiores.
- 2.
Proteínas estructurales, catalíticas y reguladoras, que se sintetizan en pequeñas cantidades en respuesta a factores ambientales. En ellas se incluyen las profilinas, la beta-fructofuranosidasa en tomate y la glixalasa i del arroz.
- 3.
Proteínas de defensa: frente a invasiones de patógenos y plagas (virus, bacterias, hongos, insectos, nematodos).
Su función es el suministro de nutrientes durante la germinación. Se clasifican en 2 superfamilias: prolaminas y cupinas, con secuencias de aminoácidos muy diferentes, pero que comparten dominios conformacionales. Alguna de estas proteínas se emplea en el procesado de productos alimenticios con el fin de conferirles propiedades de viscosidad, tensoactivas, etc., por lo que pueden encontrarse en alimentos sin etiquetar. Las fuentes de proteínas de reserva son los cereales, las legumbres, los frutos secos y las especias.
Superfamilia de las prolaminasSon proteínas de gran importancia en el procesado de alimentos. Incluye 2 grupos: las prolaminas propiamente dichas (en harinas y cereales) y las albúminas.
ProlaminasSon proteínas insolubles en agua, ricas en aminoácidos prolina y glutamina. Pueden causar alergia por inhalación por harina en asma del panadero o por ingestión (con clínica de dermatitis atópica o anafilaxia inducida por el ejercicio). Aunque en el asma del panadero están involucradas esencialmente enzimas inhibidoras de α-amilasa, acil-CoA oxidasa, peroxidasa y otras enzimas, también se ha demostrado la implicación de diferentes tipos de gliadinas. En anafilaxia inducida por el ejercicio y dependiente de la ingestión de trigo está demostrada su asociación a la gliadina26, de 53 KDa, proteína recientemente clonada y secuenciada, con notable identidad con las α-secalinas de arroz y la hordeína de la cebada. Se ha demostrado reactividad cruzada entre estos alérgenos y la gliadina omega-5 que se activa en el intestino durante el ejercicio formando grandes complejos de alérgeno capaces de producir reacción anafiláctica. La gliadina omega-5 es un alérgeno mayoritario en niños con alergia inmediata tras la ingestión de trigo.
Albúminas 2SSon proteínas solubles con coeficiente de sedimentación de 2. Son alérgenos mayoritarios de las leguminosas, frutos secos y especias y son el grupo más conocido de la familia de las prolaminas, com PM de 10-14 KDa y 90 a 135 aminoácidos. Son ricas en aminoácidos nitrogenados (glutamina y arginina) y sulfurados (cistina) para suministrar nitrógeno, azufre y carbono durante la germinación. Contienen mucha metionina, por lo que se utilizan en biotecnología para mejorar las propiedades nutricionales de otras semillas como la soja. Actúan en la defensa frente a bacterias grampositivas, hongos, inhibidores de serín-proteasas y actividad antagonista de la calmodulina. Las albúminas 2S pueden acceder al organismo por ingesta de la semilla o por inhalación de la harina obtenida en su molturación. Son alérgenos relevantes en la alergia causada por mostaza, cacahuete, nuez del Brasil, nuez inglesa, pipas de girasol, sésamo, guisante, almendra, avellana, anacardo, soja y col. También tienen albúminas 2S la colza y las semillas de algodón, causando alergia ocupacional. Las albúminas 2S son codificadas por familias multigénicas, por eso tienen un gran polimorfismo y en una misma semilla las hay parecidas pero no idénticas. Se han descrito más de 15 albúminas 2S, en más de 10 especies vegetales. El alérgeno más conocido es el Sin a 1 de la mostaza amarilla (Sinapsis alba). Las mostazas tienen gran proximidad filogenética porque pertenecen ambas a la familia Brassicaceae (nabos, rábanos, coles, coliflor y brócoli) por lo que hay reactividad cruzada entre ellas. Otras albúminas 2S, como las del ricino, cacahuete o girasol, tienen baja reactividad cruzada por la gran diferencia entre las regiones hipervariables. El plegamiento conformacional de las albúminas 2S es similar a las LTP, inhibidores de α-amilasa/tripsina de cereales y la proteína hidrofóbica de soja. Las albúminas 2S son muy estables ante tratamientos térmicos y enzimas proteolíticas, pues son compactas y con muchos puentes disulfuro, por lo que alcanzan el epitelio gastrointestinal de forma intacta e interaccionan con los lípidos que facilitan su absorción.
Familia de las cupinasPresentan dominios característicos de «barril beta» tipo cupina. Se encuentran en numerosas mono y dicotiledóneas. Tienen 3 tipos de proteínas: globulinas 11S o leguminas, 7S o vicilinas y germinas. Se han encontrado en soja, cacahuete, nuez, almendra, trigo, lenteja, guisante, pimienta, mostaza y naranja.
Las germinasTienen gran solubilidad, carácter glucoproteico y estabilidad frente a agentes desnaturalizantes como tratamientos térmicos y enzimas proteolíticas. Se sintetizan en paredes celulares de embriones de cereales y se expresan en etapas tempranas de su germinación. Aparecen en plantas adultas tras la agresión por agentes biológicos o ambientales (ayuno, calor, deshidratación). La GPL de pimienta es el primer miembro de una nueva familia de defensa de plantas: la PR-16.
Las cupinasPueden producir radicales peróxido, con actividad catalítica. La GLP del trigo y de la arabidopsis son alergénicas, como la de la naranja.
Leguminas (globulinas 11S) y vicilinas (globulinas 7S)Tienen un PM de 300-450 KDa, por ensamblaje de 2 dímeros. Los monómeros de 30-40 KDa contienen una estructura en barril beta. Solo se ha encontrado un miembro glucosilado en el lupino. Las vicilinas tienen poca similitud con las leguminas, pero su estructura tridimensional es similar. Se han descrito leguminas en la soja (glicinas g1 y g2), en los frutos secos, como el cacahuete (Arah3), nuez del Brasil (Ver e2), avellana (Cor a9), anacardo y mostaza, y podrían ser importantes en la nuez, coco, sésamos y almendra. Se ha encontrado reactividad cruzada entre leguminas de la soja y el cacahuete.
Tanto las leguminas como las supinas tienen labilidad térmica, pero el tostado aumenta la alergenicidad del cacahuete.
ProfilinasSon proteínas citosólicas de 14 KDa que son básicas para la formación del citoesqueleto de las plantas. Constituyen una familia de panalérgenos altamente conservada (más del 70% de homología de secuencia entre sus miembros), responsable de la cosensibilización entre pólenes y plantas. Resisten la temperatura pero son fácilmente atacadas por proteasas digestivas, y por ello producen síntomas locales y leves (SAO). La prevalencia de IgE frente a profilinas suele ser de un 20-30%, pero son mayoritarios en soja, naranja y melón.
Proteínas de defensaLas plantas representan el grupo más importante de organismos autotróficos y durante toda su vida son base alimentaria de organismos heterotróficos, que incluyen animales, insectos y microorganismos (hongos, bacterias y virus). Para contrarrestrar su ataque, han desarrollado mecanismos químicos, estructurales y metabólicos. Cuando una planta es atacada hay un mecanismo de localización rápida de las células dañadas (equivalente a una respuesta de hipersensibilidad), se acumulan sustancias antimicrobianas y se producen proteínas relacionadas con la patogénesis cuya síntesis está regulada por genes de defensa. Desde hace años se intuyó que la manipulación de estos genes podría determinar la siembra de vegetales más resistentes a plagas. Estos estudios comenzaron tras las epidemias de hambre causadas por la parasitación de vegetales de importante consumo, como la de las patatas en Europa en 1896 por el hongo Phytosphora infestans. Por ello, además de la selección natural de las especies, el hombre ha ido modificando sus cultivos, seleccionando los más resistentes e intentando manipularlos, hasta llegar actualmente a la complejidad del cultivo de especies transgénicas.
Un número creciente de familias de proteínas relacionadas con la patogénesis (proteínas PR: pathogenesis-related proteins) ha sido implicado en los mecanismos de defensa (inducidos o constitutivos) que poseen las plantas frente al ataque de plagas y patógenos por su poder antifúngico, antiparasitario o antibacteriano4,27. Tienen 2 características con relevancia clínica: a) su inducción por distintos tipos de estrés puede condicionar los niveles de un alérgeno determinado en productos comerciales, en función de las condiciones de cultivo, almacenamiento, etc., y b) muchas de estas proteínas (LTP, inhibidores) presentan una estructura compacta, estabilizada por muchos puentes disulfuro, que las hace resistentes a tratamientos térmicos y a la digestión por proteasas digestivas, lo que determina que se encuentren como alérgenos inmunológicamente activos en alimentos procesados y al interaccionar con el sistema inmunitario intestinal.
En la última década, un muy reducido grupo de estas proteínas ha sido identificado como alérgenos principales de alimentos o pólenes. Los 2 casos mejor ilustrados corresponden posiblemente a la familia de proteínas relacionada con la patogénesis (PR10P), presente en pólenes de Fagales, en frutas (manzana) y en hortalizas (apio, zanahoria)28,29, y a la familia de inhibidores de α-amilasas de cereales7,30. La amplia distribución de estas familias de proteínas de defensa y el alto nivel de similitud de secuencias entre sus miembros han sido esenciales para explicar las reacciones cruzadas entre pólenes y frutas en el primer caso, y la implicación de diferentes harinas en la alergia ocupacional conocida como «asma del panadero» en el segundo. Se ha visto que la identidad estructural de los alérgenos que tienen reactividad cruzada no ha de ser esencialmente absoluta, sino que será suficiente la existencia de cierta similitud molecular, en algunos casos mínima. Sin embargo, ha sido en el último año cuando ha empezado a sospecharse una estrecha relación entre proteínas de defensa y alérgenos vegetales como una posible característica general que, de confirmarse, puede tener consecuencias futuras muy importantes tanto en el campo de la alergia como en las estrategias a utilizar en protección vegetal.
Datos iniciales, especialmente en frutas, han involucrado a 3 nuevas familias de proteínas de defensa, ubicuas y bien caracterizadas5 en reacciones alérgicas: quitinasas de clase i con un dominio heveína N-teminal son los alérgenos principales de plátano, aguacate o castaña, 3 de los principales alimentos asociados al síndrome «látex-frutas»6,31 (fig. 1), LTP han sido caracterizadas como las proteínas con mayor capacidad de ligar IgE en frutas de la familia Rosaceae (manzana, melocotón, albaricoque, etc.) (fig. 2) en el área mediterránea32,33, y las taumatinas (osmotinas), que han sido también detectadas como alérgenos de cereza y otros frutos32,34. Además, varias enzimas como peroxidasa, cisteín-proteasas, glucanasas o esterasa, potencialmente implicadas en protección vegetal, también han sido identificadas como alérgenos en harinas y frutas8,34,35. Vamos a comentar los datos de las más estudiadas:
- 1.
Homólogos de Bet v1 (proteínas PR-10): en áreas de abedules y árboles del orden Fagales (centro y norte de Europa) un alto número de pacientes polénicos tienen IgE contra el alérgeno principal del polen de abedul (Bet v1). Entre ellos, más del 50% tiene síntomas al comer manzana y otros frutos de las rosáceas, el apio, la zanahoria y las especias, por la presencia de homólogos de Bet v1 en los mismos. Estos homólogos son proteínas lábiles, sensibles a tratamientos médicos y altamente degradables por las proteasas digestivas, por eso solo suelen dar síndrome oral. A veces, en la soja, han causado anafilaxia. Se pueden manipular manzanas de forma transgénica con niveles de homólogos disminuidos.
- 2.
Proteínas de transferencia de lípidos (LTP, proteínas PR-14): en áreas mediterráneas, sin Fagales, la alergia a frutas rosáceas no está relacionada con la familia Bet v1. Un 20% de pacientes presentan sensibilización a estos frutos sin polinosis asociada. Los alérgenos principales son LTP, polipéptidos básicos de 9 KDa con alta similitud entre ellos (30-95% de identidad) y 4 puentes disulfuro. Su conformación es compacta y se acumulan fundamentalmente en los tejidos epidérmicos de hojas y frutos, lo que explica la mayor alergenicidad de la piel. Esto sirve como mecanismo de defensa y síntesis de polímeros lipofílicos (cutina, suberina). Además del PRu p3 del melocotón y la Mal d3 de la manzana, se han descrito LTPs en naranja (Cit s 3, 126), en hortalizas (Asp o 1 en espárrago, Lac s 1 en lechuga), frutos secos (Cor a 8 en la avellana, Cas s 8 en castaña), cereales (Zea m 14 en maíz y Tri a 14 en trigo), látex (Hev b 12) y algunos pólenes: Art v3 en la Artemisia vulgaris, Ole e7 en el olivo, Par j1 en la parietaria. Todas ellas son potentes alérgenos en alimentos porque tienen alta resistencia al calor y a ser degradadas por proteasas digestivas. Por ello, mantienen su actividad en bebidas procesadas como zumos, vinos y cerveza. En segundo lugar se asocian con síntomas sistémicos graves provocando manifestaciones incluso en pacientes no polínicos, y en población mediterránea. Pueden sensibilizar por vía digestiva e inhalatoria. Mediante mutagénesis se podrían realizar variantes hipoalergénicas.
- 3.
Quitinazas y alérgenos con dominio heveína. Los alérgenos más importantes del látex son la proheveína (Heb b6.02), una proteína antifúngica de 20 KDa que se procesa generando la heveína (Heb b6.02) y que incluye la mayoría de epítopos de unión con la IgE. Un 40-60% de alérgicos a látex presentan hipersensibilidad a aguacate, plátano, castaña y kiwi. Los alérgenos responsables de la reactividad cruzada son quitinasas de clase i. También se han descrito quitinasas de clase iv como alérgenos principales de la uva y algunos pólenes. Estas enzimas con PM de 32 KDa tienen alta identidad con la heveína del látex. Son las quitinasas completas, y no solo los dominios heveína, las responsables de la alergenicidad. La inactivación de algunas quitinasas de clase i por el calor explican por qué los frutos consumidos en fresco y no los cocinados son los más relacionados con el síndrome látex-frutas.
- 4.
Taumatinas (proteínas PR-5): son proteínas antifúngicas de 23 KDa con 8 puentes disulfuro, estructura estable y resistente a tratamientos térmicos. Se han identificado Mal d2 en manzana, Pru av2 en cereza, Act c2 en kiwi, Cap a1 en pimienta y en pólenes de arizónica y Juníperus. Se ha expresado Mal d2 como recombinante en plantas transgénicas de Nicotiana bentamiana, usando vectores virales.
- 5.
Proteasas y beta 1,3 glucanasas (proteínas PR-2): están siendo estudiadas en la actualidad. La actinidina del kiwi (At c1) de 30 KDa, muy abundante en este fruto, la cucumisina del melón (Cuc c1), serí-nproteasa de 66 KDa, y sus alérgenos homólogos en calabaza y tomate. Son proteínas antifúngicas de 33-36 KDa y existen en el látex (Heb v2) y en el polen de olivo (Ole e9). También la ficina del trigo, papaína de la papaya y bromelina de la piña.
- 6.
Otros alérgenos vegetales: solo se ha encontrado un miembro de la PR-1 asociado a la alergia, el Cuc m3 del melón, de 16 KDa, que tiene una secuencia similar al grupo 5 de venenos de insectos.
- 7.
Inhibidores de cereales de α-amilasa heterólogos. Hemos dejado para el final estas proteínas porque son las que más ha estudiado nuestro grupo y de las que tenemos más información: desde 1989, en colaboración con la ETS de Ingenieros Agrónomos de Madrid, trabajamos en la identificación y purificación de alérgenos en harinas de cereales y productos derivados. Nuestros resultados sugieren que las proteínas principales de los cereales son proteínas de defensa de los mismos y además panalérgenos. Dada su ubicuidad pueden tener una gran importancia en los cuadros alérgicos21–25.
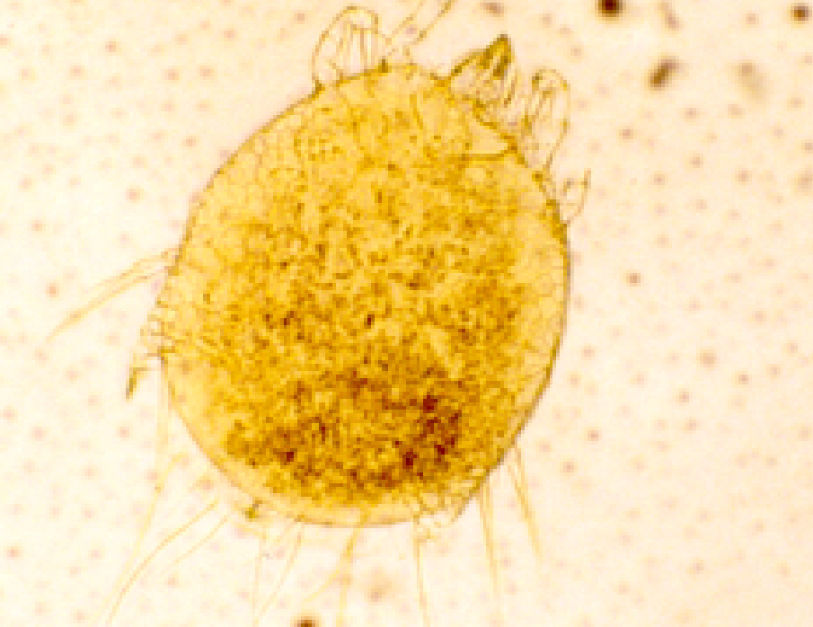
La harina es una mezcla compleja de alérgenos en la que entran a formar parte elementos vegetales: pólenes de cereales, proteínas del endospermo del grano, esporas y hongos, distintos aditivos como la α-amilasa36 y alérgenos de artrópodos como parásitos del grano, cucarachas y ácaros (principalmente de almacenamiento) que son considerados a su vez potentes alérgenos16,17. Recientemente han sido descritos cuadros de asma por la ingesta de cereales contaminados por ácaros de almacenamiento37 (fig. 3).
En cuanto a la relación entre los alérgenos vegetales y las proteínas de defensa, debe sustentarse en extensos estudios en el futuro, pero los datos ya disponibles permiten vislumbrar sus aplicaciones:
- -
La purificación y aislamiento óptimos de los panalérgenos principales de defensa para su utilización en tests in vivo e in vitro puede ser de gran importancia en el diagnóstico de las enfermedades alérgicas.
- -
El conocimiento de estas proteínas y su actividad biológica en el ser humano podría ser la base de la manipulación genética de las plantas para cultivos de especies menos alergénicas y también más resistentes a plagas.
- -
La sensibilización cruzada de pacientes alérgicos a diferentes alimentos y/o pólenes puede explicar el aumento de la incidencia de fenómenos alérgicos. Por otra parte, se debe señalar el posible peligro clínico de plantas transgénicas que sobreexpresen proteínas de defensa alergénicas (por ejemplo para obtener resistencias a hongos o parásitos). Este riesgo sería mínimo utilizando proteínas de defensa no alergénicas (en el caso del síndrome látex-frutas, expresando quitinasas de clase ii, no alergénicas y sí antifúngicas).
- -
La disminución de la alergenicidad de las plantas mediante manipulación genética podría lograr la síntesis de fármacos menos sensibilizantes, lo cual constituye una seria limitación de la biotecnología con plantas en la actualidad.
- -
Estudios de localización in situ pueden indicar en qué partes de un alimento (piel, pulpa, cubierta o endospermo de semillas) se acumula preferentemente un alérgeno.
- -
La disponibilidad de clones y estructuras terciarias de algunas de las proteínas de defensa mencionadas (LTP, quitinasas) o, en nuestro caso, inhibidores de α-amilasas, puede facilitar tanto la obtención de alérgenos recombinantes, como su manipulación por mutagénesis dirigida para producir proteínas hipoalergénicas.
- -
Por último, las propiedades alergénicas de las familias de proteínas de defensa deben considerarse en la obtención de plantas transgénicas utilizando los correspondientes genes encaminadas a obtener un aumento en la resistencia a determinadas plantas o patógenos. De no ser así podemos aumentar la prevalencia de esta importante patología.
Hemos observado que los glicanos complejos de ciertos invertebrados y plantas tienen epítopos similares13. De esta forma, los anticuerpos IgE de nuestros panaderos eran capaces de reconocer glucoproteínas de coleópteros, leguminosas y, curiosamente, de veneno de abeja (fig. 4).
En cuanto a las técnicas analíticas, en el estudio de la hipersensibilidad alérgica alimentaria hay que decir que las técnicas electroforéticas para aislamiento de proteínas son superiores a otros métodos como la cromatografía porque tienen más resolución y son capaces de resolver la compleja composición proteica, por ejemplo, de la harina en orden a caracterizar sus posibles y diferentes alérgenos36. Diferentes autores7,30, utilizando electroforesis bidimensional de alta resolución en combinación con análisis de proteínas, detectaron alrededor de 700 proteínas solubles en trigo, de las cuales 70 detectaban IgE, sobre todo las localizadas en las áreas de 14-18, 27, 37, 55 y 70 KDa. Mediante secuenciación de aminoácidos encontraron homologías en proteasas inhibidoras de α-amilasa (14-18 KDa), acil-CoA oxidasa (26 KDa) y fructosa-bifosfato aldolasa (37 KDa) de trigo, maíz y cebada. Sin embargo, estos estudios no aclaran bien qué proteínas pueden ser clínicamente relevantes. Por ello se intenta aislarlas para, una vez purificadas y aisladas en extractos diagnósticos, poder comprobar su reactividad in vivo mediante técnicas de diagnóstico alergológico (pruebas cutáneas y de provocación). También se puede poner especial atención en la potencial relación entre las proteínas de defensa presentes en las semillas de los posibles alérgenos que pudieramos identificar. Hay que aclarar que era la primera vez que se utilizaban alérgenos purificados in vitro de cereales para el diagnóstico alergológico in vivo.
Tratamiento de la hipersensibilidad alérgica alimentariaEl tratamiento de la hipersensibilidad alérgica alimentaria se basa en la evitación del alérgeno y esperar que con el tiempo se establezca su tolerancia. En la evolución natural de la alergia alimentaria, al periodo de sensibilización clínica le sigue otro de sensibilización asintomática, hasta conseguir la tolerancia total con la desaparición de anticuerpos IgE específicos (tabla 3). No todos los alérgicos a alimentos alcanzan la tolerancia, en algunos casos tiende a persistir durante años y cuanto más tiempo se mantiene la sensibilización sintomática, es menor la probabilidad de que se resuelva, siendo un índice de mal pronóstico en la alergia a proteínas de leche de vaca la persistencia de la reactividad clínica a los 5 años de edad (tabla 4)38–41.
Tratamiento de los pacientes con hipersensibilidad alérgica alimentaria
| Evitación (con nuevas provocaciones a intervalos regulares) |
| La administración de corticoides puede ser importante en algunos trastornos poco frecuentes (por ejemplo, gastroenteritis eosinofílica, diarrea secretora) |
| Evitar el uso de medicaciones como cromoglicato o antihistamínicos: no se ha comprobado su eficacia en estudios controlados |
| No debe utilizarse la terapia con inyecciones en la hipersensibilidad alimentaria a menos que se efectúe bajo protocolos experimentales |
Alimentación de lactantes con predisposición atópica
| Permitir una dieta materna prenatal normal |
| Aconsejar la lactancia materna durante al menos 6 meses |
| Advertir a la madre que evite los huevos, los cacahuetes y el pescado. Puede considerarse la evitación de productos lácteos |
| Retrasar la introducción de alimentos sólidos del modo siguiente: |
| 6-12 meses: verduras, arroz, carne, fruta |
| 12-18 meses: leche de vaca, trigo, centeno, cítricos, soja |
| 24 meses: huevos |
| 36 meses: frutos secos, pescado |
Los autores declaran no tener ningún conflicto de intereses.