La ablación por radiofrecuencia (ARF) es una alternativa efectiva al tratamiento quirúrgico en pacientes con metástasis pulmonares. La tasa media de ablación completa reportada ha sido del 90% para tumores de 2.2 cm; la sobrevida media de 8.6-33 meses y la sobrevida global del 15%-46% a 3 años.
Radiofrequency ablation (RFA) of lung metastases is an effective alternative to surgical resection. The reported median rate of complete ablation is 90% for tumor size of 2.2 cm. The median survival ranged 8.6-33 months and the overall 3-year survival rate ranged 15%-46%.
Introducción
Después del sistema linfático, los pulmones son el segundo órgano más comúnmente afectado por metástasis de tumores sólidos1. Se estima que éstas ocurren hasta en el 30% de los pacientes con adenocarcinomas primarios metastásicos. Los tumores que presentan afinidad por la invasión pulmonar incluyen: osteosarcoma, cáncer de colon, cáncer de mama, melanoma y aquellos de cabeza y cuello2.
La mayoría de estos pacientes, además, tienen múltiples lesiones pulmonares y/o enfermedad diseminada a otros sitios3. La metastasectomía ha mostrado mejorar la sobrevida libre de enfermedad, en pacientes cuidadosamente seleccionados1. El Registro Internacional de Metástasis Pulmonares (IRLM, por sus siglas en inglés), un estudio clínico, multicéntrico, reportó el resultado de 5,206 pacientes con metástasis pulmonares tratados con cirugía, en el cual los tumores epiteliales y los sarcomas representaban la mayoría de los casos (43% y 41%, respectivamente), 46% de los pacientes presentaban lesiones únicas y la sobrevida global alcanzada fue de 20%-40% a 5 años4.
Los criterios de selección para cirugía incluyen: el control completo del tumor primario, ausencia de enfermedad extratorácica, intervalo largo libre de enfermedad y un número limitado de metástasis pulmonares5. De acuerdo con los resultados del IRLM, los factores de mejor pronóstico para la sobrevida en los pacientes que se someten a metastasectomía son: la resección completa, un intervalo libre de enfermedad > 36 meses (del tumor primario a la presentación de las metástasis), una sola metástasis e histología de célula germinal5.
Sin embargo, la cirugía requiere que el paciente cuente con suficiente reserva cardiopulmonar y además se asocia a riesgo de morbilidad y recaída6.
En pacientes no candidatos a cirugía existen muy pocas opciones terapéuticas. Algunos de ellos son manejados con quimioterapia, siendo la sobrevida a largo plazo no muy alentadora5,6.
La ablación percutánea por radiofrecuencia (ARF) es una modalidad de tratamiento local, mínimamente invasiva, guiada por imagen (en el caso de pulmón, por tomografía), que consiste en la aplicación de energía, en forma de calor (térmica), a través de una aguja (electrodo), la cual se introduce a la lesión blanco y provoca agitación celular con la consecuente desnaturalización y muerte celular. Esta técnica se utiliza para tratar lesiones pulmonares tanto primarias como metastásicas. Además, es una alternativa para aquellos con enfermedad metastásica recidivante, donde una reintervención quirúrgica implica alto riesgo y para quienes no aceptan la cirugía1,5.
Aspectos técnicos
Principios elementales
La técnica de ablación térmica en el pulmón usando RF fue descrita por primera vez en un pulmón animal en 1995, y reportada en pacientes en el 20007.
En la ARF se emplea una corriente alterna de 460-480 Hz. Se aplica una potencia de salida de 10-200W a un electrodo, el cual forma un circuito eléctrico junto con 2-4 parches que se colocan en ambos muslos del paciente. La aplicación de esta radiofrecuencia (RF), agita los iones del tejido circundante al electrodo provocando que estos fluctúen a altas velocidades, dependiendo de la dirección de la corriente alternante. La fluctuación de los iones es proporcional a la intensidad del campo eléctrico; el campo eléctrico es exponencialmente atenuado dependiendo de la distancia del electrodo. La fluctuación de los iones a alta velocidad genera calor por fricción, y el calor generado da lugar a coagulación tisular8-11.
Los tejidos biológicos calentados a 50°C o más, por más de 5 minutos sufren necrosis coagulativa. Los tejidos calentados a > 105°C-115°C son carbonizados y generan gas. Es por ello que en la ARF, la temperatura tisular debe oscilar entre 60°C-105°C, idealmente menor de 100°C.
El área de coagulación depende de la forma del electrodo (aguja), de la fuerza de la energía de RF, de la corriente que fluye en determinado tiempo y de la composición de los tejidos adyacentes7-9. La energía de la RF en el pulmón se deposita de forma eficiente, ya que el aire circundante actúa como un aislador (concentrando la energía dentro del tumor), y el alto flujo vascular y el intercambio de aire actúan como una especie de "sifón" lo que llaman heat skin, disipando el calor dentro del parénquima normal7. Sin embargo, este efecto de "sifón" a la par de ese efecto "protector" del parénquima, también limita el tamaño del margen terapéutico de ablación que rodeará al tumor, margen necesario para prevenir la recurrencia local. El tamaño del volumen de ablación también se encuentra limitado en el pulmón, debido al ambiente de alta impedancia creado por el tejido aireado y pequeñas cantidades de agua por unidad de volumen tisular, si se compara con aquellas de los órganos sólidos. La infusión de solución salina y el uso de diseños de múltiples electrodos activos, ayudan a sortear esta limitante y además promueven la disminución de la alta impedancia y suscitan la conducción de la energía eléctrica7,10,11.
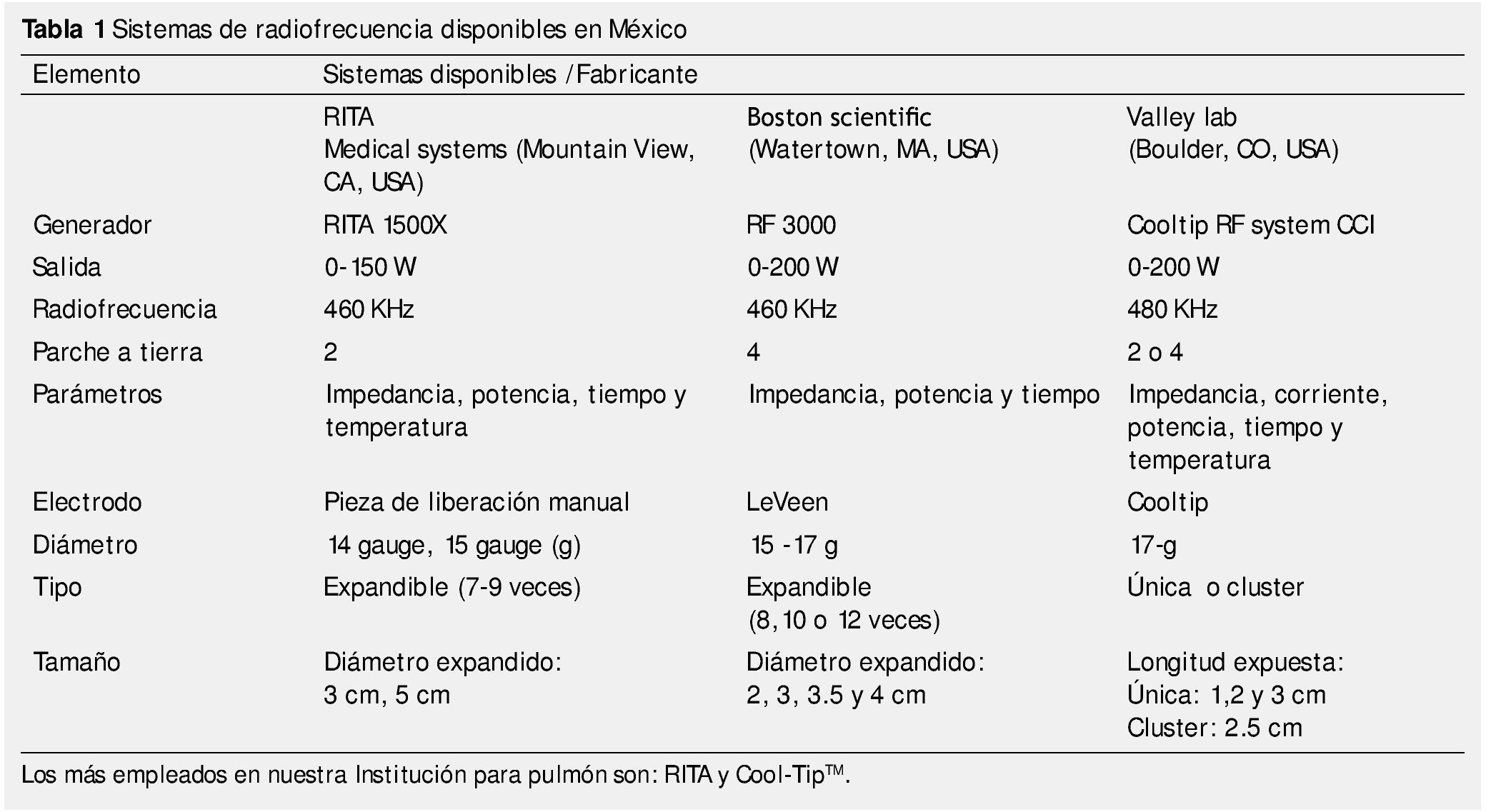
Un sistema cualquiera de RF consiste en un generador de RF, electrodos y almohadillas de tierra (o parches). Existen en el mercado mexicano 3 sistemas de este tipo, sin existir hasta ahora, una ventaja significativa de un dispositivo sobre otro. Este equipo se utiliza tanto para RF de hígado como para pulmón (tabla 1).
Él o los electrodos de la sonda de RF son liberados dentro del tumor para permitir la máxima distribución de la energía. Para controlar el volumen de ablación y limitar el daño a las estructuras circundantes, los 3 sistemas tienen un mecanismo automático de retroalimentación o feedback que determinará cuándo terminar el procedimiento. La mayoría de los algoritmos ya vienen elaborados de fábrica. El sistema de Boston y el de ValleyLab® están basados en la impedancia, donde el término del tratamiento se encuentra marcado por un incremento específico de ésta. El sistema de RITA se basa en elevación de la temperatura hasta que la temperatura del tumor, alcanza un nivel específico durante un periodo determinado de tiempo2,8-10.
Indicaciones
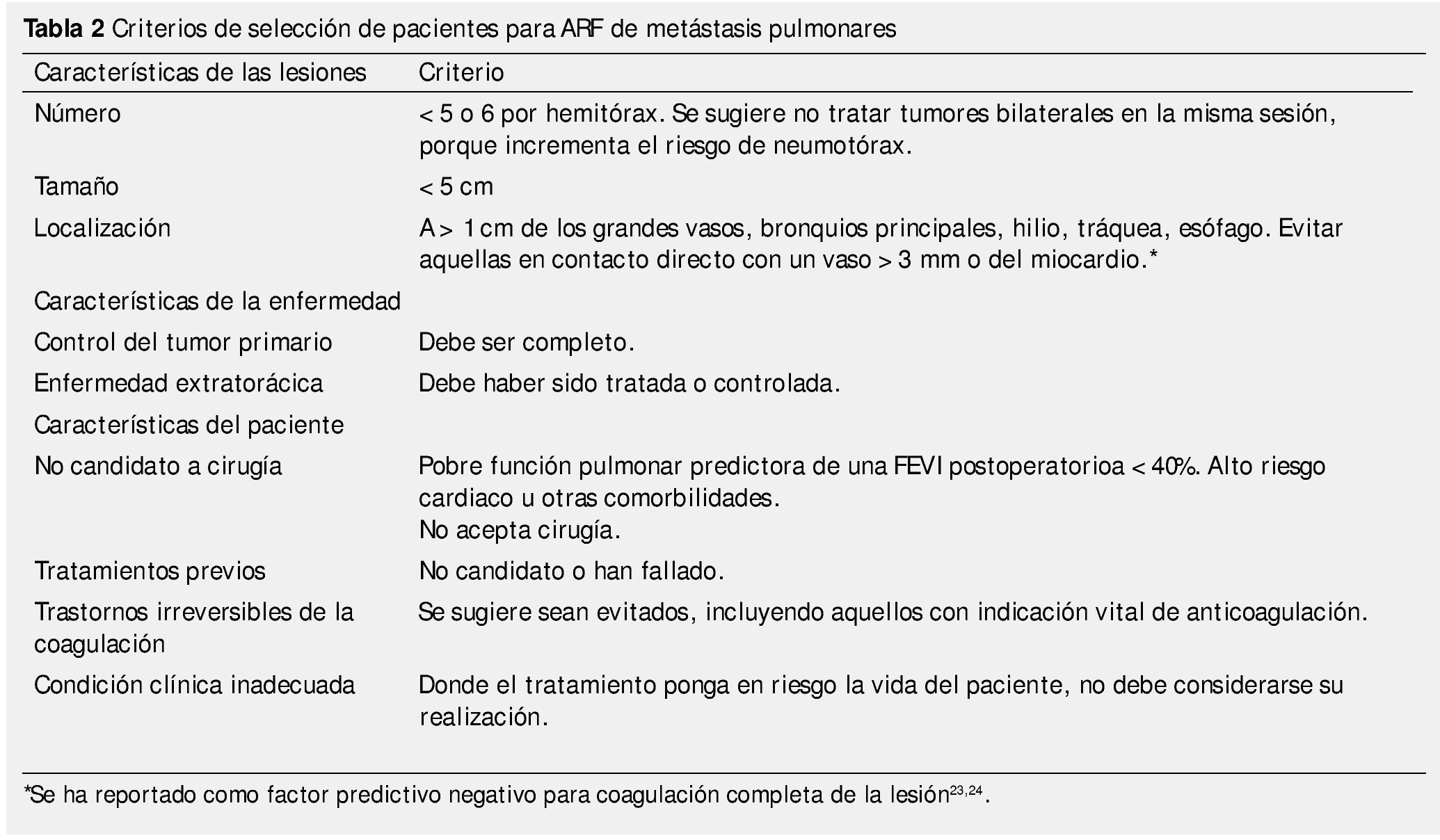
Las indicaciones para ARF de metástasis pulmonares son similares a aquellas para metastasectomía, sin embargo, la RF habitualmente se reserva para pacientes con alto riesgo quirúrgico. Se considera entonces candidato a RF pulmonar a12,13:
• Pacientes no candidatos a cirugía o aquellos que la rechazan.
• Cuando todas las lesiones son de tamaño pequeño.
• Las lesiones no abuting estructuras mediastinales.
• El tumor primario está controlado o es controlable.
• Número limitado de metástasis.
Independientemente de lo anterior, la decisión de tratar a un paciente con RF se debe tomar de manera multidisciplinaria (cirugía de tórax, oncólogo de tórax, radioterapeuta, neumólogo, anestesiólogo y el radiólogo intervencionista). La evaluación preprocedimiento debe incluir (al igual que en la cirugía), las condiciones cardiopulmonares del paciente y el riesgo de sangrado. Las pruebas de función respiratoria se recomiendan en pacientes con antecedente de cirugía pulmonar o patología pulmonar7,14. Los parámetros de laboratorio deben incluir los tiempos de coagulación, cuenta plaquetaria e INR. Los medicamentos anticoagulantes y antiagregantes plaquetarios deben descontinuarse antes del procedimiento según sea el caso, de 5 hasta 10 días antes. Pacientes con ECOG > 2 no son candidatos al procedimiento. En pacientes con marcapasos se debe considerar el uso de otras alternativas ablativas como la crioablación o microondas.
La tomografía de tórax es el estudio clave para la evaluación pretratamiento de la o las lesiones a tratar, su tamaño, localización y su relación con los vasos y bronquios. Nos permite la planeación del procedimiento y la evaluación inmediata de la respuesta al tratamiento15. Se debe contar también, idealmente, con un estudio de estadificación, lo más factible es una tomografía de abdomen y pelvis.
La biopsia se recomienda antes del tratamiento, cuando la presentación de las metástasis es atípica.
En base a los estudios publicados, la RFA para metástasis pulmonares se realiza principalmente en: cáncer de colon y recto, cáncer pulmonar, de células renales, melanoma, carcinoma hepatocelular y sarcoma16-21. El número máximo de metástasis que pueden ser tratadas aún no se encuentra bien definido. La mayoría de los estudios realizan el tratamiento en pacientes con 5 lesiones o menos7 (tabla 2).
La combinación de ARF y cirugía para el tratamiento de mayor número de lesiones en tumores bilaterales, puede ser una opción útil para incrementar la posibilidad de limitación de una enfermedad invasiva21. También, por ejemplo, otros proponen la combinación de ARF con quimioterapia sistémica en pacientes con metástasis irresecables de colon y recto22. Sin embargo, las terapias combinadas aún requieren de estudios posteriores para su validación.
Técnica del procedimiento
La ARF debe ser un procedimiento no doloroso, por lo cual es realizado usualmente con anestesia local más sedación consciente o, en algunos casos, con anestesia general. La ventaja de esta última radica en que permite un mejor control de la vía aérea, así como la obtención de apneas cuando se requiere durante el procedimiento, sobre todo durante la colocación de la aguja dentro de la lesión. Sin embargo, tiene la desventaja de incrementar el costo y la duración del procedimiento, así como la exacerbación del neumotórax con ventilación con presión positiva.
La modalidad de imagen guía habitualmente empleada para la ARF es la tomografía por razones ya conocidas (disponibilidad, nos muestra la localización exacta de la lesión y la relación de ésta con nuestro electrodo, se pueden tomar medidas y realizar movimientos de la aguja adecuadamente orientados, etc.). Su limitante es carecer en algunos casos de tiempo real, pero cuando se cuenta con la modalidad de fluoroscopia, tanto el médico radiólogo como el paciente, deben estar de acuerdo en aceptar la exposición a mayor dosis de radiación. Esta modalidad en tiempo real facilita la colocación del electrodo dentro de la lesión.
Ya en el tomógrafo, la posición del paciente dependerá de la localización de la lesión y del abordaje que permita obtener la distancia más corta a ella desde la pared torácica. Se deberán colocar uno o 2 parches en cada pierna (dependiendo del sistema de RF a emplear), para permitir la puesta a tierra. Es preciso cerciorarse de la buena adhesión de los parches a la piel, ya que si esto no sucede, la corriente de energía se concentrará en los márgenes de los parches y esto puede ocasionar quemaduras25.
En nuestra Institución, el sitio de entrada en la piel se marca con un objeto metálico pequeño (por ejemplo, clip) y se realizan cortes para corroborar la situación. En base al clip, se decide si la aguja entrará en su borde medial, lateral, superior, inferior o punto medio. Se infiltra con lidocaína al 2% en piel y en plano muscular hasta antes de tocar la pleura. Se realiza una pequeña incisión con hoja de bisturí en la piel, para que la aguja electrodo no tenga dificultad para entrar. La aguja se avanza en dirección a la lesión y su situación se corrobora realizando cortes de tomografía con el FOV cerrado, que incluya los márgenes de la lesión. Una vez corroborada la localización de la aguja dentro del tumor en al menos 2 planos (reconstrucción multiplanar, MPR), se aplica la energía recomendada por el algoritmo de ablación de tejido pulmonar.
El objetivo técnico de la ARF es alcanzar la necrosis coagulativa del tumor y dejar un anillo de 0.5-1 cm de "margen quirúrgico".
Complicaciones
La ARF se considera un procedimiento relativamente seguro, con una morbilidad global, relacionada al procedimiento en el rango del 15.2%-55.6% (media de 35.7%) y un rango de mortalidad entre 0%-5.6%26. Las complicaciones que se presenten dentro de los primeros 30 días posteriores al procedimiento, aún pueden estar relacionadas con él27.
Algunos pacientes pueden presentar dolor leve a moderado e incluso elevación de la temperatura (como resultado de liberación de citocinas y mediadores de respuesta inflamatoria), durante o inmediatamente después del procedimiento. El neumotórax y el derrame pleural son las complicaciones más frecuentes durante la RF, presentándose en cerca del 40% de los casos y en algunos de ellos necesitarán la colocación de tubo pleural (hasta en el 30%)1,8,27. La aspiración manual del neumotórax, durante la ablación puede ser de utilidad principalmente para aquellos neumotórax moderados para evitar la coagulación excesiva del parénquima atelectásico durante la aplicación de energía. Es posible que el neumotórax se vuelva a formar posteriormente. Un neumotórax tardío o persistente puede indicar la presencia de fístula broncopleural a lo largo del trayecto coagulado de salida, producido con el mismo electrodo. Por ello, algunos recomiendan realizar una zona de ablación en la vía de acceso, pero ésta debe limitarse a 2-3 cm por fuera del tejido ablatido, lo cual no sólo minimizaría el riesgo de fístula broncopleural sino también el de sangrado y de siembra8,28.
La hemorragia pulmonar ocurre alrededor del 7%-8% de los casos, asociándose en la minoría de los casos a hemoptisis. Si ésta se presenta durante el procedimiento, siempre que el paciente permanezca estable, no es indicación para suspenderlo. Otras complicaciones pueden ser: neumonía, absceso pulmonar y exacerbación de enfermedad pulmonar obstructiva crónica1,8,26-28. Hay que recordar que todas aquellas complicaciones que resulten en incapacidad permanente del paciente, hospitalización prolongada y muerte deben ser consideradas mayores.
Resultados y efectividad
La tasa media de ablación completa reportada es del 90% para tumores de 2.2 cm con una alta variabilidad, desde 38%-97% tanto para lesiones primarias como metastásicas. La sobrevida media va de 8.6-33 meses y la sobrevida global del 15%-46% a 3 años 26,29.
Se ha demostrado que lesiones > 3 cm se asocian de forma independiente con disminución de la sobrevida global (p<0.003)30.
Uno de los reportes iniciales de sobrevida a largo plazo fue el de Simon et al., quienes evaluaron una cohorte mixta de 153 pacientes con metástasis pulmonar de cáncer colorrectal y carcinoma de células no pequeñas. La sobrevida global a 1, 2, 3, 4 y 5 años para aquellos con cáncer primario (n=75) fue 78%, 57%, 36%, 27% y 27%, respectivamente, y para aquellos con metástasis fueron 87%, 78%, 57 %, 57% y 57%. La sobrevida fue mayor para tumores menores de 3 cm (p<0.002)31. El estudio RAPTURE (por sus siglas en inglés), sobre la evaluación de la respuesta de tumores pulmonares posterior a ARF fue un estudio prospectivo, de un solo brazo, con intención a tratar, multicéntrico, que involucró a 7 países de Europa, Estados Unidos y Australia, dirigido por Leoinci et al.32, en el cual se incluyeron a 106 pacientes con 183 tumores, no candidatos a cirugía o no aptos para quimioterapia ni radioterapia. Del total de lesiones, 33 fueron carcinoma de células no pequeñas (CCNP), 55 metástasis de colon y recto y 20 metástasis de otros primarios. Se confirmó respuesta completa a un año en 75 de los pacientes (88%). La tasa de sobrevida para aquellos con CCNP a 1 y 2 años fueron 70% (CI=51%-83%) y 48% (CI=30%-65%), respectivamente. Para aquellos con metástasis de cáncer colorrectal, la tasa de sobrevida a 1 y 2 años fue del 89% (76%-95%) y 66% (CI=53%-79%), respectivamente.
También se ha propuesto un efecto sinérgico de la ARF a la radioterapia convencional de rayo externo; ello basado en el principio de que, si la radioterapia con rayo externo reduce el número de células cancerígenas, altera la cinética del ciclo celular y cambia el microambiente del tumor, entonces esta puede potencializar los efectos de la ARF. Existen estudios de la combinación de estos 2 tratamientos que demuestran beneficio en la sobrevida cuando se compara con el tratamiento solo con radioterapia, tanto en CCNP como en metástasis de colon y recto30,33-35.
Seguimiento posprocedimiento y evaluación de la respuesta por imagen
Es importante conocer los hallazgos esperados posteriores a la ARF a través del tiempo, porque de eso depende nuestra conducta a seguir con respecto al paciente disminuyendo también la cantidad de estudios innecesarios (en tiempo) para su valoración.
Hay que subrayar la importancia de hacer un estudio de tomografía, simple o contrastada inmediata e idealmente un mes posterior al procedimiento, la cual será nuestro nuevo estudio basal a partir del cual se compararán los estudios posteriores (tabla 3).
La tomografía por emisión de positrones (PET, por sus siglas en inglés) si se realiza de forma inmediata posterior a la ARF puede mostrar un anillo de actividad hipermetabólica, que no deberá confundirse con actividad tumoral. La inflamación post-ablación, puede oscurecer focos residuales de tumor; por ello el PET no se recomienda antes de los 2 meses post-ARF. Posterior a este tiempo cualquier incremento en la actividad metabólica con patrón central en la zona de ablación o nodular es sugestivo de recurrencia.
Cualquier crecimiento de la lesión posterior a los 3 meses debe considerarse sospechoso de recurrencia, así como cualquier reforzamiento nodular > de 10 mm o central > 15 uH o cualquiera mayor al tumor original, así como crecimientos ganglionares regionales o a distancia y la aparición de nuevas lesiones intra o extratorácicas36-37,39.
El criterio de evaluación de respuesta en tumores sólidos, RECIST (por sus siglas en inglés), es un sistema obsoleto para la correcta evaluación de tumores post-ablación, sobre todo tratándose del periodo inmediato y mediato después de la misma, ya que en este lapso todas las zonas sometidas a ARF deben verse más grandes que el tumor original. Ello ha resultado en una modificación del RECIST40 basado en la densidad y el tamaño de la lesión, así como en su actividad metabólica en estudio de PET. De tal manera que la respuesta completa, respuesta parcial, enfermedad estable y la progresión de la enfermedad se basarán en la ausencia o presencia de una o 2 de las características propuestas tanto por tomografía computada (tamaño y densidad), como por PET (captación < 2.5).
Conclusión
La ARF ha demostrado ser un tratamiento alternativo (no sustitutivo) a la cirugía, en pacientes con tumores pulmonares tanto primarios como metastásicos, con tasas de respuesta y efectividad que impactan en lo sobrevida de los pacientes. El conocimiento de la técnica y sobre todo la adecuada elección de los pacientes, son las piezas clave para lograr los mejores resultados. Es necesario que tanto radiólogos intervencionistas, como oncólogos clínicos y cirujanos estén familiarizados con la misma (en todos sus aspectos), ya que la elección, el tratamiento y seguimiento de los pacientes deberán ser multidisciplinarios.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Financiamiento
Los autores no recibieron patrocinio para llevar a cabo este artículo.
* Autor para correspondencia:
Av. San Fernando N° 22, Colonia Sección XVI, Delegación Tlalpan, C.P. 14080, México D.F., México.
Teléfono: (55) 5628 0400, (55) 5655 4766. Celular: 55 9193 7471.
Correo electrónico: eunice@ctcardiomexico.com (Eunice Alejandra Lara-García).