Efectuar una evaluación de costo-efectividad del esquema panitumumab + FOLFOX como primera línea en pacientes con CCRm RAS-WT vs. el uso de bevacizumab + FOLFOX.
MétodoMediante un modelo de Markov, se evaluó una cohorte hipotética de pacientes a través de 7 estados de salud en ciclos de transición de 2 semanas. La supervivencia libre de progresión (SLP) y la supervivencia global (SG) se tomaron del estudio PEAK. El uso de recursos se obtuvo de un panel de 5 oncólogos pertenecientes a 4 hospitales públicos. El costo incluye quimioterapia, seguimiento, eventos adversos, resección de metástasis, segunda línea, cuidados paliativos y gastos funerarios. Se aplican costos del IMSS, con una tasa de descuento del 5% a beneficios y costos con un horizonte a 5 años. Se realizó un análisis de minimización de costos vs. cetuximab debido a la equivalencia en SG según el estudio ASPECCT y resultados similares en SLP y SG en primera línea en población RAS-WT.
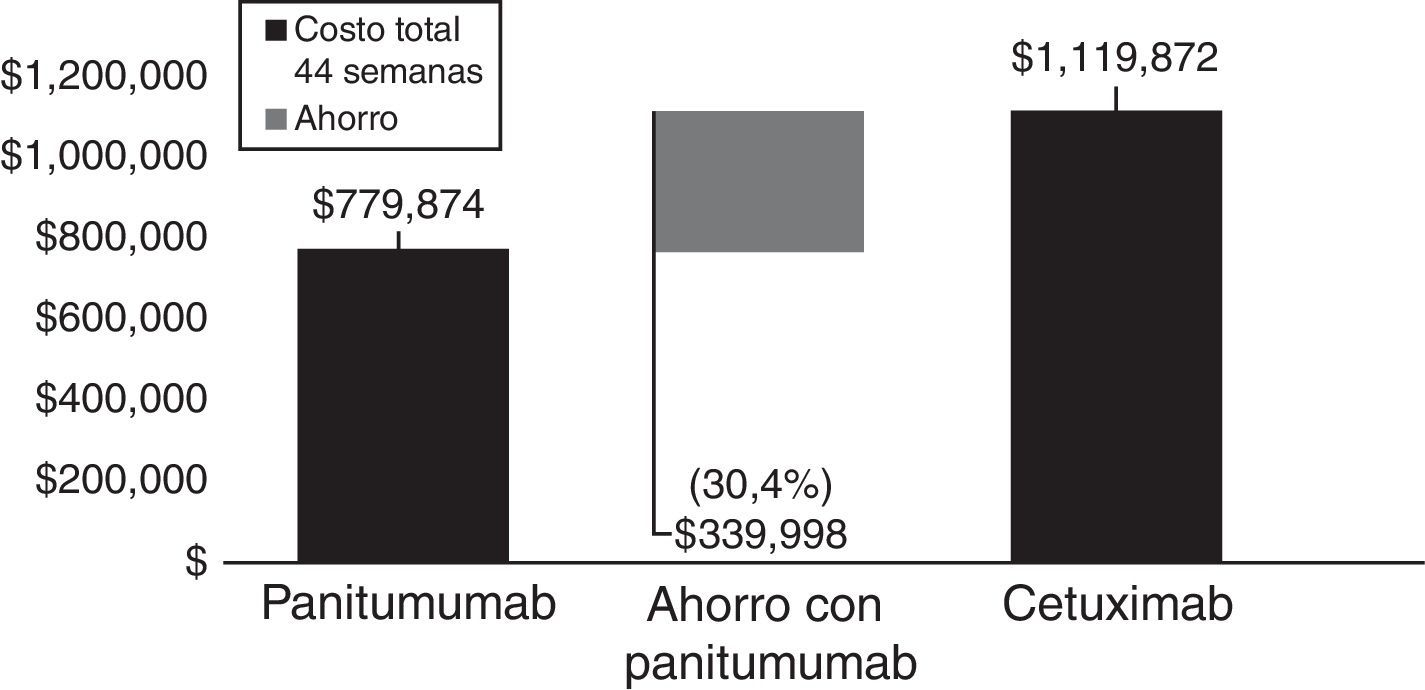
ResultadosEl costo total con panitumumab es de $ 1,048,009.42 y de $ 872,201.70 con bevacizumab, con una media de 3.47 y 2.80 años de vida y una razón costo-efectividad promedio de $ 25,173 y $ 25,932, respectivamente, por mes de SG. De la proyección a 10 meses con la terapia anti-EGFR, el costo es de $ 779,873.60 y $ 1,119,871.90 con panitumumab y cetuximab, respectivamente, lo cual representa un ahorro de $ 339,998.30 (30.4%) por paciente.
ConclusionesPanitumumab como primer tratamiento mejora los parámetros clínicos en pacientes con CCRm RAS-WT y presenta una razón costo-efectividad media similar a bevacizumab en dicha población. Con respecto a cetuximab, panitumumab constituye una estrategia costo-ahorradora para las instituciones de salud pública en México.
To conduct a cost-effectiveness analysis of panitumumab+FOLFOX vs. bevacizumab+FOLFOX as first-line therapy in RAS-WT mCRC patients.
MethodUsing a Markov model, a hypothetical cohort of patients was assessed throughout seven health stages in two-week transition cycles. Progression-free survival (PFS) and overall survival (OS) were taken from the PEAK trial. The use of resources was obtained from a panel of five oncologists at four public hospitals. The costs include chemotherapy, follow-up, adverse events, metastases resection, second-line therapy, palliative care, and funeral expenses. IMSS’ costs were applied, with costs and benefits discounted at 5% for a 5-year time line. A cost-minimisation analysis vs. cetuximab was performed due to the OS equivalence according to the ASPECCT trial and similar PFS and OS results as first-line in RAS-WT populations.
ResultsTotal costs are $1,048,009.42 for panitumumab and $872,201.70 for bevacizumab with a mean of 3.47 and 2.80 years of life, and a mean cost-effectiveness ratio per month of OS of $25,173 and $25,932, respectively. The 10-month projection for anti-EGFR therapies reveals a total cost of $779,873.60 for panitumumab and $1,119,871.90 for cetuximab, which represents savings of $339,998.30 (30.4%) per patient.
ConclusionsPanitumumab as first-line treatment improves clinical parameters in RAS-WT mCRC patients and has a mean cost-effectiveness ratio similar to bevacizumab in this population. Compared to cetuximab, panitumumab represents a cost-saving strategy for public healthcare institutions in Mexico.
El cáncer colorrectal es la cuarta neoplasia más común en hombres y la tercera en mujeres a nivel mundial. Cuando la neoplasia es localizada o se encuentra en ganglios linfáticos adyacentes, la supervivencia a 5 años puede ser hasta de un 93%. Sin embargo, cuando se presentan metástasis a sitios distantes, la supervivencia a 5 años es inferior al 10%. En la última década se ha observado una mejora importante en la supervivencia de los pacientes con cáncer colorrectal metastásico. En parte, esto se debe al desarrollo de fármacos que actúan directamente sobre el soporte nutricional y vascular del tumor, como los inhibidores del receptor del factor de crecimiento epitelial (EGFR)1.
Algunas mutaciones activadoras en genes como KRAS se han establecido como factores predictivos de la eficacia terapéutica de los fármacos anti-EGFR. Los pacientes con mutaciones en el exón 2 de KRAS muestran una respuesta inadecuada al tratamiento anti-EGFR. Otras mutaciones en la familia de proteínas RAS (KRAS o NRAS) también se han identificado como biomarcadores predictivos negativos para la terapia anti-EGFR2.
Pregunta de investigación¿Tiene el uso de panitumumab + FOLFOX como primera línea de tratamiento en pacientes con cáncer colorrectal metastásico (CCRm) con RAS no mutado (wild-type [WT]) una razón costo-efectividad promedio inferior frente a bevacizumab + FOLFOX, evaluados desde la perspectiva de las instituciones de salud del sector público en México?
ObjetivoLlevar a cabo una evaluación de la razón costo-efectividad del uso del esquema panitumumab + FOLFOX como primera línea de tratamiento en pacientes con CCRm RAS WT (exones 2, 3 y 4 de KRAS y NRAS) en comparación con el uso de bevacizumab desde la perspectiva de las instituciones del sector público de salud en México.
Objetivo del tratamientoEl objetivo del tratamiento en los pacientes con enfermedad metastásica consiste en prolongar la vida y mejorar la calidad de la misma. La selección del tratamiento adecuado depende de las características del tumor, así como de la expresión de EGFR y del estado de mutación de las distintas proteínas RAS3. La guía norteamericana sobre cáncer de colon de la Red Nacional Integral del Cáncer (National Comprehensive Cancer Network) recomienda la terapia neoadyuvante por 2 a 3 meses con el esquema FOLFIRI o FOLFOX y adicionalmente bevacizumab o panitumumab, o FOLFIRI + cetuximab (KRAS/NRAS WT únicamente). En los pacientes con tumores no resecables se recomiendan los mismos esquemas como terapia sistémica4. Las guías europeas de la Sociedad Europea de Oncología Médica (European Society of Clinical Oncology) recomiendan el uso de los esquemas FOLFIRI o FOLFOX como terapia de base en pacientes con CCRm, y la búsqueda rutinaria de marcadores pronósticos que permitan seleccionar la terapia adecuada en cada paciente. El empleo de anticuerpos monoclonales contra el factor de crecimiento del endotelio vascular o contra EGFR debe ser considerado en todos los pacientes, puesto que incrementan la supervivencia5.
Biomarcadores y factores predictivos de respuesta al tratamientoLos miembros de la familia de proteínas RAS actúan como transductores e integradores de señales para factores de crecimiento de superficie, lo cual resulta en proliferación celular, resistencia a la apoptosis e invasividad. La familia de genes RAS está integrada por HRAS, NRAS y KRAS. Hasta un 40% de los casos de CCR presentan mutaciones en el exón 2 del gen KRAS, lo cual se manifiesta en la falta de efectividad de las terapias contra el EGFR. Otras mutaciones menos frecuentes en K- y NRAS también se han encontrado en casos de CCR y algunos estudios han indicado que estas mutaciones también se asocian a resistencia e incluso a efectos nocivos con panitumumab. La frecuencia de las principales mutaciones en genes de proteínas RAS se muestra en la tabla 1.
En la extensión del análisis del estudio PRIME9 se encontraron mutaciones activadoras de RAS adicionales en el 17% de los pacientes con KRAS-WT (exón 2) (16% en el brazo con panitumumab + FOLFOX y 17% en el brazo con FOLFOX), situación que reduce el tamaño de la población elegible a recibir tratamiento con panitumumab. Es necesario identificar las mutaciones para evitar el uso inadecuado de recursos y potencializar los beneficios (fig. 1).
Prevalencia de mutaciones adicionales en el exón 2 en la población con KRAS WT.
Mutaciones en el exón 2 de KRAS previamente identificadas.
Fuente: Douillard et al., 20132.
Panitumumab es un anticuerpo monoclonal totalmente humano tipo IgG2 que se une al EGFR con mayor afinidad que el ligando natural. Aprobado por el Cuadro Básico y Catálogo de Medicamentos para el tratamiento de pacientes con cáncer colorrectal metastásico con KRAS no mutado (natural) en combinación con quimioterapia con los esquemas FOLFOX (primera línea) y FOLFIRI (segunda línea) o como monoterapia tras el fracaso de la quimioterapia convencional10. Se administra como infusión intravenosa (IV) en dosis de 6mg/kg cada 2 semanas. Panitumumab se une al dominio de fijación al ligando de EGFR e inhibe la dimerización y consecuente autofosforilación del receptor inducidas por ligandos conocidos de EGFR. La unión de panitumumab a EGFR provoca la internalización del receptor, la inhibición del crecimiento celular, la inducción de la apoptosis y un descenso en la producción de interleucina 8 y del factor de crecimiento del endotelio vascular11.
ComparadoresSe define como el comparador a bevacizumab (Avastin®), un anticuerpo monoclonal recombinante que inhibe la angiogénesis mediante el antagonismo de la actividad del factor de crecimiento del endotelio vascular humano y que se administra mediante infusión IV a dosis de entre 5 y 10mg/kg una vez cada 2 semanas12. Su elección obedeció a la posibilidad de comparar ambos fármacos directamente a partir del análisis extendido del estudio PEAK (Schwartzberg et al. 2014), en el que se incluyó a pacientes en quienes se investigaron mutaciones no sólo en KRAS (exones 3 y 4), sino también en los exones 2, 3 y 4 de NRAS. En este estudio se comparó la eficacia de panitumumab + FOLFOX6 frente a bevacizumab + FOLFOX6 en el tratamiento del CCRm en pacientes con KRAS y NRAS inicialmente sin mutaciones (WT).
EfectividadSe observó una supervivencia libre de progresión (SLP) de 13 meses con panitumumab en comparación con 9.5 meses con bevacizumab, así como una supervivencia global (SG) de 41.3 meses frente a 28.9 meses en cada grupo, respectivamente (Estudio PEAK)13.
SeguridadEl perfil de seguridad reportado en el estudio PEAK13 resultó similar a lo reportado en estudios anteriores, sin que se observara ningún evento nuevo adicional. En el análisis de la subpoblación con RAS WT, el evento adverso más serio y más frecuentemente reportado fue la embolia pulmonar, sin ninguna diferencia superior al 5% en la incidencia de eventos adversos serios entre ambas alternativas. Sin embargo, el 5 y el 9% de los pacientes tratados con panitumumab y bevacizumab, respectivamente, experimentaron eventos adversos fatales. Adicionalmente, se analizó la presencia de reacciones serias a la administración del fármaco. Algunas de estas reacciones a la infusión pueden incluir obstrucción de vías aéreas de aparición súbita, urticaria, hipotensión o paro cardíaco (Kang y Saif, 2007)14. El 2% de los pacientes bajo tratamiento con panitumumab y el 5% de quienes recibieron bevacizumab reportan reacción en el sitio de infusión grado 3; no se reportó ningún evento grado 4 o 5.
Tipo de evaluaciónLa evaluación económica de panitumumab + FOLFOX frente al manejo con bevacizumab + FOLFOX como primera línea en pacientes con CCRm con RAS WT en instituciones del sector público de salud en México se realizó mediante el desarrollo de un modelo de Markov que simula el curso clínico de una cohorte hipotética de 1,000 pacientes. Como criterios de valoración de la efectividad se emplean la SG y la SLP. La simulación se efectúa en ciclos de transición de 2 semanas de duración, con un horizonte temporal a 60 meses (horizonte suficiente para captar los costos y los beneficios de los tratamientos) y se aplica una tasa de descuento del 5% anual sobre los costos y beneficios clínicos. Los resultados se expresan mediante la razón costo-efectividad promedio, la cual indica el costo que habría que pagar con panitumumab y con bevacizumab por unidad de SG ganada.
Descripción del análisis conducidoLa evaluación de los esquemas de tratamiento se realizó mediante un modelo de Markov que simula el curso clínico de una cohorte de pacientes con CCRm con KRAS (exones 2, 3 y 4) y NRAS (exones 2, 3 y 4) no mutados (RAS WT). Una vez que el paciente es diagnosticado o reestadificado inicia un tratamiento sistémico con bevacizumab o panitumumab en combinación con FOLFOX (fig. 2).
La evolución del paciente se evalúa a medida transita por los diferentes estados de salud del modelo:
- •
Los pacientes inician la simulación en el estado libre de progresión, donde reciben tratamiento con panitumumab o bevacizumab hasta que la enfermedad progresa o son sometidos a resección de metástasis o mueren. Aquellos pacientes que suspenden tratamiento debido a la presencia de eventos adversos graves permanecen en dicho estado hasta que la enfermedad progresa.
- •
La duración del ciclo de transición se definió en 2 semanas, acorde con la duración del ciclo de tratamiento.
- •
Las probabilidades de transición a lo largo del modelo se estimaron a partir de los resultados de SLP y SG del estudio PEAK y se ajustaron conforme a una distribución Weibull para extrapolar los resultados más allá del tiempo de seguimiento del estudio.
- •
El escenario base sobre el porcentaje de pacientes sometidos a resección de metástasis y la tasa de éxito de la intervención se define conforme a lo reportado por el panel de médicos expertos (11% de intento de resección y 80% de tasa de éxito con panitumumab y 22.2% de resección y una tasa de éxito del 71% con bevacizumab). Sin embargo, se consideran 2 escenarios adicionales para evaluar las repercusiones que esta variable tiene sobre el resultado global del modelo: el primero asumiendo los mismos porcentajes reportados en el estudio PEAK (13.6% de intento de resección y 66.7% de tasa de éxito con panitumumab y 11% de resección y tasa de éxito del 77.8% con bevacizumab) y el segundo asumiendo que no se efectúa resección del sitio de metástasis (0% de intentos).
- •
Cuando los pacientes progresan o suspenden la primera línea de tratamiento debido a eventos adversos, pueden pasar a una segunda línea de terapia (tratamiento activo) o recibir manejo paliativo; en ambos casos, el porcentaje de pacientes asignados a cada tratamiento es definido por el panel de médicos expertos de acuerdo con la práctica habitual en sus instituciones. Los tratamientos incluyen: anti-EGFR + FOLFIRI, bevacizumab + FOLFIRI, FOLFIRI solo y cuidados paliativos.
- •
El análisis se efectúa para un horizonte temporal de 60 meses, horizonte suficiente para cubrir los costos y los beneficios asociados a los tratamientos. La perspectiva utilizada en esta evaluación es la del Sistema Nacional de Salud pública y se aplican costos del IMSS.
La realización de un análisis farmacoeconómico que resulte relevante al contexto nacional es determinada por la calidad de la información que la alimente y la coherencia de los supuestos empleados en el modelo de evaluación con la práctica clínica en México. Por tal motivo, se integró un panel de médicos expertos, con el objeto de identificar el perfil del paciente y de la práctica clínica habitual en el tratamiento del CCRm en instituciones de salud pública en México.
El panel se conformó con 5 oncólogos médicos pertenecientes a 4 instituciones de salud pública: uno del Instituto Nacional de Cancerología, uno del Instituto Nacional de Ciencia Médicas y Nutrición Salvador Zubirán de la SSa, 2 médicos del Centro Médico Nacional Siglo XXI del IMSS y uno más del Hospital General Naval de Alta Especialidad de la SEMAR. Para la recolección de datos se desarrolló un instrumento en el que se recolectó información sobre el perfil del paciente, esquemas de tratamiento, monitorización y seguimiento médico, atención de eventos adversos, procedimientos quirúrgicos y cuidados paliativos.
Se incluyen los costos médicos directos, dentro de los que se contempla: el costo de la primera línea de tratamiento, el cual incluye una terapia dirigida + quimioterapia; la atención de eventos adversos grado 3/4; el soporte y seguimiento médico (consultas y estudios); la resección de metástasis (cirugía); el costo del tratamiento de 2ª línea; el costo del tratamiento paliativo, y los gastos funerarios.
- •
Prueba para detección de mutaciones en RAS. Todos los pacientes en el brazo con panitumumab son evaluados para detectar mutaciones en RAS.
- •
Soporte y seguimiento médico. Se aplica el costo de una consulta de oncología médica cada 4 semanas para valoración y una tomografía computarizada cada 8 semanas.
- •
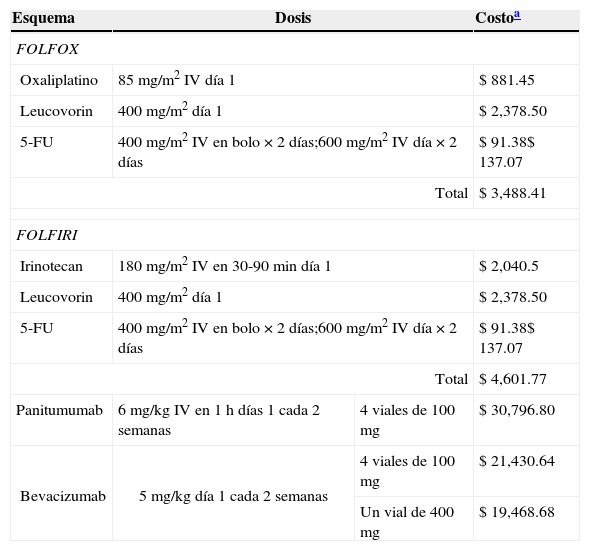
Tratamiento. Se incluye en el análisis el costo de los anticuerpos monoclonales y el costo de la quimioterapia, la administración y el seguimiento médico. El costo de panitumumab fue proporcionado por Amgen México; el costo del resto de los fármacos (irinotecán, 5-fluorouracilo, leucovorin, bevacizumab y oxaliplatino) se obtuvo de los costos publicados en el portal del Sistema Electrónico de compras del IMSS (compras.imss.gob.mx). Los costos de cada medicamento son calculados por ciclo conforme a las dosis recomendadas de cada uno de ellos (tabla 2).
Tabla 2.Costo promedio por ciclo de 14 días de tratamiento citotóxico por tipo de esquema
Esquema Dosis Costoa FOLFOX Oxaliplatino 85mg/m2 IV día 1 $ 881.45 Leucovorin 400mg/m2 día 1 $ 2,378.50 5-FU 400mg/m2 IV en bolo×2 días;600mg/m2 IV día×2 días $ 91.38$ 137.07 Total $ 3,488.41 FOLFIRI Irinotecan 180mg/m2 IV en 30-90min día 1 $ 2,040.5 Leucovorin 400mg/m2 día 1 $ 2,378.50 5-FU 400mg/m2 IV en bolo×2 días;600mg/m2 IV día×2 días $ 91.38$ 137.07 Total $ 4,601.77 Panitumumab 6mg/kg IV en 1 h días 1 cada 2 semanas 4 viales de 100mg $ 30,796.80 Bevacizumab 5mg/kg día 1 cada 2 semanas 4 viales de 100mg $ 21,430.64 Un vial de 400mg $ 19,468.68 aLos costos de los esquemas de quimioterapia se estiman por vial conforme la dosis recomendada, es decir, una vez que un vial es abierto, el contenido sobrante no puede ser usado en otro paciente (se contabiliza como desperdicio). Se considera un peso promedio de 67kg de acuerdo con los datos reportados por Fuchs Tarlovsky y Gutiérrez Salmeán, 200815, quienes evaluaron el estado nutricional de 117 pacientes con cáncer (26% de mujeres con cáncer de colon y 33% de hombres con cáncer de colon, gástrico y recto) atendidos en el Servicio de Oncología del Hospital General de México y una superficie corporal de 1.70m2 estimada según la fórmula de Dubois y Dubois 1.70=√((67kg×155cm)/3,600). Los costos de los AcMo se estiman por vial para un peso promedio de 67kg y una superficie corporal de 1.70m2.
- •
Resección metástasis. El costo de la cirugía de resección del sitio de metástasis en aquellos pacientes con respuesta adecuada y viabilidad de resección se estimó a partir de la relación de insumos y procedimientos reportados por el panel de médicos consultados. Se incluyen cirugía, hospitalización, consultas y pruebas de laboratorio, obteniéndose un total de $ 67,178.08.
- •
Eventos adversos. El costo de los eventos adversos por grado fue tomado de las cédulas médico-económicas (grupos relacionados de diagnóstico [GRD]) publicadas por el IMSS16 y actualizadas a precios del 2014 de conformidad con la información acumulada reportada por el Instituto Nacional de Estadística y Geografía17. El costo de aquellos eventos adversos no identificados en los GRD se estimó a partir del manejo reportado por el panel de médicos expertos. El costo del manejo médico de la reacción en el sitio de la infusión se calculó a precios del IMSS conforme al manejo descrito por Kang y Saif, 200714.
Si bien la toxicidad cutánea es un evento adverso frecuente, se puede reducir su incidencia hasta en un 50% con medidas generales que incluyen humectantes, doxiciclina y corticoides tópicos (Lacouture et al., 2010)18, lo que equivaldría a una reducción del 50% en el costo previsto de $ 11.41 y 4.57 con bevacizumab y panitumumab, respectivamente (costo total de atención de $ 228.27, con una incidencia del 2% de reacciones grado 3 con panitumumab), es decir, un costo por concepto de atención de una reacción en el sitio de la infusión de $ 5.71 y $ 2.28, respectivamente, por paciente. Por tal motivo, en el presente análisis no se incluyen los costos de atención de dichos eventos adversos, por el bajo impacto que representan en el costo previsto del tratamiento y las relaciones costo-efectividad.
- •
Manejo paliativo. El costo del manejo sintomático del paciente que ha progresado fue definido por el panel de médicos expertos en $ 3,306.06 (rango: $ 1,516.74-$ 7,728.98) cada 2 semanas e incluye medicamentos para el manejo del dolor (buprenorfina, dexametasona, diclofenaco, fentanilo, ketorolaco, morfina, ondansetrón, oxígeno domiciliario, paracetamol, senósidos AB y tramadol), así como consultas y estudios de seguimiento. Los esquemas más frecuentes son: buprenorfina 0.2mg c/8h por un mes, tramadol-paracetamol 37.5-325mg c/6h×30 días, morfina 15mg c/8h y fentanilo un parche c/3 días por un mes. Adicionalmente, se incluyen los gastos generados al final de la vida, los cuales se toman de la compensación que otorga el IMSS a las familias del paciente fallecido por concepto de gastos funerarios ($ 4,037.40), equivalente a 60 salarios mínimos en el Distrito Federal19, que para el año de 2014 es de $ 62.29 (Comisión Nacional de los Salarios Mínimos, 201420).
- •
Tasa de descuento. Por tratarse de una evaluación con un horizonte temporal a 60 meses, se emplea una tasa de descuento del 5% anual a los beneficios clínicos y a los costos.
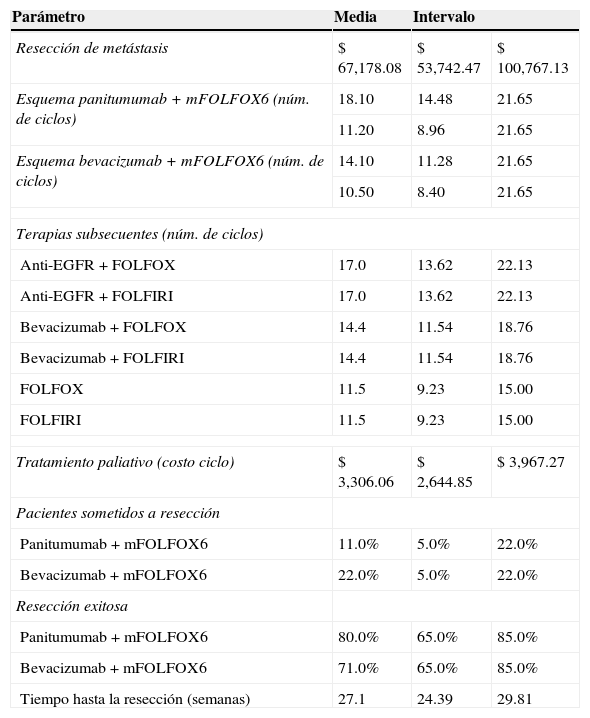
Se efectuó un análisis multivariante de sensibilidad con las variables clave del modelo: número de ciclos de los esquemas de primera y segunda línea, costo de la resección de metástasis, costo de la terapia paliativa, porcentaje de pacientes sometidos a resección, tasa de éxito de la resección y media del tiempo transcurrido hasta que se llevó a cabo la intervención. Los valores utilizados en el caso base y los rangos de variación de cada una de las variables se muestran en la tabla 3.
Parámetros utilizados en el análisis de sensibilidad
| Parámetro | Media | Intervalo | |
|---|---|---|---|
| Resección de metástasis | $ 67,178.08 | $ 53,742.47 | $ 100,767.13 |
| Esquema panitumumab + mFOLFOX6 (núm. de ciclos) | 18.10 | 14.48 | 21.65 |
| 11.20 | 8.96 | 21.65 | |
| Esquema bevacizumab + mFOLFOX6 (núm. de ciclos) | 14.10 | 11.28 | 21.65 |
| 10.50 | 8.40 | 21.65 | |
| Terapias subsecuentes (núm. de ciclos) | |||
| Anti-EGFR + FOLFOX | 17.0 | 13.62 | 22.13 |
| Anti-EGFR + FOLFIRI | 17.0 | 13.62 | 22.13 |
| Bevacizumab + FOLFOX | 14.4 | 11.54 | 18.76 |
| Bevacizumab + FOLFIRI | 14.4 | 11.54 | 18.76 |
| FOLFOX | 11.5 | 9.23 | 15.00 |
| FOLFIRI | 11.5 | 9.23 | 15.00 |
| Tratamiento paliativo (costo ciclo) | $ 3,306.06 | $ 2,644.85 | $ 3,967.27 |
| Pacientes sometidos a resección | |||
| Panitumumab + mFOLFOX6 | 11.0% | 5.0% | 22.0% |
| Bevacizumab + mFOLFOX6 | 22.0% | 5.0% | 22.0% |
| Resección exitosa | |||
| Panitumumab + mFOLFOX6 | 80.0% | 65.0% | 85.0% |
| Bevacizumab + mFOLFOX6 | 71.0% | 65.0% | 85.0% |
| Tiempo hasta la resección (semanas) | 27.1 | 24.39 | 29.81 |
Cada parámetro es generado aleatoriamente dentro de los rangos definidos, con cada nuevo valor se evalúa el modelo y se guarda el resultado, y una vez que se han generado 1,000 simulaciones, se obtienen medias e intervalos de confianza (IC) sobre cada una de las salidas del modelo.
Análisis de minimización de costos con el uso de antirreceptor del factor de crecimiento epitelialActualmente, a nivel institucional se dispone de otro anti-EGFR (cetuximab, clave: 010.000.5475.00 y 010.000.5475.01) aprobado para el tratamiento del cáncer colorrectal metastásico. Sin embargo, ante la falta de evidencia comparativa directa entre ambos terapias, el análisis se limitó a la cuantificación del costo de la atención como primera línea en pacientes con CCRm RAS WT.
ResultadosDel modelo de evaluación se obtiene el costo promedio previsto de atención por paciente con panitumumab y bevacizumab desde el inicio de la primera línea hasta la muerte, donde se manejan costos por conceptos como la prueba para el diagnóstico de mutaciones (prueba RAS), primera línea de tratamiento, eventos adversos, resección de metástasis, segunda línea de tratamiento, consultas médicas, monitorización de la enfermedad, cuidados paliativos y gastos funerarios, lo cual arroja un costo total por paciente de $ 1,048,009.42 con el esquema de panitumumab + mFOLFOX6, y de $ 872,201.70 con bevacizumab + mFOLFOX6, donde el costo total de la atención previa a la progresión de la enfermedad representa el 68.4% y el 51.7% del costo total en los grupos tratados con panitumumab y pevacizumab, respectivamente, con un costo por mes de SG de $ 25,173 con panitumumab y de $2 5,932 con bevacizumab. Por lo tanto, se obtiene una reducción de $ 759 por mes de sobrevida global con el uso de panitumumab en el escenario base (fig. 3).
En el análisis de sensibilidad se obtiene un costo previsto de atención con panitumumab de $ 1,055,020.05 (IC del 95%, $ 1,048,139.51-$ 1,061,900.59) y con bevacizumab de $ 973,632.13 (IC del 95%, $ 965,350.40-$ 981,913.86). A partir de estos valores se obtiene nuevamente el costo por mes de SG (razón costo-efectividad promedio) de $ 25,244.69 (IC del 95%, $ 25,075.13-$ 25,414.25) con panitumumab y de $ 30,209.49 (IC del 95%, $ 29,929.64-$ 30,489.34) con bevacizumab. Esta tendencia favorable a panitumumab es resultado del diferencial en los meses de SG reportado en el estudio PEAK de 41.3 meses frente a 28.9 meses con bevacizumab (fig. 4).
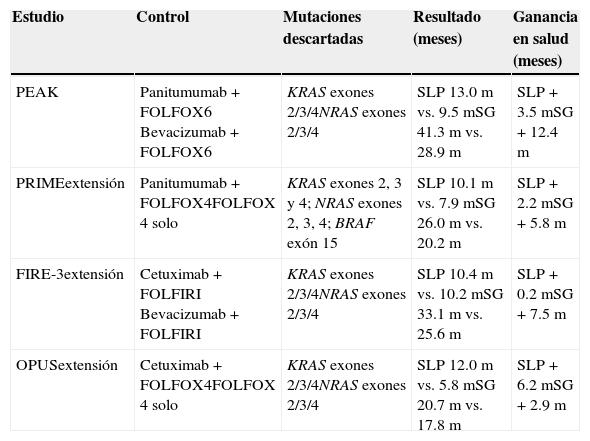
Análisis de minimización de costos con el uso de antirreceptor del factor de crecimiento epitelialPanitumumab y cetuximab son inhibidores del EGFR y ambos han sido evaluados recientemente como primera línea de tratamiento en pacientes con CCRm RAS WT en los estudios PRIME-extensión2, PEAK13, OPUS8 y FIRE-321 (tabla 4).
Estudios empleados en el análisis
| Estudio | Control | Mutaciones descartadas | Resultado (meses) | Ganancia en salud (meses) |
|---|---|---|---|---|
| PEAK | Panitumumab + FOLFOX6 Bevacizumab + FOLFOX6 | KRAS exones 2/3/4NRAS exones 2/3/4 | SLP 13.0m vs. 9.5mSG 41.3m vs. 28.9m | SLP + 3.5mSG + 12.4m |
| PRIMEextensión | Panitumumab + FOLFOX4FOLFOX 4 solo | KRAS exones 2, 3 y 4; NRAS exones 2, 3, 4; BRAF exón 15 | SLP 10.1m vs. 7.9mSG 26.0m vs. 20.2m | SLP + 2.2mSG + 5.8m |
| FIRE-3extensión | Cetuximab + FOLFIRI Bevacizumab + FOLFIRI | KRAS exones 2/3/4NRAS exones 2/3/4 | SLP 10.4m vs. 10.2mSG 33.1m vs. 25.6m | SLP + 0.2mSG + 7.5m |
| OPUSextensión | Cetuximab + FOLFOX4FOLFOX 4 solo | KRAS exones 2/3/4NRAS exones 2/3/4 | SLP 12.0m vs. 5.8mSG 20.7m vs. 17.8m | SLP + 6.2mSG + 2.9m |
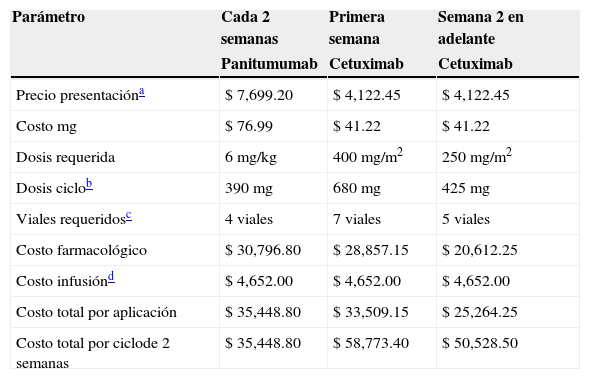
Si bien panitumumab parece producir mayores beneficios que cetuximab en la SG vs. sus respectivos brazos de control, panitumumab presenta ganancias de entre 5.8 y 12.4 meses vs. los controles, en tanto que cetuximab reporta ganancias de entre 2.9 y 7.5 meses vs. los controles. No existen actualmente estudios que los comparen directamente en población con RAS WT. El único antecedente de comparación directa entre ambos agentes anti-EGFR es el estudio ASPECCT, el cual evaluó su uso como monoterapia en pacientes con KRAS WT y fue diseñado para demostrar no inferioridad. Por lo tanto, la evaluación se realizó en términos de costos y únicamente se incluyen el costo de la terapia anti-EGFR y el costo de la infusión (tabla 5).
Costo por ciclo de 2 semanas
| Parámetro | Cada 2 semanas | Primera semana | Semana 2 en adelante |
|---|---|---|---|
| Panitumumab | Cetuximab | Cetuximab | |
| Precio presentacióna | $ 7,699.20 | $ 4,122.45 | $ 4,122.45 |
| Costo mg | $ 76.99 | $ 41.22 | $ 41.22 |
| Dosis requerida | 6mg/kg | 400mg/m2 | 250mg/m2 |
| Dosis ciclob | 390mg | 680mg | 425mg |
| Viales requeridosc | 4 viales | 7 viales | 5 viales |
| Costo farmacológico | $ 30,796.80 | $ 28,857.15 | $ 20,612.25 |
| Costo infusiónd | $ 4,652.00 | $ 4,652.00 | $ 4,652.00 |
| Costo total por aplicación | $ 35,448.80 | $ 33,509.15 | $ 25,264.25 |
| Costo total por ciclode 2 semanas | $ 35,448.80 | $ 58,773.40 | $ 50,528.50 |
Precio por presentación de cetuximab-costos publicados en el portal del Sistema Electrónico de Compras del IMSS (http://compras.imss.gob.mx); el costo de panitumumab fue proporcionado por Amgen México.
El número total de viales se calcula suponiendo que el medicamento sobrante no es utilizado en otro paciente, se presume desperdicio.
Los precios se toman de los «Costos unitarios por nivel de atención médica para 2014 para el IMSS», publicados en el Diario Oficial de la Federación el día 29 de abril del 201422.
Los resultados se proyectan a un horizonte temporal de 10 meses, conforme a la mediana mínima de SLP reportada para panitumumab y cetuximab en población con RAS WT en los estudios PRIME-extensión y FIRE-3.
Como se muestra en la figura 5, el uso de panitumumab genera un ahorro del 30% para las instituciones públicas de salud, lo cual equivale a reducir el gasto por concepto de terapia anti-EGFR en $ 339,998.30 por paciente en un periodo de 10 meses.
ConclusionesEl uso de panitumumab (Vectibix®) como primera línea de tratamiento en adición a una quimioterapia basada en oxaliplatino incrementa significativamente la SLP y mejora en gran medida la SG con respecto al uso de bevacizumab en pacientes con CCRm RAS WT (exones 2, 3 y 4 de KRAS y NRAS), lo cual se traduce en una mejora en los parámetros clínicos de este grupo de pacientes (aproximadamente un 43% del total de los pacientes con CCRm) que, aunada a la evaluación de su razón costo-efectividad media con base en el costo por mes de SG, permite a panitumumab posicionarse como el anticuerpo monoclonal con la mejor relación costo-efectividad en pacientes con RAS WT.
Al efectuar la evaluación económica centrada en el uso de agentes anti-EGFR, se observa que el uso de panitumumab constituye una estrategia costo-ahorradora, con una reducción en los costos totales de tratamiento y administración para las instituciones de salud pública.
FinanciamientoEsta investigación se realizó con el apoyo financiero de AMGEN México, sin que esto generara ningún tipo de compromiso legal y/o sobre los resultados de la misma.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Se extiende un cordial agradecimiento a los médicos con los que se integró un panel de expertos con objeto de identificar el perfil del paciente y práctica clínica habitual en el tratamiento del CCRm en instituciones de salud pública en México:
María del Consuelo Díaz Romero, del Instituto Nacional de Cancerología; Fidel David Huitzil Meléndez, del Instituto Nacional de Ciencia Médicas y Nutrición Salvador Zubirán de la SSa; Miguel Ángel Pluma Jiménez, del Centro Médico Nacional Siglo XXI del IMSS; Miguel Quintana Quintana, del Hospital General Naval de Alta Especialidad de la SEMAR, y Juan Alejandro Silva, del Centro Médico Nacional Siglo XXI del IMSS.