Los tumores del estroma gastrointestinal son lesiones mesenquimatosas derivadas de las células intersticiales de Cajal. El tratamiento más efectivo en la enfermedad primaria localizada es la cirugía. Con imatinib como tratamiento neoadyuvante en las lesiones de alto riesgo o en enfermedad metastásica, la supervivencia a 5 años ha aumentado a cerca del 80%. El objetivo del presente trabajo consiste en analizar los factores pronósticos que determinan la recurrencia y la supervivencia libre de enfermedad en este tipo de tumores.
Material y métodosEstudio observacional, retrospectivo y longitudinal. Pacientes del Hospital de Oncología, CMN Siglo XXI, con confirmación histológica y tratamiento quirúrgico de la lesión primaria.
ResultadosSe identificaron 66 pacientes; la localización más frecuente fue el estómago (66.6%), seguido por el intestino delgado (28.7%) y el colon (1.54%). El 7.57% presentó metástasis en el momento del diagnóstico: 4.54% (3) en hígado y 3.03% (2) en peritoneo. El tamaño promedio de los tumores fue de 10.84cm (2.2 a 38cm). La tasa de supervivencia global a 5 años fue del 82%, y la tasa de supervivencia libre de recurrencia a 5 años del 61%. En el caso de la supervivencia global, la localización de la lesión fue el único factor que mostró significación estadística, con p=0.0054
ConclusiónLa localización del tumor, el tamaño, el número de mitosis, el grupo de riesgo y el tratamiento adyuvante con imatinib fueron estadísticamente significativos como factores pronósticos de recurrencia de la enfermedad. La localización de la lesión fue el único factor que mostró significación estadística como factor pronóstico de supervivencia global.
Gastrointestinal stroma tumours are mesenchymal lesions derived from Cajal interstitial cells. The most effective treatment in primary localised disease is surgery. With imatinib as neoadjuvant treatment in high-risk lesions or metastatic disease, 5-year survival has increased to nearly 80%. The purpose of this work is to analyse prognostic factors that determine recurrence and disease-free survival in this type of tumour.
Material and methodsObservational, retrospective, longitudinal study of patients from the Oncology Hospital, CMN Siglo XXI, with histological confirmation and surgical treatment of the primary lesion.
ResultsSixty-six patients were identified. The most common tumour site was the stomach (66.6%), followed by small bowel (28.7%), and colon (1.54%). At the time of diagnosis, 7.57% had metastasis: 4.54% (3) in the liver and 3.03% (2) in the peritoneum. The mean size of tumours was 10.84cm (2.2 to 38cm). Overall 5-year survival was 82%, and 5-year recurrence-free survival was 61%. In the case of overall survival, the site of the lesion was the only factor showing statistical significance, with P=.0054.
ConclusionTumour location and size, number of mitoses, risk group, and adjuvant treatment with imatinib were statistically significant as prognostic factors of disease recurrence. Lesion location was the only factor that showed statistical significance as a prognostic factor of overall survival.
Los tumores del estroma gastrointestinal (TEGI) son lesiones mesenquimatosas derivadas de las células intersticiales de Cajal1,2; esta definición fue utilizada por primera vez en 1983 por Mazur y Clark3. Los TEGI representan el 0.1-0.3% de las neoplasias gastrointestinales y 10-15% de todos los sarcomas4. La incidencia estimada de este tipo de neoplasia en Europa es de 1.5/100,000/ año5.
Por lo general, los TEGI se presentan en adultos (media de edad de 55-60 años) y rara vez en personas jóvenes. Las presentaciones pediátricas representan el 1-2% del total de casos y constituyen una entidad clínica y patológica diferente. Predominan ligeramente en el sexo masculino6. La mayoría de los casos son esporádicos, aunque existen casos asociados a mutaciones hereditarias en la línea germinal (síndrome familiar de TEGI)7.
Hasta el 95% de los tumores del estroma gastrointestinal son positivos al receptor de tirosina cinasa CD117 (gen KIT) y también pueden ocurrir mutaciones en el receptor alfa del factor de crecimiento derivado de las plaquetas (PDGRFRA), aunque con menor frecuencia (5-8%). Se han descrito TEGI sin mutaciones en KIT o PDGFRA, los cuales son conocidos como TEGI nativos8,9 y pueden ser identificados por el marcador Discovered On GIST DOG1 (descubierto en TEGI).
Aproximadamente el 70% de los TEGI presenta síntomas10, entre los cuales los más frecuentes son sangrado del tubo digestivo (>50%), obstrucción intestinal (35%) y dolor abdominal (20%)11. Hasta un 20% puede cursar asintomático o con síntomas sumamente inespecíficos.
Las localizaciones más frecuentes son estómago (60%), seguido por intestino delgado (yeyuno e íleon 30%, duodeno 5%) y colon (4%). Los TEGI extragastrointestinales surgen del epiplón, el mesenterio y el retroperitoneo10. Su tamaño es variable, y oscila entre menos de 3cm hasta más de 35cm10,12.
Cerca del 50% de los pacientes presenta metástasis en el momento del diagnóstico, comúnmente al hígado y al peritoneo; las metástasis al hueso y al cerebro son raras y ocurren de manera muy tardía en el curso de la enfermedad12–15.
Casi todos los TEGI presentan el potencial para recidivar tras la resección quirúrgica completa del tumor primario. La tasa de recurrencia a 5 años es superior al 50%, con una media de supervivencia libre de recurrencia de 18 a 24 meses16. Los sitios más frecuentes de recurrencia son el hígado (67%), seguido por el peritoneo. Los pacientes con recurrencia posterior al tratamiento quirúrgico presentan enfermedad resecable en el 26-30% de los casos. La tasa de supervivencia a 5 años es de entre el 35% y el 65%. En los pacientes con enfermedad no resecable la media de supervivencia es de 10 a 20 meses11,17–22.
Material y métodosSe llevó a cabo un estudio observacional, retrospectivo y longitudinal. Los pacientes seleccionados para el estudio fueron aquellos con diagnóstico histológico de TEGI y con tratamiento quirúrgico de la lesión primaria, admitidos en el Hospital de Oncología del Centro Médico Nacional Siglo XXI, IMSS, en el periodo comprendido entre el 1 de enero de 1991 y el 30 de abril de 2012. Fueron excluidos los pacientes con expediente clínico incompleto o falta de corroboración del diagnóstico histológico por parte del Departamento de Patología del Hospital de Oncología.
Las variables evaluadas como factores pronósticos fueron la edad (menores y mayores de 50 años), el género, la presencia o ausencia de comorbilidades, el tamaño de la lesión primaria (≤5cm, >5cm, ≤10cm y >10cm), localización, número de mitosis por 50/CSF (≤5 y >5), perfil de inmunohistoquímica (CD117, CD34, S-100, desmina y actina de músculo liso), presencia o ausencia de enfermedad metastásica en el momento del diagnóstico, tipo de cirugía (multiestructural y no multiestructural), rotura de la cápsula del tumor, grupo de riesgo (de acuerdo con la clasificación de los Institutos Nacionales de Salud de EE. UU.) y tratamiento con imatinib.
Los análisis de supervivencia global y supervivencia libre de enfermedad actuariales fueron calculados a 12, 36, 60 y 120 meses.
ResultadosCaracterísticas clínicasEntre el 1 de enero de 1991 y el 30 de abril de 2012 se encontraron 66 pacientes con diagnóstico histopatológico de TEGI, en quienes se pudo realizar la resección tumoral y que contaban con expediente clínico completo. La media de la edad fue de 58 años (rango de 24 a 89); de los 66 pacientes 28 fueron hombres y 38 mujeres. Nueve de los 66 pacientes fueron sometidos a tratamiento quirúrgico fuera del Hospital de Oncología, pero su seguimiento fue llevado a cabo en dicho hospital. La media del tiempo de seguimiento fue de 55.86 meses, con un rango de 0.2 a 204.13 meses (17 años).
El 80.3% (53) de los pacientes presentó síntomas y en 3 casos (4.54%) el hallazgo de la lesión fue incidental. El síntoma más frecuente fue dolor abdominal (26 pacientes, 39.39%), seguido por sangrado del tubo digestivo alto o bajo (20, 30.30%). Los otros síntomas fueron distensión abdominal, síndrome anémico, obstrucción intestinal, pérdida de peso, estreñimiento y, en un caso, palpación del tumor por parte del paciente.
La localización primaria más frecuente fue el estómago, seguido por el intestino delgado, mesenterio, colon y un caso en el que no fue posible determinar el órgano de origen de la lesión. En 14 casos fue posible identificar el segmento del intestino delgado en que se encontró la lesión: 6 (9.09%) correspondieron al duodeno, 6 (9.09%) al yeyuno y 2 (3.03%) al íleon.
El tamaño promedio de los tumores fue de 10.84cm, con un rango de 2.2 a 38cm. El tamaño se distribuyó en 3 grupos: 16 (24.24%) fueron menores a 5cm, 17 (25.75%) se ubicaron en el rango de 5 a 10cm y 21 (31.81%) fueron mayores a 10cm.
Se encontraron 5 (7.57%) pacientes con enfermedad metastásica con posibilidades de resección completa durante la extracción de la lesión primaria. En 3 (4.54%) de estos casos las lesiones metastásicas eran hepáticas y en 2 (3.03%) peritoneales.
Características histopatológicasEn 26 de los 66 pacientes fue posible saber el número de mitosis del tumor: 7 (10.6%) presentaron una mitosis por 50 CSF, 12 (18.18%) de 2 a 5 mitosis por 50 CSF y 7 (10.6%) más de 5 mitosis en 50 CSF.
Tratamiento y resultadosTodos los pacientes incluidos en el estudio fueron sometidos a resección quirúrgica de la lesión: 20 (30.30%) resección gástrica en cuña, 13 (19.69%) gastrectomía subtotal, 5 (7.57%) gastrectomía total, 12 (18.18%) resección intestinal, 13 (19.69%) resección multiestructural y en 3 casos (4.54%) algún otro tipo de resección.
Las intervenciones se clasificaron a su vez en 2 grupos: resecciones multiestructurales (17, 25.75%) y no multiestructurales (49, 74.24%).
Se detectó recurrencia en 25 de los 66 pacientes estudiados (37.87%): 5 en el grupo de bajo riesgo, 4 en el de riesgo intermedio y 11 en el grupo de alto riesgo; en 5 casos no se contó con información suficiente para asignarles un grupo de riesgo. En 13 casos (19.69%) la recurrencia fue en el hígado, en 5 (7.57%) en el peritoneo y en un caso en el pulmón; además, se presentaron 4 casos (6.06%) de recurrencia local. Quince pacientes con recurrencia o metástasis de la enfermedad (22.72%) fueron sometidos a una segunda intervención quirúrgica, con la finalidad de limitar la enfermedad o lograr su resección completa.
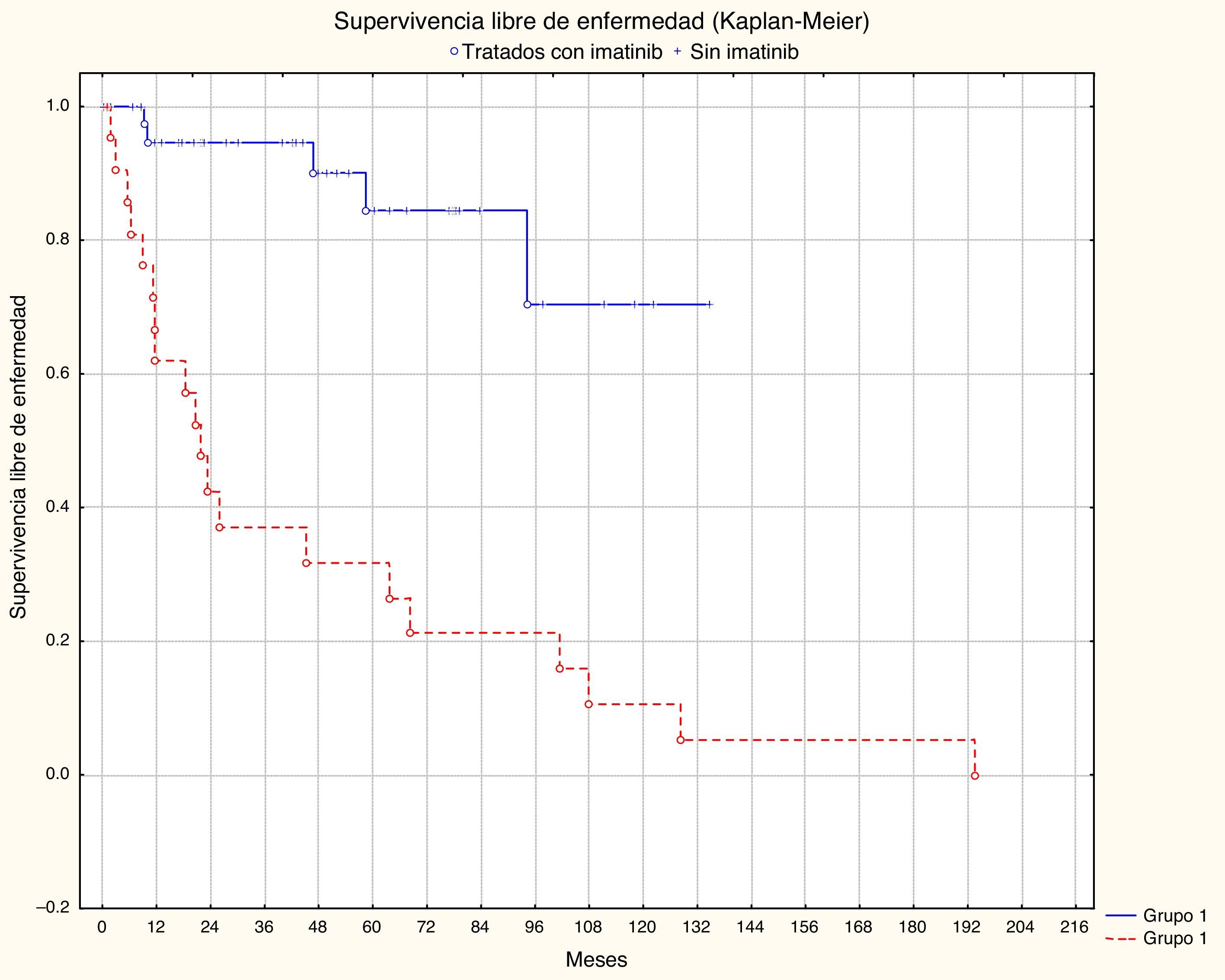
Recibieron tratamiento adyuvante con mesilato de imatinib 22 (33.33%) pacientes: 2 casos del grupo de bajo riesgo, 4 del de riesgo intermedio, 10 del de alto riesgo y 6 en los que el grupo de riesgo no fue asignado para este estudio por falta de datos en el expediente clínico.
Análisis de supervivenciaSe analizaron los datos de 66 pacientes que satisficieron los criterios de inclusión. Se observó una media de supervivencia libre de recurrencia de 45 meses (rango de 0.20-193.46 meses) y una media de supervivencia global de 60.33 meses (rango de 0.16-204.133 meses).
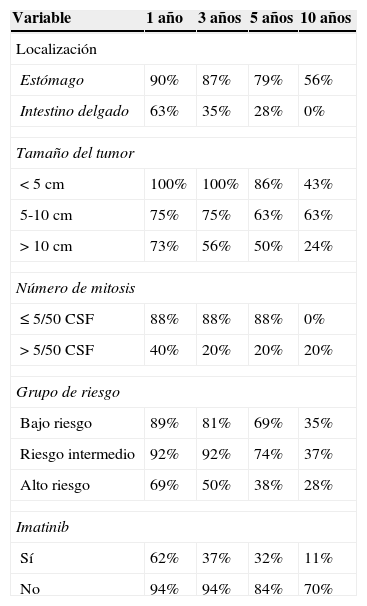
La tasa de supervivencia libre de recurrencia actuarial a 1, 3, 5 y 10 años fue del 81%, el 70%, el 61% y el 39%, respectivamente, en tanto que la tasa de supervivencia global a 1, 3, 5 y 10 años fue del 97%, el 93%, el 82% y el 75%.
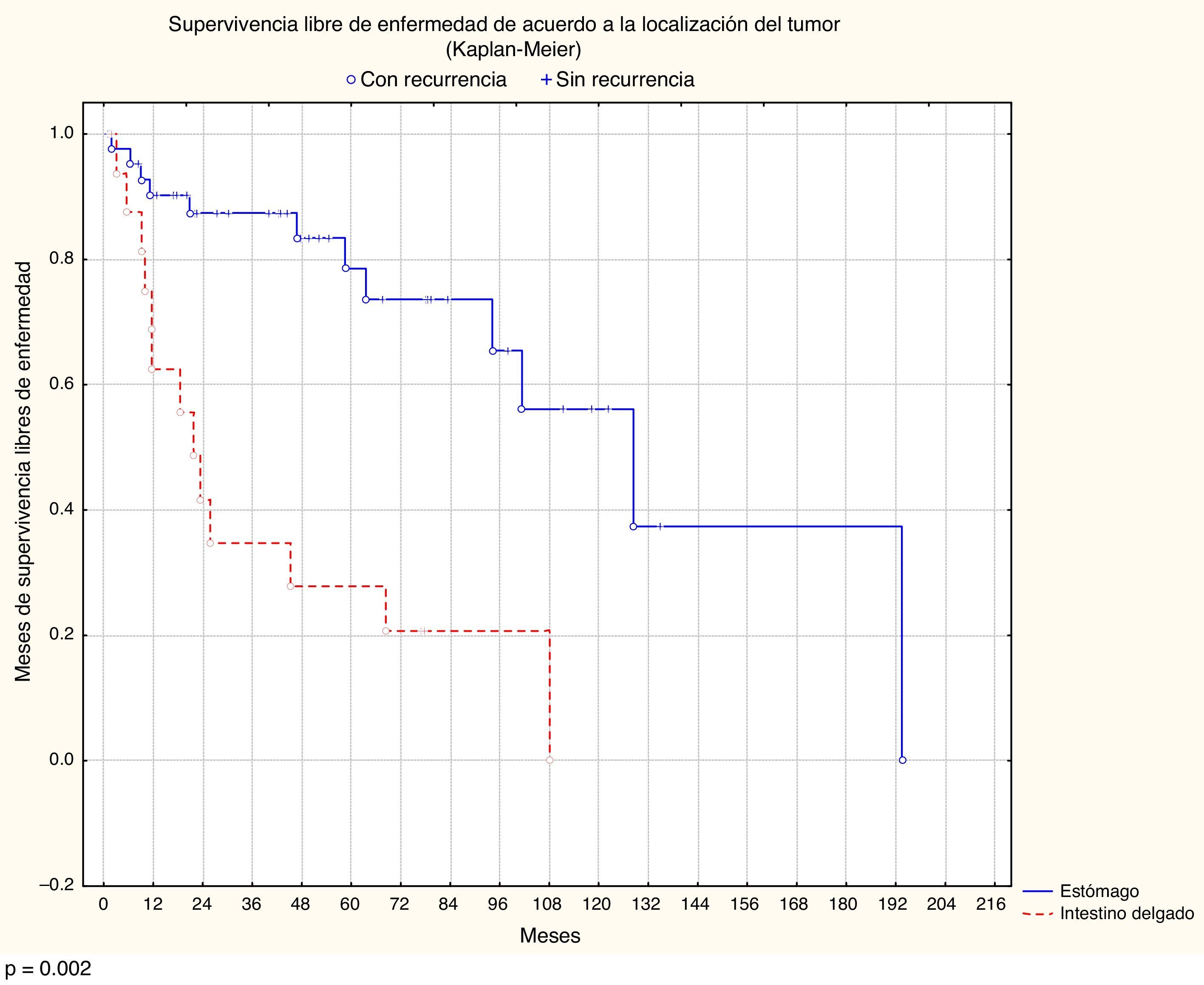
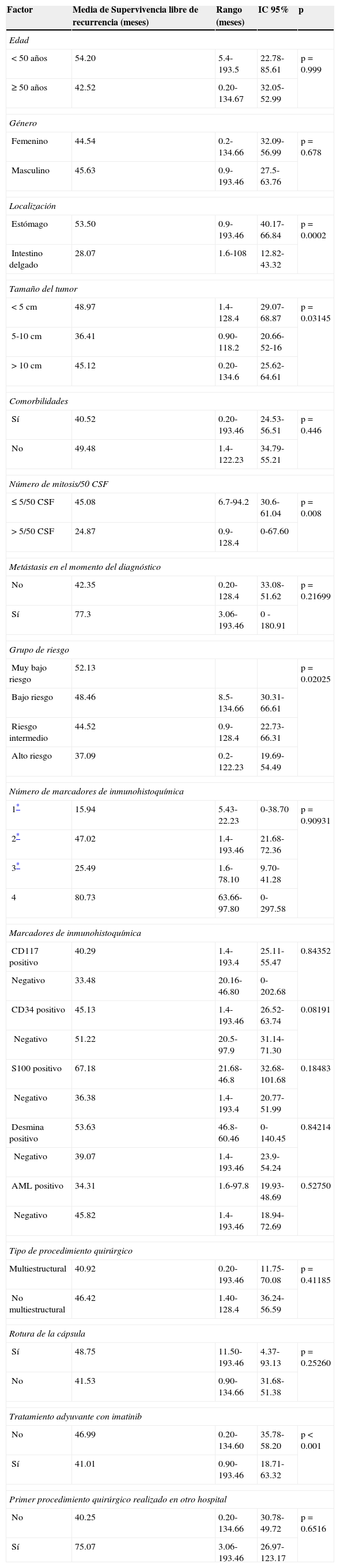
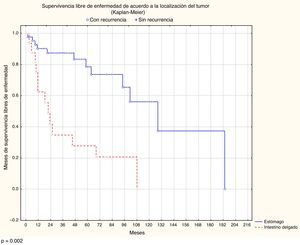
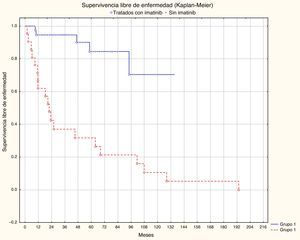
La localización y el tamaño del tumor, el número de mitosis, el grupo de riesgo y el tratamiento adyuvante con imatinib mostraron una diferencia estadísticamente significativa en el análisis multivariado de la supervivencia libre de recurrencia. El tamaño tuvo un valor p=0.03145, la localización p=0.0002, el número de mitosis p=0.008 y el grupo de riesgo p=0.02025 (figs. 1 y 2; tabla 1).
Supervivencia libre de recurrencia de acuerdo a diversos factores pronósticos
| Factor | Media de Supervivencia libre de recurrencia (meses) | Rango (meses) | IC 95% | p |
|---|---|---|---|---|
| Edad | ||||
| <50 años | 54.20 | 5.4-193.5 | 22.78-85.61 | p=0.999 |
| ≥50 años | 42.52 | 0.20-134.67 | 32.05-52.99 | |
| Género | ||||
| Femenino | 44.54 | 0.2-134.66 | 32.09-56.99 | p=0.678 |
| Masculino | 45.63 | 0.9-193.46 | 27.5-63.76 | |
| Localización | ||||
| Estómago | 53.50 | 0.9-193.46 | 40.17-66.84 | p=0.0002 |
| Intestino delgado | 28.07 | 1.6-108 | 12.82-43.32 | |
| Tamaño del tumor | ||||
| <5cm | 48.97 | 1.4-128.4 | 29.07-68.87 | p=0.03145 |
| 5-10cm | 36.41 | 0.90-118.2 | 20.66-52-16 | |
| >10cm | 45.12 | 0.20-134.6 | 25.62-64.61 | |
| Comorbilidades | ||||
| Sí | 40.52 | 0.20-193.46 | 24.53-56.51 | p=0.446 |
| No | 49.48 | 1.4-122.23 | 34.79-55.21 | |
| Número de mitosis/50CSF | ||||
| ≤5/50CSF | 45.08 | 6.7-94.2 | 30.6-61.04 | p=0.008 |
| >5/50CSF | 24.87 | 0.9-128.4 | 0-67.60 | |
| Metástasis en el momento del diagnóstico | ||||
| No | 42.35 | 0.20-128.4 | 33.08-51.62 | p=0.21699 |
| Sí | 77.3 | 3.06-193.46 | 0 -180.91 | |
| Grupo de riesgo | ||||
| Muy bajo riesgo | 52.13 | p=0.02025 | ||
| Bajo riesgo | 48.46 | 8.5-134.66 | 30.31-66.61 | |
| Riesgo intermedio | 44.52 | 0.9-128.4 | 22.73-66.31 | |
| Alto riesgo | 37.09 | 0.2-122.23 | 19.69-54.49 | |
| Número de marcadores de inmunohistoquímica | ||||
| 1* | 15.94 | 5.43-22.23 | 0-38.70 | p=0.90931 |
| 2* | 47.02 | 1.4-193.46 | 21.68-72.36 | |
| 3* | 25.49 | 1.6-78.10 | 9.70-41.28 | |
| 4 | 80.73 | 63.66-97.80 | 0-297.58 | |
| Marcadores de inmunohistoquímica | ||||
| CD117 positivo | 40.29 | 1.4-193.4 | 25.11-55.47 | 0.84352 |
| Negativo | 33.48 | 20.16-46.80 | 0-202.68 | |
| CD34 positivo | 45.13 | 1.4-193.46 | 26.52-63.74 | 0.08191 |
| Negativo | 51.22 | 20.5-97.9 | 31.14-71.30 | |
| S100 positivo | 67.18 | 21.68- 46.8 | 32.68-101.68 | 0.18483 |
| Negativo | 36.38 | 1.4-193.4 | 20.77-51.99 | |
| Desmina positivo | 53.63 | 46.8-60.46 | 0-140.45 | 0.84214 |
| Negativo | 39.07 | 1.4-193.46 | 23.9-54.24 | |
| AML positivo | 34.31 | 1.6-97.8 | 19.93-48.69 | 0.52750 |
| Negativo | 45.82 | 1.4-193.46 | 18.94-72.69 | |
| Tipo de procedimiento quirúrgico | ||||
| Multiestructural | 40.92 | 0.20-193.46 | 11.75-70.08 | p=0.41185 |
| No multiestructural | 46.42 | 1.40-128.4 | 36.24-56.59 | |
| Rotura de la cápsula | ||||
| Sí | 48.75 | 11.50-193.46 | 4.37-93.13 | p=0.25260 |
| No | 41.53 | 0.90-134.66 | 31.68-51.38 | |
| Tratamiento adyuvante con imatinib | ||||
| No | 46.99 | 0.20-134.60 | 35.78-58.20 | p<0.001 |
| Sí | 41.01 | 0.90-193.46 | 18.71-63.32 | |
| Primer procedimiento quirúrgico realizado en otro hospital | ||||
| No | 40.25 | 0.20-134.66 | 30.78-49.72 | p=0.6516 |
| Sí | 75.07 | 3.06-193.46 | 26.97-123.17 | |
AML: actina de músculo liso; CSF: campos seco fuerte.
En el caso de supervivencia global la localización de la lesión fue el único factor que mostró significación estadística, con p=0.0054.
Se observó una media de supervivencia libre de recurrencia de 45 meses (rango de 0.20 a 193.46 meses) y una media de supervivencia global de 60.33 meses (rango de 0.16 a 204.133 meses).
DiscusiónLos TEGI son neoplasias mesenquimatosas poco frecuentes, en los cuales la resección quirúrgica con márgenes negativos constituye el tratamiento de elección23. El riesgo de recurrencia está presente en todos los TEGI, incluso en los de muy bajo riesgo. Muchos de los factores pronósticos considerados para los TEGI aún son controvertidos24–26.
El tratamiento adyuvante de los TEGI de alto riesgo y los TEGI con enfermedad metastásica con terapia molecular dirigida (mesilato de imatinib) ha elevado las tasas de supervivencia a más del 80%. Considerando la existencia de un tratamiento eficaz para las lesiones de alto riesgo, es de suma importancia la identificación de factores que permitan seleccionar a los pacientes que se beneficiarán con cada uno de los tratamientos disponibles27–30.
La posibilidad de predecir la recurrencia posoperatoria de cualquier tumor primario tratado con resección quirúrgica es importante por varias razones: los pacientes pueden ser orientados adecuadamente en función de su resultado estimado, se puede seleccionar adecuadamente a los candidatos a tratamiento adyuvante, y los médicos a cargo pueden seleccionar el tipo y la frecuencia del seguimiento postoperatorio (exploración física, estudios de laboratorio e imagen). Asimismo, en el contexto de un sistema de solidaridad social podría ayudar a planear y distribuir los recursos de diagnóstico y tratamiento de una manera más equitativa y oportuna31–34.
Antes del advenimiento de los inhibidores de la tirosina cinasa en 2002, la respuesta de los TEGI a la quimioterapia era inferior al 5%. Los resultados en los pacientes con enfermedad localmente avanzada, en los pacientes con TEGI no resecable y en los pacientes con enfermedad metastásica son similares. Con el uso de mesilato de imatinib como tratamiento adyuvante en las lesiones de alto riesgo o en enfermedad metastásica, la supervivencia a 5 años y la supervivencia global han mejorado significativamente hasta alcanzar cifras cercanas al 80%35–40.
El mesilato de imatinib ha cambiado la evolución de los pacientes con TEGI no resecables, inoperables o metastásicos. También es utilizado como tratamiento adyuvante en TEGI localizados de alto riesgo que han sido completamente resecados41–43.
La primera línea de tratamiento con imatinib produce altos índices de control de la enfermedad en los pacientes con enfermedad avanzada; sin embargo, la mayoría de los pacientes experimenta progresión de la enfermedad tras 2-3 años de iniciado el tratamiento debido a la urgencia de clonas molecularmente resistentes a imatinib44–46.
En los pacientes con enfermedad recurrente o metastásica y buena respuesta a imatinib, se puede llevar a cabo la resección de las lesiones en que se haya desarrollado resistencia secundaria. Hasta este momento no existen criterios definitivos sobre qué lesiones metastásicas o recurrentes son resecables o no; esto se debe definir caso por caso conforme al tamaño y la localización de la lesión y el riesgo del paciente47–51. El tiempo idóneo sugerido para el abordaje quirúrgico en estos casos es dentro del primer año de tratamiento con imatinib52–54.
Análisis de recurrencia y supervivenciaLa tasa de supervivencia histórica a 5 años oscila entre el 35% y el 65% en los pacientes sometidos a resección quirúrgica completa55,56. En este estudio se encontró una supervivencia global actuarial a 1, 3,5 y 10 años del 97%, el 93%, el 82% y el 75%; la tasa de supervivencia a 5 años en esta serie de casos es superior a las de otros reportes. La media de supervivencia fue de 60 meses en el grupo de pacientes analizados (tabla 2).
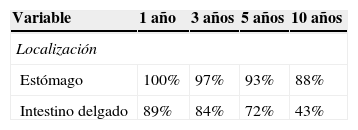
Más del 50% de los TEGI presenta recurrencia a 5 años de la resección completa del tumor primario. La supervivencia libre de recurrencia actuarial en la serie presentada a 1, 3, 5 y 10 años fue del 81%, el 70%, el 61% y el 39% respectivamente. En el grupo de pacientes reportado, la probabilidad de llegar a 5 años de seguimiento sin recurrencia de la enfermedad fue del 61%; por lo tanto, los índices de recurrencia en los pacientes estudiados son inferiores a los observados en series previas. La media del tiempo hasta la recurrencia fue de 45 meses, frente a los 18-24 meses considerados por otros autores en artículos de revisión (tabla 3).
Tasa de supervivencia libre de recurrencia
| Variable | 1 año | 3 años | 5 años | 10 años |
|---|---|---|---|---|
| Localización | ||||
| Estómago | 90% | 87% | 79% | 56% |
| Intestino delgado | 63% | 35% | 28% | 0% |
| Tamaño del tumor | ||||
| <5cm | 100% | 100% | 86% | 43% |
| 5-10cm | 75% | 75% | 63% | 63% |
| >10cm | 73% | 56% | 50% | 24% |
| Número de mitosis | ||||
| ≤5/50CSF | 88% | 88% | 88% | 0% |
| >5/50CSF | 40% | 20% | 20% | 20% |
| Grupo de riesgo | ||||
| Bajo riesgo | 89% | 81% | 69% | 35% |
| Riesgo intermedio | 92% | 92% | 74% | 37% |
| Alto riesgo | 69% | 50% | 38% | 28% |
| Imatinib | ||||
| Sí | 62% | 37% | 32% | 11% |
| No | 94% | 94% | 84% | 70% |
CSF: campos seco fuerte.
Los pacientes con recurrencia posterior al tratamiento quirúrgico presentan enfermedad resecable en el 26-30% de los casos; en el 67% de los casos el hígado es el sitio de recurrencia, seguido por el peritoneo. En el presente estudio se encontró recurrencia en 25 pacientes (37.87%). Doce casos, los cuales representan el 48% de los pacientes con recurrencia, así como el 18% del total de los pacientes estudiados, fueron candidatos a un segundo procedimiento quirúrgico.
Análisis de factores pronósticos de recurrencia y supervivenciaSe encontró que el tamaño de la lesión constituye un factor pronóstico de recurrencia de la enfermedad; sin embargo, no lo es para la supervivencia global. Esta variable pudo verse alterada dependiendo de si la medición se llevó a cabo con la pieza fijada o no.
El grupo de riesgo constituye un factor pronóstico de recurrencia; sin embargo, no lo es en el caso de la supervivencia. Para el análisis se tuvieron que fusionar los casos del grupo de muy bajo riesgo con los del grupo de bajo riesgo. El grupo de alto riesgo constituyó el 27% de los casos tratados y el de bajo riesgo el 28%; es probable que esta distribución se deba a que muchos de los casos de alto riesgo no pueden no haber sido incluidos en el estudio por no ser resecables en el momento del diagnóstico, y por lo tanto no satisfacer los criterios de inclusión requeridos.
Tras la resección primaria, la supervivencia libre de recurrencia a 5 años es del 96% en los pacientes de bajo riesgo, del 54% en los de riesgo intermedio y del 20% en los de alto riesgo (Duensing, 2012), con una media de tiempo hasta la recurrencia de 19-25 meses. En el análisis realizado se encontró una supervivencia libre de recurrencia actuarial a 5 años del 74%, el 69% y el 38% en los grupos de bajo riesgo, riesgo intermedio y alto riesgo, respectivamente.
No se encontraron diferencias significativas en la recurrencia y la supervivencia entre los pacientes sometidos a resecciones no multiestructurales y multiestructurales; en 2 de los casos de resecciones multiestructurales los pacientes fallecieron por complicaciones de la cirugía. La mayor parte de las resecciones multiestructurales se realizaron en tumores originados en el intestino delgado (especialmente en el duodeno).
Es probable que los índices más bajos de supervivencia observados en el grupo de pacientes con resecciones multiestructurales obedezcan a una naturaleza más agresiva del tumor. La necesidad de resecciones multiestructurales en la mayoría de las ocasiones se debe al gran tamaño del tumor, lo cual por sí mismo es un factor de mal pronóstico. Por el momento, aunque el tipo de resección no es un factor pronóstico de recurrencia o supervivencia, sí queda claro que los pacientes con necesidad de resecciones multiorgánicas deben ser referidos a un centro con experiencia, puesto que la morbimortalidad del abordaje resulta muy elevada.
ConclusionesLos TEGI son neoplasias en las que aún quedan varias incógnitas por resolver.
La supervivencia libre de recurrencia a 5 años fue del 61%, con una media de tiempo hasta la recurrencia de 45 meses. La supervivencia global a 5 años fue del 82%, con una media de supervivencia de 60 meses.
La localización y el tamaño del tumor, el número de mitosis, el grupo de riesgo y el tratamiento adyuvante con imatinib mostraron una diferencia estadísticamente significativa en el análisis como factores pronósticos de recurrencia de la enfermedad. La localización de la lesión fue la única variable que mostró significación estadística como factor pronóstico de la supervivencia.
El diagnóstico precoz y la resección radical de la lesión primaria constituyen el tratamiento de referencia para la curación.
Este estudio presenta el grupo más grande de pacientes en México en el que se hayan analizado factores pronósticos de recurrencia y supervivencia en TEGI. Es el primero de este tipo en pacientes del Instituto Mexicano del Seguro Social.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.