El cáncer colorrectal es una de las neoplasias malignas más frecuentes en el mundo. El tratamiento de las etapas avanzadas ha sufrido un cambio profundo que se ha reflejado en un efecto directo en la supervivencia global media. Esto se debe, en parte, a la introducción de nuevos tratamientos farmacológicos conocidos como "terapias blanco".
Actualmente, se dispone de agentes novedosos que están dirigidos a bloquear el crecimiento tumoral mediante la inhibición de la angiogénesis (bevacizumab) o inhibición del receptor de factor de crecimiento epidérmico (cetuximab y panitumumab).
Estas terapias han demostrado un beneficio tanto en el tratamiento de pacientes con enfermedad sistémica irresecable, como en enfermedad oligometastásica, en donde el objetivo es ofrecer un tratamiento potencialmente curativo.
La evidencia actual ha llevado a la optimización de los recursos y al descubrimiento de factores predictivos de respuesta, como el caso de los genes de la familia RAS (K-, N-) y BRAF. Sin embargo, hay un grupo de pacientes, desde luego menor, en los que estos factores no nos ayudan a personalizar su tratamiento, ya que el crecimiento tumoral se expresa en diferentes alteraciones moleculares en cada paciente.
Colorectal cancer is one of the most frequent neoplasms in the world. The treatment of this disease, in the advance setting, has suffered a deep change with a direct impact on the median overall survival. This is due to, in part, the introduction of new pharmacologic treatments known as "targeted therapy".
Currently, novel agents targeted to block tumor growth by inhibiting angiogenesis (bevacizumab) or by inhibiting the epidermal growth factor receptor (cetuximab and panitumumab) are available.
These therapies have shown a benefit in patients with systemic unresectable disease, as in those patients with oligometastatic disease, where the endpoint is offering a potentially curative treatment.
The available evidence has driven us to the optimization of the resources with the discovery of predictive factors of response, such as the RAS (K-, N-) and BRAF gene family. Nevertheless, there are still some patients, admittedly a few, who cannot be identified by means of these factors, since tumor growth is driven by other molecular alterations.
Introducción
El cáncer colorrectal es una de las neoplasias malignas más frecuentes en el mundo1. En México, la mortalidad por esta enfermedad ha aumentado en los últimos 10 años2.
Los avances en el conocimiento de la biología tumoral han llevado al descubrimiento de nuevos agentes terapéuticos dirigidos a un blanco específico, conocidos como "terapias blanco". Actualmente, se cuenta con 3 anticuerpos monoclonales para el tratamiento de primera línea del cáncer colorrectal metastásico. Bevacizumab (que inhibe la angiogénesis tumoral) y los anticuerpos anti-EGFR, como cetuximab y panitumumab, de utilidad únicamente en pacientes sin mutaciones en el gen de KRAS y NRAS, el cual se encuentra en aproximadamente 60% de los pacientes3.
Estas terapias pueden ser utilizadas tanto para el tratamiento paliativo de pacientes con enfermedad metastásica múltiple como para enfermedad oligometastásica, en los cuales la quimioterapia "neoadyuvante" y la conversión a enfermedad resecable pueden brindar un objetivo potencialmente curativo4.
En esta revisión abarcaremos de una manera breve, el papel de las terapias blanco como tratamientos efectivos en la primera línea de cáncer colorrectal y la evidencia disponible sobre su efectividad en la quimioterapia de conversión con un enfoque que se dirige hacia una terapia personalizada, de acuerdo con los diversos biomarcadores existentes hasta el momento.
Epidemiología
El cáncer colorrectal es la tercera neoplasia maligna más frecuente en hombres y la segunda en mujeres en el mundo. Las mayores tasas de incidencia se han reportado en Australia, Nueva Zelanda, europa y Norteamérica. En algunos países asiáticos, como Japón, ha aumentado debido a cambios en los patrones dietéticos, obesidad e incremento en el consumo de tabaco1.
En México, el registro Histopatológico de Neoplasias Malignas reportó 3,626 casos diagnosticados, 2,827 muertes en 2003, y que la frecuencia es más alta en hombres que en mujeres5.
De acuerdo con datos provenientes del INeGI, la mortalidad por cáncer colorrectal en México ha aumentado en los últimos 10 años: 4,056 muertes en el año 2010, en comparación con 1998, cuando se reportaron 2,386 decesos. Ello representa la sexta causa de muerte por cáncer en ambos sexos2. No es claro si esto se debe al aumento en la incidencia del cáncer colorrectal o a limitantes en el registro de las causas de muerte, por todas las causas en México.
Histopatología y factores pronósticos
El tipo histológico más común del cáncer de colon es el adenocarcinoma, que representa aproximadamente del 90%-95% de todos los tumores de colon; mientras que el adenocarcinoma mucinoso o coloide representa alrededor de 17% (estos adenocarcinomas se definen por la gran cantidad de mucina extracelular retenida dentro del tumor); y sólo del 2%-4% corresponde a adenocarcinoma con células en anillo de sello. Existen otras variantes poco comunes de tumores epiteliales que incluyen los carcinomas de células escamosas (epidermoides) y carcinomas adenoescamosos, a veces llamados también adenoacantomas. Asimismo, se encuentran los carcinomas indiferenciados, que no contienen estructuras glandulares u otras características como secreciones mucosas. Otros tipos de tumores que pueden aparecer en el colon incluyen los tumores carcinoides y tumores no epiteliales como leiomiosarcomas, neoplasias linfoides y hematopoyéticas y tumores del estroma gastrointestinal (GIST)6.
Pronóstico de la enfermedad avanzada o metastásica
De manera general, la supervivencia global (SG) media de los pacientes con cáncer colorrectal sin tratamiento es de aproximadamente 5-6 meses; con tratamiento a base de 5-Fu alcanza los 10-12 meses. Con el uso de dobletes a base de 5-Fu con oxaliplatino o irinotecán, las tasas de respuesta han incrementado cerca de 50% con SG de 18-24 meses. El pronóstico está determinado por diversos factores como etapa y biología del tumor y los relacionados con el paciente; los cuales pueden ser modificados por la intervención terapéutica. Sin embargo, existen factores predictivos que pueden ser de utilidad para decidir el mejor tratamiento, con respecto a la intensidad, selección de fármacos y combinación de tratamiento de primera línea.
¿ Relacionados con el tumor:
• Carcinomatosis peritoneal sintomática.
• Múltiples sitios de metástasis/enfermedad extensa.
¿ Bioquímica
• Eficacia después del inicio del tratamiento.
• ACE elevación y/o descenso.
¿ Molecular
• Mutación de KRAS/NRAS.
Intención del tratamiento del cáncer colorrectal metastásico: primera línea
La selección del tratamiento dependerá siempre del objetivo. Se tomará en cuenta la presentación clínica, comportamiento de la enfermedad (sitios de metástasis, dinámica de la progresión, síntomas a paliar, marcadores moleculares o bioquímicos), factores relacionados con el paciente (comorbilidades, potencial de realizarse una resección) y los relacionados con los fármacos (toxicidades y disponibilidad de las terapias blanco).
Se ha propuesto una estratificación para los pacientes en primera línea de tratamiento, con la intención de orientar mejor el tratamiento. Se describen 4 grupos:
Grupo 0: Metástasis hepáticas o pulmonares resecables: pacientes en lo que claramente se puede realizar R0 incluso sin necesidad de QT preoperatoria.
Grupo 1: Metástasis hepáticas o pulmonares no resecables (R1 o R0). Busca la reducción tumoral con la quimioterapia de inducción, permitiendo realizar una cirugía.
Grupo 2: Tratamiento intermedio o intensivo. El objetivo es paliativo, no curativo. Sin embargo, es importante la disminución tumoral para paliación de síntomas o de complicaciones asociadas. Se utiliza un esquema de primera línea muy activo.
Grupo 3: Tratamiento no intensivo, secuencial, cuyo objetivo es el control de los síntomas, aumento en la supervivencia con la menor toxicidad posible.
Importancia del gen KRAS y otros biomarcadores
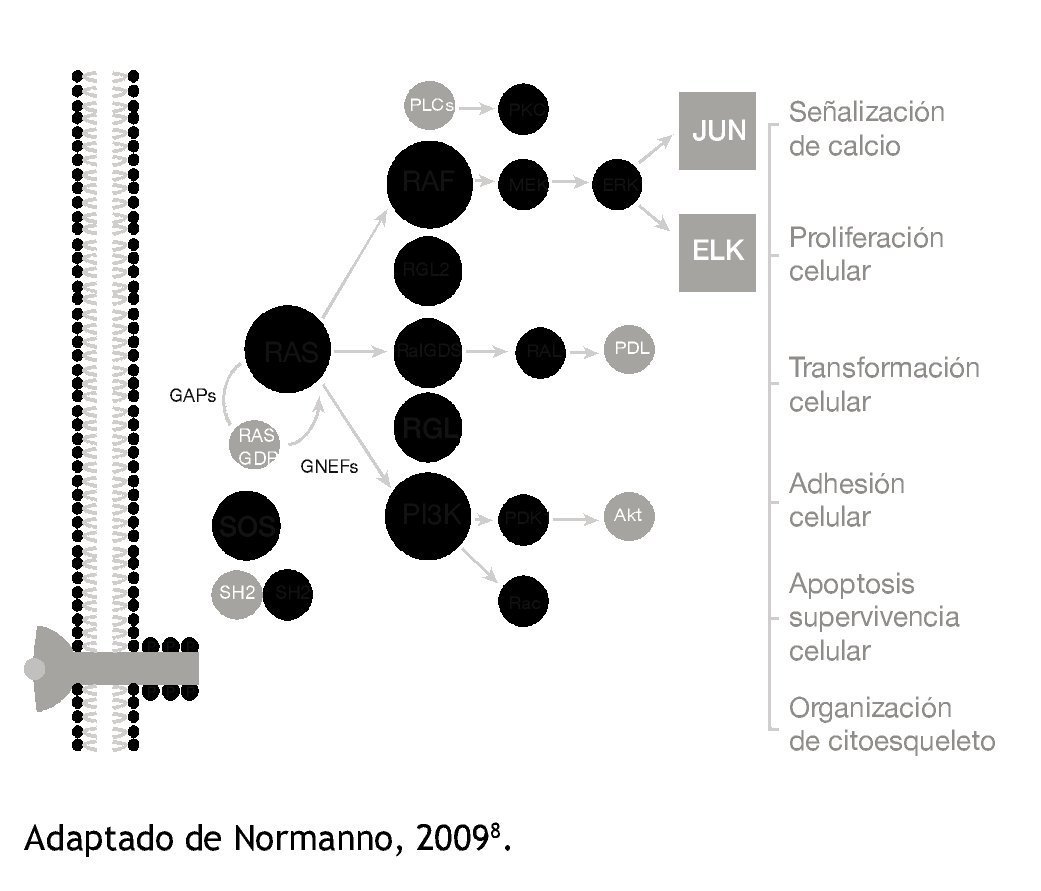
El cáncer colorrectal es una enfermedad heterogénea definida por diferentes mutaciones en diversos receptores de tirosin cinasa (RTC) o mutaciones de activación o de pérdida de la función en componentes corriente abajo de vías intracelulares activadas por RTCs. Por tanto, la eficacia de las terapias dirigidas está ligada a las alteraciones moleculares específicas de cada tumor7. El EGFR (o ERBB1/HER1) es un RTC que pertenece a la familia ERBB. Al activarse, se activan vías de señalización corriente abajo, como son la del fosfatidil inositol 3-cinasa (PI3K)/AKT y RAS/MAP2K, también llamado ERK2/1 (fig. 1)8.
Figura 1 Señalización RAS en cáncer de colon.
cirugía. Los primeros indicios del efecto terapéutico de esta mutación fueron descritos en los últimos años, cuando las mutaciones en el proto-oncogén de KRAS fueron consideradas de pobre respuesta al tratamiento anti-EGFR para cáncer colorrectal metastásico9. Esto favoreció la práctica de determinar el estado del KRAS en los pacientes con cáncer colorrectal metastásico, en donde el uso de los anticuerpos anti-EGFR como panitumumab y cetuximab reflejó un beneficio en pacientes sin mutaciones del KRAS10,11. Ello permitió el nacimiento de la terapia personalizada en el cáncer.
Sin embargo, en los últimos años se ha identificado que tanto el grupo de pacientes con KRAS mutado, como el grupo de pacientes con KRAS no mutado, son heterogéneos de acuerdo con su pronóstico clínico.
Por un lado, se ha observado que las mutaciones del gen KRAS se encuentran presentes en aproximadamente 40% de los pacientes con cáncer colorrectal. Las más frecuentes se hallan en el codón 12 y 13 del KRAS y se han identificado como un biomarcador pronóstico negativo9. No obstante, las mutaciones en el codón 13 (G13D), presentes en alrededor de 8% al 20% de los tumores con KRAS mutado, se han relacionado -en estudios retrospectivos- con un beneficio del tratamiento con terapias anti-EGFR como cetuximab12.
Por otro lado, se ha encontrado que mutaciones en otros genes distintos al KRAS pueden influir en la respuesta a anticuerpos anti-EGFR.
El BRAF es un miembro de la familia RAF (BRAF, ARAF1 y RAF 1), codificador de una proteína serina-treonina cinasa que es un efector corriente debajo de la proteína KRAS activado. Aproximadamente 15% de los cánceres colorrectales tiene mutaciones del BRAF. Éstas confieren mal pronóstico y el número de pacientes con tumores con BRAF mutado disminuye conforme incrementa el número de líneas de tratamiento. La mutación más frecuente es la V600E.
Las mutaciones de KRAS y BRAF son mutuamente excluyentes, lo cual sugiere que ocurren en diferentes tipos de tumores y pueden tener distintos pronósticos. Además, las mutaciones del BRAF están asociadas al fenotipo metilador de islas CpG y a inestabilidad microsatélite. Ello se traduce en peor pronóstico que el KRAS para el cáncer colorrectal. En muchos estudios no se mostró respuesta a cetuximab o panitumumab en pacientes con mutaciones en BRAF en el escenario de refractariedad a la quimioterapia7.
En un estudio retrospectivo que evaluó la asociación de mutaciones distintas a KRAS en pacientes con KRAS no mutado tratados con quimioterapia + panitumumab, 17% tenía mutaciones en los genes RAS distintas a las encontradas en el exón 2 (exón 3 o 4 de los genes KRAS y NRAS) y 8% tenía mutaciones del gen BRAF. Los pacientes tratados con FOl-FOX4 + panitumumab (que tenían mutaciones de los genes RAS distintas a las del exón 2) tuvieron SG y supervivencia libre de progresión inferior, en comparación con los pacientes sin mutaciones de KRAS. Las mutaciones de BRAF fueron asociadas a peor pronóstico, pero no fueron identificadas como un factor predictivo negativo13.
Los PI3K son una familia de cinasas lipídicas agrupadas en tres clases, con diferente estructura y preferencia de sustrato. La activación de la clase IA de PI3K es iniciada cuando un factor de crecimiento se une a un RTC que incluye miembros de la familia ERBB, entre otros. Las moléculas de la clase IA son heterodímeros compuestos por una subunidad reguladora (p85) y una catalítica (p110). La isoforma p110 está mutada en alrededor de 15%-18% de los cánceres colorrectales. Éstas pueden coexistir con mutaciones de BRAF y KRAS. Las mutaciones en el exón 20 se han asociado a una pobre respuesta a cetuximab en pacientes con KRAS silvestre7.
La señalización de PI3K es inhibida por la fosfatasa y homólogo de tensina (PTEN). Se ha sugerido que la pérdida de la expresión de PTEN, medida por inmunohistoquímica, está asociada con pérdida del beneficio de cetuximab en cáncer colorrectal. Esta pérdida de expresión puede coexistir con mutaciones en KRAS, BRAF y PI3K. No obstante, la pérdida de expresión de PTEN varía desde 19% hasta 36% y el efecto en las tasas de respuesta y en la supervivencia es contradictorio entre estudios. Además, la pérdida de la expresión de PTEN no es concordante entre el tejido primario y el metastásico, por lo cual este marcador aún no puede considerarse de manera confiable para análisis pronóstico7.
Bevacizumab
El bevacizumab es un anticuerpo monoclonal IgG1 recombinante, humanizado, que neutraliza VEGF-A y previene su unión al receptor de VEGF 2, su receptor primario. Esto resulta en la inhibición de la angiogénesis tumoral y reducción de la presión intersticial intratumoral, lo cual facilita la llegada de la quimioterapia citotóxica14.
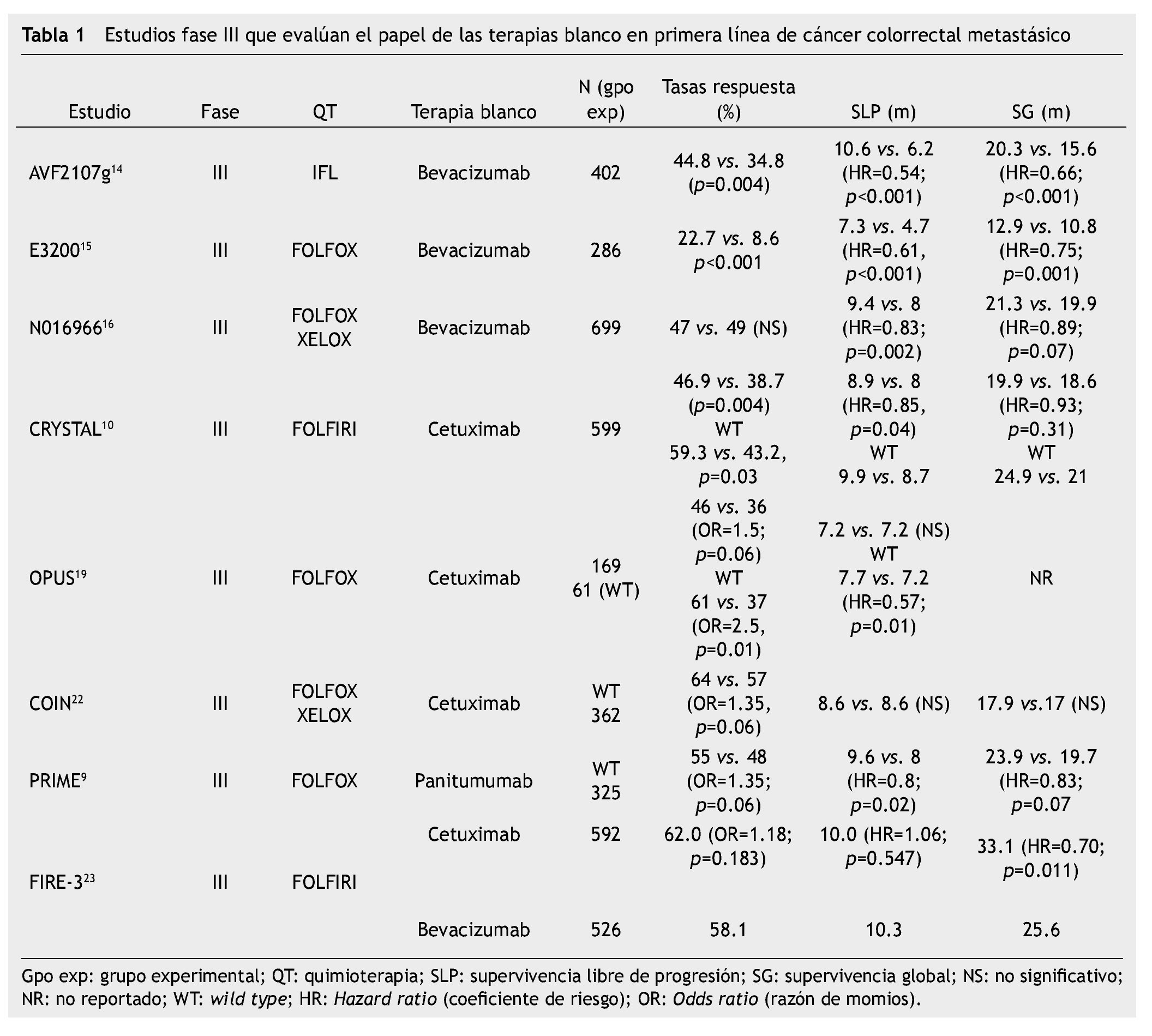
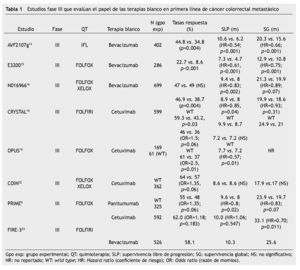
Bevacizumab ha mostrado beneficio clínico en combinaciones con fluoropirimidinas solas y combinadas con oxaliplatino o irinotecán (tabla 1)14.
La mutación del KRAS fue identificada como un factor pronóstico negativo para recurrencia de la enfermedad hace ya más de una década en pacientes con cáncer colorrectal sometidos a
El estudio fase III, realizado por Hurwitz et al. (AVF2107g) llevó a la aprobación inicial de bevacizumab en primera línea por la FDA. Este estudio comparó un esquema de irinotecán, 5-Fu bolo y leucovorin (IFl) con o sin bevacizumab en pacientes con cáncer colorrectal metastásico; y mostró beneficio tanto en SG como en SLP para el grupo de bevacizumab15.
En el estudio factorial NO16966 se aleatorizó a 1,401 pacientes para recibir FOLFOX04 contra el esquema con capecitabina y oxaliplatino (CAPEOX). Ambos grupos eran aleatorizados a su vez para recibir bevacizumab o placebo. El análisis unificado de los grupos de quimioterapia + placebo, contra los grupos con bevacizumab, demostró beneficio en el objetivo primario del estudio que fue la SLP; sin embargo, no mostró beneficio para las tasas de respuesta o la SG16. Hasta el momento no se han encontrado biomarcadores predictivos para el uso de bevacizumab.
Para los pacientes no candidatos a oxaliplatino o irinotecán, la combinación de 5-Fu, leucovorin o capecitabina (en combinación con bevacizumab) ha mostrado beneficio consistente en SLP y, en algunos estudios, en SG14.
El bevacizumab está relacionado con mayores tasas de sangrado, eventos tromboembólicos arteriales (por ejemplo, evento vascular cerebral, infartos del miocardio, ataque isquémico transitorio y angina), perforación gastrointestinal, alteraciones en la cicatrización e hipertensión17,18.
Cetuximab
El cetuximab es un anticuerpo monoclonal IgG1 quimérico dirigido contra el EGFR19. El estudio CRYSTAL20 y el OPuS19 fueron los 2 primeros estudios aleatorizados que compararon la quimioterapia sola contra la quimioterapia con cetuximab en primera línea (tabla 1). En el estudio CRYSTAL, la combinación del esquema FOLFIRI con cetuximab resultó en SLP más prolongada y en mayores tasas de resección de metástasis. En un subanálisis se observó mayor beneficio para pacientes con KRAS silvestre tanto en tasas de respuesta como en SLP y SG. Sin embargo, el estudio OPUS que evaluó el esquema FOLFOX04, en combinación con cetuximab, no logró demostrar beneficio en SLP, aunque si resultó en mejores tasas de respuesta y, al igual que en el estudio CRYSTAL, en un subanálisis, para pacientes con KRAS silvestre, hubo beneficio tanto en tasas de respuesta como en SLP.
El estudio COIN, de fase III, aleatorizó pacientes con cáncer colorrectal metastásico a esquema de quimioterapia basada en oxaliplatino (FOLFOX o CAPEOX), con o sin cetuximab21,22. Este estudio se diseñó con una estratificación por estado del KRAS (silvestre o mutado) antes de la aleatorización. Se demostró beneficio del cetuximab en tasas de respuesta, pero no se cumplió el objetivo primario que era la SLP. Es por esto que se prefiere no utilizar la combinación de oxaliplatino con cetuximab.
El estudio FIRE-323, primer estudio fase III que compara de manera directa terapias blanco en pacientes con cáncer colorrectal metastásico en primera línea, incluyó a pacientes con la mutación KRAS no tratados y comparó a cetuximab + FOLFIRI con bevacizumab + FOLFIRI. Los resultados mostraron que la tasa de respuesta global favoreció el tratamiento con cetuximab en población con ITT; sin embargo, sólo alcanzó significancia estadística en pacientes evaluables para respuesta. Asimismo, la SG fue marcadamente superior (Δ=7.5 meses, HR=0.70) en todos los pacientes con RAS tipo silvestre y que recibieron terapia de primera línea con cetuximab. No se observó beneficio cuando se trató a los pacientes con tumores con RAS mutado con FOLFIRI + cetuximab, en comparación con FOLFIRI + bevacizumab.
Panitumumab
El panitumumab es un anticuerpo monoclonal IgG2 humano dirigido contra el EGFR19. El estudio PRIME evaluó la eficacia de panitumumab en primera línea de cáncer colorrectal metastásico en combinación con quimioterapia a base del esquema FOLFOX, demostrando superioridad en SLP en comparación con la quimioterapia sola10. En 2013, hubo una actualización del estudio, se hizo un análisis de los biomarcadores KRAS (exones 3 y 4) NRAS (exones 2, 3 y 4) y BRAF (exón 15), en cada grupo de tratamiento. Se evidenció un incremento en la SG de los pacientes con RAS no mutado de 5.8 meses24, con IC del 95% del 0.78 (0.62-0.99; p=0.04) y, por otro lado, se observó que las mutaciones de BRAF no tienen un valor predictivo sobre los inhibidores de EGFR.
Terapias de conversión
La resección ofrece posibilidad de cura en pacientes con cáncer colorrectal avanzado con metástasis aisladas hepáticas. Hay series que reportan SG a 5 años, después de la resección de entre el 24% al 58% (media de 40%)25, con tasas de mortalidad generalmente menores al 5%. Mientras que con el empleo únicamente de regímenes de quimioterapia activos, a 5 años se reporta una SG del 11%26.
En el pasado, la presencia de 4 o más lesiones intrahepáticas y de enfermedad bilobar se consideraban contraindicaciones para una resección hepática. Actualmente, las únicas contraindicaciones universalmente aceptadas son:
• Imposibilidad para realizar una resección R0.
• Imposibilidad para preservar un volumen hepático remanente adecuado para la vida y la función.
La quimioterapia de conversión se ha propuesto para designar el uso de quimioterapia de inducción en pacientes con metástasis hepáticas que inicialmente son irresecables.
Los reportes muestran que entre el 12%-33% de estos pacientes pueden tener respuestas objetivas suficientes para permitir una resección completa (R0). Incluso la supervivencia a 5 años, posterior al tratamiento con quimioterapia más metastasectomía R0 de lesiones hepáticas, es similar a la obtenida cuando las lesiones hepáticas son inicialmente resecables (supervivencia a 5 años de 33%-50%)27.
La primera experiencia sobre la quimioterapia de conversión en lesiones hepáticas fue presentada por Bismuth hace más de 10 años28, en la que se obtuvo una tasa de conversión de lesiones hepáticas del 16% con quimioterapia basada en infusión de 5-Fu/leucovorin y oxaliplatino. Asimismo, la SG a 5 años en los pacientes con lesiones hepáticas resecadas fue de 50%28.
De manera general, los esquemas de combinación de 2 fármacos como FOLFOX y FOLFIRI, ofrecen elevadas tasas de respuesta como primera línea de tratamiento en CRCm: tasa de respuesta global de 54%-58%4.
Los tripletes (oxaliplatino/irinotecán y 5-Fu) como FOLFOXIRI también han demostrado un importante aumento en las tasas de respuesta (70%); convertir lesiones hepáticas irresecables en resecables con tasas de resección de 19% y supervivencia global a 8 años de 33%. El estudio del Gruppo Oncologio Nord Ovest (GONO) que comparó FOLFOXIRI con FOLFIRI, demostró aumento en las resecciones R0 de las lesiones hepáticas en el grupo de FOLFOXIRI (36% vs. 12%). En el análisis multivariado, el uso de FOLFOXIRI fue un factor independiente predictivo de resección R027.
Evidencia reciente, tanto del Seer como de series multi-institucionales retrospectivas, con un total de 51,000 pacientes en 16 años (1990-2006), ha demostrado que el uso secuencial de quimioterapia y resección de lesiones hepáticas mejoran el panorama global en el CRCm27.
Papel de los anticuerpos para incremento de las tasas de resección
Bevacizumab
Dos estudios son los que han dado más información sobre bevacizumab en este contexto. El estudio first BEAT, observacional y fase IV, donde bevacizumab fue añadido a la mejor quimioterapia escogida por el médico. En este estudio, la información quirúrgica se recolectó de manera prospectiva4. De 1,914 pacientes elegibles, 225 (11.2%) fueron llevados a cirugía con intento curativo y 173 (9.0%) lograron una resección. Setecientos cuatro pacientes tenían sólo lesiones hepáticas, 107 (15.2%) fueron llevados a resección y 85 (12.1%) lograron resecciones R0.
En el estudio aleatorizado más grande de bevacizumab NO16966 (n=1,400 pacientes) donde FOLFOX o XELOX + bevacizumab se compararon contra FOLFOX o XelOX sin bevacizumab, las tasas de respuesta fueron de 37%-38% vs. 36%-38% y la tasa de resección en toda la cohorte solamente incrementó 1.4% (4.9 vs. 6.3% con bevacizumab), no se logró mostrar beneficio en el subgrupo de pacientes sólo con lesiones hepáticas (11.6 vs. 12.3% con bevacizumab)4,29.
Pareciera que añadir bevacizumab a un esquema de quimioterapia no mejora las tasas de resección de lesiones hepáticas más que las obtenidas por la quimioterapia convencional29.
Anti-EGFR
En el estudio CRYSTAL, la adición de cetuximab a FOLFIRI (pacientes con KRAS no mutado), demostró aumento en las tasas de respuesta de manera global (43 vs. 59%), así como aumento en las tasas de resección de las lesiones hepáticas en 7.6% (4.5 vs. 9.8%)29,30. También se observó en el estudio CRYSTAL y OPUS que la reducción tumoral temprana igual o más del 20% (reducción radiológica del tamaño tumoral a las 8 semanas) en los pacientes con KRAS silvestre tratados con quimioterapia + cetuximab, tuvieron SLP (14.1 vs. 7.3 meses; HR=0.32; p<0.001; y 11.9 vs. 5.7 meses; HR=0.22; p<0.001) y SG (30 vs. 18.6 meses; HR=0.53; p<0.001; y 26 vs. 15.7 meses; HR=0.43; p=0.006) más largas31.
El estudio CELIM, fase II, evaluó el papel de cetuximab junto con FOLFOX06 o FOLFIRI en el contexto neoadyuvante32 y en 106 pacientes con lesiones hepáticas que eran irresecables. Cetuximab/FOlFOX06 o FOLFIRI lograron una tasa de respuestas de 68% y 57%, respectivamente (sin diferencia significativa) y la resección R0 se logró en 38% y 30%, respectivamente.
En el estudio PRIME, la adición de panitumumab al esquema FOLFOX demostró una mejoría en la SLP (9.6 vs. 8.0 meses; HR=0.80; p=0.02), pero no se reportó el porcentaje de pacientes llevados a resecciones R04.
Pacientes resecados
Los estudios realizados en la actualidad no han demostrado beneficio en el empleo de las terapias blanco, posterior a la metastasectomía. Asimismo, se ha observado falta de efectividad de éstas en la adyuvancia para pacientes con cáncer colorrectal estadios clínicos II y III33.
Hacia dónde van las terapia blanco
Actualmente, la investigación en terapias blanco en cáncer colorrectal metastásico se dirige hacia el desarrollo de nuevos agentes que inhiban la angiogénesis y que venzan la resistencia a los anticuerpos monoclonales anti-EGFR.
El aflibercept es un agente antiangiogénico que bloquea la actividad de VeGFA, VeGFB y el factor de crecimiento placentario (PIGF); además previene la unión de estos ligandos a sus receptores. Este fármaco ya ha sido probado en un estudio fase III con pacientes previamente tratados con quimioterapia y terapias blanco, y ha demostrado beneficio en la SG34. El estudio OPTIMOX es un estudio fase II que valorará la eficacia de aflibercept en primera línea de tratamiento para cáncer colorrectal metastásico, que hoy en día está en fase de reclutamiento35.
El regorafenib es un inhibidor multicinasa que bloquea la actividad de varias tirosin cinasas incluidas las involucradas en la angiogénesis (VEGFR1, VEGFR2, VEGFR3, TIE2), oncogénesis (KIT, RET, RAF1, BRAF) y el microambiente tumoral (PDGFR y FGFR). En el estudio CORRECT demostró beneficio en SG en pacientes con cáncer de colon metastásico ya tratado con quimioterapia y terapia blanco36. Se encuentran pendientes los resultados de un estudio fase III en primera línea de tratamiento para pacientes con cáncer colorrectal metastásico tratado con quimioterapia + regorafenib37.
Uno de los puntos de mayor interés en el tratamiento del cáncer colorrectal metastásico es el desarrollo de terapias blanco en pacientes que desarrollan resistencia a los anticuerpos anti-EGFR. Hay diversos mecanismos moleculares que podrían estar involucrados en la resistencia a los anticuerpos monoclonales anti-EGFR, entre los cuales se han identificado cambios en el EGFR de las células tumorales (mutaciones genéticas, regulación a la baja del receptor, localización subcelular alterada) o mecanismos dependientes de EGFR (activación de vías de señalización corriente abajo: PI3K/AKT, RAS/MAP2K/MAPK, producción y expresión de VEGF). Algunas de las terapias blanco que están siendo probadas en el contexto preclínico son los inhibidores de MAP2K, BRAF, PI3K y mTOR7.
Debido al entrecruzamiento entre muchas de las vías de los RTC, no se espera dependencia de un gen único. Además, cuando las células del cáncer son tratadas con fármacos que bloquean una sola vía, son capaces de activar vías alternas como mecanismos de escape para vencer el bloqueo y, por tanto, la efectividad de estos fármacos. Las combinaciones de terapias blanco pueden revertir o incluso vencer la resistencia. Algunas combinaciones que están siendo probadas en investigaciones preclínicas se mencionan en la tabla 27.
Conclusiones
Las terapias blanco han revolucionado el panorama global del tratamiento del cáncer colorrectal. En los últimos años, el tratamiento de la enfermedad ha sufrido grandes cambios y requiere de un grupo multidisciplinario, formado por cirujanos oncólogos, oncólogos médicos, radiólogos intervencionistas, radiooncólogos y enfermeras, para lograr un tratamiento óptimo y para que el número de pacientes con tratamientos potencialmente curables aumente38.
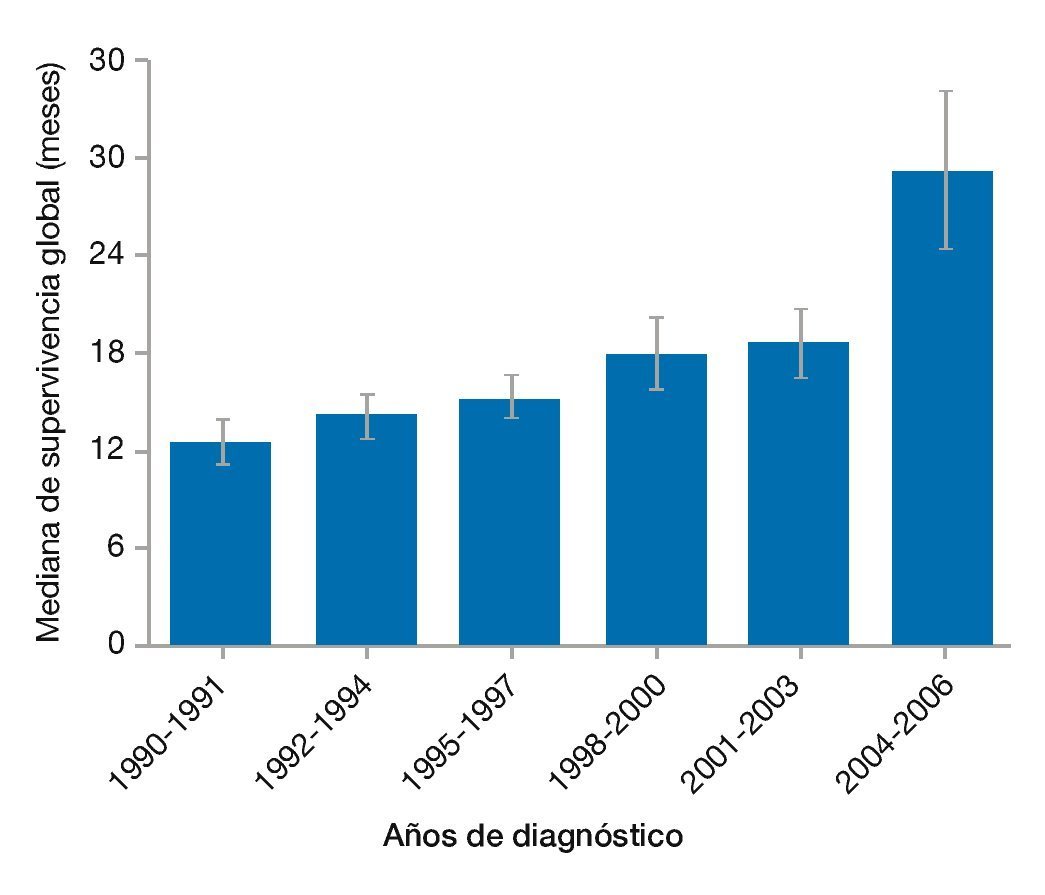
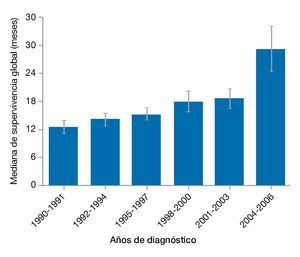
Los avances en el tratamiento sistémico han conseguido, de manera general, una mejoría en la SG, con incremento de las medianas de supervivencia de 8 a 24 meses en los últimos 20 años (fig. 2). La disposición de nuevos agentes citotóxicos, el advenimiento de terapias blanco y la implementación de la medicina personalizada han sido parte imprescindible durante este proceso38.
Figura 2 Supervivencia global en pacientes con cáncer color-rectal metastásico38.
El uso de estos novedosos fármacos es una posibilidad en nuestro país; sin embargo, la universalidad de su uso aún se encuentra lejos de lo deseado, debido principalmente a su alto costo, entre otros.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Financiamiento
Los autores no recibieron patrocinio para llevar a cabo este artículo.
* Autor para correspondencia:
Instituto Nacional de Cancerología.
Av. San Fernando N° 22, Colonia Sección XVI, Delegación Tlalpan,
C.P. 14080, México D.F., México.
Teléfono: +52 (55) 5652 9395.
Correo electrónico: ochoacarrillo@prodigy.net.mx (Francisco Javier Ochoa-Carrillo).