El carcinoma hepatocelular (CHC) es un problema de salud en todo el mundo. Representa la 3° causa de muerte por cáncer y el 6° cáncer más frecuente.
La presencia de cirrosis hepática en la mayoría de los pacientes con CHC, hace del tratamiento de esta enfermedad un verdadero reto. Por esto la formación de grupos multidisciplinarios es esencial para la obtención de buenos resultados.
En los últimos años se han publicado diversas guías para el diagnóstico y tratamiento de esta enfermedad. Esta revisión describe los aspectos más importantes en el diagnóstico y tratamiento del carcinoma hepatocelular.
Hepatocellular carcinoma represents a health problem around the world. It is the third leading cause of death related to cancer and it's the sixth most frequent cancer.
The coexistence of liver disease, most commonly cirrhosis, in patients with hepatocellular carcinoma makes treatment of this disease a real challenge. That is why multidisciplinary groups should be made in order to get appropriate outcomes for these patients.
Recently multiple guidelines for diagnosis and treatment of hepatocellular carcinoma have been published. This review describes the most important aspects of diagnosis and treatment for hepatocellular carcinoma.
Introducción
El carcinoma hepatocelular (CHC) es un problema de salud pública por su frecuencia y mortalidad, por lo que ha surgido la necesidad de contar con métodos eficaces para la detección temprana, diagnóstico, estadiaje y tratamiento, así como para la adecuada evaluación de la respuesta a las medidas terapéuticas.
En los últimos años han sido publicadas diferentes guías por diversas organizaciones para estandarizar el tamizaje, diagnóstico y tratamiento del CHC.
Esta revisión describe los principales aspectos del CHC y los diferentes métodos y técnicas de imagen utilizados, y las opciones terapéuticas para el manejo integral de este tumor.
Epidemiología
El CHC representa el tumor maligno más frecuente del hígado, siendo el 5° cáncer más frecuente en hombres y el 7° en mujeres a nivel mundial, es la 3° causa de muerte por cáncer en el mundo1,2. En la mayoría de los casos se presenta como complicación de una enfermedad hepática crónica (70%-90%)3.
La cirrosis es un importante factor de riesgo para el CHC, entre las diferentes causas se encuentran la hepatitis viral crónica, el alcohol, el hígado graso no alcohólico, y las enfermedades metabólicas hereditarias4. En México, las principales causas de cirrosis son el alcohol y el virus de hepatitis C5.
El riesgo de desarrollar CHC es mayor en los pacientes con hepatitis viral, a nivel mundial el virus de hepatitis B es el principal factor de riesgo, representa al menos el 50% de los casos de CHC2.
Diagnóstico
Detección temprana y tamizaje
A fin de diagnosticar el tumor en estadios tempranos, la población en riesgo debe ser sometida a un programa de vigilancia, se ha aceptado que la vigilancia es costo-efectiva cuando el riesgo CHC es mayor al 1.5% al año6.
La detección precoz del CHC busca reducir la mortalidad asociada a la enfermedad. Existe un estudio aleatorizado que comparó ultrasonido (US) y α-fetoproteína (AFP) cada 6 meses contra no tamizaje, a pesar de la pobre adherencia al programa de tamizaje (menor al 60%), se redujo la mortalidad en 37% en los pacientes que se sometieron al tamizaje7.
Para el tamizaje los estudios que se han propuesto por las diversas guías son la AFP y el US6,8-12.
El método preferido para tamizaje es el US ya que es un estudio no invasivo, bien tolerado, ampliamente disponible, y con un costo relativamente moderado, con una eficacia diagnóstica aceptable (sensibilidad de 58%-94% y especificidad mayor al 90%)13,14. La AFP muestra un menor rendimiento diagnóstico y muchas veces puede representar sólo una exacerbación de la enfermedad hepática. Cuando se combina el US y la AFP se detecta de forma adicional 6% a 8% casos no identificados previamente por US, sin embargo incrementan los resultados falsos positivos aumentando el costo en 80% por cada CHC detectado12.
En base al tiempo promedio de duplicación en el volumen del CHC y a que la sensibilidad es mejor en programa de vigilancia cada 6 meses comparado al de 12 meses, el intervalo de 6 meses representa una opción razonable12,14.
Las guías clínicas de la American Association for the Study of Liver Disease (AASLD) recomiendan incluir en los programas de vigilancia con US cada 6 meses, a todos aquellos pacientes con cirrosis que tengan posibilidades de ser tratados, si es que se les diagnostica CHC y aquellos pacientes con infección por virus de hepatitis B sin cirrosis que su incidencia anual de CHC sea mayor al 0.2%6.
Otros marcadores tumorales como la des-γ carboxiprotrombina o fracciones de AFP no han mostrado un desempeño mejor3.
Los nódulos encontrados por US de tamizaje menores a 1 cm debe ser seguidos por US cada 3 a 6 meses, si no hay crecimiento en 2 años se puede regresar a la vigilancia habitual, ya que la mayoría de ellos rara vez representa CHC y aquellos nódulos mayores a 1 cm deben de investigarse con tomografía multidetector cuatrifásica o RM dinámica contrastada6.
Diagnóstico
Los criterios para el diagnóstico de CHC han evolucionado en los últimos años. Hasta el año 2000 el diagnóstico se basaba en la confirmación histopatológica. La biopsia conlleva algunas limitaciones como el riesgo de complicaciones, sangrado o la siembra tumoral en el trayecto, reportado en el 2.7%, y que la exactitud diagnóstica entre los nódulos displásicos de alto grado y el CHC temprano es complejo15.
Para minimizar el uso de la biopsia, diversos grupos han adoptado criterios de imagen diagnósticos que predicen cáncer con una exactitud aceptable6,8-12,16-18.
Diagnóstico no invasivo
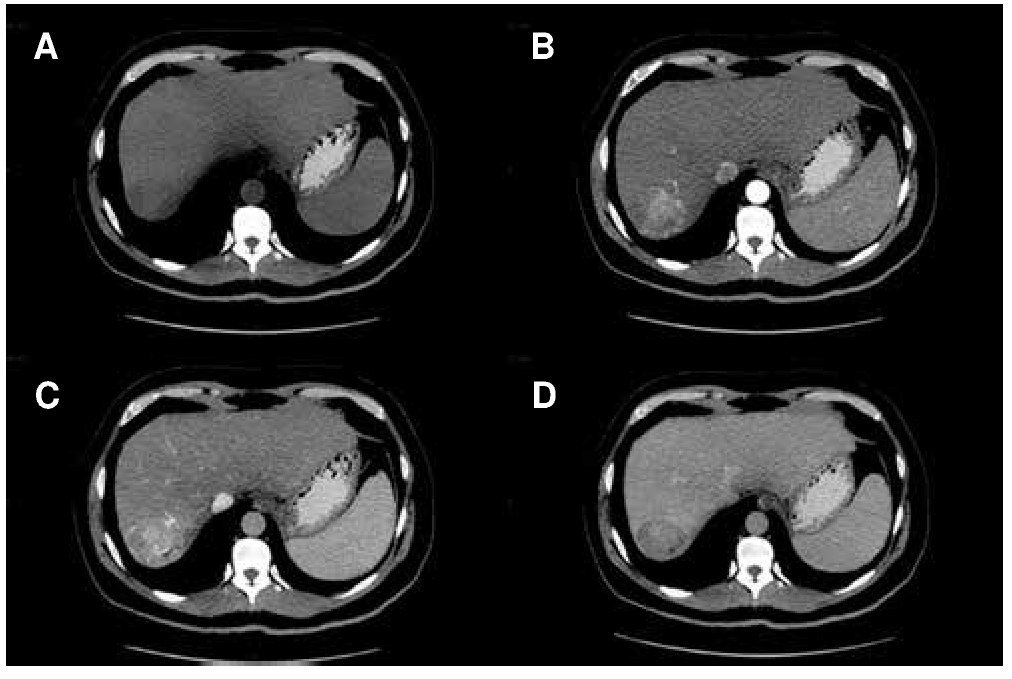
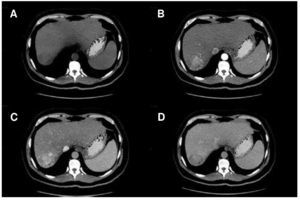
En 2001 un panel de expertos en CHC publicó las guías de la EASL y presentó por primera vez criterios diagnósticos no invasivos para CHC. Estos criterios se han ido modificando y a partir del 2010, sólo los hallazgos por tomografía computada (TC) y RM son válidos para realizar diagnóstico de CHC. Actualmente, sólo un estudio de imagen seccional es suficiente para el diagnóstico de CHC en lesiones mayores a 1 cm que muestren las características típicas de realce arterial y lavado en la fase venosa o tardía por imagen (fig. 1)6. Estos criterios de imagen son válidos únicamente en pacientes con cirrosis o infección crónica por VHB, ya que la probabilidad pre-prueba de CHC es alta6. El valor de estos criterios no invasivos para CHC en pacientes con cirrosis ha sido confirmado prospectivamente19-21.
Figura 1. Carcinoma hepatocelular (CHC) diagnosticado por tomografía multifásica. A) Fase simple con imagen hipodensa en segmento VII. B) Realce del tumor durante la fase arterial, C) presencia de realce durante la fase portal y D) lavado durante la fase tardía.
En 2011, el American College of Radiology (ACR) publicó un sistema para el reporte de TC y RM hepáticas en pacientes con cirrosis u otros factores de riesgo para CHC, el LIRADS (Liver Imaging Reporting and Data System), en 2013 se publicó una actualización. Los objetivos de este sistema incluyen el reducir la variabilidad en la interpretación de la lesión, mejorar la comunicación con los clínicos, estandarizar el contenido del reporte y la estructura facilitando el monitoreo del resultado, así como asegurar la calidad. Los hallazgos por imagen se asignan a una de las 5 categorías que van de LR1 (definitivamente benigno) a LR5 (definitivamente CHC), con recomendaciones en el manejo según la categoría16.
La tomografía por emisión de positrones (PET-CT) con 18F fluorodeoxiglucosa (FDG) es limitada, debido a diferentes grados de acumulación de FDG en los CHC. Actualmente no se recomienda para el diagnóstico. El uso de nuevos radiotrazadores como el 11 acetato, ha mejorado la sensibilidad y especificidad22.
Diagnóstico patológico
El estudio histopatológico se recomienda para todos los nódulos que no muestren las características por imagen típicas o que se presenten en pacientes con hígado no cirrótico. Si el resultado de la biopsia es negativo la lesión debe ser seguida cada 3-6 meses hasta que el nódulo desaparezca, crezca o muestre criterios diagnósticos para CHC. Si la lesión crece se debe repetir la biospia6.
Una vez confirmado el diagnóstico de CHC se recomienda realizar tomografía de tórax, a fin de descartar enfermedad extrahepática y gammagrafía ósea si clínicamente se sospecha de metástasis óseas17.
Diversos estudios han mostrado que el PET-CT con 18-FDG muestra una mayor sensibilidad en la detección de metástasis que en detección de tumores primarios, sin embargo su uso se encuentra limitado por la alta tasa de falsos positivos22.
Tratamiento
El desarrollo de opciones terapéuticas para el manejo del CHC, es un gran reto que requiere del abordaje de un equipo multidisciplinario conformado por Oncología Médica, Hepatología, Cirugía de Hígado - Trasplantes y Radiología Intervencionista23.
Los abordajes terapéuticos están convencionalmente clasificados como curativos y paliativos24. Dentro de estos tratamientos se incluyen cirugía radical (resección o trasplante); terapias locorregionales (TLR) que incluyen ablación por radiofrecuencia (ARF), inyección percutánea de alcohol (IPA), quimioembolización intraarterial (QEIA), tratamientos combinados y terapia sistémica (sorafenib)25.
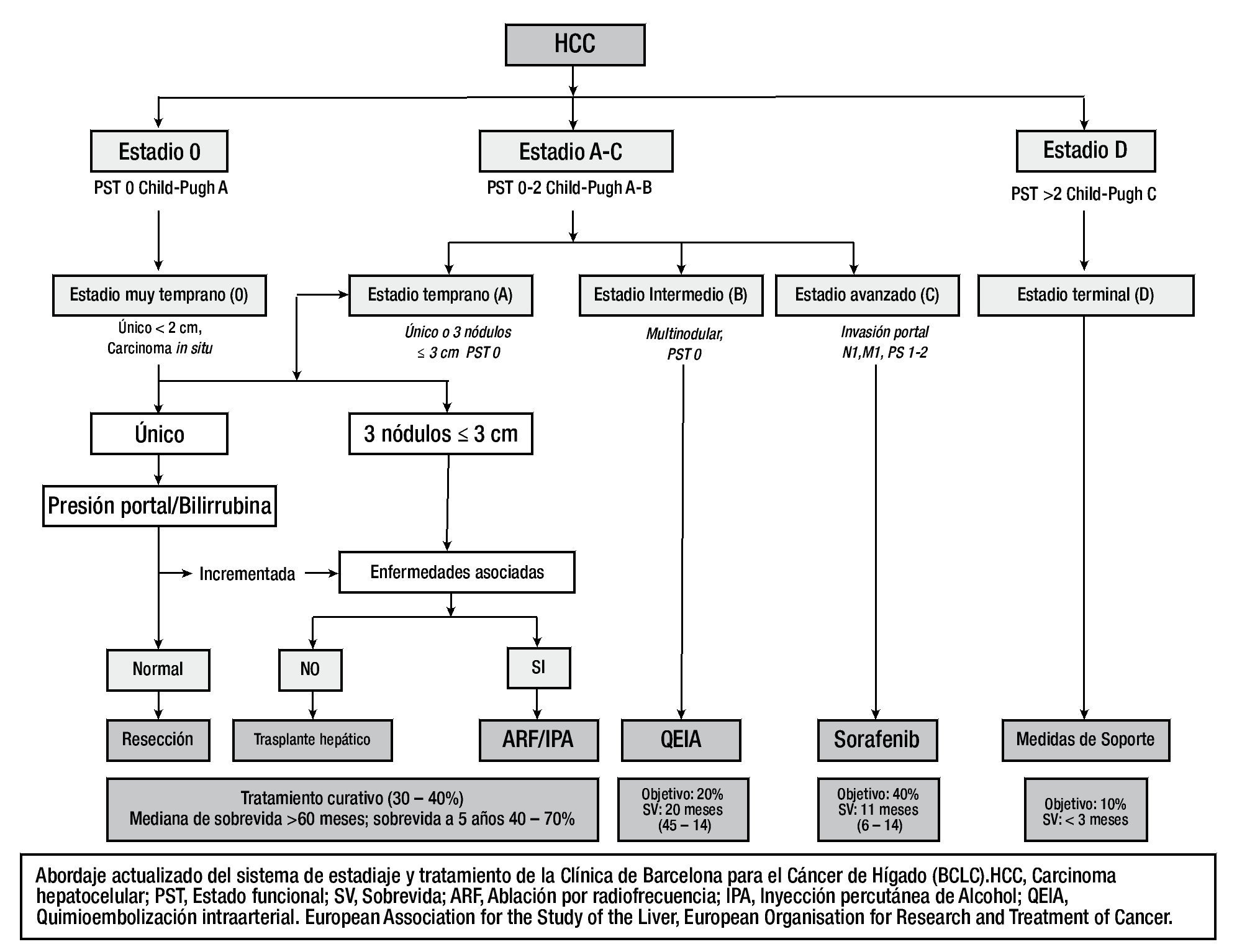
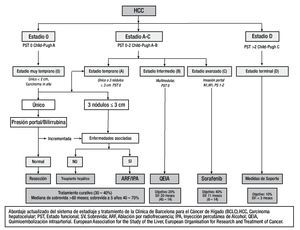
La estrategia de tratamiento para un paciente con CHC es elegida en base al estadio oncológico, estado funcional (PST) y enfermedades hepáticas subyacentes25. Estas variables son integradas dentro de la Clasificación de Cáncer Hepático de la Clínica de Barcelona (BCLC) (fig. 2), que han sido endosadas por múltiples asociaciones.
Figura 2. Abordaje actualizado del sistema de estadiaje y tratamiento de la Clínica Barcelona para el cáncer de hígado (BCLC).
Resección
Hígado sano
Los pacientes con hígado sano pueden ser candidatos a resección cuando presenten CHC sin enfermedad extrahepática. El estadiaje debe ser realizado con TC toracoabdominal y gammagrama óseo. En este escenario, el volumen hepático remanente (VHR) debe ser ≥ 30%. Es indispensable realizar volumetría hepática cuando se sospeche un VHR menor26. En los casos donde el VHR sea < 30% es recomendable realizar embolización portal (EP) para incrementar el VHR27. Es poco común que el CHC se presente en un hígado completamente sano (<5%), y es por lo tanto importante considerar la presencia de fibrosis, esteatosis o estatohepatitis al considerar una resección amplia. Por lo tanto, en los casos donde exista duda de la presencia de alguna alteración hepática (fibrosis, esteatosis o esteatohepatitis) es conveniente realizar biopsia del hígado remanente previo al procedimiento28.
La EP se puede realizar tanto de forma quirúrgica o percutánea. Seis a 8 semanas después de la embolización, se debe realizar una nueva tomografía trifásica con nueva volumetría para calcular el nuevo VHR. De no conseguirse el mínimo deseado, no debe ser considerado un buen candidato a una resección hepática29-31.
Hígado cirrótico
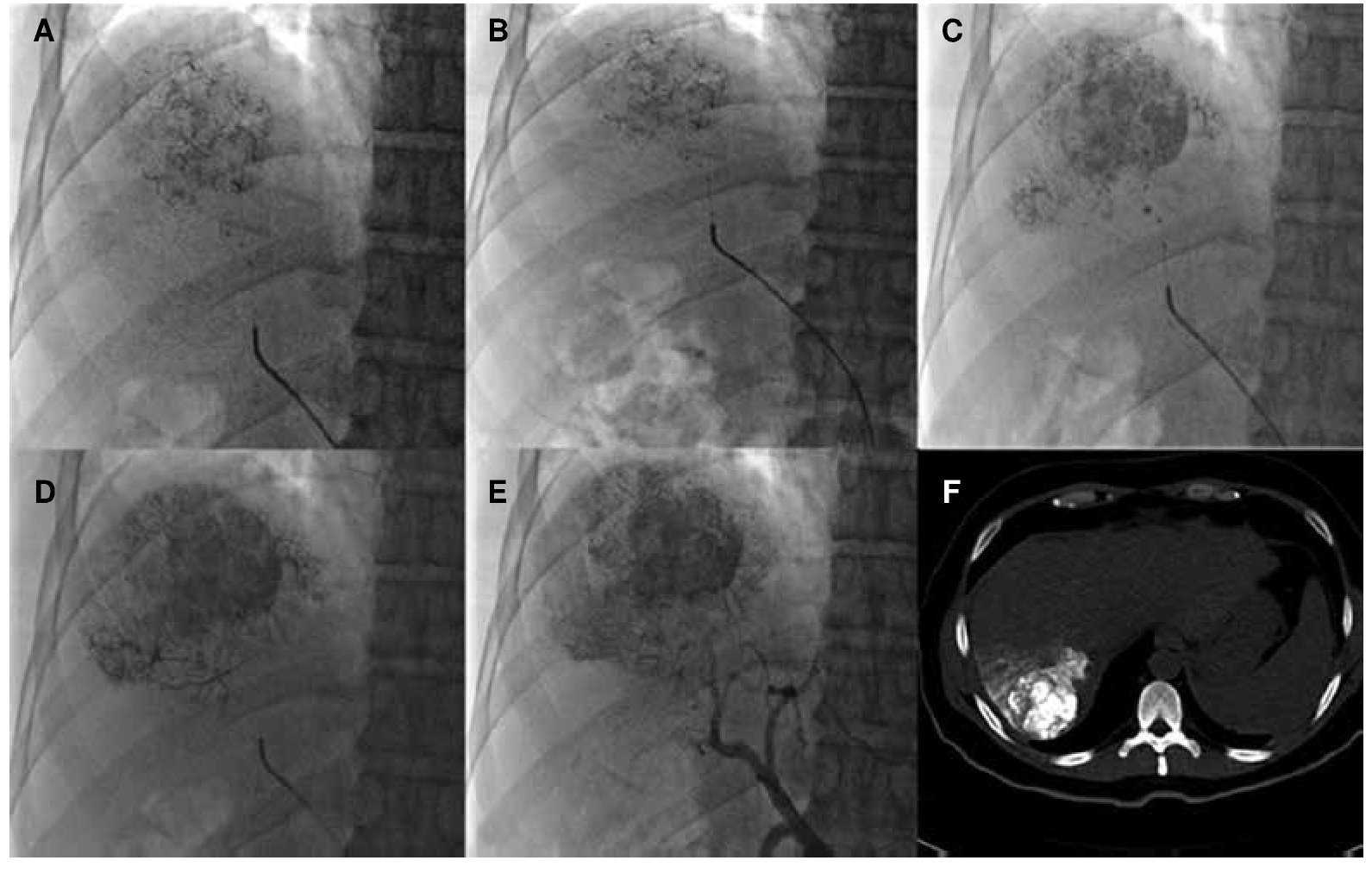
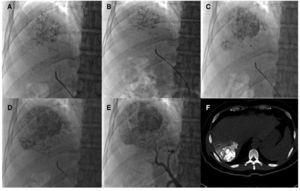
Son candidatos a resección quirúrgica los pacientes con función hepática en Child-Pugh A, sin HTP clínicamente significativa (< 10 mmHg) y VHR > 50%32. En el caso de una resección mayor al 50% es necesario realizar un estudio de función metabólica. El más utilizado de estos es la inyección intravenosa de verde de indiocianina (VI 0.5 mg/Kg), que se excreta exclusivamente por la bilis. En los pacientes con retención de VI < 10% a los 15 minutos, pueden ser sometidos a una hepatectomía amplia. Los pacientes con retención > 20% sólo pueden considerarse para una resección pequeña33. Algunos autores recomiendan la resección aún en la presencia de HTP, siempre y cuando exista una bilirrubina total ≤ 1 mg/dL y una depuración de VI adecuado34 (fig. 3). Desafortunadamente, en nuestro país por el momento no se cuenta con VI.
Figura 3. Quimiembolización intraarterial. A-D) Administración de lipiodol y cisplatino a lesión irrigada por arteria hepática derecha anterior. E) Control angiográfico postembolización sin realce de la lesión tratada. F) Tomografía en fase simple posterior a la embolización, donde se observa captación del fármaco y lipiodol en CHC del segmento VII.
El estándar actual para resecar tumores en un paciente cirrótico son: mortalidad < 3%, transfusiones < 10% y una sobrevida de por lo menos 50% a 5 años, de no ser así será conveniente referir al paciente a algún centro con experiencia en esta área35.
Trasplante hepático
Se consideran candidatos a trasplante hepático los pacientes en Child-Pugh A con HTP (> 10 mmHg), Child-Pugh B o C, que se encuentren dentro de los criterios de Milán o UCSF36,37, sin que exista enfermedad extrahepática con estadiaje con TC toracoabdominal y gammagrama óseo.
Los únicos criterios validados por radiología (preoperatorio) y por patología (postoperatorio) para considerar un paciente para trasplante hepático son los criterios de Milán y los criterios de UCSF (tabla 1).
Para la asignación de órganos, los pacientes con CHC deben de recibir puntos extras en la clasificación de MELD.
Estos pacientes pueden presentar MELD bajo que no les permite competir en la asignación de órganos contra pacientes, que presentan enfermedad hepática más avanzada. Los casos de CHC recibirán 22 puntos al ingreso a la lista de espera (cada 3 meses con un incremento del 10% en el riesgo de mortalidad), cuando el CHC mide más de 2 cm. En los pacientes con CHC y lesiones menores de 2 cm no se otorgan puntos extras.
En los pacientes con CHC que estarán más de 6 meses en la lista de espera, la utilización de ARF o QEIA es una buena opción como tratamiento puente, si la función hepática lo permite (Child-Pugh A o B)38. En algunos casos la disminución del estadiaje está permitida siempre y cuando se cumpla con los criterios de disminución del estadiaje de la USFC39.
En los pacientes donde se haya realizado resección hepática de primera intención y posteriormente se presenten recidiva del CHC, se podrá considerar para THO de salvamento40.
El trasplante hepático de donador vivo puede ser una buena opción en el caso de CHC. Se deben de seguir exactamente las mismas guías que para donador cadavérico y el donador debe conocer claramente los riesgos y posibles complicaciones41.
Si la resección quirúrgica o el trasplante no son posibles, los TLR son considerados la mejor opción de tratamiento para pacientes con CHC.
Tratamientos locorregionales
Estadio muy temprano (BCLC-0)
Este estadio incluye pacientes con un CHC único < 2 cm de diámetro. Estos pacientes tienen enfermedad hepática bien compensada (Child-Pugh A), sin signos de HTP y niveles de bilirrubina normales (< 1 mg/dL). En estos pacientes la resección quirúrgica es la primera elección y cuando la selección de pacientes es bien realizada, la mortalidad perioperatoria es menor del 3% y una sobrevida a 5 años de aproximadamente 50%; sin embargo el pronóstico permanece afectado por tasas de recurrencia que alcanzan 50% a 3 años y 70% a 5 años42.
Estadio temprano (BCLC-A)
Los pacientes con Child-Pugh A, buen estado funcional (PST) y un solo CHC < 5 cm o hasta 3 CHC ≤ 3 cm. Actualmente, los métodos ablativos más ampliamente utilizados son la IPA y la ARF. La IPA consiste en la inyección de alcohol absoluto directamente dentro del CHC a través de una aguja. Este método fue el primer tratamiento estándar de ablación antes de la aparición de la ARF42. La capacidad curativa de la IPA en tumores mayores de 2 cm es limitada y requiere múltiples inyecciones y múltiples sesiones43. La IPA alcanza necrosis completa del tumor en 70% de los nódulos < 3 cm y en aproximadamente 100% en nódulos < 2 cm.
La ARF es considerada en la actualidad como el método de ablación más seguro, y que brinda mejores resultados en los pacientes BCLC-A42,44.
Las tasas de respuesta completa alcanzan el 80% en pacientes con tumores < 3 cm, 50% en pacientes con tumores de 3-5 cm y 25% en tumores > 5 cm. La ARF es asociada con una sobrevida de 76% a 5 años42.
La información disponible es suficiente para concluir que la ARF mejora significativamente la sobrevida y reduce la recurrencia local comparada con la IPA. La inyección percutánea de alcohol debe ser reservada sólo cuando la ARF no está disponible o no es técnicamente posible43.
Estadio intermedio (BCLC-B)
Este grupo incluye hepatocarcinomas grandes (> 5 cm) o multinodulares sin invasión macrovascular, en pacientes con buen estado funcional y hepatopatía en etapas A y B de Child-Pugh42.
La QEIA es el principal tratamiento utilizado para CHC no resecable43.
Este procedimiento requiere del avance endovascular de un catéter hasta la arteria hepática y navegar con el uso de un microcatéter hacia las ramas segmentarias, hasta un punto que maximice la exposición del tumor a la administración de agentes quimioterapéuticos (fig. 3).
Los agentes de quimioterapia mayormente utilizados son cisplatino y doxorrubicina mezclados en una emulsión con lipiodol, un material de contraste oleoso que es retenido dentro del tumor y magnifica la exposición de las células neoplásicas a la quimioterapia. Esta emulsión es distribuida entre los segmentos o lóbulos afectados y selectivamente infundida hacia el tumor43.
La QEIA alcanza respuestas parciales en 15%-55% de los pacientes, con retraso en la progresión tumoral e invasión vascular.
Las tasas de sobrevida son de 82%, 47% y 26% a 1, 3 y 5 años, respectivamente.
Induce necrosis en 30%-50% de pacientes, sin embargo, raramente alcanza respuesta completa, especialmente después de una sola sesión de tratamiento42.
Los agentes embolizantes son administrados posterior a la emulsión de quimioterapia durante el mismo procedimiento. Los más utilizados son: gelfoam, micropartículas de polivinil alcohol o microesferas de gelatina de tris-acril. La obstrucción vascular disminuye el lavado del agente de quimioterapia42.
Embolización blanda: esta técnica es muy similar a la QEIA, sin la administración de la emulsión de quimioterapia con lipiodol. Posterior a la angiografía diagnóstica se inyectan partículas embolizantes directamente desde la arteria aferente al tumor, con el fin de causar isquemia y necrosis tumoral. Esta técnica es particularmente útil en pacientes que presentan carga tumoral significativa y la futura progresión puede llevarlos a estado de intratabilidad. También se han detectado menos efectos adversos45.
La mayoría de las ventajas de la embolización blanda son compartidas con la QEIA y actualmente continúa el debate entre cuál técnica brinda mejores beneficios. Dentro de los pocos ensayos controlados comparando QEIA/embolización blanda vs. manejo conservador, se demostró beneficio en la sobrevida a 1 y 2 años para la quimioembolización con 82% y 63% contra 75% y 50% para la embolización blanda, y 63% y 27% para el manejo conservador22,43. En este número, Miguel et al. comparó los resultados obtenidos en nuestra Institución con estas 2 técnicas. En principio la tasa de respuesta es similar entre ambos grupos, sin embargo los pacientes tratados con QEIA tuvieron un tiempo libre de progresión 3 meses mayor que los pacientes con embolización blanda, esto sin ser estadísticamente significativo. En la actualidad la técnica estándar más utilizada es la quimioembolización.
Las contraindicaciones más importantes para realizar la QEIA son: la ausencia de flujo portal al hígado debido a trombosis, flujo hepatofugo o anastomosis portosistémicas. Pacientes con hepatopatías en Child-Pugh C y algunos en B con puntaje alto asociado a otras comorbilidades, estadio terminal de la BCLC-D, y síntomas oncológicos de etapa terminal. Estos deben ser minuciosamente analizados y en su caso excluidos de los TLR, debido a que el insulto isquémico puede llevarlos a eventos adversos severos o fatales43.
Otra aplicación de la QEIA es en pacientes dentro de estadio temprano, en los cuales el tratamiento ablativo no puede ser llevado a cabo debido a la localización del tumor (cercanía a la vesícula biliar, conductos biliares principales o ramas principales de la vena porta) u otras contraindicaciones.
Tratamiento combinado
La combinación de quimioembolización con ARF se ha convertido en una técnica prometedora para mejorar el control tumoral en las lesiones de 3-5 cm.
Dentro de las ventajas del tratamiento combinado es que la agresión hipóxica por la embolización junto con el efecto del agente quimioterapéutico es sinérgica, disminuyendo el aporte sanguíneo y decreciendo la impedancia del tumor. Además, que una disrupción en los septos intratumorales posterior a la quimoembolización puede facilitar la distribución del calor dentro del tumor y disminuir el enfriamiento tisular mediado por la perfusión, teniendo como resultado una zona mayor de ablación.
El protocolo sugerido es la realización primero de la quimioembolización selectiva de los nódulos, seguida de la ARF dentro de los 14 días posteriores a la QEIA46.
Se ha demostrado incremento en la sobrevida para el tratamiento combinado contra solo la ARF, con tasas de 92%, 66% y 61% vs. 85%, 59% y 45% a los 1, 3 y 4 años, respectivamente. De igual manera la sobrevida libre de recurrencia con tasas de 79%, 60% y 54% vs. 66%, 44% y 38% en los mismos periodos47.
Tratamiento sistémico
Estadio avanzado (BCLC-C)
Este grupo incluye pacientes con invasión portal y enfermedad extrahepática. También se consideran en etapa avanzada aquellos pacientes con volumen tumoral mayor al 50% del volumen hepático, y aquellos con síntomas específicos de enfermedad avanzada. Estos pacientes no son candidatos a tratamiento quirúrgico ni a las TLR descritas previamente. En ellos, el tratamiento de primera línea es la terapia sistémica con sorafenib.
El sorafenib es una molécula de bajo peso molecular que bloquea la proliferación celular y la angiogénesis a través de un mecanismo de acción doble, que involucra la inhibición de la cinasa BRAF y el bloqueo del receptor del factor de crecimiento del endotelio vascular.
Su utilidad en el tratamiento del carcinoma hepatocelular quedó demostrada en 2 ensayos clínicos controlados, en los cuales pacientes con enfermedad tumoral irresecable o metastásica y con función hepática conservada, fueron aleatorizados a recibir sorafenib 800 mg/día o placebo. Los resultados se resumen en la tabla 248,49.
Los eventos adversos más frecuentemente observados en los pacientes tratados con sorafenib incluyen diarrea, pérdida de peso, síndrome de mano-pie e hipofosfatemia. Los eventos adversos graves (grado 3 y 4) ocurren en menos del 12% de los pacientes48,49.
Si bien, los resultados son sólidos en términos de disminución de casi el 40% en el riesgo de muerte, se hace evidente que el pronóstico global de estos pacientes es aún pobre y resalta la necesidad de nuevos tratamientos. También resalta el hecho de que el beneficio de sorafenib no se logra a través de respuesta tumoral, la cual es mínima, sino a través de estabilidad de la enfermedad.
Recientemente, se publicaron los resultados del análisis de subgrupos del primer estudio aleatorio. El sorafenib tuvo un efecto favorable en sobrevida en todos los subgrupos analizados independientemente de la etiología de la enfermedad, la carga tumoral, el estado de desempeño físico, la etapa del tumor y la terapéutica previa. El tiempo a la progresión no fue mejor en el subgrupo de pacientes con hepatitis B50.
Por último, se debe enfatizar que el uso de sorafenib está restringido a pacientes con enfermedad avanzada y función hepática conservada (categoría A de la clasificación de Child-Pugh). Los estudios aleatorios no sustentan el uso de sorafenib en pacientes con Child-Pugh B o C.
Para mejorar el pronóstico de los pacientes con hepato-carcinoma avanzado, actualmente se desarrollan nuevos fármacos que bloquean diferentes vías de señalización (como ejemplo prometedor se encuentran los inhibidores de MET) o bien, se investigan combinaciones de sorafenib con otras terapias dirigidas o agentes de quimioterapia (como ejemplo prometedor resalta la combinación de doxorrubicina con sorafenib)51.
Los pacientes con clasificación C en la escala de Child-Pugh o con un estado funcional deteriorado, entran en el grupo D de la BCLC. A estos pacientes se les ofrece tratamiento de soporte y es considerada la etapa terminal de la enfermedad.
Evaluación de la respuesta terapéutica
Los objetivos de evaluar la respuesta al tratamiento son la detección temprana de enfermedad residual o recurrencia tumoral, así como identificar la progresión de la enfermedad, para lo cual la TC y RM dinámica han mostrado gran exactitud. La densidad alta del lipiodol representa una limitación para la evaluación de la respuesta mediante TC debido a que puede enmascarar el realce, la RM no muestra este problema ya que no existen artefactos asociados, por lo que se prefiere este método de imagen15.
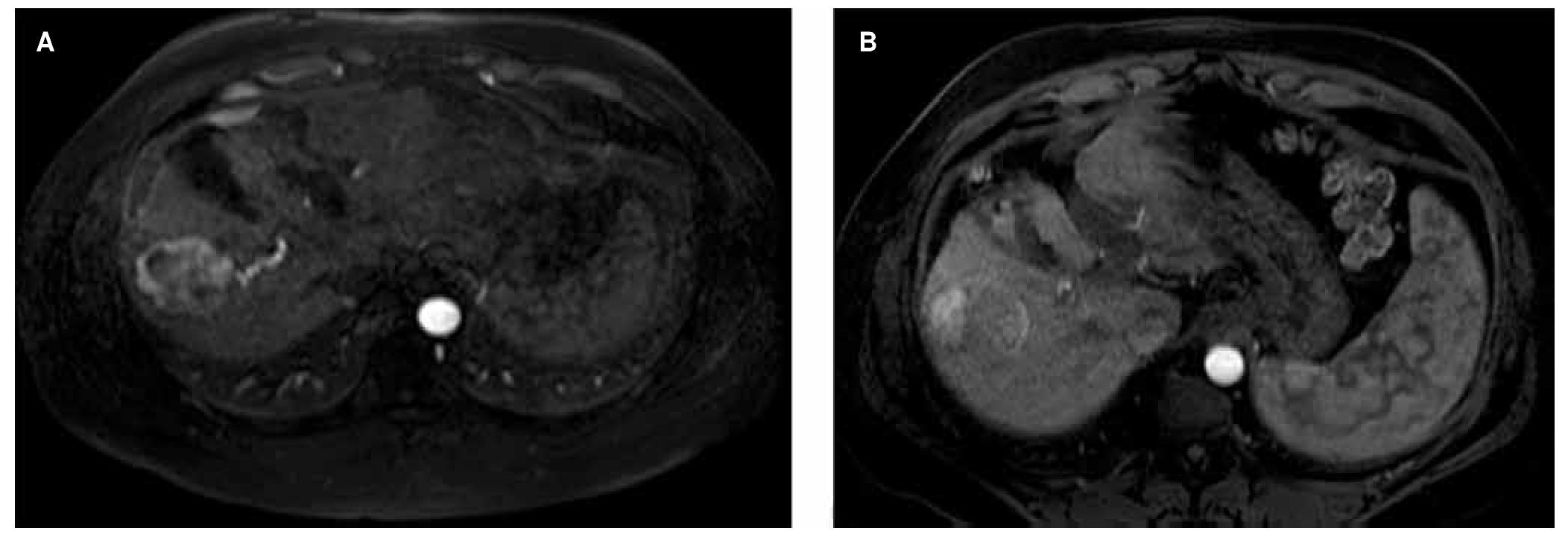
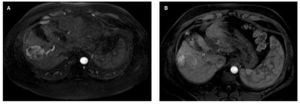
Diversos criterios han sido desarrollados para evaluar la respuesta al tratamiento, en el año 2000 el National Institute of Cancer con el propósito de unificar criterios publicó sus guías Response Evaluation Criteria in Solid Tumors (RECIST), en las cuales se evalúa únicamente el tamaño, sin embargo muchos tratamientos para CHC actúan mediante la inducción de necrosis tumoral o disminuyendo la vascularidad del tumor que no siempre se acompaña de una disminución en el tamaño de la lesión, por lo que estos criterios infravaloran la respuesta al tratamiento (fig. 4). En el año 2008, la AASLD junto con el Journal of the National Cancer Institute (JNCI) publicó una modificación de estos criterios, conocida como mRECIST, tomando en cuenta la viabilidad del tumor (tabla 1). Diferentes estudios han mostrado su utilidad en la evaluación de la respuesta al tratamiento52-54.
Figura 4. Ejemplo de RECIST 1.1 vs. mRECIST. A) CHC al momento de diagnóstico en estadio A de la BCLC. B) Seguimiento posterior a la QEIA, se observa respuesta parcial (70%), sin disminución en el tamaño global del tumor. Al utilizar RECIST 1.1 este paciente sería considerado como enfermedad estable, ya que no existe disminución del tamaño total del tumor. Sin embargo, la zona que realza es menor al 30% del volumen total, de acuerdo a mRECIST este paciente presenta respuesta parcial a la QEIA.
Los estudios de imagen funcional están obteniendo resultados prometedores para la monitorización de la respuesta terapéutica, no obstante se requieren más estudios de investigación para validar su utilidad clínica en la toma de decisiones. La difusión y perfusión por RM han dado resultados prometedores en el diagnóstico y seguimiento del tratamiento del CHC, sin embargo estas técnicas de imagen funcional no han sido estandarizadas lo que impide su uso sistemático en la evaluación en la respuesta al tratamiento55.
Seguimiento
No hay un consenso uniforme acerca del esquema de seguimiento más apropiado, se sugiere realizar TC contrastada o RM dinámica cada 3-6 meses8,15,17. En nuestro Instituto el seguimiento se realiza cada 3 meses.
Conclusiones
La coexistencia de cirrosis hepática con enfermedad tumoral hace de esta enfermedad un reto para el tratamiento.
Los mejores resultados son obtenidos por grupos multidisciplinarios que tienen como objetivo establecer sistemas de tamizaje, diagnósticos oportunos y tratamientos adecuados para una enfermedad que por su naturaleza es difícil de tratar.
El conocimiento de las opciones terapéuticas para cada grupo de pacientes y sus contraindicaciones son esenciales, para asegurar buenos desenlaces para los pacientes con CHC.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Financiamiento
Los autores no recibieron patrocinio para llevar a cabo este artículo.
* Autor para correspondencia:
Departamento de Radiología e Imagen Molecular, Instituto Nacional de Ciencias Médicas y Nutrición "Salvador Zubirán".
Vasco de Quiroga N° 15, Colonia Sección XVI, Delegación Tlalpan, C.P. 14000, México D.F., México.
Teléfono: 5487 0900, ext. 2157. Celular: 55 3955 0999.
Correo electrónico: adpepe@gmail.com (Adrián José González-Aguirre).