Objetivos: Evaluar el patrón de la primera progresión (PPP) después del tratamiento con terapias locorregionales (TLR) en pacientes con carcinoma hepatocelular (CHC), e identificar si la clasificación de Child-Pugh (CP), el estadio de Cáncer Hepático de la Clínica de Barcelona (BCLC) y el tipo de tratamiento influenciaron en el PPP.
Material y métodos: Estudio restrospectivo de pacientes con CHC, que recibieron TLR como primer tratamiento del 02 de 2006 a 12 de 2012 con BCLC-0, A y B, y tuvieron progresión de la enfermedad (PE) durante su seguimiento. Los pacientes fueron divididos en 4 grupos según PPP: grupo 1 (G1), recurrencia local; grupo 2 (G2), mismo segmento; grupo 3 (G3), mismo lóbulo, diferente segmento; grupo 4 (G4), lóbulo contralateral. Se realizó ji cuadrada para hacer las comparaciones entre las frecuencias de progresión.
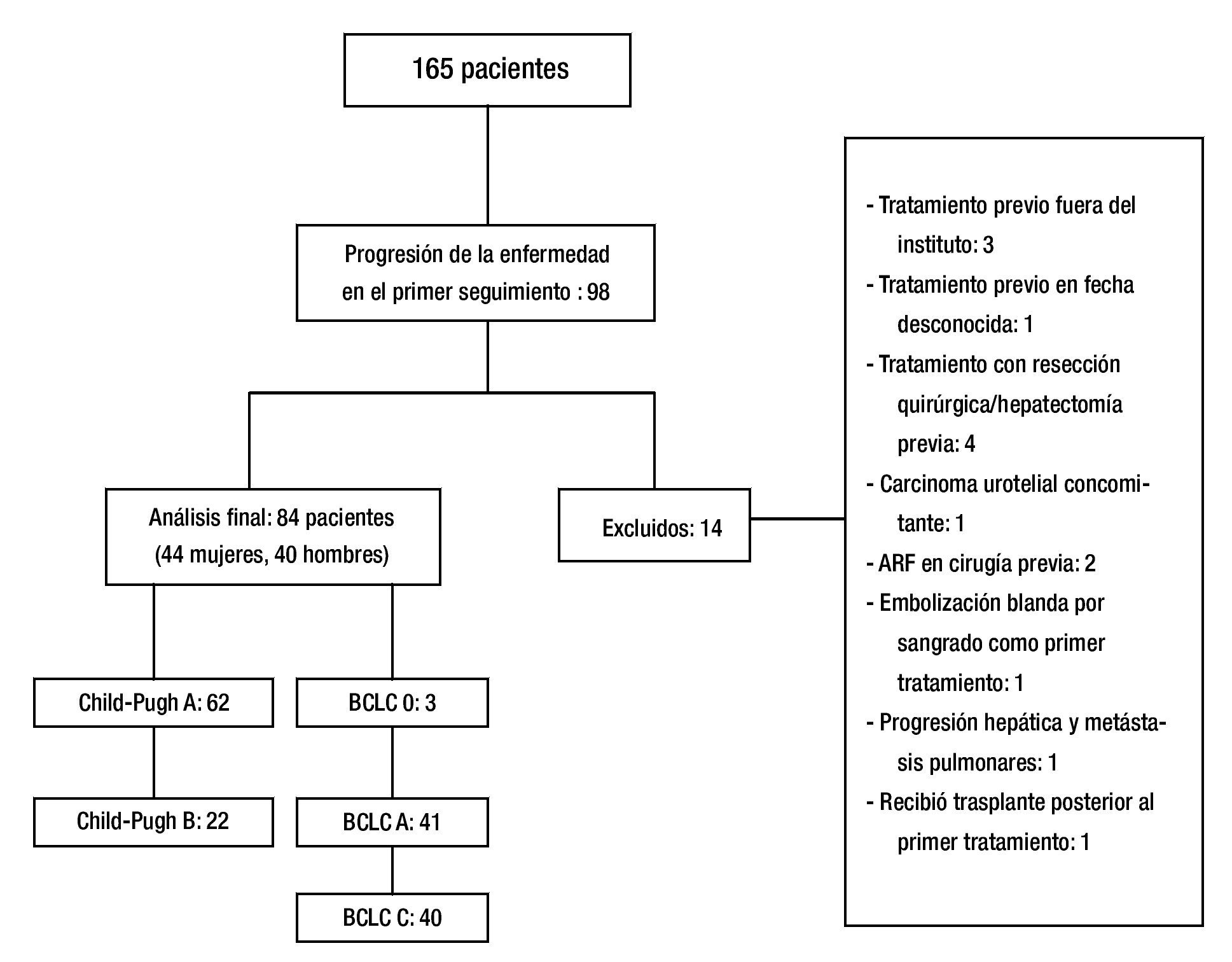
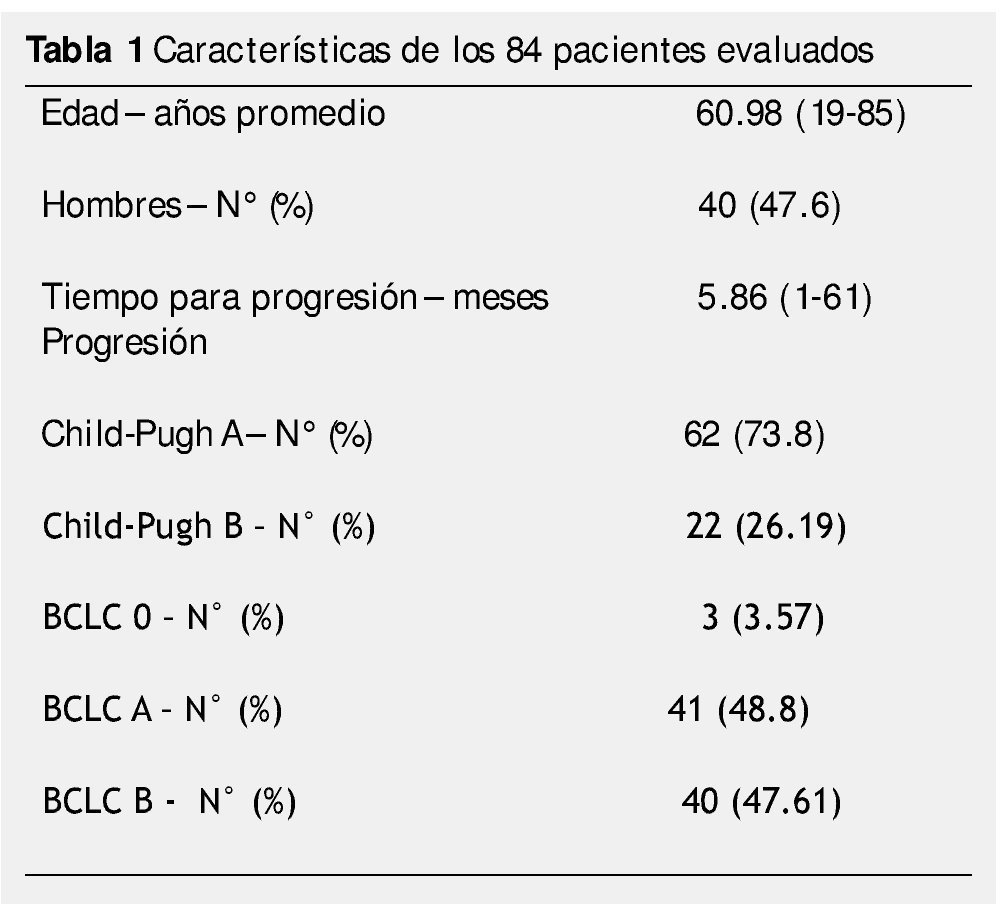
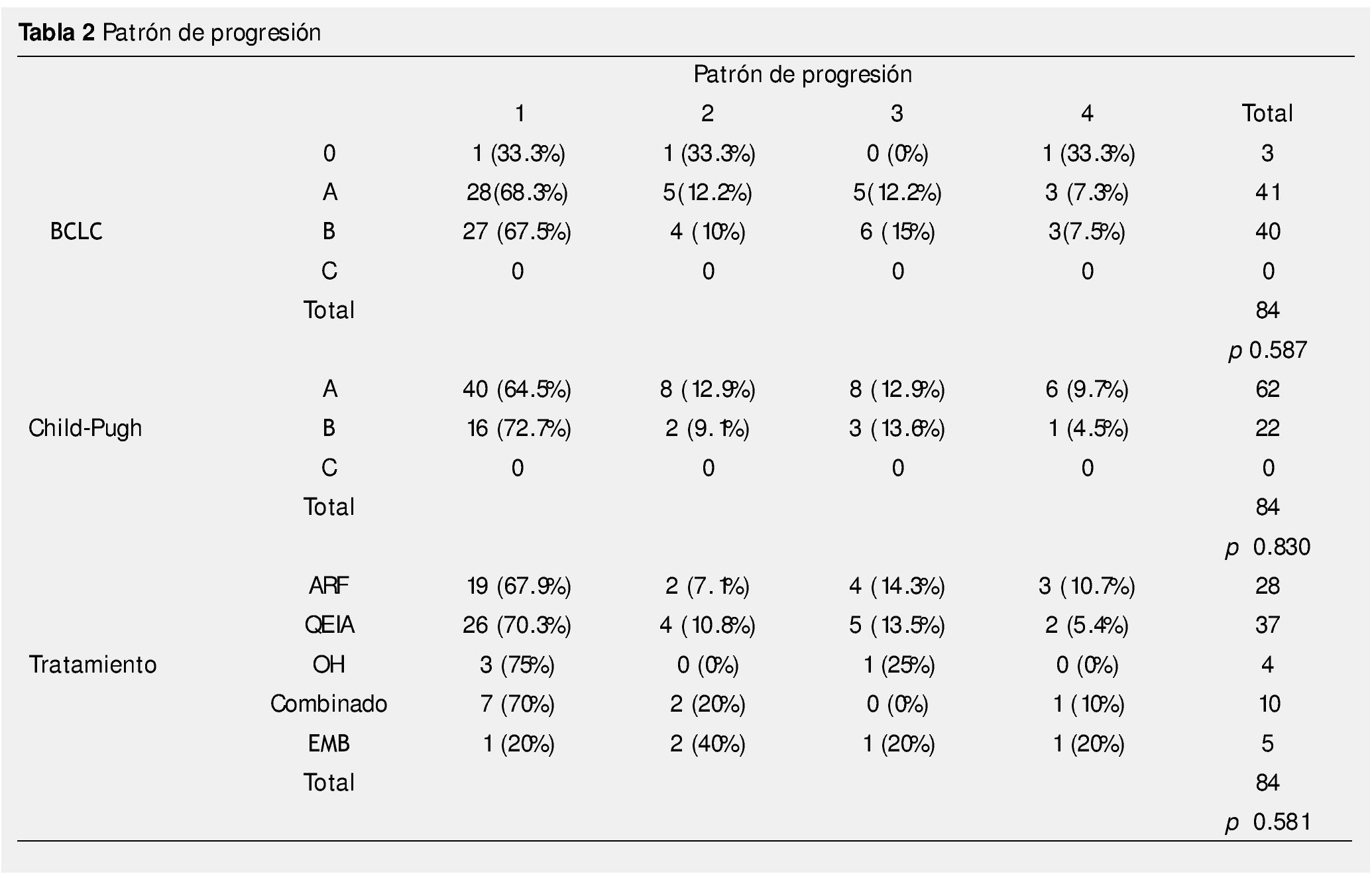
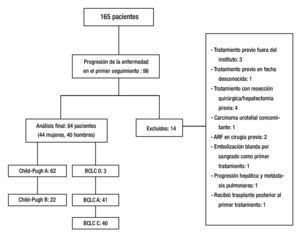
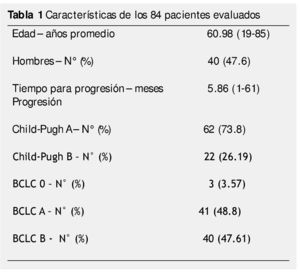
Resultados: Ciento sesenta y cinco pacientes fueron tratados con TLR, 98 tuvieron PE durante el seguimiento, 14 fueron excluidos. Cuarenta y cuatro fueron mujeres, 62 con CP A y 22 con CP B. Tres pacientes fueron BCLC-0, 41 BCLC-A y 40 BCLC-B. El tratamiento inicial fue con ablación por radiofrecuencia (ARF) para 28 pacientes, quimioembolización intraarterial (QEIA) para 37, embolización blanda 5, alcohol 4 y 10 pacientes recibieron tratamiento combinado. El tiempo promedio de progresión fue de 5.86 meses (3-61). Cincuenta y seis pacientes (66.7%) estaban en el G1, sólo 7 pacientes (8.3%) en G4. No hubo asociación significativa entre el tipo de TLR, BCLC, CP y PPP.
Conclusión: EL PPP más frecuente fue recurrencia local, sin encontrar relación con la clasificación de CP, estadio BCLC o tipo de TLR.
Objective: Evaluate the pattern of first progression (PFP) after locoregional therapies (LRT) in patients with hepatocellular carcinoma (HCC) and identify whether Child-Pugh classification (CP), Barcelona Classification (BCLC) and type of treatment (TT) influence pattern of first progression (PFP).
Materials and methods: Restrospective study. Patients with HCC who underwent LRT as first treatment between 02/2006 to 12/2012. HCC BCLC 0, A and B with progression during follow up were included. Patients were divided in 4 groups according to the PFP: group 1 (G1), local recurrence; group 2 (G2), same segment; group 3 (G3), same lobe, different segment; group 4 (G4), contralateral lobe. x2 test was performed to make comparisons between frequencies of progression.
Results: A total of 165 patients were treated with LRT, 98 had disease progression during follow up, and 14 were excluded. Eighty-four patients were included in the final analysis. Forty-four were female, 62 were CP A and 22 were CP B. Three patients were BCLC 0, 41 were BCLC-A and 40 were BCLC-B. Initial treatment was RFA for 28 patients, TACE for 37, embolization of 5, alcohol 4, and 10 patients received combined treatment. Mean time to progression was 5.86 months (range 3-61). Overall, 56 patients (66.7%) of 84 had local progression, and only 7 patients (8.3%) had progression in the contralateral lobe.
Conclusion: In our population, once patients are treated the most common PFP is local recurrence. There was no significant relationship between PFP and CP, BCLC and type of LRT.
Introducción
El carcinoma hepatocelular (CHC) es el 5° cáncer más común en hombres, el 7° más común en mujeres, y la 3° causa de muerte relacionada con cáncer en el mundo1.
La resección hepática es considerada el tratamiento de primera línea más apropiado para pacientes con CHC solitario, que no son cirróticos o que son cirróticos sin hipertensión portal2-4, con tasas de sobrevida a 5 años de 55%-71%5,6. Cerca del 70% de los pacientes tienen recurrencia dentro de los primeros 5 años7,8, la mayoría de estos pacientes desarrollan recurrencias hepáticas9.
Cuando el trasplante hepático o la resección quirúrgica no son factibles, se puede optar por terapias de ablación percutánea, como la inyección de etanol y la ablación por radiofrecuencia (ARF). La ARF es la forma preferida de ablación percutánea, debido a su mayor eficacia en términos de curación local en comparación con la inyección con etanol10-13.
Los tratamientos curativos son posibles sólo en un porcentaje pequeño de pacientes, debido a factores limitantes como el daño hepático, el tamaño, número y distribución de los tumores. En pacientes con CHC en los que no es posible realizar trasplante hepático, resección quirúrgica o ARF, la quimioembolización intraarterial (QEIA) es una terapia esencial para mejorar el pronóstico14,15.
El hepatocarcinoma es una enfermedad que por naturaleza recurre después del primer tratamiento, y sigue siendo el principal problema después de la resección hepática, ablación percutánea o QEIA3,14,16. Se supone que la resección hepática tiene ventaja sobre la ARF en que es una intervención efectiva porque remueve de manera sistemática el segmento hepático que contiene el tumor, y generalmente se observan en el espécimen resecado nódulos satélites no detectados por exámenes radiológicos realizados previos a la cirugía17-19. Sin embargo, las lesiones microscópicas no necesariamente están confinadas en el segmento resecado, lo que explica la tasa de recurrencia de hasta el 70% después de 5 años de resección quirúrgica7,8.
El objetivo primario de este estudio es evaluar el tipo de primera progresión (recurrencia local, mismo segmento, mismo lóbulo otro segmento, lóbulo contralateral) después de terapias locorregionales (TLR) (ARF, inyección de etanol, QEIA) en pacientes con CHC. El objetivo secundario de este estudio es identificar si la clasificación de Child-Pugh (CP), el estadio de Cáncer Hepático de la Clínica de Barcelona (BCLC) y el tipo de tratamiento tienen influencia en el tipo de primera progresión.
Material y métodos
De forma retrospectiva se revisaron los expedientes de los pacientes con CHC tratados entre febrero del 2006 a diciembre de 2012.
El CHC fue diagnosticado histológicamente o mediante los criterios no invasivos de la American Association for the Study for Liver Diseases (AASLD).
De forma estandarizada los pacientes con clasificación Child-Turcotte-Pugh C son excluidos de los TLR. En este análisis se incluyeron los pacientes con estadio BCLC-0, A y B que fueron sometidos a TLR como primer tratamiento. Los pacientes con resección quirúrgica y trasplante hepático no fueron incluidos en el estudio.
Después del primer TLR, los pacientes fueron evaluados a los 3 meses con resonancia magnética (RM) con medio de contraste, siempre y cuando el primer tratamiento haya sido definido por el radiólogo intervencionista como exitoso.
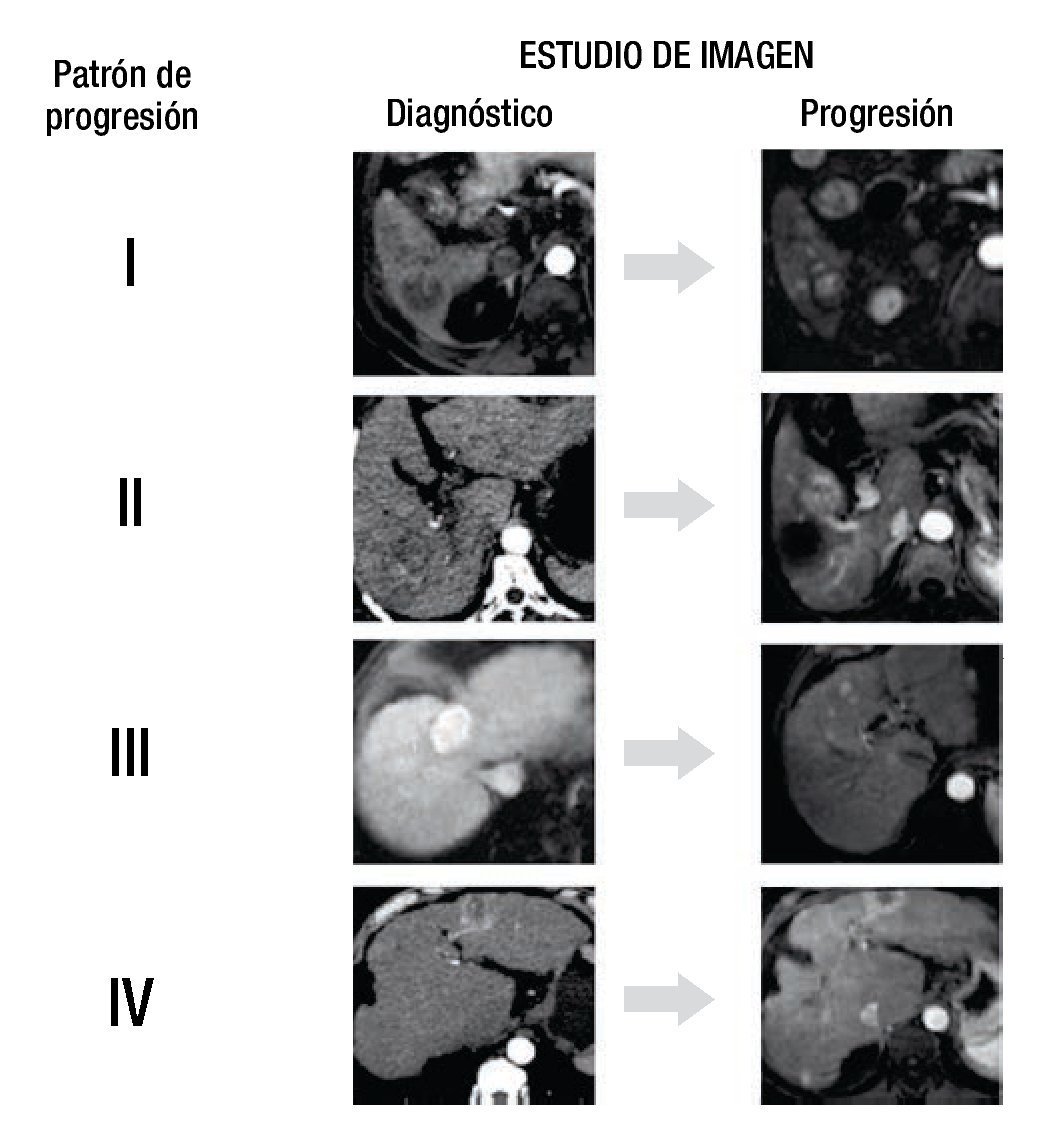
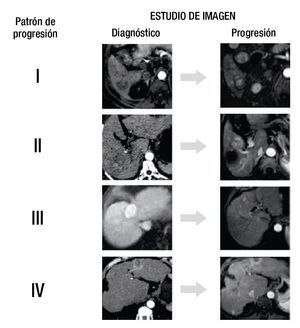
Se definió la progresión de la enfermedad según los criterios del mRECIST20. Los pacientes fueron divididos en 4 grupos de acuerdo al patrón de la primera progresión. Grupo 1 (G1), recurrencia local; grupo 2 (G2), mismo segmento; grupo 3 (G3), mismo lóbulo, diferente segmento; grupo 4 (G4), lóbulo contralateral (fig. 1).
Figura 1. Estudio de imagen.
Todas las imágenes fueron evaluadas en consenso por 2 radiólogos (A.G.A y L.C.), ciegos a los detalles clínicos, de laboratorio y a la evolución de los pacientes, el patrón de progresión fue clasificado de acuerdo a los 4 grupos diseñados.
El tiempo de recurrencia fue medido de la fecha del primer TLR, al tiempo de progresión del CHC.
Análisis estadístico
Todos los datos se presentaron como promedios con una desviación estándar, mediana o frecuencias.
Se utilizó t de Student para variables continuas y ji cuadrada para variables no paramétricas.
Todos los análisis estadísticos fueron realizados usando el software SPSS versión 17.0 (SPSS, Chicago, IL, USA). Un valor de p menor a 0.05 fue considerado estadísticamente significativo.
Resultados
Un total de 165 pacientes fueron tratados con TRL de febrero 2006 a diciembre 2012. De estos pacientes, 98 presentaron progresión de la enfermedad durante el seguimiento, 14 fueron excluidos. Ochenta y cuatro pacientes fueron incluidos en el análisis final (fig. 2). Las características de los pacientes en este estudio se muestran en la tabla 1.
Figura 2. Resultado.
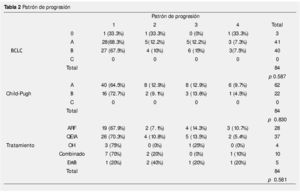
En 28 pacientes el tratamiento inicial fue ARF, 37 recibieron QEIA, 5 recibieron embolización blanda, 4 pacientes fueron tratados con inyección de alcohol, y 10 pacientes tenían tratamiento combinado, el patrón de progresión se muestra en la tabla 2. El tiempo promedio para progresión fue 5.85 meses (3-61 meses).
Discusión
Las TLR para el tratamiento del CHC han mostrado beneficio en la sobrevida21,22, sin embargo la recurrencia es común, la cual tiene un impacto negativo en el pronóstico de estos pacientes23.
En el presente estudio la tasa de recurrencia fue de 58%, en estudios anteriores la tasa de recurrencia reportada postratamiento locorregionales ha sido reportada de hasta 84%7,23-25.
Diferentes estudios han mostrado que la localización de la recurrencia está frecuentemente relacionada al tumor1,7,23,24, en el presente estudio el 66.7% se presentó como recurrencia local y sólo el 8.3% de los pacientes tuvieron progresión en el lóbulo contralateral.
La recurrencia del CHC se ha explicado por diferentes mecanismos: crecimiento de tumores residuales y carcinogénesis de novo26.
Se han asociado diferentes variables al tipo de recurrencia, la multinodularidad y el valor de la α-fetoproteína como factores predictivos de recurrencia temprana que puede ser principalmente por tumores residuales no detectados, siendo la recurrencia local la más frecuente y los factores asociados a carcinogénesis de novo, como la cirrosis, y la pobre reserva hepática, como predictores de progresión tardía7.
En el estudio de Tateishi, los factores de riesgo (FR) fueron similares entre el tipo de recurrencia, a excepción de que la edad mayor fue un FR sólo para recurrencia extra-subsegmentaria después del tratamiento con ARF1. Sin embargo, el patrón de recurrencia no ha demostrado tener un impacto en la sobrevida1,7.
La mayor tasa de recurrencia local se puede deber a que la necrosis tumoral es incompleta y a las limitaciones de los métodos de imagen para detectar tumores residuales pequeños.
El conocer los patrones de recurrencia ayudaría en la detección y manejo posterior al TLR.
Las limitaciones de este estudio, incluyen su naturaleza retrospectiva y un número pequeño de pacientes en algunos grupos de tratamiento.
La mayoría de los pacientes después de terapias locorregionales presentó la primera recurrencia de forma local, lo que podría estar en relación a la presencia de tumores residuales y no a carcinogénesis de novo. Sin embargo, no se encontró relación del patrón de progresión con la clasificación de CP o el estadio de BCLC, ni con el tipo de tratamiento.
La presencia de progresión en lóbulo contralateral fue baja (8.4%), lo que podría sugerir que una vez que los pacientes con CHC son tratados la probabilidad de presentar enfermedad bilobar es baja.
Conclusión
En este grupo de pacientes tratados con TLR, la gran mayoría de los casos de progresión fue recurrencia local. La progresión en otro segmento o lóbulo fue rara. Este hallazgo debe motivar la búsqueda intencionada de evidencia de progresión, en los sitios con TLR previos.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Financiamiento
Los autores no recibieron patrocinio para llevar a cabo este artículo.
* Autor para correspondencia:
Departamento de Radiología e Imagen Molecular, Instituto Nacional de Ciencias Médicas y Nutrición "Salvador Zubirán".
Vasco de Quiroga N° 15, Colonia Sección XVI, Delegación Tlalpan, C.P. 14000, México D.F., México.
Teléfono: 5487 0900, ext. 2157. Celular: 55 3955 0999.
Correo electrónico: adpepe@gmail.com (Adrián José González-Aguirre).