¿INTRODUCCIÓN
Los sarcomas de partes blandas del adulto constituyen un grupo heterogéneo de neoplasias con poca incidencia. Su respuesta a quimioterapia es limitada, por lo que la cirugía es el abordaje óptimo para alcanzar tasas de supervivencia de largo plazo. Desafortunadamente, 40-60% de los pacientes con esta clase de neoplasias desarrollan metástasis después del tratamiento local, lo cual demanda una terapia adyuvante efectiva. En la enfermedad metastásica o recurrente no resecable la combinación de ifosfamida más doxorrubicina se ha convertido en el manejo estándar. Las respuestas globales oscilan entre 34 y 68% con dosis altas, aunque con mayor toxicidad y requerimiento de apoyo con factores estimulantes de colonias.1,2
Históricamente, el cisplatino ha demostrado causar bajas respuestas al indicarse en sarcomas avanzados de partes blandas. Desde 1979, Karakousis y cols. probaron este compuesto y observaron respuestas que variaban entre 18 y 28%; sin embargo, estos resultados no han sido corroborados en la literatura por otros autores, en el mejor de los casos sólo se reportaban tasas de respuesta de 6%.3-5 Otros investigadores han estudiado también el uso de cisplatino, pero en dosis mayores a 100 mg/m2 por ciclo de tratamiento con respuestas de hasta 15%, aunque a expensas de una mayor toxicidad, por lo que cisplatino se ha considerado un fármaco de uso limitado en esta patología.6-9
La combinación de cisplatino con doxorrubicina y mitomicina fue previamente evaluada en la Clínica Mayo, el porcentaje de respuesta fue 32%, con una tasa de supervivencia media de 8 meses, que no difiere significativamente de lo alcanzado con la combinación de ifosfamida + doxorrubicina con dosis estándares, aunque con una toxicidad menor a la atribuida a este último esquema.1 Un reporte reciente de Kalofonos y cols. nos habla del manejo con doxorrubicina, a razón de 75 mg/m2 en 3 días + cisplatino a razón de 100 mg/m2 en el primer día en una población de 30 pacientes con enfermedad avanzada o metastásica, se obtuvo una tasa de respuesta global de 17%, así como una tasa de supervivencia media de 11.5 meses.10
Doxorrubicina es un fármaco que, desde los reportes iniciales de eficacia, mostró un rango de respuesta de 20-25% (con 38% en la actualidad, administrada en dosis altas), por ello se perfiló como el medicamento de elección en sarcomas de partes blandas. En pacientes con osteosarcoma candidatos a quimioterapia una de las combinaciones de quimioterapia estándar es cisplatino + doxorrubicina, por ello nosotros ensayamos esta combinación en sarcomas de partes blandas.
Este equipo de investigadores ensayó la combinación cisplatino + doxorrubicina en pacientes con enfermedad avanzada o metastásica irresecable, con el objetivo de evaluar el porcentaje de respuesta, toxicidad, supervivencia y beneficio clínico.
¿PACIENTES Y MÉTODOS
En total, 31 pacientes (once mujeres y veinte hombres) con diagnóstico de sarcoma de partes blandas de alto grado, avanzado o metastático y no resecable, recibieron la combinación cisplatino + doxorrubicina entre noviembre del 2001 y junio del 2003. El estudio es de cohorte histórica retrospectiva.
¿ESQUEMA TERAPÉUTICO
Se administró cisplatino en dosis de 100 mg/m2 por vía IV/4 horas de infusión, más doxorrubicina en dosis de 60 mg/m2 por vía IV/60 minutos de infusión en el mismo día de tratamiento. Todos los pacientes recibieron hidratación previa y antieméticos (inhibidores de la 5-hidroxitriptamina), esteroides (dexametasona [16 mg]), además se forzó diuresis osmótica con manitol (250 mL, al 20%.). Este esquema se repitió cada 21 días. En pacientes con toxicidad grado 2 o más (excepto alopecia) al momento de la siguiente aplicación de quimioterapia fueron diferidos una o dos semanas para su recuperación. En caso de mayor tiempo se suspendió definitivamente la quimioterapia.
Se utilizaron los criterios de toxicidad del Instituto Nacional de Cáncer de Estados Unidos, así como criterios para ajuste de dosis. Previamente a cada ciclo, se evaluó con biometría hemática y química sanguínea con cálculo de depuración de creatinina. La evaluación de la respuesta se llevó a cabo cada 2 ciclos de quimioterapia, de acuerdo con las guías de la Organización Mundial de la Salud y estudios de imagen (TC) de la región o regiones afectadas. Los pacientes eran considerados para medición de respuesta si ya habían recibido, por lo menos, 2 ciclos de quimioterapia.
¿ANÁLISIS ESTADÍSTICO
Por tratarse de un estudio retrospectivo, que no tuvo grupo control, se realizó solamente estadística descriptiva, los resultados fueron presentados en porcentajes, medias y medianas.
¿RESULTADOS
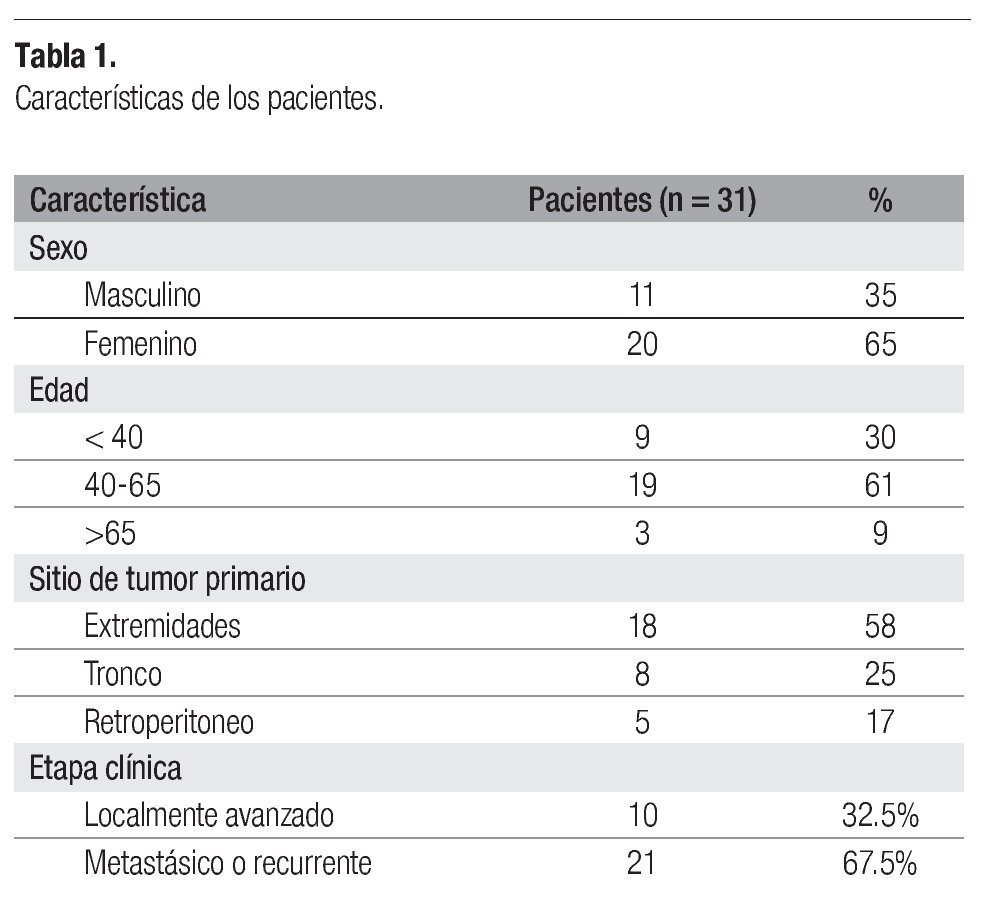
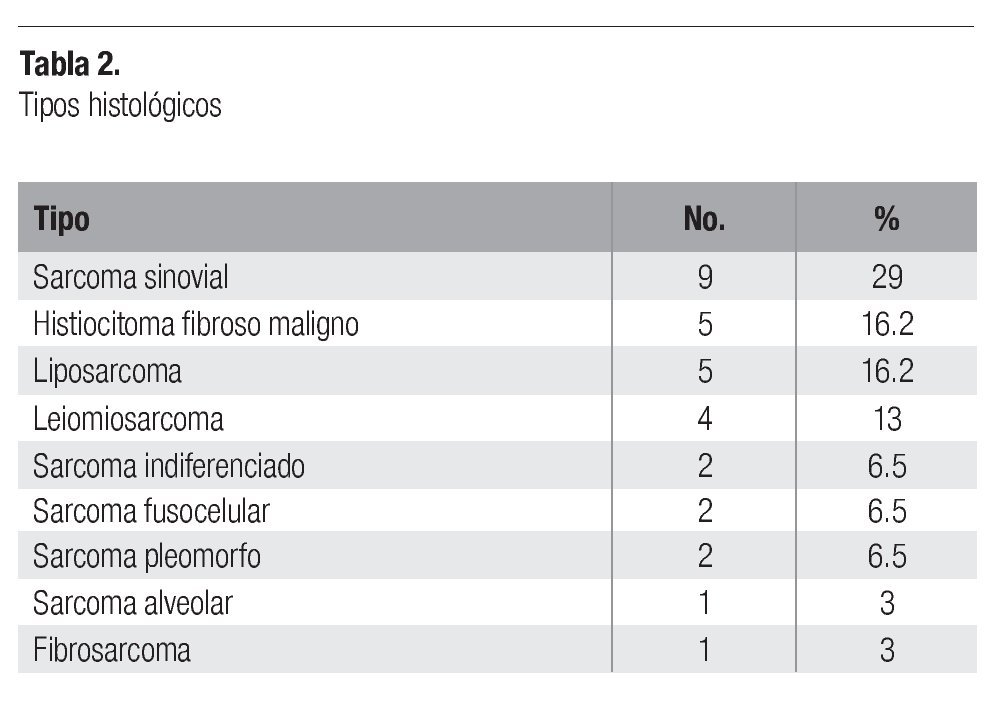
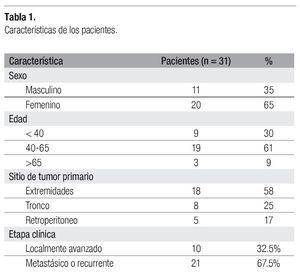
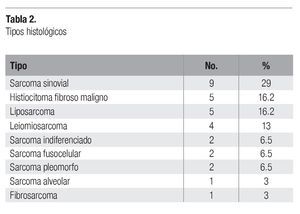
Entre noviembre del 2001 y junio del 2003, se trataron un total de 31 pacientes con el esquema de quimioterapia cisplatino + doxorrubicina. Las características demográficas se presentan en la Tabla 1. De los 31 pacientes, 20 fueron mujeres (65%) y 11 hombres (35%), con una edad media de 53 años (intervalo = 21-74 años). La localización predominante fue en extremidades, con 18 pacientes (58%), seguida del tronco, con 8 pacientes (25%), y retroperitoneo, con 5 pacientes (17%). La etapa clínica metastásica o recurrente se presentó en la mayor parte de pacientes, con 21 casos (67.5%), mientras que el cáncer localmente avanzado sólo en 10 pacientes (32.5%). Los tipos histológicos fueron diversos (Tabla 2), con el sarcoma sinovial como el más común, con nueve casos (29%), seguido del histiocitoma fibroso maligno y del liposarcoma, con cinco casos cada uno (16.2%). Todos los tipos histológicos en esta población fueron de "alto grado".
¿QUIMIOTERAPIA
Se aplicaron un total de 126 ciclos de quimioterapia con un rango de 2-8, y una media de 4 ciclos. Se administraron a una intensidad de dosis de 83% para cisplatino y de 85% para doxorrubicina. La modalidad de tratamiento principal fue la paliativa, en un total de 23 pacientes (74%), y la de inducción en 8 pacientes (26%).
¿RESPUESTA AL TRATAMIENTO
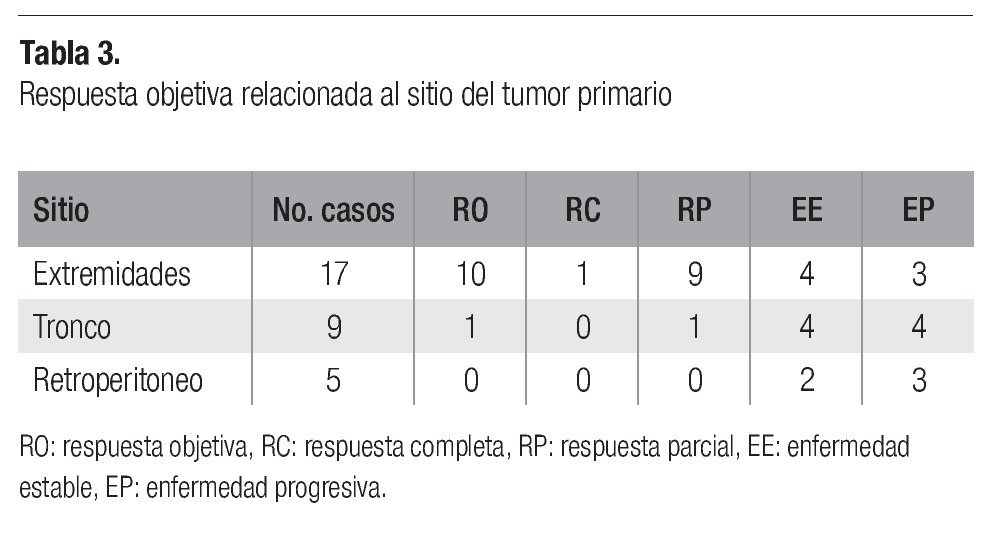
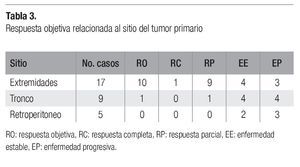
En general, se observaron respuestas objetivas en 11 pacientes (35.5%), una respuesta completa (3.4%) y diez parciales (32.1%). El caso de respuesta completa, fue en una mujer de 60 años con histiocitoma fibroso maligno de glúteo, lográndose resección después de 5 ciclos, con confirmación histológica de respuesta completa. Se observó enfermedad estable en diez casos (32.1%) y los restantes diez (32.1%) cursaron con progresión. Las respuestas analizadas por localización del tumor se observan en la Tabla 3. El grupo de sarcomas de extremidades mostró el mayor porcentaje de respuestas objetivas (59%), seguido del grupo de tronco (12%), mientras que no se observó respuesta alguna entre los de retroperitoneo, quienes se mantuvieron con enfermedad estable en 40% y con progresión en 60%.
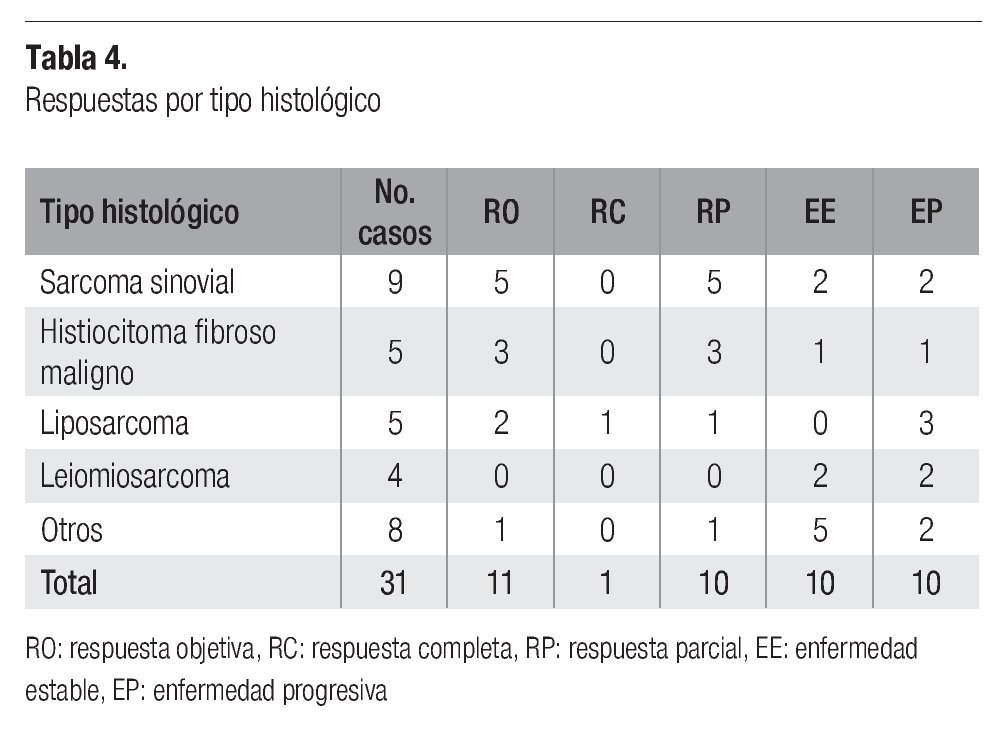
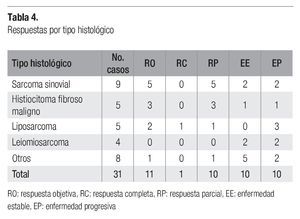
En la Tabla 4 se observan los tipos histológicos que más respuestas globales presentaron, siendo el histiocitoma fibroso maligno y el sarcoma sinovial (con 60 y 56%, respectivamente), en tanto que ningún leiomiosarcoma mostró respuesta objetiva.
¿SUPERVIVENCIA GLOBAL Y SUPERVIVENCIA LIBRE DE PROGRESIÓN
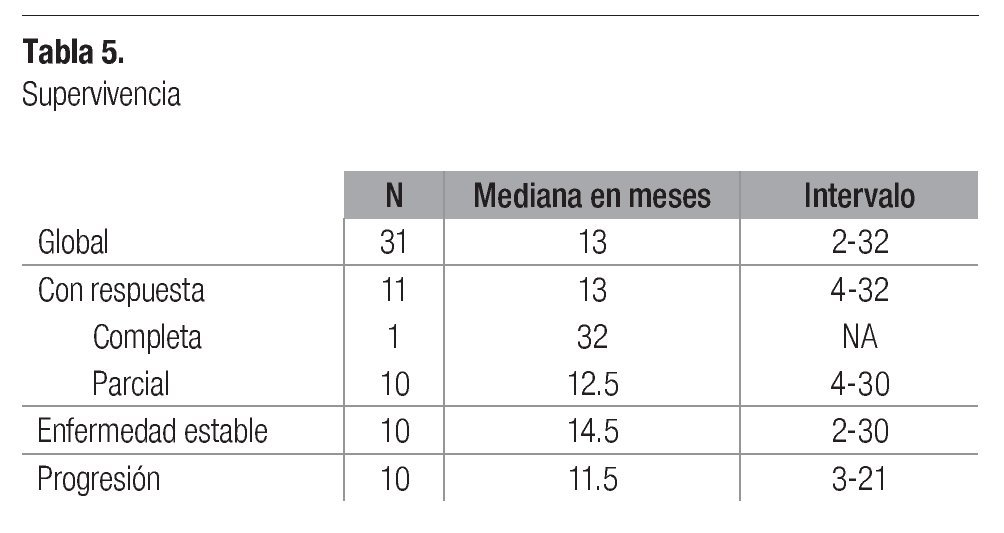
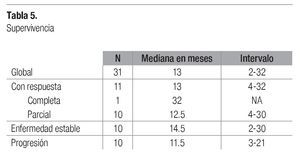
La supervivencia se calculó en medianas: la global para todos los pacientes fue de 13 meses. En este grupo de pacientes, aquellos con enfermedad estable lograron la mayor supervivencia, con 14.5 meses y con un intervalo de 2 a 30 meses (Tabla 5). La supervivencia libre de progresión observada en pacientes que respondieron fue de 5 meses, con un intervalo de 2 a 24 meses, mientras que en quienes tuvieron enfermedad estable fue de sólo 2 meses, con un intervalo de 2 a 20 meses (Tabla6).
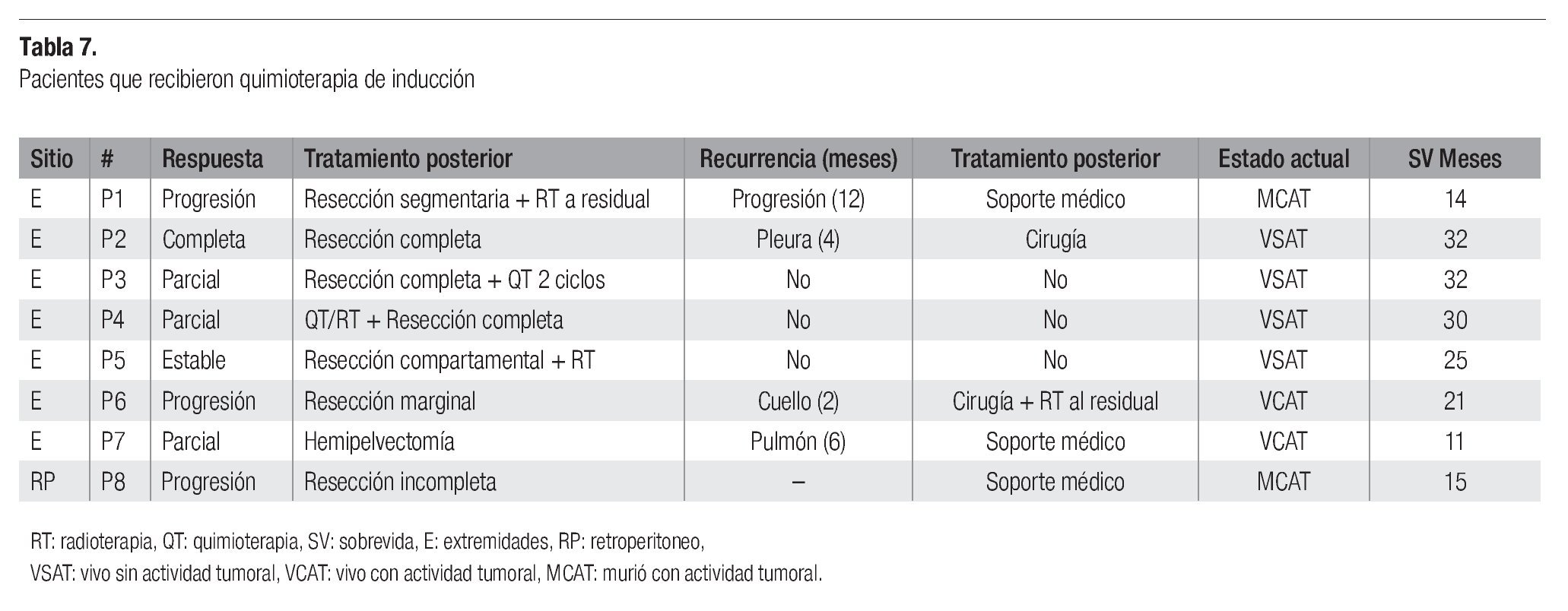
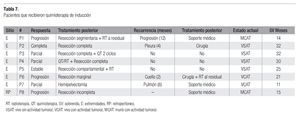
De 10 pacientes con enfermedad localmente avanzada, recibieron quimioterapia de inducción, en ocho pudieron ser sometidos a tratamiento posterior, de los cuales siete fueron de extremidades y uno de retroperitoneo (Tabla 7). En ellos, se realizó el máximo esfuerzo terapéutico, complementándose con resección completa o parcial y en tres casos además radioterapia local. Se observó que cuatro pacientes se encuentran vivos y sin datos de actividad tumoral, con una supervivencia de 25, 30, 31 y 32 meses; otros dos pacientes vivos con actividad tumoral, con una supervivencia de 11 y 21 meses, y dos pacientes muertos por progresión tumoral, con una supervivencia de 14 y 15 meses. De los restantes 2 casos en quimioterapia de inducción, progresaron sin posibilidad quirúrgica.
¿TOXICIDAD
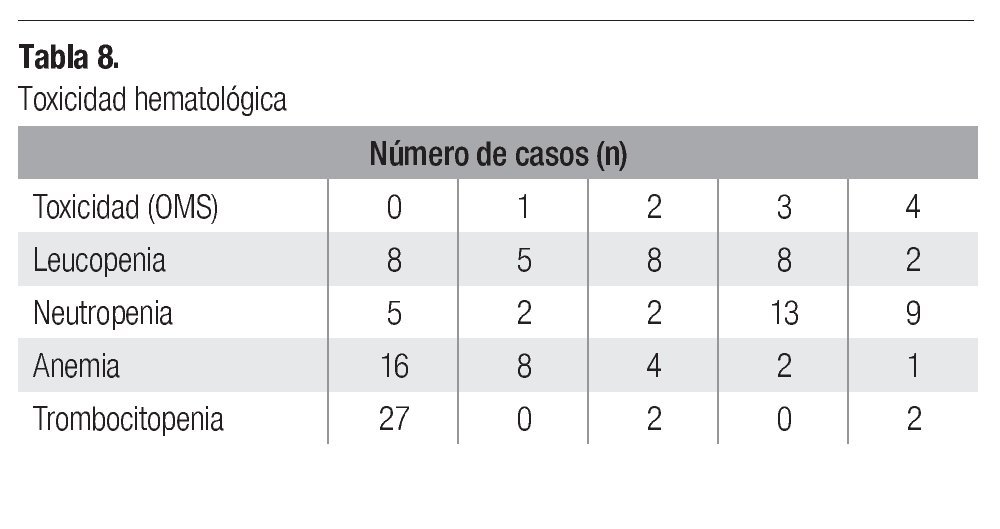
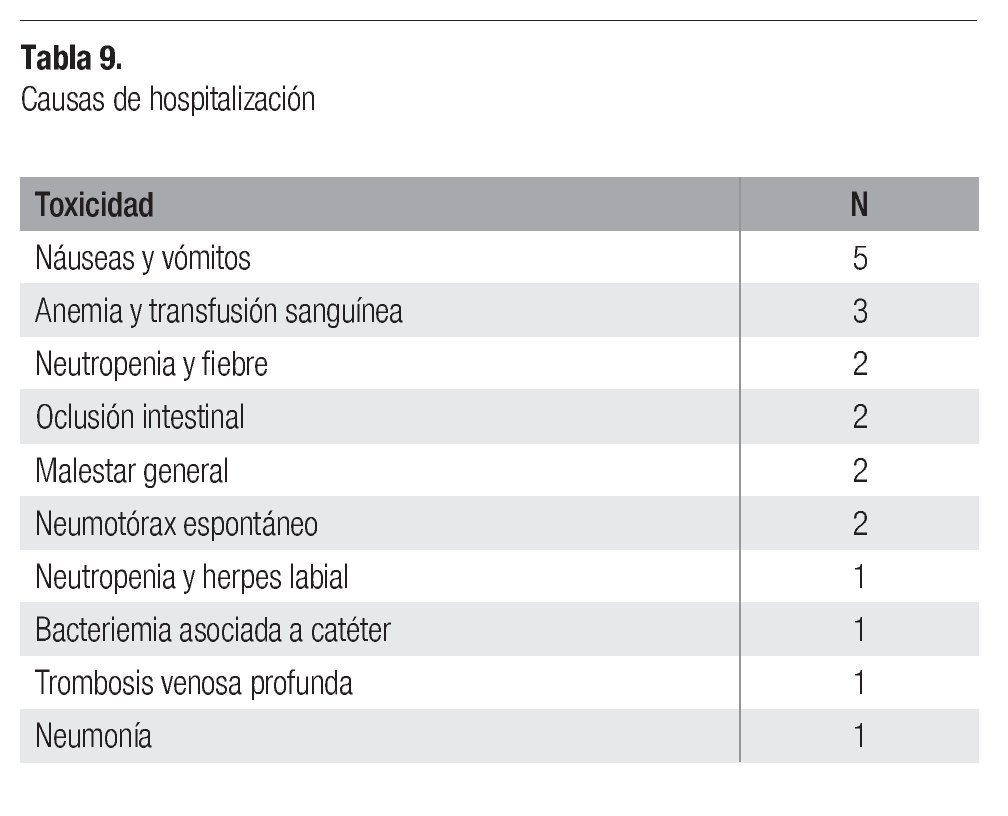
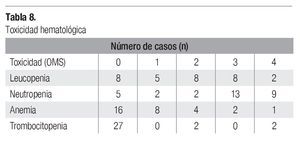
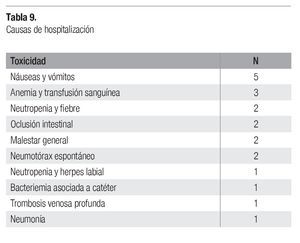
Los 31 pacientes fueron incluidos en la evaluación de toxicidad. De la toxicidad hematológica grado 3-4, se observó leucopenia en 10 pacientes (32%), neutropenia en 22 (71%), anemia en 3 (9%) y trombocitopenia en 2 pacientes (6%) (Tabla 8). En 7 pacientes hubo necesidad de hospitalización, 3 para transfusión sanguínea por anemia, 2 por neutropenia más fiebre, 1 por neutropenia más herpes labial y 1 por pancitopenia. De la toxicidad no hematológica grado 3-4, la náusea y vómito fue lo más frecuente (32%) seguido por astenia (6%). Otros internamientos fueron realizados en 14 pacientes por deshidratación por vómitos en 5, suboclusión intestinal en 2 (pacientes con tumor retroperitoneal), malestar general en 2 casos, trombosis venosa profunda de pierna en 1 caso, bacteriemia asociada a catéter central en un caso, neumotórax asociado a actividad tumoral en 2 y neumonía sin alteraciones hematológica en 1 caso (Tabla 9).
¿DISCUSIÓN
Evaluamos en 31 pacientes la eficacia clínica y toxicidad de la combinación doxorrubicina y cisplatino como tratamiento de primera línea en sarcomas de partes blandas. El régimen es de fácil administración y generalmente en nuestro centro se aplicó de forma ambulatoria. El principal sitio de afección fueron las extremidades, lo cual concuerda con lo reportado en la literatura mundial para este tipo de tumores.11 Considerando lo diverso de los tipos histológicos y lo variable en la sensibilidad a quimioterapia con pronósticos diferentes,12 sólo se incluyeron casos de alto grado siendo el sarcoma sinovial el más común.
En nuestro estudio sólo un paciente presentó respuesta patológica completa y en 10 casos fue parcial. Una variedad de diferentes agentes citotóxicos han sido evaluados en sarcomas de partes blandas por varias décadas. En la mayoría de ellos, se ha demostrado actividad marginal al orden del 10% (doxorrubicina, epirrubicina, ifosfamida, DTIC, cisplatino, taxanos, gemcitabine).13,14 Se han ensayado varias combinaciones, siendo la de doxorrubicina e ifosfamida las más aceptadas con rangos de respuesta entre 20 y 30% a dosis convencionales.15,17 En nuestro grupo se logró respuesta objetiva del 36%, siendo superior al promedio del esquema más utilizado. Éste puede explicarse por varios factores, entre ellos, que 55% de los pacientes fueron sarcomas de localización primaria en extremidades y 52% comprendió a sarcoma sinovial, histiocitoma fibroso maligno y sarcoma indiferenciado. Datos observados en dos reportes de Patel18,19 de 33 y 79 pacientes evaluados sometidos a altas dosis de doxorrubicina e ifosfamida encontró altos porcentajes de respuesta hasta del 80% cuando cumplían 2 requisitos: sitio primario en extremidades y sarcoma de alto grado (arriba referidos). Existe poca información de resultados con combinaciones de quimioterapia que incluyen cisplatino con alguna antraciclina, Edmonson en 1985,20 publicó la combinación de doxorrubicina, mitomicina y cisplatino en sarcomas de partes blandas con respuesta global del 43%. Posteriormente, Jelic en 1997 con dosis altas de epirrubicina y cisplatino (100 mg/m2) con respuesta del 54%.21 Kalofonos en el 2004 presenta la combinación doxorrubicina a 25 mg/m2 días 1-3 y cisplatino 100 mg/m2 en 30 pacientes con sarcomas de partes blandas con 16.7% de respuesta objetiva;10 a diferencia de nuestro estudio, ellos incluyeron pacientes con tipos histológicos malos respondedores a quimioterapia y 75% con enfermedad metastásica.
La mediana de supervivencia global para nuestros pacientes fue de 13 meses. De los diversos reportes para pacientes con sarcomas avanzados la supervivencia media oscila entre 9 y 14 meses, siendo en el grupo que presentamos dentro de lo esperado. Del reporte con cisplatino y doxorrubicina publicado en el 2004,10 la supervivencia media fue de 11.5 meses. Nosotros observamos en el grupo de pacientes con enfermedad estable posquimioterapia, una supervivencia media de 14.5 meses, esto puede justificarse por el número pequeño de pacientes que tenemos. El único paciente que tuvo respuesta patológica completa ha permanecido vivo a 32 meses del término del tratamiento.
El 67% de nuestros casos se presentó con enfermedad metastásica, siendo 10 con enfermedad localmente avanzada. En ellos se intentó quimioterapia de inducción, que con un manejo combinado de cirugía y radioterapia fue el grupo con mayor supervivencia. En el 2000 Patel y cols. reportaron el uso de quimioterapia a base de doxorrubicina e ifosfamida en pacientes con sarcomas de extremidades, con beneficio en resecabilidad y supervivencia, años después Pisters y Patel publican el uso de tratamiento neoadyuvante con doxorrubicina con radioterapia concomitante.22 Datos recientes apoyan el cambio de estrategia en este grupo de enfermos, donde habrá que considerar el manejo multimodal con quimioterapia, radioterapia y cirugía.
El perfil de toxicidad observado en nuestros enfermos fue aceptable, siendo la toxicidad hematológica la más común. Tuvimos alto porcentaje de neutropenia grado 3-4 (71%) y 13% de neutropenia febril. Comparativamente con la combinación doxorrubicina-ifosfamida o altas dosis de ifosfamida, han reportado neutropenia grado 3-4 del 60 al 100% con neutropenia febril hasta 39%.19,23,24 La trombocitopenia grado 3-4 ha sido referida hasta 30%,23 siendo en nuestro grupo significativamente menor del 6%. De eventos de anemia grado 3-4, se observó en 5 casos siendo en 3 de ellos motivo de hospitalización. Tuvimos 21 hospitalizaciones, 12 directamente relacionadas al tratamiento citotóxico y 9 secundarias a la actividad tumoral. Estos internamientos similares a lo informado por otros autores.
Han sido evaluadas una gran variedad de combinaciones con quimioterapia en ensayos fase II-III que incluyen doxorrubicina e ifosfamida. Actualmente, se han utilizado los taxanos (principalmente docetaxel), gemcitabine e incluso terapias blanco como un inhibidor de tirosin cinasa25 sin lograr superar a la doxorrubicina a dosis de 75 mg/m2 cada 3 semanas. Se ha tenido una variabilidad en los resultados tanto de eficacia como de tolerancia, ya que en diversos estudios se han incorporado los factores estimulantes de colonias. Los agentes alquilantes son el segundo grupo de medicamentos más utilizados en esta enfermedad, con la ifosfamida como la más activa. La combinación doxorrubicina e ifosfamida ha sido utilizada extensamente.26 El cisplatino derivado de los platinos ha sido promisorio con actividad demostrada en sarcomas de hueso y pediátricos. Nuestros resultados confirman actividad aceptable y comparable con la combinación estándar con toxicidad moderada, pero manejable. En caso de indicar esta combinación habrá que considerar el uso de factores estimulantes de colonias y agregar al manejo profiláctico con antieméticos del tipo de aprepitant, ya que este fármaco no existía en el mercado cuando administramos cisplatino en nuestros enfermos de esta revisión retrospectiva.
¿C0NCLUSIÓN
La combinación cisplatino-doxorrubicina es activo y tolerable. Llamando la atención la mayor supervivencia en pacientes con enfermedad resecable después de la quimioterapia e incluso de algunos con radioterapia. Futuros estudios deberán evaluar el papel del tratamiento multi-modal en el manejo de pacientes con sarcomas de partes blandas avanzados.
Correspondencia:
Dr. Germán Calderillo. Sociedad Médica, Instituto Nacional de Cancerología.
Av. Sn. Fernando núm. 22, Col. Sección 16, Del. Tlalpan, C.P. 14080, México, D.F.
Tel. 56-28-04-00, ext. 829 o 427
Correo electrónico:calderillo06@yahoo.com.mx