Introducción: La leucemia linfoblástica aguda (LLA) es el cáncer más frecuente en la niñez. El inmunofenotipo de las células leucémicas es uno de los factores que establecen riesgo de recaída. La elección del panel de anticuerpos para diagnóstico inmunológico de LLA, puede variar entre instituciones. No todos los casos de LLA expresan antígenos para un solo linaje, ya que se han reportado numerosos casos donde las células expresan características de más de un linaje hematopoyético. De acuerdo a diferentes criterios encontramos definiciones de LLA con expresión aberrante de antígenos, infidelidad de linaje, de linaje mixto y leucemias bifenotípicas (BAL). El Grupo Europeo de Clasificación Inmunológica de Leucemias (EGIL), creó un sistema basado en puntos para distinguir casos de BAL, de aquellos con expresión aberrante de otro linaje. Está basado en el número y grado de especificidad de marcadores (linfoides y mieloides), expresados en las células leucémicas.
Métodos: Se realizó un estudio retrospectivo y transversal, en el Hospital Infantil de México Federico Gómez, se revisaron los expedientes de 113 pacientes con diagnóstico de LLA, en un periodo del 2008 al 2010. Se utilizó la clasificación del grupo del EGIL, para determinar si las leucemias tenían criterios de BAL.
Resultados: De los casos estudiados, se identificaron 29 pacientes asignados como riesgo habitual y 84 de alto riesgo. En 32 casos se pudo constatar por criterios del EGIL que se trataba de bifenotipia, esto correspondió al 28.3% del total de la muestra. El grupo donde se presentó el mayor número de BAL, fue el grupo de alto riesgo de recaída (25 pacientes con bifenotipia en LLA alto riesgo contra 7 en el grupo de riesgo habitual).
Conclusiones: Este trabajo es un intento para clasificar a las leucemias de manera sistemática, sin embargo queda pendiente conocer si este diagnóstico impacta en el resultado clínico.
Introduction: Acute lymphoblastic leukemia (ALL) is the most common cancer in childhood. The immunophenotype of leukemic cells is one of the factors that set risk of relapse. The choice of antibodies for diagnostic panel immune ALL may vary between institutions. Not all cases of ALL express antigens for a single lineage as many cases have been reported where cells express the characteristics of more than one hematopoietic lineage. According to different criteria there are definitions of ALL with aberrant expression of antigens, lineage infidelity, mixed lineage, and biphenotypic leukemias (BAL). The European Group of Immunological Classification of Leukemia (EGIL) created a points-based system to distinguish BAL of those with aberrant expression. It is based on the number and degree of specificity markers (lymphoid and myeloid cells) expressed in leukemic cells.
Methods: We conducted a retrospective study at Hospital Infantil de México; we reviewed the clinical records of 113 patients diagnosed with ALL in a period from 2008 to 2010. EGIL group classification was used to determine if ALL had the criteria to BAL.
Results: One hundred thirteen clinical records were analyzed, 29 patients were identified as standard-risk and 84 as high risk patients. In 32 cases it was found BAL by EGIL criteria, this corresponded to 28.3% of the total sample. The group which had the highest number of BAL was the group of high risk of relapse (25 patients with high-risk against 7 patients with standard risk group).
Conclusions: This study is an attempt to classify systematically acute leukemia, however remains to know if this diagnosis impact on outcome.
Introducción
La leucemia linfoblástica aguda (LLA) es el cáncer más frecuente en la niñez, representa el 23% de los diagnósticos de cáncer en menores de 15 años1, con una incidencia anual de 30 a 40 casos por millón2. En pediatría, la edad más frecuente de presentación es dentro del grupo de edad de 3 a 5 años3,4. Aproximadamente 2,400 niños y adolescentes menores de 20 años son diagnosticados con LLA cada año en los Estados Unidos, existiendo un aumento gradual de su incidencia en los últimos 25 años.
En América Latina la incidencia de la LLA es mayor a la reportada en otras partes del mundo, con tasas de hasta 120 pacientes por millón por año5,6, por lo que existen argumentos que hacen sospechar que los pacientes con LLA en esta región, podrían tener algunas variaciones biológicas con respecto a otros lugares del mundo.
La sospecha diagnóstica de LLA se basa en la identificación de síndromes sugestivos como síndrome infiltrativo, hemorrágico, anémico y síndrome febril, así como la determinación de pruebas hematológicas, metabólicas y radiológicas. El estándar de oro para el diagnóstico es el aspirado de médula ósea, donde se deben realizar estudios de morfología, inmunocitoquímica, fenotipo y de biología molecular7.
La diferenciación morfológica de los blastos en LLA se clasifica en L1, L2 y L3 de acuerdo al Grupo Cooperativo Franco-Americano-Británico (FAB, por sus siglas en Inglés)8.
La presencia de alteraciones citogenéticas se relaciona con el pronóstico de estos pacientes. Las modificaciones en el número de cromosomas (hiperdiploidía, trisomía), se asocian como factores favorables9. Por otro lado, existen translocaciones tales como t(12;21), t(9;22), t(4;11), t(1;19), entre otras, que tienen repercusión en la respuesta al tratamiento y por ende en el pronóstico10-12.
Como resultado de estudios epidemiológicos13 se sabe que los pacientes con edad entre uno a 9 años y del sexo femenino, tienen una mejor supervivencia que los que se encuentran fuera de este rango de edad; mientras que el pronóstico es desfavorable para los pacientes con infiltración a sistema nervioso central (SNC) y leucocitosis (más de 50,000/mm3) al diagnóstico14.
Con base en todo lo anterior, además de la respuesta a la quimioterapia y el fenotipo de la leucemia se establece el riesgo que tiene el paciente de recaer, por lo que de acuerdo al centro hospitalario se clasifican a los pacientes en varios estratos. En algunos centros se estratifican en pacientes de riesgo bajo, habitual o estándar, riesgo alto y riesgo muy alto15.
Un punto relevante es la clasificación inmunológica de esta neoplasia; las leucemias agudas se clasifican, de acuerdo a la célula progenitora que las origina, en linfoblásticas y mieloblásticas, siendo mucho más frecuentes las linfoblásticas, y dentro de éstas últimas, el fenotipo de células precursoras B que representa el 80%-85% de los casos de LLA infantil. Los pacientes que presentan fenotipo de células T, han demostrado tener asociación con características clínicas de mal pronóstico16.
El fenotipo celular se define como aquellos marcadores de superficie e intracelulares, que precisan estirpes o linajes específicos17. Para determinar el fenotipo se utiliza la citometría de flujo, la cual se basa en la reacción de antígenoanticuerpo. Los anticuerpos unidos a fluorocromos se unen a las proteínas de las células, que posteriormente pasan a través de un haz de luz y por medio de un sistema informático se puede calcular tanto el porcentaje de células que expresan esos antígenos, como la intensidad media de fluorescencia para el anticuerpo deseado. Todo ello ha llevado a colocar el fenotipo celular, no sólo con fines diagnósticos en las LLA, sino con fines pronósticos18.
El uso de anticuerpos monoclonales y el desarrollo de citómetros multiparamétricos han revolucionado la clasificación de muchas enfermedades, entre ellas las LLA. Gracias a estudios con citometría de flujo e inmunobiología, se ha observado que la transformación leucémica y la expansión clonal de las LLA, pueden ocurrir en diferentes etapas del proceso de maduración y diferenciación linfoide19,20.
Actualmente se han desarrollado más de 200 anticuerpos monoclonales (CD, cluster of differentiation, por sus siglas en Inglés), los cuales pueden detectar antígenos asociados con los linajes hematopoyéticos y están disponibles a la venta. Usando un panel de anticuerpos monoclonales asociados con la etapa de maduración de las células B, los investigadores han subclasificado las LLA de precursores B, en diversas etapas de acuerdo al grado de diferenciación y maduración. Sin embargo, ninguno se utiliza de manera aislada para establecer el diagnóstico21.
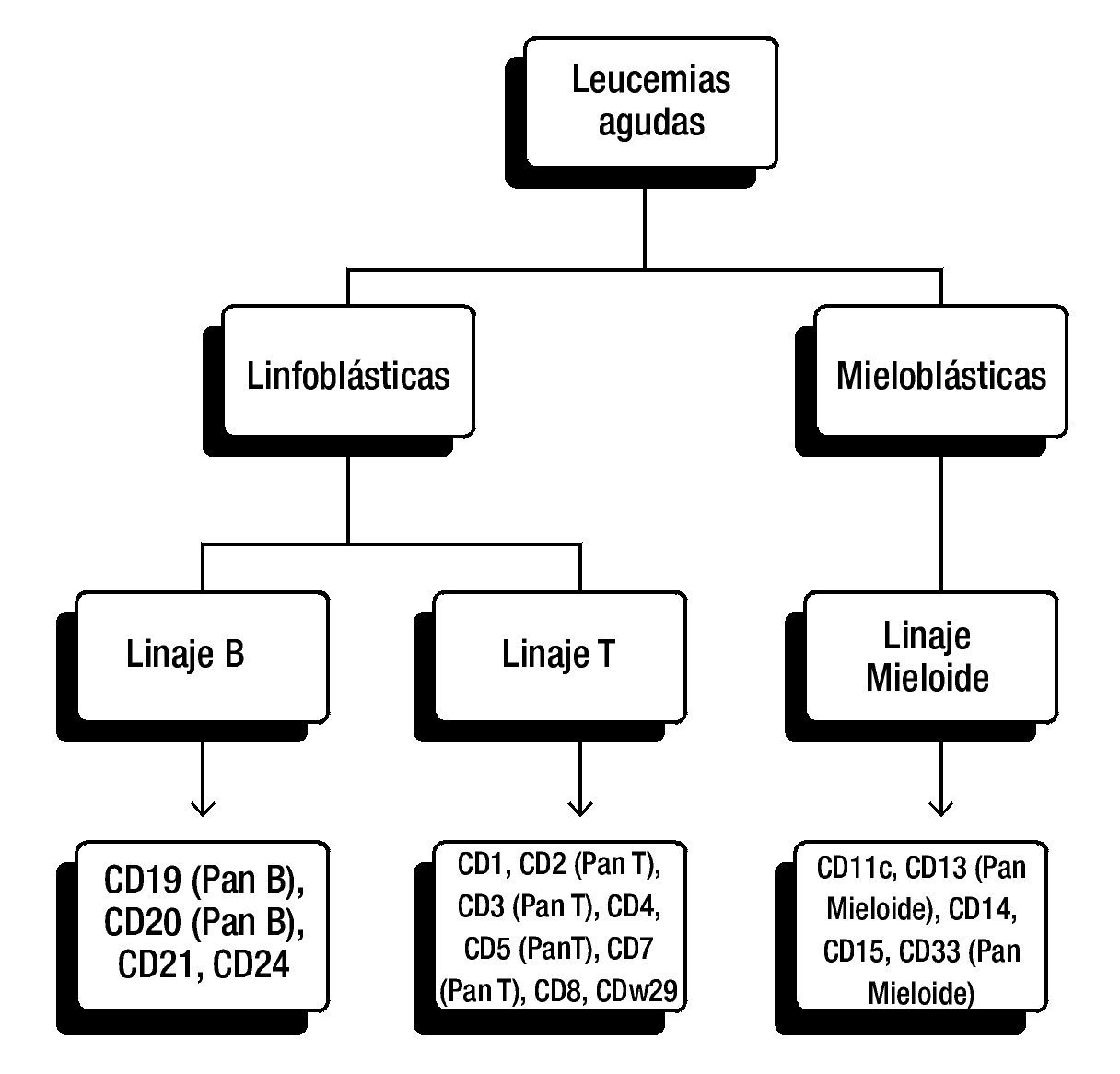
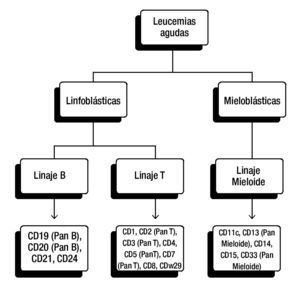
La elección del panel diagnóstico puede variar entre instituciones y laboratorios, en general, para la clasificación de leucemias linfoblásticas se incluyen anticuerpos para antígenos de células T (CD3, CD5 y/o CD7) y antígenos de células B (CD10, CD19, CD20 y CD22) (fig. 1).
Figura 1. Panel diagnóstico para la clasificación de leucemias agudas. Panel frecuentemente utilizado de CD (cluster of differentiation, por sus siglas en Inglés). De esta manera se pueden detectar antígenos asociados con los linajes hematopoyéticos. La elección del panel diagnóstico puede variar entre instituciones y laboratorios.
Es importante señalar que no todos los casos de LLA expresan antígenos para un solo linaje, ya que se han reportado numerosos casos donde las células expresan características de más de un linaje hematopoyético22.
Las leucemias agudas con este tipo de expresión aberrante de antígenos, incluye casos de LLA que expresan antígenos mieloides asociados (My+ ALL), y casos de leucemias mieloides agudas que expresan antígenos linfoides asociados (Ly+AML). En observaciones epidemiológicas, se ha demostrado que los pacientes con My+ALL y Ly+AML (infidelidad de linaje), no tienen diferencias significativas en el pronóstico de su enfermedad23.
En contraste, las leucemias agudas de linaje mixto (linaje ambiguo) representan a un grupo heterogéneo de leucemias poco comunes y con escasa diferenciación, que poseen características de ambos linajes: linfoides y mieloides24.
La Organización Mundial de la Salud (OMS) define a las leucemias de linaje mixto (MPAL) con base en la expresión de marcadores específicos, en el caso de las células T, por la expresión del CD3 citoplasmático, y en el caso de antígenos mieloides, por la expresión de mieloperoxidasa (MPO) y con antígenos de diferenciación monocitoide. En el caso de las leucemias de progenitores de células B, no define un antígeno único o específico, pero se recomienda que expresen fuertemente CD19 junto con otro antígeno de linaje de células B asociado, o en caso de una débil expresión de CD19, se debe tener la expresión de al menos 3 marcadores de linaje B. Adicionalmente, la OMS reconoce 2 categorías distintas de MPAL; aquellas que presentan la t(9;22)(q34;q11)/ BCR-ABL1 y las MPAL con t(v;11q23)/MLL. Los otros casos de MPAL se identifican como NOS (no especificadas, por sus siglas en Inglés)25.
El grupo del Hospital St. Jude, propone definir a las leucemias agudas bifenotípicas (BAL) cuando las características de 2 linajes se presentan en una misma población de blastos, mientras que las leucemias bilineales son definidas como características de 2 linajes en distintas poblaciones de blastos de un mismo paciente23.
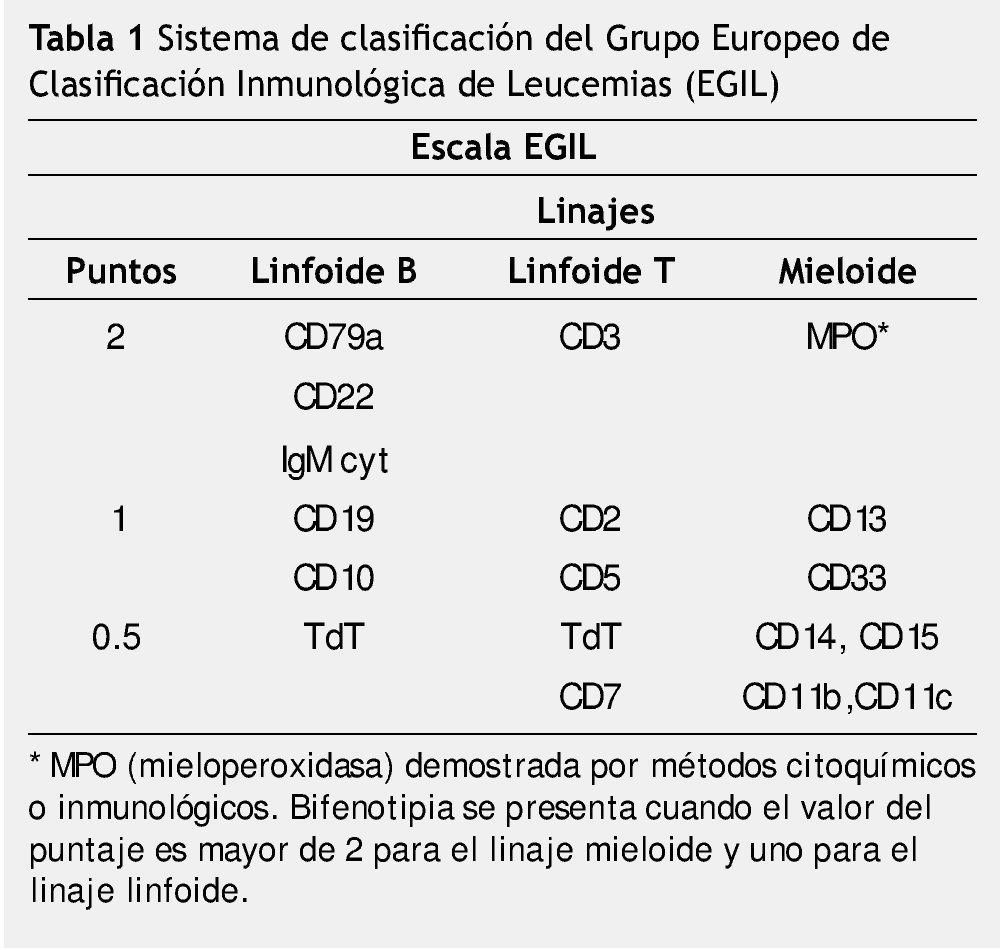
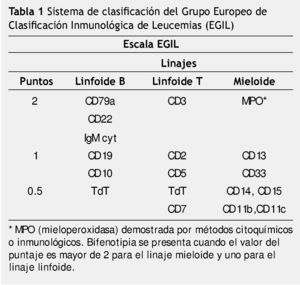
Otro sistema de clasificación fue fundado por el Grupo Europeo de Clasificación Inmunológica de Leucemias (EGIL), el cual ha creado un sistema de basado en puntajes que dan grados de especificidad a los linajes hematopoyéticos linfoide y mieloide, expresados en las células leucémicas26.
El grupo del EGIL propone un sistema de clasificación para distinguir los casos de BAL, de aquellos con expresión aberrante de otro linaje.
Este sistema está basado en el número y grado de especificidad de marcadores (linfoides y mieloides), expresados en las células leucémicas (tabla 1).
Los antígenos o marcadores seleccionados por el EGIL fueron para el linaje B-linfoide: el CD79a, que corresponde a una proteína transmembrana unida a inmunoglobulina, que forma parte del receptor para el reconocimiento de los linfocitos B, también seleccionaron el CD22.
Para el linaje T-linfoide, el CD3 que se une al receptor de células T y que se expresa en el citoplasma en el desarrollo temprano del linaje T.
Para el linaje mieloide la mieloperoxidasa (MPO) que puede ser detectada por inmunocitoquímica convencional o anticuerpos monoclonales, contra la cadena α de MPO en forma de proenzima.
De acuerdo a este sistema de clasificación, un caso considerado como bifenotipia se presenta, cuando el valor del puntaje es mayor de 2 para el linaje mieloide y uno para el linaje linfoide26,27.
Por todo lo anterior, se puede observar que a clasificación de las leucemias con linajes ambiguos, las BAL y bilineales son heterogéneos, por ende la incidencia de estos fenómenos tiene amplias variaciones en la literatura internacional23,28.
El objetivo de este trabajo fue aplicar la clasificación inmunológica del EGIL reportada en un periodo de 3 años en el Hospital Infantil de México Federico Gómez. Consideramos que es de suma importancia para estratificar a los pacientes bajo un sistema internacional.
Métodos
Tipo de estudio
Se realizó un estudio retrospectivo y transversal, se revisaron los expedientes de 113 pacientes con diagnóstico de LLA en un periodo de enero del 2008 a diciembre del año 2010; se realizó estadística descriptiva. Se clasificó a los pacientes de acuerdo a los criterios del EGIL.
Fenotipo por citometría de flujo
La citometría de flujo se realizó en muestras provenientes de aspirado de médula ósea. El procesamiento de las muestras se realizó de acuerdo a la rutina del protocolo de lisis de eritrocitos. Las células mononucleares se tiñeron con los siguientes fluorocromos y antígenos:
(CD34 PE/CD45 FITC), (CD20 PE/CD5 FITC), (CD19 PE/ CD10 FITC), (CD7 PE/CD33 FITC), (CD2 PE/CD22 FITC), (glicoforina A PE/CD3 FITC), (CD58 PE/CD15 FITC), (CD117 PE/ CD41a FITC), (CD14 PE/CD61 FITC), (CD13 PE/HLA-DR FITC), (CD79a PE), (MPO FITC), (anti-Kappa FITC), (anti-Lambda FITC), (Anti-TdT PE) Becton Dickinson Biosciences®, San Diego, CA.
Las muestras fueron adquiridas en un citómetro FACSCalibur (Becton Dickinson Biosciences) y posteriormente, analizadas utilizando el programa CellQuest (Becton Dickinson Biosciences).
Los antígenos considerados como positivos se definieron como la expresión de un fluorocromo cuando ≥ 30% de la población celular expresó el marcador de fluorescencia arriba de este punto de corte, utilizando el correspondiente control de isotipo.
Se utilizó la clasificación del grupo del EGIL para determinar si las leucemias tenían criterios de bifenotipia.
Resultados
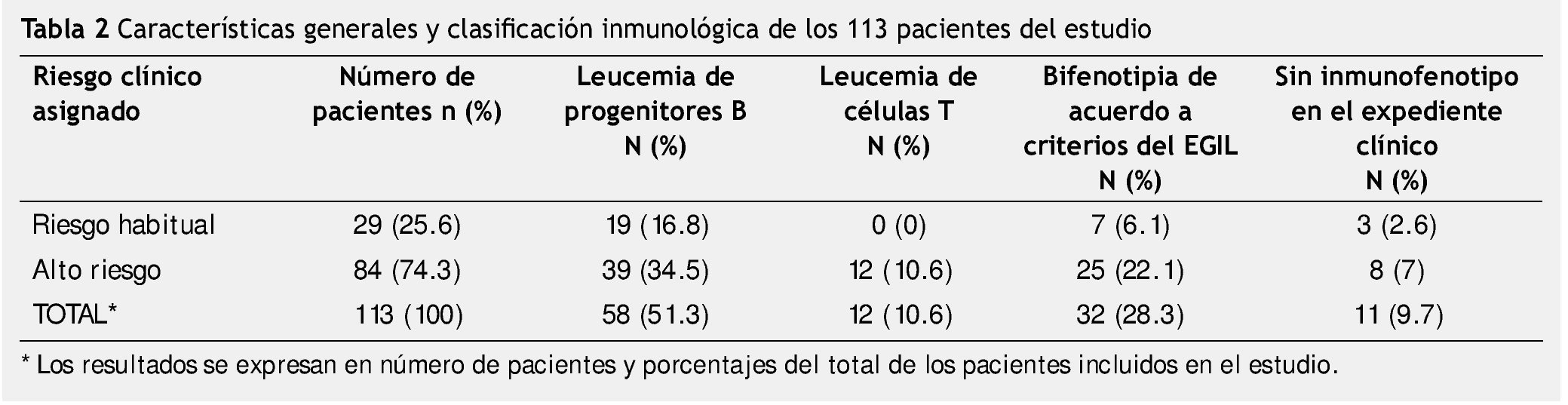
De los 113 pacientes estudiados, se diagnosticaron 29 pacientes como de riesgo habitual y 84 como de alto riesgo (tabla 2). Realizamos la revisión retrospectiva de los expedientes para hacer la clasificación sistemática del inmunofenotipo en estos pacientes. Encontramos que dentro del grupo de riesgo habitual, 19 pacientes que correspondía al 16.8% de la muestra total, se clasificaron con inmunofenotipo B, no existieron pacientes con fenotipo T en este grupo y encontramos 7 pacientes a los cuales clasificamos como bifenotipia de acuerdo al EGIL.
En 3 casos (2.6% del total de la muestra), no se encontró resultado del inmunofenotipo en el expediente de los pacientes clasificados como de riesgo habitual.
Encontramos que 84 pacientes habían sido asignados por su oncólogo como de alto riesgo, y de ellos 39 pacientes tuvieron inmunofenotipo de progenitores B y 12 pacientes se clasificaron de células T. En 32 casos se pudo constatar por criterios del EGIL que se trataba de bifenotipia, esto correspondió al 28.3% del total de la muestra.
En el grupo de alto riesgo encontramos que en 11 casos no existía el reporte de inmunofenotipo en el expediente clínico por lo que no fue posible hacer la clasificación inmunológica (tabla 2).
Al analizar de manera separada solo al grupo de leucemias que cumplían criterios de bifenotipia por la clasificación del EGIL, de los 7 pacientes clasificados como portadores de bifenotipia dentro del grupo de riesgo habitual, 6 se clasificaron como bifenotipia para fenotipo B/T con puntaje de 4.45 + 0.57y uno para T/Mieloide, con resultado de 3.5 puntos al aplicar la escala.
En el grupo de pacientes catalogados como de alto riesgo, 19 cumplieron criterio para bifenotipia B/T con una media de 3.76 + 0.63 puntos y en 6 casos los pacientes cumplieron con criterios para bifenotipia de B/mieloide con media de 3.25 + 1 puntos. En este último grupo ningún paciente calificó para bifenotipia T/Mieliode (tabla 3).
Discusión
Los sistemas de clasificación inmunológica de las leucemias a través del tiempo han sido heterogéneos, de igual manera los puntos de corte para considerar positivos los porcentajes en los CD, que deben tomarse como diagnósticos para determinar linaje. Otro problema es que el panel de anticuerpos para determinar linaje entre cada institución varía de acuerdo con las posibilidades para adquirir anticuerpos y si a esto agregamos el diferente entrenamiento entre el personal que realiza citometría, hacen que el diagnóstico inmunológico sea más difícil de replicar entre instituciones.
La tendencia mundial gira en torno a homologar paneles de anticuerpos indispensables para diagnóstico, así como incorporar otros marcadores con mayor grado de especificidad diagnóstica, de hecho el mismo grupo del EGIL propone actualmente considerar marcadores que reconozcan cadenas específicas del receptor de células T y al CD117 para linaje mieloide.
También es importante discutir que la clasificación del EGIL tiene limitaciones, y que la OMS en el 2008 difiere en general de las definiciones de este Grupo Europeo, y no se señalan implicaciones en el diagnóstico o tratamiento de los pacientes con bifenotipia29.
Este trabajo es un intento para clasificar a las leucemias de los pacientes de manera sistemática y bajo un criterio establecido, sin embargo queda pendiente conocer si este diagnóstico impacta en el resultado clínico de los pacientes.
También es probable que conforme los criterios de clasificación cambien, algunas BAL tengan que ser reclasificadas en un futuro.
Conclusiones
Implementar escalas como esta para clasificar de una manera objetiva y sistemática a nuestros pacientes, podría mejorar el diagnóstico y tal vez establecer consideraciones pronósticas, lo que impactaría directamente en la salud infantil de los pacientes oncológicos.
Es importante considerar que en este trabajo tuvimos un 9% de pacientes sin resultado de inmunofenotipo en el expediente, lo cual es una limitante importante para la asignación del riesgo de recaída, las instituciones de salud debemos trabajar por que este número disminuya.
Puede observarse que la clasificación de las leucemias con linajes ambiguos, las bifenotípicas y bilineales son heterogéneas, por ende la incidencia de estos fenómenos tiene amplias variaciones en la literatura médica internacional. Este trabajo propone una forma de clasificación en un centro hospitalario en México, sería muy conveniente normar lineamientos de calidad en citometría de flujo para clasificar de manera homogénea a las leucemias de los pacientes, así como estandarizar los criterios diagnósticos para poder realizar trabajos colaborativos entre las instituciones.
Financiamiento
No se recibió ningún patrocinio para la realización de este artículo.
Conflicto de intereses
Los autores declaran no tener conflicto de intereses.
* Autor para correspondencia:
Doctor Márquez N° 162, Colonia Doctores, C.P. 06720, México D.F., México.
Teléfono: (55) 52289917, ext. 2124.
Correo electrónico: elisadorantes@hotmail.com (Elisa Dorantes-Acosta).