Introducción: Los tumores diagnosticados durante el primer mes de vida son infrecuentes y representan 0.5% al 2% de las neoplasias pediátricas. Tienen características histológicas, clínicas y de respuesta al tratamiento diferentes a las observadas en la edad pediátrica. En este estudio se describe la epidemiología de los tumores congénitos en el Hospital Infantil de México, en un periodo de 69 años (1943-2012).
Métodos: Se realizó un estudio descriptivo, retrospectivo, retrolectivo, que incluyó la revisión de los registros del Servicio de Patología de los últimos 69 años, en búsqueda de reportes de tumores malignos en pacientes menores de 6 meses. Posteriormente, se revisaron los expedientes de los pacientes con tumores malignos cuyos síntomas iniciaron en el primer mes de vida.
Resultados: Setenta y cuatro tumores neonatales cumplieron los criterios para el estudio. El 56.3% pertenecen al género masculino. El promedio de edad al diagnóstico fue de 16.32 días. El neuroblastoma fue el tumor más frecuentemente reportado (27.5%), seguido por los teratomas inmaduros (13.7%), rabdomiosarcomas y retinoblastomas (11% cada uno). Igualmente se estudiaron el peso al nacer, la edad gestacional, la edad de los padres, el motivo de consulta y la asociación con síndromes genéticos.
Conclusiones: Actualmente los métodos diagnósticos y el conocimiento sobre la terapéutica en los neonatos han mejorado, por lo que se esperaría un aumento en el diagnóstico, mejoría en la sobrevida y sobre todo mayor número de pacientes curados en un futuro.
Background: The tumors diagnosed during the first month of life are infrequent: 0.5% to 2% of pediatric cancer. They have different histology, clinical presentation and therapy that make them a unique group apart from the pediatric tumors. This study describes the epidemiology of congenital cancer at Hospital Infantil de México in the last 69 years (1943-2012).
Methods: We conducted a descriptive, retrospective, retrolective study that included the review of charts in the Pathology department of the last 69 years, looking for tumors in patients under 6 months of age, who started their symptoms within the first month of life.
Results: Seventy four cases fulfilled criteria for the study. Of them, 56.3% were male. The mean age at diagnosis was 16.32 days. Neuroblastoma was the most frequent tumor reported (27.5%), followed by teratomas (13.7%), rabdomyosarcomas and retinoblastomas (11% each). We also studied weight at birth, gestational age, parents' age and genetic syndromes associated.
Conclusions: Nowadays better diagnostic tools and knowledge in the field are available, reason why one should expect a rise in diagnosis and a better overall survival.
Introducción
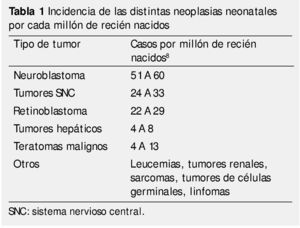
El cáncer que se desarrolla en la edad pediátrica constituye alrededor del 1% a 2% del total. De éste, el 1.7% corresponde a tumores diagnosticados durante la etapa neonatal con una incidencia de 3.74 casos por 100,000 recién nacidos vivos por año. De los 7,000 niños diagnosticados con cáncer en Estados Unidos, un 10% se diagnostica durante el primer año de vida, un 2% durante el primer mes y sólo un 1% en el primer día, dando una prevalencia para las neoplasias congénitas de uno por cada 12,500 nacimientos1 (tabla 1). En otros países los resultados son similares2-5. Además, es de llamar la atención que según datos del National Cancer Institute´s Surveillance Epidemiology and End Results Program (SEER), la incidencia de cáncer en menores de 12 meses muestra un incremento del 15% año tras año desde 1970.
Las neoplasias en la edad pediátrica presentan características distintas a las propias de etapas posteriores de la vida, alcanzando una sobrevida a los 3 años superior al 70%, variando de acuerdo al tipo histológico6-8. Los principales aparatos y sistemas afectados son: el sistema hematopoyético, el sistema nervioso (central y simpático), así como los tejidos derivados del mesénquima. Incluido en las mismas, existe un subgrupo de neoplasias que merece mención especial: "los tumores neonatales", reconocidos como aquellos que se presenta durante las 4 primeras semanas de vida.
Estos tumores difieren del resto en incidencia, grado de diferenciación histológica, respuesta al tratamiento (mayor número de complicaciones quirúrgicas, así como aumento en la toxicidad por quimioterapia) y pronóstico. Además la inmadurez anatómica y fisiológica propia del recién nacido, requiere de terapéuticas y métodos diagnósticos especiales9,10. Los criterios histológicos empleados para las neoplasias en adultos no siempre son extrapolables a la población pediátrica, ya que el desarrollo normal de los órganos y tejidos durante el periodo neonatal muestra un aumento de la actividad mitótica, y el tejido estudiado contiene estructuras inmaduras que podrían confundirse con neoplasias malignas. De la misma forma, neoplasias histológicamente malignas, pueden tener un comportamiento benigno, como es el caso del neuroblastoma en su etapa 4S, el cual presenta en muchos de los casos, involución espontánea. Si lo anterior no fuera suficiente, en la literatura médica mundial se emplean como sinónimos términos que definen subgrupos tumorales distintos11 (tabla 2).
Etiopatogenia
Las neoplasias se originan por la combinación variable de 2 tipos de determinantes: el ambiental y el genético. Los principales mecanismos de oncogénesis descritos en los tumores neonatales, se pueden dividir a su vez en preconcepcional (transplacentaria, transmisión materno-fetal de células tumorales -melanomas, coriocarcinomas, linfomas, etc.-) y la de presentación posnatal12-18. Sin embargo, este segundo mecanismo oncogénico actualmente está en controversia, ya que es demasiado escaso el tiempo entre el nacimiento y la presentación de la neoplasia, para pensar que el desarrollo suceda exclusivamente fuera del útero.
Los factores ambientales son los responsables del 98% de todos los cánceres, predominando en la segunda mitad de la vida, ya que se requiere de largos periodos de exposición y latencia a agentes carcinogénicos para producir mutaciones en los genes supresores de tumor, así como en los protooncogenes. Los agentes pueden ser: físicos (radiación ionizante y no ionizante7,8,12,19-22), químicos (fármacos, tabaco, alcohol19,23-26) o biológicos (infecciones, dieta12) y la exposición puede darse directamente en la mujer embarazada o secundaria a la exposición ocupacional de alguno de los padres (ejemplo, pesticidas, solventes, pinturas, hidrocarburos, etc.27-29).
Sin embargo, la presentación clínica difiere a la reportada en otras etapas de la vida7,8,11,12,23 al presentarse de manera temprana, cuestión que se ha asociado con: una mayor división celular, un menor tiempo de actividad reparadora del DNA, la inmadurez fisiológica en los mecanismos hormonales de detoxificación e inmunovigilancia, así como una mayor predisposición de los agentes cancerígenos en la inducción de anomalías en el desarrollo.
Por otro lado, la mayoría de los autores asocian a los factores genéticos con la génesis del 4% a 10% de los tumores infantiles, encontrándose una relación directa entre algunos síndromes genéticos y el cáncer hasta en el 2%12. En estos casos, las mutaciones específicas se dan en las células germinales y por lo tanto, están presentes también en todas las restantes células somáticas. Dichas patologías se pueden heredar de manera: recesiva (ataxia telangiectasia, anemia de Fanconi, xeroderma pigmentoso, síndrome de Bloom); dominante (síndrome de Li- Fraumeni, retinoblastoma familiar, neurofibromatosis, tumor de Wilms familiar, neuroblastoma familiar, síndrome de neoplasia múltiple endocrina, esclerosis tuberosa, síndrome de von Hippel-Lindau, etc.) o por alteraciones cromosómicas no hereditarias (síndrome de Down y alteraciones de los cromosomas sexuales).
En 1962, Willis30 publicó la hipótesis de que estos tumores se originan en algún estadio durante la organogénesis11. Otra característica descrita por Bolande13 en 1985, es el "periodo de gracia oncológico neonatal", en la que estos tumores tienen un mejor comportamiento biológico que en épocas posteriores de la vida, por lo que la edad per se es un factor pronóstico importante e independiente al tipo tumoral, patrón histológico y extensión del mismo. Esto es debido a 2 fenómenos diferentes que condicionan una desaparición parcial o completa del tumor: la regresión espontánea31 y la citodiferenciación.
Tratamiento
La fisiología propia del neonato, ocasiona que el tratamiento multidisciplinario necesario en las enfermedades neoplásicas, sea modificado sustancialmente en este grupo de edad para evitar toxicidad y secuelas. El tratamiento más utilizado es la cirugía32, lo que requiere de una preparación y estabilización preoperatoria, así como avanzados cuidados postoperatorios. Le sigue en frecuencia la quimioterapia33, la cual requiere de modificar la dosis y las vías de administración de los diversos fármacos de quimioterapia ya que la absorción, biotransformación y excreción de los mismos son diferentes a las de otras edades. La radioterapia32 normalmente se omite, ya que lesiona gravemente los tejidos sanos, ocasionando problemas a corto plazo, así como secuelas por deformidad, sin olvidar el mayor poder oncogénico de la misma.
Nuestro objetivo fue describir la experiencia en el Hospital Infantil de México Federico Gómez.
Métodos
Se realizó un estudio descriptivo, retrolectivo, retrospectivo, que incluyó a los pacientes menores de 6 meses de edad, cuya sintomatología inició en los primeros 28 días de vida con la presencia de un tumor sólido. La obtención de pacientes se realizó a partir de las bitácoras de reportes histopatológicos del Departamento de Patología del Hospital Infantil de México Federico Gómez, en el periodo comprendido desde 1943 a enero de 2012. Una vez recopilada la información, se excluyeron los tumores benignos. A pesar de no considerarse neoplasias propiamente, aquellos reportes de histiocitosis de células de Langerhans fueron incluidas, ya que reciben tratamiento con quimioterapia. Las leucemias agudas no se consideraron en el estudio, ya que el reporte de las mismas se realiza por un Departamento distinto y no se contaba con la información completa correspondiente.
De los restantes, se revisaron los expedientes clínicos para el análisis de las siguientes variables: frecuencia y tipo de tumor (diagnóstico histológico), sexo, peso al nacimiento, edad gestacional, edad materna y paterna al momento del nacimiento, asociación a síndromes genéticos u otras malformaciones congénitas, tratamiento empleado (cirugía, quimioterapia y/o radioterapia) y el estado actual de la enfermedad.
Para la discusión, los datos obtenidos se compararon con los observados en la literatura médica en series similares, tomando como patrón de búsqueda los últimos 25 años en Medline y PubMed, con los siguientes términos: "neonatal, congenital", "tumors, cancer, neoplasms", "tumores neonatales", "neoplasias neonatales", "cáncer neonatal".
Resultados
Se incluyeron 123 reportes de tumores neonatales. Se excluyeron 49 (37 correspondían a neoplasias benignas confirmadas y 12 por no pertenecer a patologías malignas).
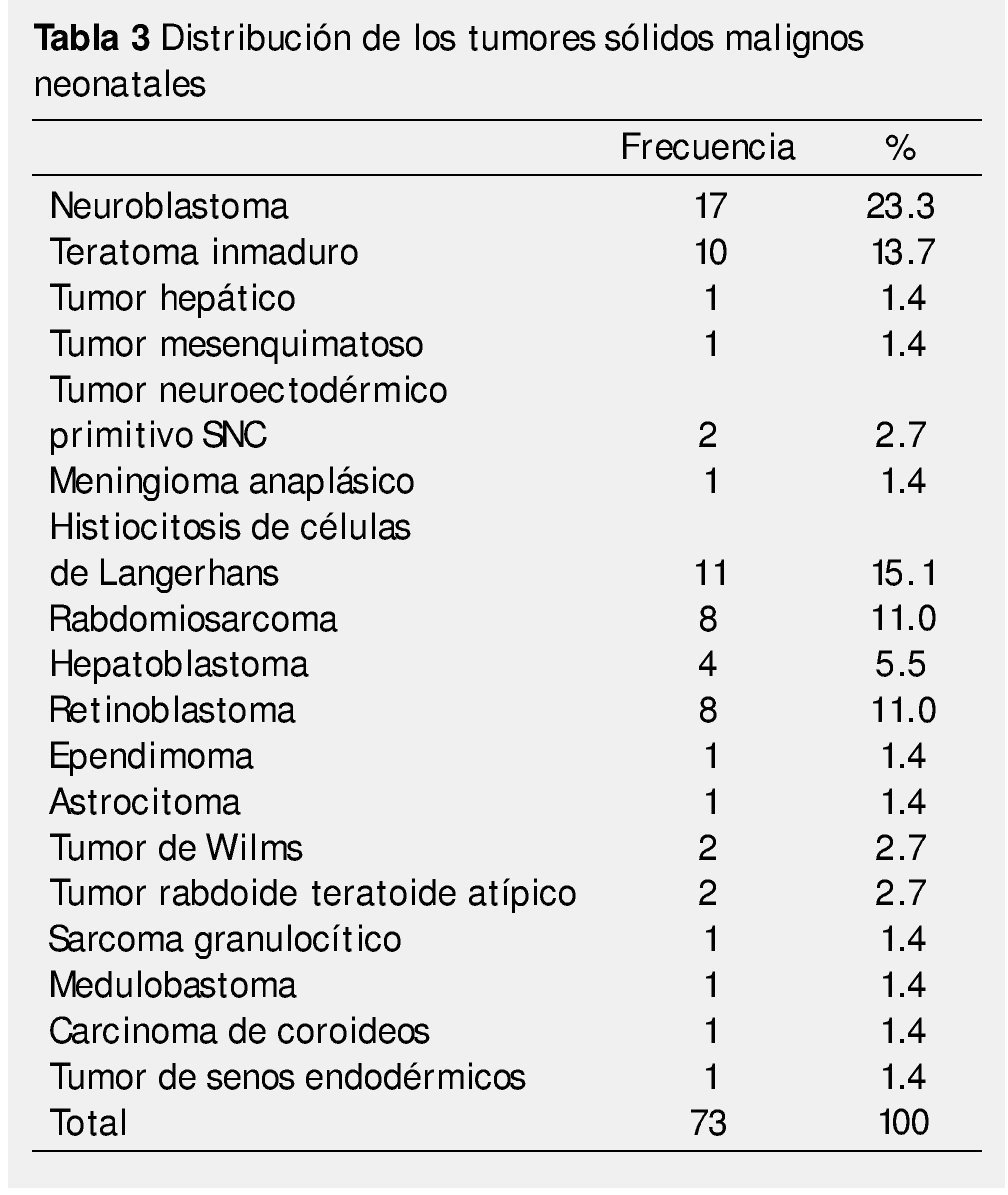
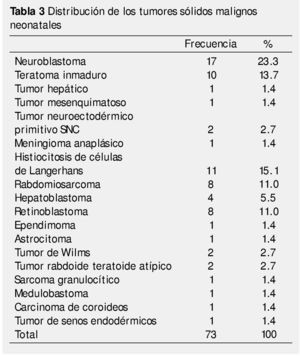
El total de casos confirmados de tumores malignos neonatales fue de 73, con la siguiente distribución: el 23.3% corresponde a neuroblastomas, siendo el que se presenta con mayor frecuencia; seguido por la histiocitosis de células de Langerhans con 15.1%, y el teratoma inmaduro con 13.7%.
La síntesis de los tumores encontrados y su frecuencia se enlistan en la tabla 3.
Del grupo estudiado, el 43.2% corresponde al género femenino y el 56.8% al masculino. El peso al nacimiento fue en promedio de 3,050 g, registrándose como mínimo 1,600 g y máximo 4,100 g. La edad gestacional varió desde 32 hasta 42 semanas, con un promedio de 36.8. Al momento del nacimiento, la edad de la madre fue en promedio de 27.46 años (rango 15-48). Por su parte, la edad del padre en el mismo momento fue de 30.32 años (rango 18- 48).
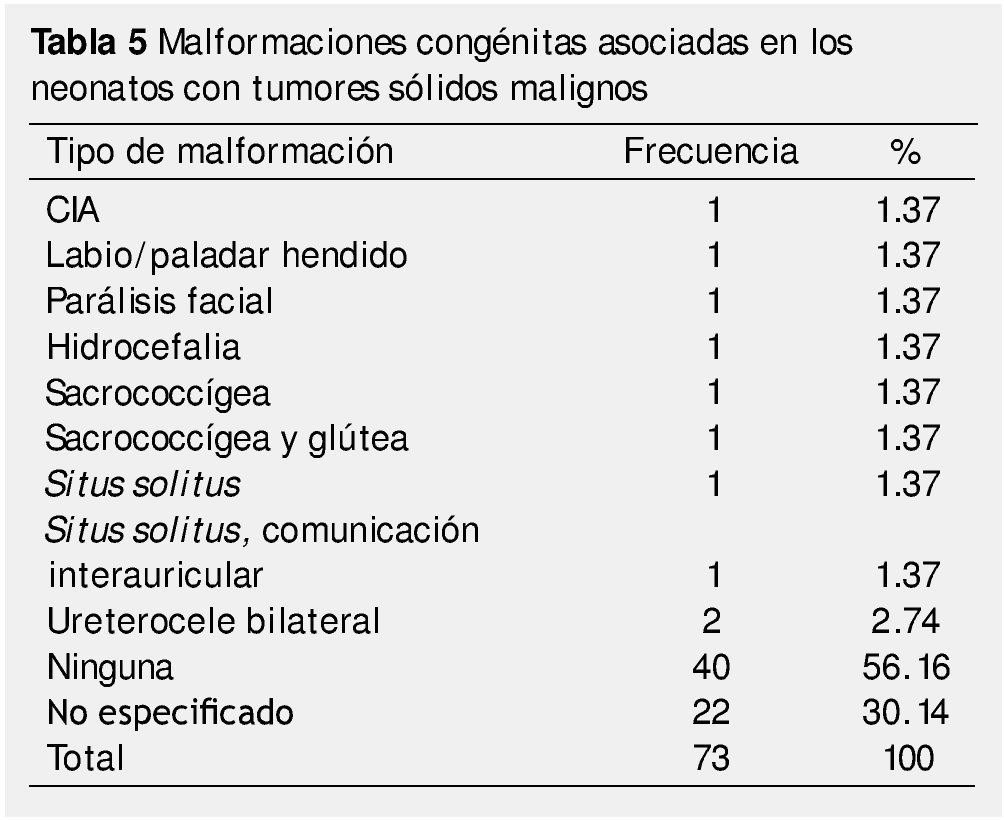
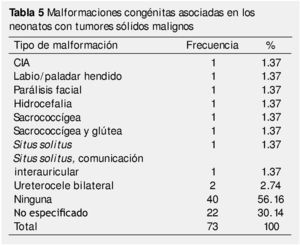
En cuanto a la asociación con síndromes genéticos o malformaciones agregadas, en el 67.1% de los casos la neoplasia no se presentó con asociación a algún síndrome, 30.1% no se especificaba, encontrándose un caso de vejiga denervada y otro asociado a síndrome de Down (tabla 4). El 82.2% no presentaron malformación congénita asociada; para el resto, el ureterocele bilateral fue el más común con un 2.8% (tabla 5).
Con respecto a los motivos de consulta inicial, los mismos dependieron directamente del tipo de neoplasia diagnosticada, entre los que se encontraron: ausencia de evacuaciones (estreñimiento), diarrea, vómito, hepatomegalia, distensión abdominal, masa sacrococcígea, dificultad a la alimentación, hiporexia, falla de medro, síndrome infiltrativo, ictericia, síndrome anémico y palidez, irritabilidad, tos, distrés respiratorio, dermatitis seborreica, pápulas generalizadas, hemangiomas múltiples, otitis media, hidrocefalia, paresias, parestesias, somnolencia, hipertensión intracraneal, movimientos tónico-clónicos, parálisis del 3º par craneal, movimientos oculares anormales, hipertensión arterial, retraso en el desarrollo intrauterino, sepsis, conjuntivitis bacteriana, ERGE, masa testicular, entre otras. Los 3 motivos de consulta más recurrentes fueron la masa abdominal (20.5%), la fiebre (9.6%) y la leucocoria (6.8%), respectivamente. El resto se encontró entre el 2.7% y 4.1% de los casos. Además se buscó intencionadamente la presencia de hipotermia, rubicundez, hematuria, masa en cuello, nódulos cutáneos, oliguria, poliuria, pancitopenia y equimosis, sin encontrarse en los pacientes estudiados.
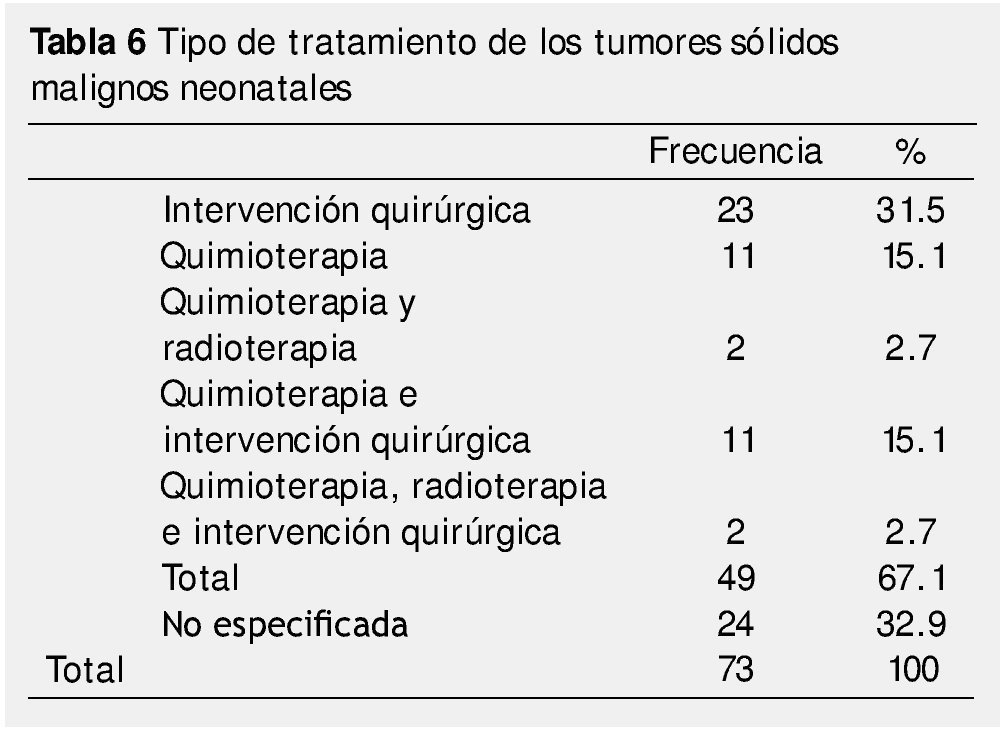
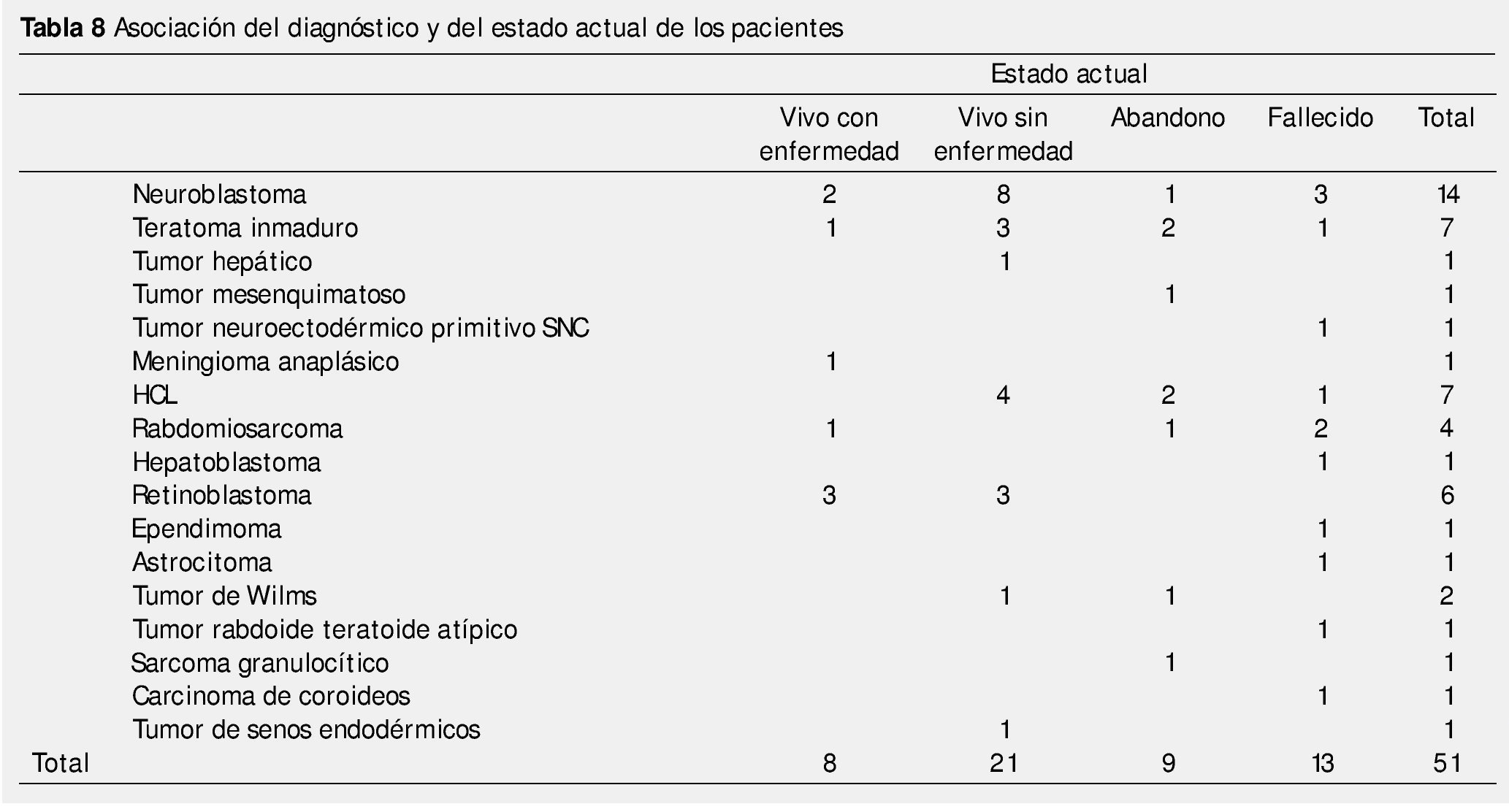
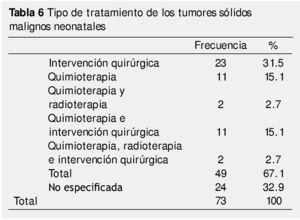
Al analizarse el tipo de tratamiento empleado, se encontró que el 31.5% recibió manejo quirúrgico y el 15.1% recibió quimioterapia, ambos como monoterapia. En cuanto al tratamiento combinado, 15.1% recibió cirugía y quimioterapia, 2.7% quimioterapia y radioterapia y 2.7% las 3 modalidades de tratamiento (quimioterapia, radioterapia y cirugía). El porcentaje restante (32.9%) no especificaba tipo de tratamiento (tabla 6). Con dicha terapéutica, el estado actual de los pacientes al momento del corte del estudio fue: el 28.8% se encontraban vivos sin enfermedad, el 17.8% murieron, el 12.3% abandonaron su seguimiento por el Hospital, el 11% correspondían a quienes están vivos con enfermedad. El porcentaje restante, 30.1% no se especificaba en los expedientes revisados (tabla 7). En la tabla 8 se muestra la relación existente entre la histología de los tumores neonatales y el estado actual de la enfermedad.
Discusión
Las neoplasias neonatales son entidades poco frecuentes; no obstante, es difícil definir su incidencia exacta porque las series reportadas siguen criterios distintos, sobre todo con respecto a la edad al diagnóstico34. A diferencia de lo reportado en otras series34, en la nuestra predominan discretamente los pacientes del género masculino. Este hallazgo probablemente se deba a que el neuroblastoma, principal tumor encontrado es más común en dicho género, mientras que en las otras series, predominan los teratomas, más comunes en el sexo opuesto35-38. Éstos últimos caen hasta el 3° lugar de nuestra serie, debido a la inclusión de los casos de histiocitosis de células de Langerhans, otra razón que influye directamente en el género predominante en la serie. El resto de los tumores mantienen el orden habitual de presentación, contando en 4° lugar con los tumores del sistema nervioso central (9 casos totales si se toman en cuenta como grupo todas las histologías), en 5° los sarcomas de partes blandas y finalmente, los retinoblastomas en 6° lugar. Un solo caso fue reportado para cada uno de los otros tipos tumorales.
La mayoría de los tumores neonatales son diagnosticados por una clínica de aumento de volumen palpable o visible, debido a que predominan aquellos con presentación abdominal y lumbosacra35,36,38,39. En muchos de los casos, el diagnóstico de los neuroblastomas así como de los teratomas se realiza de manera prenatal, ya sea por escrutinio hormonal durante el embarazo con la toma de catecolaminas40 o a través de los estudios de imagen (ultrasonogramas de seguimiento) durante el embarazo41-44. Sin embargo, en nuestra serie no contamos con la información suficiente para saber el momento del diagnóstico y el método por el cual se realizó, ya que el hospital es un centro de referencia y los pacientes ingresan posterior a la atención en otros centros. Sin embargo, en los pocos casos donde se describió en la historia clínica, el diagnóstico se realizó de manera posnatal al momento del nacimiento o en las primeras 24 horas.
El riesgo de desarrollar cáncer durante el primer año de vida es 6 veces mayor, en quienes presentan malformaciones congénitas, particularmente aquellas que se presentan en el sistema nervioso central y las vías urinarias, y aunque este no es un estudio de casos y controles es una observación interesante. Este riesgo obliga a dar seguimiento estrecho de por vida, a todo paciente que presenta malformaciones al nacimiento45. Para efectos de nuestra serie, no se pudo documentar una malformación congénita en más de la mitad de los casos, sólo el 17% se asoció con alguna de ellas, siendo las mismas de variada etiología.
El cáncer neonatal provoca 6.26 muertes por millón de recién nacidos vivos, su mortalidad es la más baja de la oncología pediátrica35. Las recaídas/progresión de la enfermedad y las complicaciones relacionadas con el tratamiento son las causas más frecuentes de muerte. En cuanto a la histología, los tumores del sistema nervioso central son mucho menos frecuentes en el recién nacido que en pacientes de mayor edad, sin embargo, también son los que presentan una de las más altas tasas de mortalidad, con 6 defunciones en 9 casos encontrados. En la literatura médica se reporta que la tasa de mortalidad de las neoplasias neonatales, equivale a la 5° parte de su incidencia34. En este estudio se reafirmó dicho hallazgo, además de encontrarse que cerca del 40% de los pacientes están vivos, ya sea con o sin enfermedad, información similar a lo reportado en los distintos centros a nivel mundial.
No existen observaciones especiales con el peso al nacer, la edad gestacional, la edad de la madre o el padre y al no ser un estudio de casos y controles, no podemos emitir conclusiones de riesgo. Describimos la frecuencia de las neoplasias neonatales diagnosticadas y tratadas en nuestro centro, así como su desenlace al momento de corte. Metodológicamente, se encuentra limitado por el sesgo en la obtención de la información, así como el sesgo de que los criterios diagnósticos se han modificado a lo largo de la historia del hospital. Actualmente, los métodos diagnósticos y el conocimiento sobre la terapéutica en los neonatos han mejorado, por lo que se esperaría un aumento en el diagnóstico (mejores técnicas de imagen e inmunohistoquímica), mejoría en la sobrevida y sobre todo mayor número de pacientes curados en un futuro.
Financiamiento
No se recibió ningún patrocinio para la realización de este artículo.
Conflicto de intereses
Los autores declaran no tener conflicto de intereses.
* Autor para correspondencia:
Departamento de Hemato-Oncología, Hospital Infantil de México Federico Gómez.
Teléfonos: 5228 9917, ext. 2124. Celular: (55)12958809.
Correo electrónico: carlo.cicero.oneto@gmail.com (Carlo Cicero-Oneto).