Introducción: El propósito de este estudio fue comparar el tipo de respuesta al tratamiento y el tiempo libre de progresión en pacientes tratados con quimioembolización intraarterial (QEIA) vs. pacientes tratados con embolización blanda (EIA). Existen pocos estudios de este tipo en la literatura, con resultados discrepantes entre estos. Para el estadio B de la Clínica de Barcelona el tratamiento es QEIA, sin embargo durante algunos meses de 2011 no se contó con lipiodol en México, indispensable para la entrega del agente quimioterapéutico.
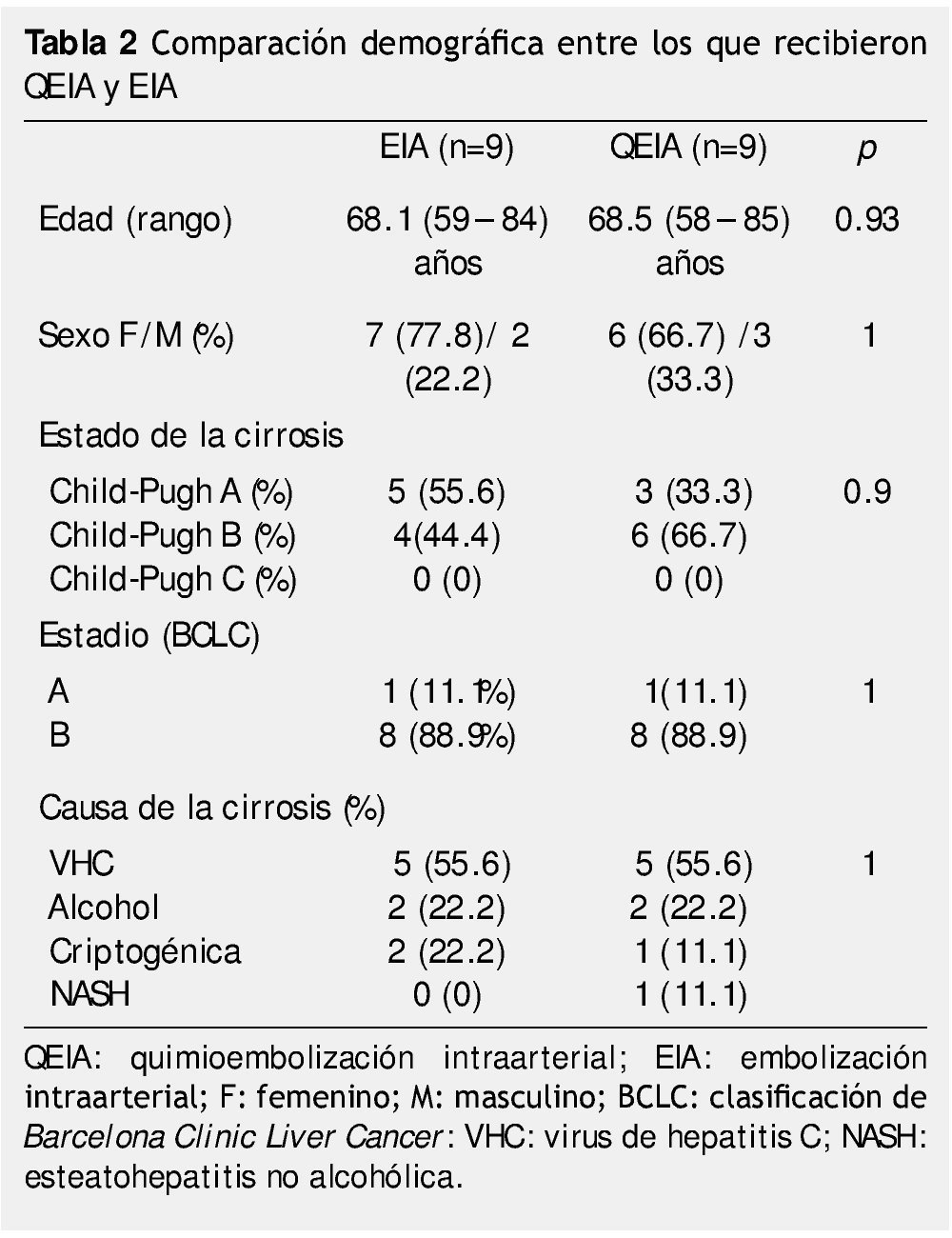
Material y métodos: Este es un estudio retrospectivo, se incluyeron 18 pacientes, 9 para cada grupo, ambos presentaban características clínicas y demográficas similares (test de Fisher, p=1; prueba de Mann-Whitney, p=0.93), los cuales tenían como primer tratamiento QEIA o EIA.
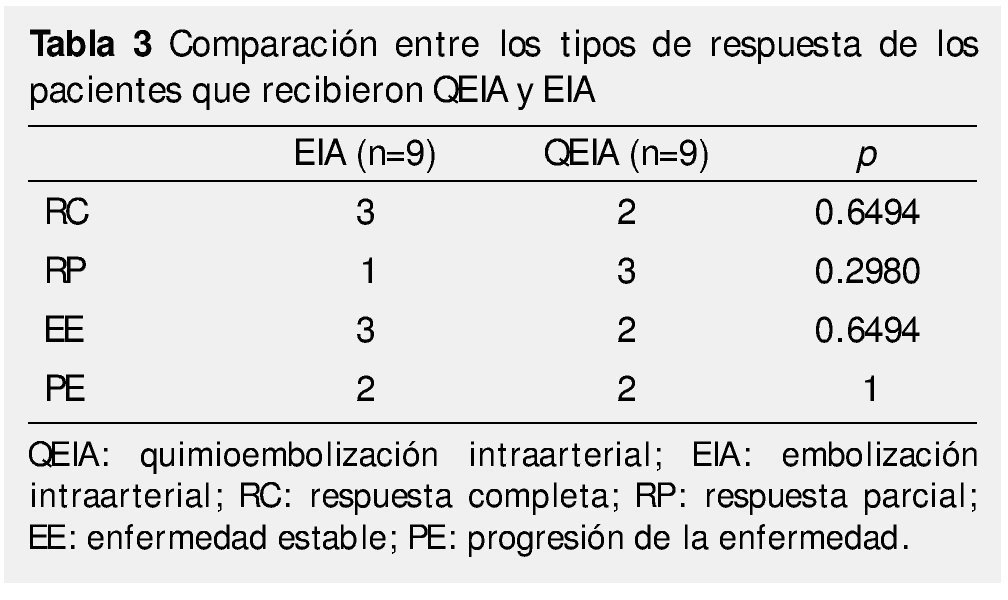
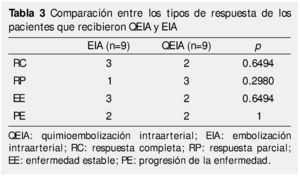
Resultados: No se encontraron diferencias significas en términos de respuesta (p=1) y tiempo libre de progresión (p=0.1639). Respuesta al tratamiento según criterios del mRECIST para EIA: 33.3% presentaron respuesta completa (RC), 33.3% enfermedad estable (EE), 11.1% respuesta parcial (RP), así como 22.2% con progresión (PE) al momento de la evaluación. Respuesta al tratamiento QEIA: 22.2% se presentaron con RC, EE en el 22.2%, 33.3% con RP y 22.2% con PE; ElTLP fue de 6.88 meses para EIA y de 10.55 meses para QEIA (p=0.1639).
Conclusiones: En nuestra población ambos métodos resultaron ser igual de eficaces para el control de la enfermedad, sin embargo se advierte una tendencia a un mayor tiempo libre de progresión en pacientes tratados con QEIA, sin ser estadísticamente significativo en este estudio.
Introduction: The main purpose of this study was to compare treatment response and time to progression in patients with hepatocelluar carcinoma treated with bland embolization (BE) vs. chemoembolization (TACE). There are just few studies in the literature that compare these 2 treatments, and some are findings are inconsistent. For patients in Barcelona B classification the first line treatment is TACE, nevertheless in our country there was a shortage of lipidol during some months of 2011.
Material and methods: This is a retrospective study, 18 patients were included, 9 for each group, both has similar clinical and demographic characteristics (Fisher's exact test p=1; Mann-Whitney p=0.93) who had received TACE or BE as first treatment.
Results: There was no statistical difference in terms of type of response (p=1) and time to progression (p=0.1639). Treatment response according to mRECISTin the BE group was: 33.3% had complete response (CR), 33.3% with stable disease (SD), 11.1% showed partial response (PR), in 22.2% had DP at the first follow up, for TACE: 22.2% with CR, ED in 22.2%, 33.3% had PR and DP in 22.2%. Medium time to progression in BE was 6.88 months and for TACE was 10.55 months (p=0.1639).
Conclusion: TACE and BE showed the same efficacy in terms of treatment response and time to progression, nevertheless TACE show short advantage in terms of median time to progression without statistical significance in our population.
Introducción
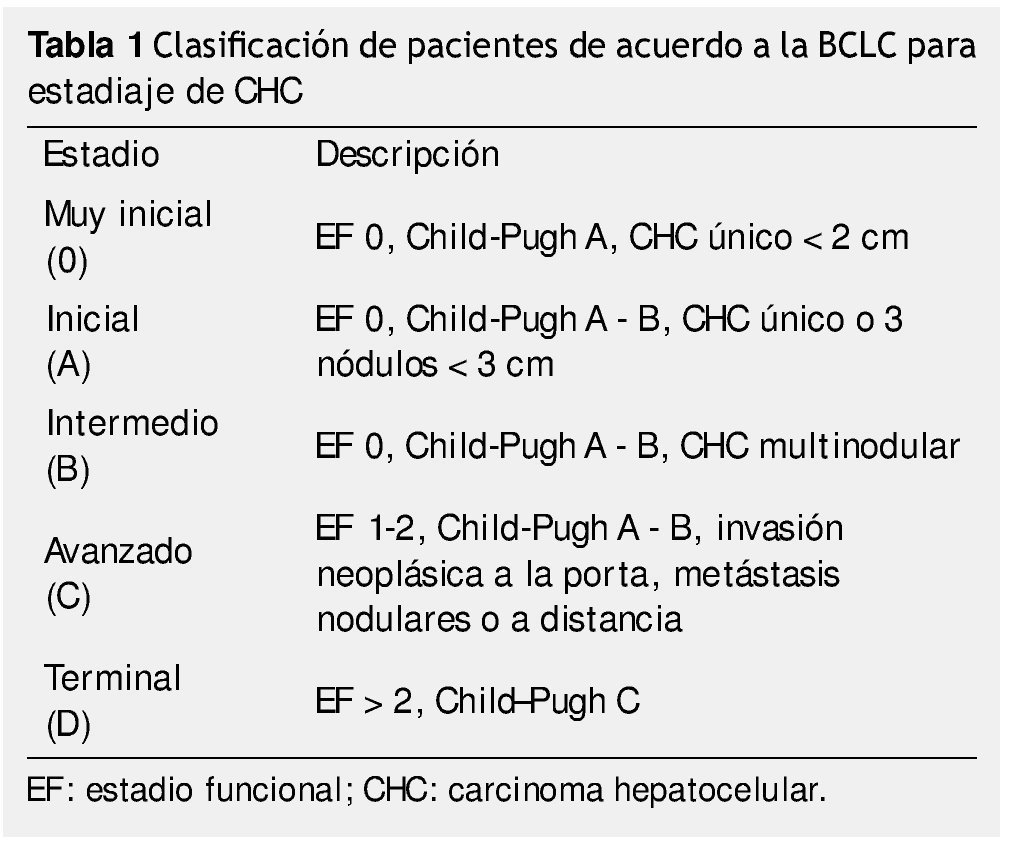
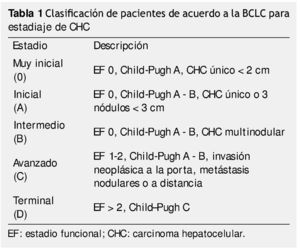
El carcinoma hepatocelular (CHC) es la 6° causa de cáncer y la 3° causa de muerte directamente relacionada con cáncer, es diagnosticado en más de medio millón de personas alrededor del mundo cada año1-4. Con un pronóstico desalentador, usualmente es diagnosticado en estadios avanzados5, actualmente existen diversos tratamientos para el CHC, los cuales podemos dividir en curativos y paliativos. Estos tratamientos son elegidos en base a las características del tumor, estado funcional del paciente, reserva funcional del hígado (clasificación de Child-Pugh), disponibilidad de recursos y nivel de experiencia de los tratantes1-8. Existen diversos sistemas de clasificación para el manejo de pacientes con CHC, en los últimos años la clasificación de Barcelona Clinic Liver Cancer (BCLC), es la más utilizada ya que es la única que relaciona el estadio de la enfermedad y las opciones terapéuticas (tabla 1), además de estar validada en Estados Unidos y Europa1,3,4,7.
Para el estadio B de la BCLC, el tratamiento propuesto es la quimioembolización intraarterial (QEIA), la cual tiene el propósito de inducir isquemia tisular, lo que lleva a hipoxia y muerte celular en el tumor3,4,7,9,10. La vena porta lleva el 75% del flujo sanguíneo hepático, la arteria hepática aporta el otro 25%. En cambio, las neoplasias malignas hepáticas reciben el 95% de su flujo sanguíneo de la arteria hepática3,10,11. Este es el principio por el cual la embolización hepática induce necrosis isquémica selectiva en las neoplasias hepáticas, mientras que el tejido hepático normal sobrevive por el aporte sanguíneo de la vena porta. Tanto la QEIA como la EIA, inducen necrosis extensa del tumor en más del 16% al 55% de los pacientes10.
La evaluación de la respuesta al tratamiento debe tomar en cuenta las áreas de necrosis y no sólo la reducción del tamaño tumoral12-14.
La embolización, ya sea con quimioterapéutico o blanda (EIA), es ampliamente utilizada hoy en día, sin embargo no existe un consenso o estandarización del protocolo empleado, existiendo diferencias en cuanto a dosis, tipo de fármaco quimioterapéutico, así como el uso de diferentes tipos de materiales embolizantes10-14.
Los criterios del mRECIST clasifican la respuesta según las áreas que presentan realce en tomografía computada (TC) trifásica o resonancia magnética (RM) contrastada. La respuesta completa (RC) se define como la ausencia de cualquier realce arterial intratumoral en las lesiones blanco. La respuesta parcial (RP) se define como la disminución al menos del 30% en la suma del diámetro mayor de la porción viable, en 2 lesiones blanco. Progresión de la enfermedad (PE) es un incremento de 20% o más en la suma del diámetro mayor en 2 lesiones blanco. La enfermedad estable (EE) son todos los casos que no cumplen criterios para RC, RP o PE14.
Algunos autores consideran que la embolización blanda puede ser igual de efectiva que la QEIA para el tratamiento paliativo de CHC12,14,15. Sin embargo, en algunas series se ha sugerido mejor respuesta del tumor al tratamiento con QEIA al compararlo con EIA, estos estudios son difíciles de confrontar debido a que existe gran diferencia entre poblaciones, características clínicas, protocolos de QEIA, número de intervenciones, seguimiento o criterios de evaluación14-16. Existen datos que demuestran que los hepatocarcinomas secretan factores de crecimiento angiogénicos como respuesta a la embolización14, siendo este un justificante para el uso de quimioterapéutico, el cual tendría efecto citotóxico sobre las células desprovistas de vasculatura, impidiendo así su crecimiento, a pesar de ello existen pocos estudios que comparan el tipo de respuesta al tratamiento entre estas 2 modalidades14,17,18.
El objetivo de estudio es comparar la respuesta y el tiempo libre de progresión en pacientes tratados con QEIA y EIA en nuestro Instituto.
Material y métodos
Durante los meses de marzo a septiembre de 2011 no se contó en nuestro país con lipiodol, medio de contraste oleoso indispensable para la entrega del agente quimioterapéutico durante la QEIA, por lo cual los pacientes que requirieron tratamiento locorregional para CHC fueron sometidos a embolización blanda. En la base de datos de Radiología Intervencionista del Instituto Nacional de Ciencias Médicas y Nutrición "Salvador Zubirán" (INCMNSZ), se identificaron a los pacientes que durante estas fechas recibieron embolización blanda como primer tratamiento de CHC y se compararon con pacientes cuyo primer tratamiento fue QEIA, entre los años 2010 y 2011.
El diagnóstico se realizó mediante TC trifásica de hígado o RM contrastada, en pacientes cirróticos previamente conocidos y que mostraban el comportamiento típico de CHC o mediante biopsia percutánea, en pacientes no cirróticos o con comportamiento atípico.
El tratamiento se realizó en la Sala de Hemodinamia del INCMNSZ, por parte de médicos de la División de Radiología Intervencionista. La EIA se llevó a cabo con partículas de PVA de 255 a 500 micras, con una técnica estándar.
La QEIA se realizó con 50 mg de cisplatino liofilizado, el cual se mezcló con 10 mL de lipiodol y posteriormente, se embolizó con partículas de PVA de 255 a 500 micras.
Los pacientes tratados con QEIA o EIA son evaluados de forma rutinaria al cumplir 3 meses después de su tratamiento. Estos pacientes se evalúan con TC trifásica o RM contrastada, según los criterios del mRECIST.
Los pacientes con EE, RP o PE fueron sometidos a nuevos tratamientos, de acuerdo al estadio de la enfermedad al momento de la evaluación. Fueron comparadas el tipo de respuestas entre los pacientes que recibieron embolización blanda vs. Los que recibieron QEIA, además de contrastar la sobrevida libre de enfermedad y el tiempo libre de progresión.
Las características clínicas y demográficas de los pacientes en ambos grupos, se compararon utilizando diversas pruebas estadísticas. La prueba U de Mann-Whitney fue utilizada para analizar variables paramétricas, la prueba exacta de Fisher fue usada para la medición de variables no paramétricas.
Resultados
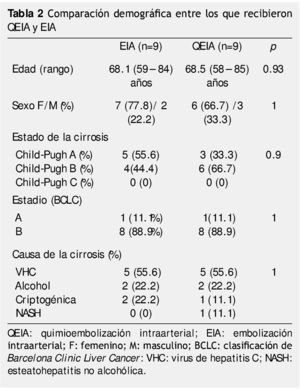
La tabla 2 resume las características clínicas y demográficas de los pacientes en ambos grupos. La edad fue analizada con la prueba U de Mann-Whitney, sin encontrar diferencia significativa (p=0.93). El género, estado de la cirrosis y estadio de BCLC se analizaron con prueba exacta de Fisher, sin encontrar diferencias significativas entre los 2 grupos. Tampoco se encontraron diferencias significativas en el tamaño de la lesión inicial, el número de lesiones y localización de las mismas:
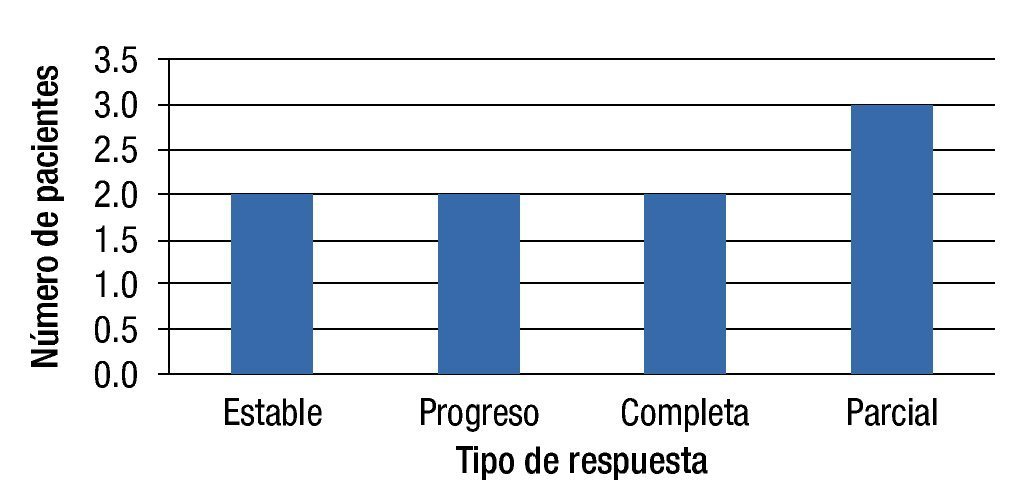
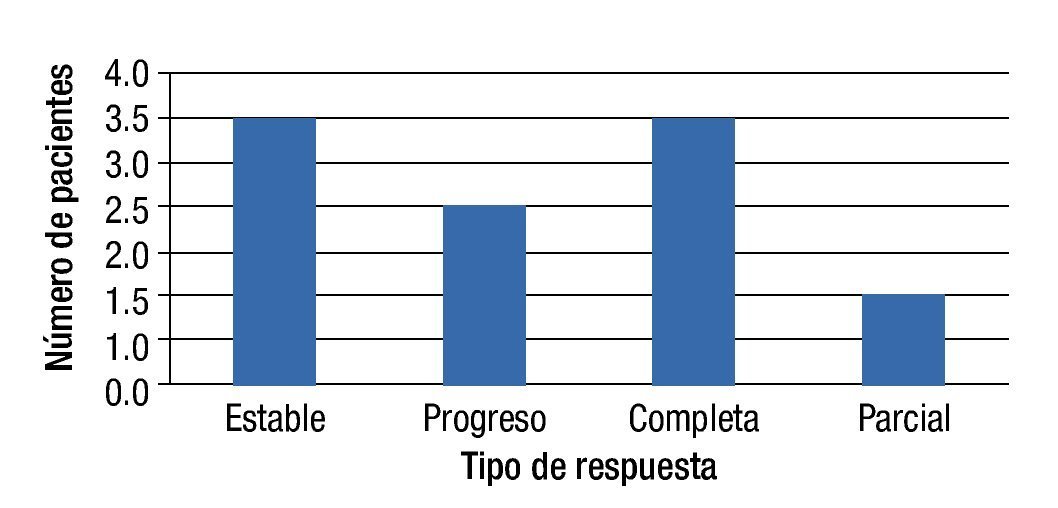
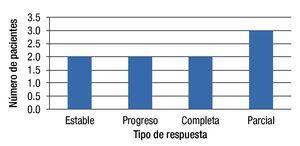
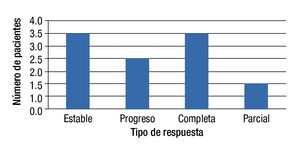
Respuesta al tratamiento EIA (3 meses después de este): Tres pacientes (33.3%) presentaron RC, 3 pacientes (33.3%) presentaron EE, un paciente (11.1) presentó RP y 2 pacientes (22.2%) progresaron al momento de la evaluación (fig. 1).
Figura 1. Tipo de respuesta en pacientes tratados con QEIA.
Respuesta al tratamiento QEIA (3 meses después de este): Dos pacientes (22.2%) se presentaron con RC, 2 pacientes con EE (22.2%), 3 pacientes con RP (33.3%) y 2 pacientes más con PE (22.2%) (fig. 2).
Figura 2. Tipo de respuesta en pacientes tratados con EIA.
Al dividir los grupos en respondedores (RP, RC) y no respondedores (EE, PE) y tras el análisis con la prueba exacta de Fisher, no se encontraron diferencias significativas entre el grupo de EIA vs. QEIA (p=1) (tabla 3).
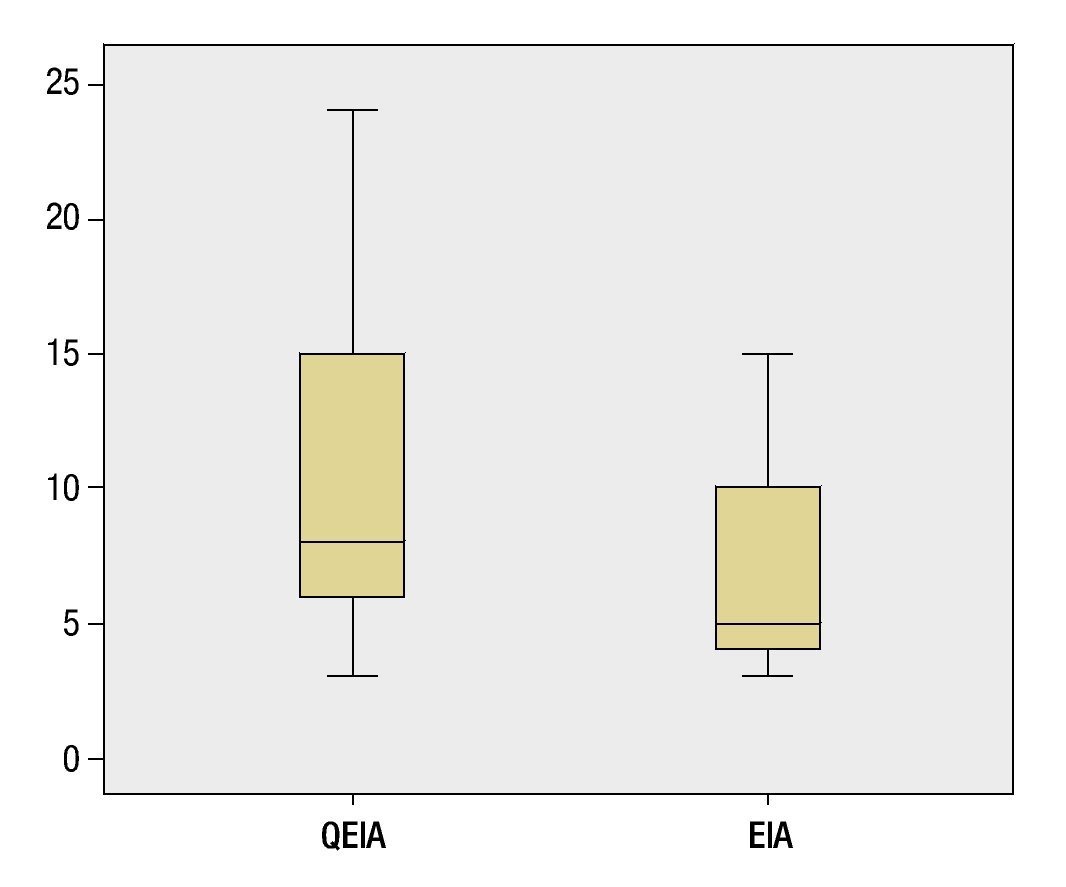
El tiempo libre de progresión para el grupo de embolización blanda en promedio fue de 6.88 meses y para el de QEIA de 10.55 meses, sin encontrar una diferencia estadísticamente significativa (Mann-Whitney, p=0.1639) entre el tiempo libre de progresión de ambos grupos.
Al comparar los pacientes que recibieron EIA vs. los que recibieron QEIA como tratamiento inicial de CHC localmente avanzado, no se encontraron diferencias significativas en cuanto al tipo de respuesta según mRECIST, así como tampoco se encontró diferencia en el tiempo libre de progresión, sin embargo existe una tendencia a mayor tiempo libre de progresión en el grupo de QEIA.
Discusión
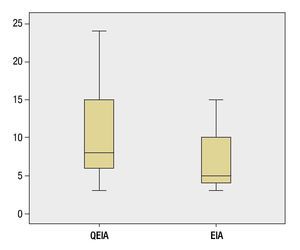
En este estudio comparamos la respuesta al tratamiento en los pacientes que recibieron EIA vs. QEIA, en la literatura médica existen pocos estudios que realicen esta comparación, además hay resultados discrepantes entre estos estudios14. Es importante recalcar que algunos autores han dado un discreto beneficio al uso de quimioterapéutico, debido a la posibilidad de que la embolización blanda induzca la angiogénesis como han sugerido los trabajos de Liao et al. y Kobayashi et al.14, no obstante la mayoría de estos estudios realizan la valoración únicamente de la sobrevida, sin considerar la respuesta al tratamiento, que en el caso de nuestro trabajo no demostró diferencia estadística entre ambos grupos; otro aspecto importante es el hecho de que la población presentaba características clínicas similares. Una limitante en el estudio es la falta de medición del tiempo de sobrevida, debido a que algunos de los pacientes recibieron diversos tratamientos posteriores a la realización de TACE o TAE, incluyendo quimioembolizaciones subsecuentes en el grupo de pacientes tratados con embolización blanda, imposibilitando la comparación entre ambos grupos a largo plazo. Al ser un estudio observacional y descriptivo existen otras limitantes como la falta de aleatorización de los pacientes, sin embargo nuestros resultados son similares a los observados por Malagari et al.14. En este estudio, se obtuvo RC en el 26.8% de los pacientes tratados con QEIA, 14% en el grupo de embolización blanda, la RP fue alcanzada en un 46.3% (QEIA) y 41.9% (EIA), con tasa de recurrencia de 8 y 12 meses para el grupo de QEIA y EIA, respectivamente, con diferencia estadísticamente significativa. En nuestro caso, la falta de diferencia estadística entre el tiempo libre de progresión entre uno y otro grupo muy probablemente se deba al tamaño de la muestra, ya que ambas medias son diferentes y existe tendencia a un tiempo libre de progresión mayor en el grupo de QEIA (fig. 3).
Figura 3. Diagrama de caja brazo mostrando el tiempo libre de progresión en meses, de los pacientes tratados con quimioembolización intraarterial (QEIA) y embolización blanda (EIA), con una media de 10.55 y 6.88 meses, respectivamente (Mann-Whitney p= 0.1639). En el diagrama destaca la tendencia a un mayor tiempo libre de progresión en el grupo tratado con QEIA.
Conclusiones
En nuestra población no existieron diferencias significativas en términos de respuesta. Ambas técnicas son eficaces en el control de enfermedad. Llama la atención que a pesar de no ser significativamente diferentes, el tiempo libre de progresión es diferente entre ambos grupos, lo que podría significar un discreto beneficio de la QEIA.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Financiamiento
Los autores no recibieron patrocinio para llevar a cabo este artículo.
* Autor para correspondencia:
Departamento de Radiología e Imagen Molecular, Instituto Nacional de Ciencias Médicas y Nutrición "Salvador Zubirán".
Vasco de Quiroga N° 15, Colonia Sección XVI, Delegación Tlalpan, C.P. 14000, México D.F., México.
Teléfono: 5487 0900, ext. 2157. Celular: (55) 3955 0999.
Correo electrónico: adpepe@gmail.com (Adrián José González-Aguirre).