Objetivo: Identificar en carcinomas uroteliales de vejiga, la asociación entre la expresión inmunohistoquímica de las variantes 3, 6 y 9 de CD44 y la invasión a la capa muscular propia.
Material y métodos: Se seleccionaron casos diagnosticados como carcinoma urotelial de vejiga, en el Departamento de Patología del Hospital de Oncología del Centro Médico Nacional Siglo Xxi, durante un periodo de cinco años. El material fue evaluado en forma independiente por dos patólogos para identificar grado histológico, patrón de crecimiento, características de la mucosa adyacente, invasión vascular, invasión perineural e invasión a la pared vesical. La expresión de las variantes 3, 6 y 9 de CD44 se evaluaron por inmunohistoquímica en los cortes seleccionados.
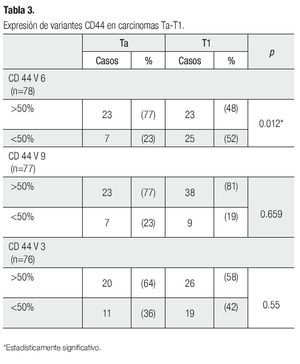
Resultados: Se estudiaron 118 pacientes, en 28 se analizó más de una neoplasia. Se obtuvieron un total de 152 muestras, 52 con invasión a muscular propia y 98 sin invasión. Se observó un menor porcentaje de expresión de la variante 9 de CD44, en los casos con invasión a muscular propia. Entre los carcinomas Ta-T1 hubo menor expresión de la variante 6, que en los carcinomas que infiltraban la lámina propia.
Conclusiones: Consideramos que la disminución en la expresión de las variantes de CD44 en los carcinomas uroteliales, puede ser un epifenómeno asociado a la invasión estromal por las células neoplásicas.
Objective: Our objective was to identify the association between immunohistochemical expression of CD44 variants 3, 6, and 9 and invasion to muscularis propia in transitional cell carcinoma (TCC) of the urinary bladder.
Materials and methods: We selected cases identified with this cancer type from the Pathology Archives in a 5-year period. The material was evaluated independently by two Pathologists to identify neoplasia stage, histologic grade, growth pattern, adjacent mucosa, and vascular and perineural invasion. CD44 variant expression was evaluated by immunochemistry with the corresponding specific antibodies, comparing these with a negative control. Analysis was carried out according to the presence of a response to a stain of > 50%.
Results: We studied 118 patients with a 3:1 ratio of males to females. In 28 cases, we analyzed more than one neoplasia; thus, we had a total count of 152 samples, 54 with and 98 without invasion to muscularis propia. We observed a smaller number of samples that expressed CD44 variant 9 (v9) in carcinomas with invasion to muscularis propia. Among superficial carcinomas, we observed a diminution in our CD44 variant 6 (v6)-expressing samples in samples presenting invasion to muscularis propia.
Conclusions: We consider that diminution of CD44 variants in urothelial carcinomas can be an epiphenomenon associated with stromal invasion by neoplasic cells.
INTRODUCCIÓN
El carcinoma urotelial es el subtipo histológico más frecuente de cáncer de vejiga, representa el 90% de estas neoplasias. Comprende un espectro de neoplasias con comportamientos clínicos y biológicos diversos. Entre el 70% a 80% las neoplasias son papilares, confinadas a la mucosa o lámina propia, y 75% de estas pueden presentar recurrencia. Alrededor del 30% de los pacientes con carcinoma urotelial de vejiga, se presentan desde un inicio con invasión a la muscular propia, de éstos el 50% puede recurrir con enfermedad metastásica en un lapso de dos años.1
El grado histológico y el estadio son factores determinantes en el pronóstico y en las estrategias de tratamiento, sin embargo, hay un grado significativo de variabilidad en el comportamiento de los tumores aun estando en los mismos subgrupos pronósticos.
La diferente expresión de marcadores moleculares relacionados con ciclo celular, apoptosis, angiogénesis, factores de crecimiento, señalización, moléculas de adhesión e interacción con matriz extracelular, explican en algunos casos la heterogeneidad observada en estas neoplasias.2
El CD44 es una glicoproteína transmembrana que participa en la interacción célula-célula, célula-matriz extracelular, diferenciación y migración celular. La diversidad de funciones de esta molécula está dada por el gran numero de isoformas, producidas por el fenómeno de corte y empalme (splicing) alternativo del RNAm.3
Todas las isoformas de CD44 comparten una región de unión con el ácido hialurónico, un glicosaminoglicano componente de la matriz extracelular. La señalización desencadenada por la unión ácido hialurónico/CD44 se ha relacionado con invasión y metástasis tumoral. Esta señalización puede estar dada por la interacción con la forma estándar de CD44 o sus variantes.4
La variante 3 de CD44 participa en la función de factores de crecimiento unidos a heparina como el factor de crecimiento fibroblástico básico, factor de crecimiento vascular endotelial y el factor de crecimiento unido a heparina, por lo que se considera capaz de promover la proliferación celular, aún sin participación del ácido hialurónico.5
Se ha relacionado la expresión de la variante 6 con progresión tumoral, ya que su transfixión convierte células de carcinoma de rata no metastásicas en metastásicas.6
En carcinomas de estómago, colon, mama y pulmón, la expresión de las variantes de CD44 se han asociado a un comportamiento agresivo.7-10
En carcinomas uroteliales de vejiga se ha observado disminución en la expresión de algunas variantes, a medida que el tumor progresa.11-13 Sin embargo, existen estudios en los que se ha observado expresión de la variante 6 en carcinomas T3.14
En este estudio, evaluamos la expresión de las variantes 3, 6 y 9 de CD44 en carcinomas uroteliales de vejiga y su asociación con invasión a la muscular propia.
MATERIAL Y MÉTODOS
Del archivo del Departamento de Patología, del Hospital de Oncología, de Centro Médico Nacional Suglo XXI, se obtuvieron los casos de pacientes diagnosticados como carcinoma urotelial de vejiga en un periodo de cinco años. Los datos clínicos recabados se obtuvieron del expediente clínico.
Las laminillas fueron revisadas por dos patólogos en forma independiente para confirmar el diagnóstico de carcinoma urotelial, evaluar infiltración, grado histológico de acuerdo a los criterios de la OMS (1973),15 patrón de crecimiento de la neoplasia, características de la mucosa adyacente, invasión vascular e invasión perineural. Del material evaluado, se seleccionaron cortes representativos de cada lesión para realizar reacciones de inmunohistoquímica para las variantes 3, 6 y 9 de CD44.
TÉCNICA DE INMUNOHISTOQUÍMICA
Se utilizaron cortes de 5 micras que se desparafinaron y rehidrataron. Se realizó exposición de antígenos con horno de microondas por 10 minutos en el sistema retrival (Dako Corporation®, Carpinteria, CA., USA). La peroxidasa endógena se bloqueo con peróxido de hidrogeno al 10%, en metanol por 30 minutos a temperatura ambiente. El bloqueo de uniones inespecíficas del anticuerpo primario, se realizó con albúmina al 5% por 30 minutos a temperatura ambiente. Los anticuerpos primarios anti CD44v6 clona MAB40073 (Chemicon International®, Temecula, CA., USA) a dilución 1:300; anti CD44v9 clona C2398-63 (U.S. Biological®, Suampscott, MA. USA) a dilución 1:300 y anti CD44v3 (Chemicon Internationalse®, Temecula, CA., USA) a dilución 1:250 se incubaron toda la noche.
Se reveló con el sistema de detección peroxidasa-antiperoxidasa (Dako, Envision) que fue incubado 30 minutos a temperatura ambiente. El revelado de la reacción se realizó con diaminobenzidina (Dako), y se contrastó con hematoxilina. Entre cada paso se realizaron lavados con buffer de fostatos.
ANÁLISIS ESTADÍSTICO
Se determinó más del 50% de expresión de las variantes de CD44 como positivo, a través de la realización de curvas ROC. Para evaluar la asociación de invasión a la muscular propia, con las características histopatológicas y la expresión de las variantes de CD44 se utilizo ji cuadrada. Las características que mostraron diferencias entre los carcinomas con invasión a muscular propia y aquellos sin invasión, se tomaron en cuenta para realizar un análisis de regresión logística.
Se utilizo un valor de p<0.05 para considerar los resultados estadísticamente significativos.
RESULTADOS
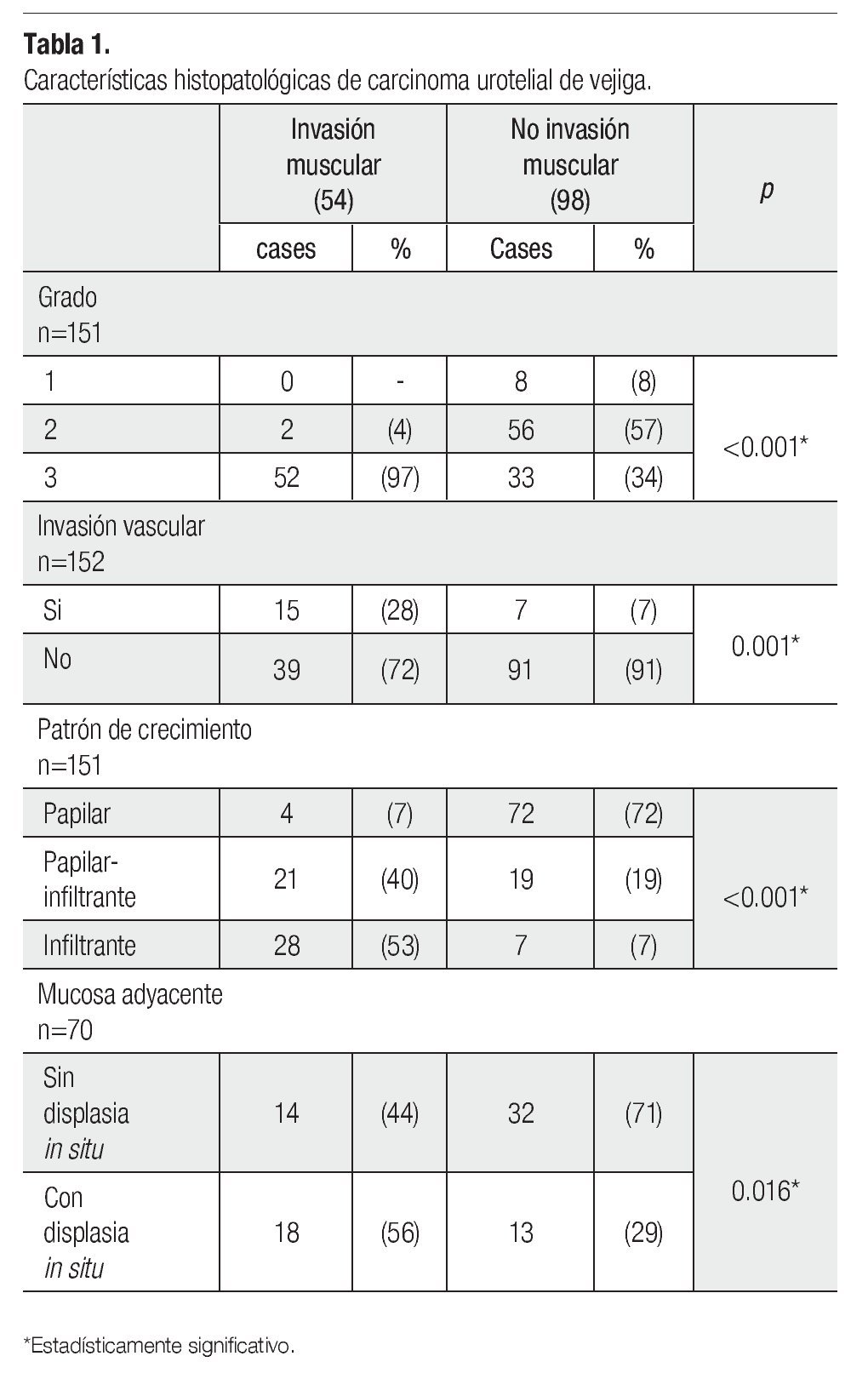
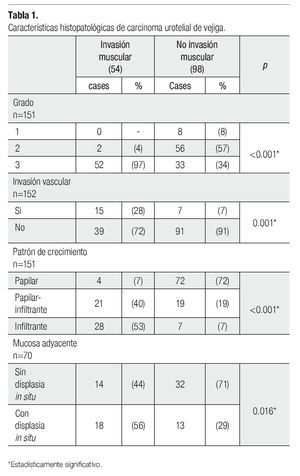
Se obtuvieron 118 pacientes, 91 hombres y 27 mujeres (relación 3:1). De los 118 pacientes, en 28 se estudió más de una neoplasia. De todos se evaluaron 152 neoplasias, 54 con invasión a la muscular propia y 98 sin invasión. Las características histológicas evaluadas se presentan en la Tabla 1.
El grado 3, patrón de invasión infiltrante, la invasión vascular y la presencia de carcinoma in situ o displasia fueron características que mostraron asociación estadísticamente significativa con la invasión a la muscular propia.
EXPRESIÓN DE VARIANTES CD44
La expresión de las variantes se observó predominantemente en la membrana celular.
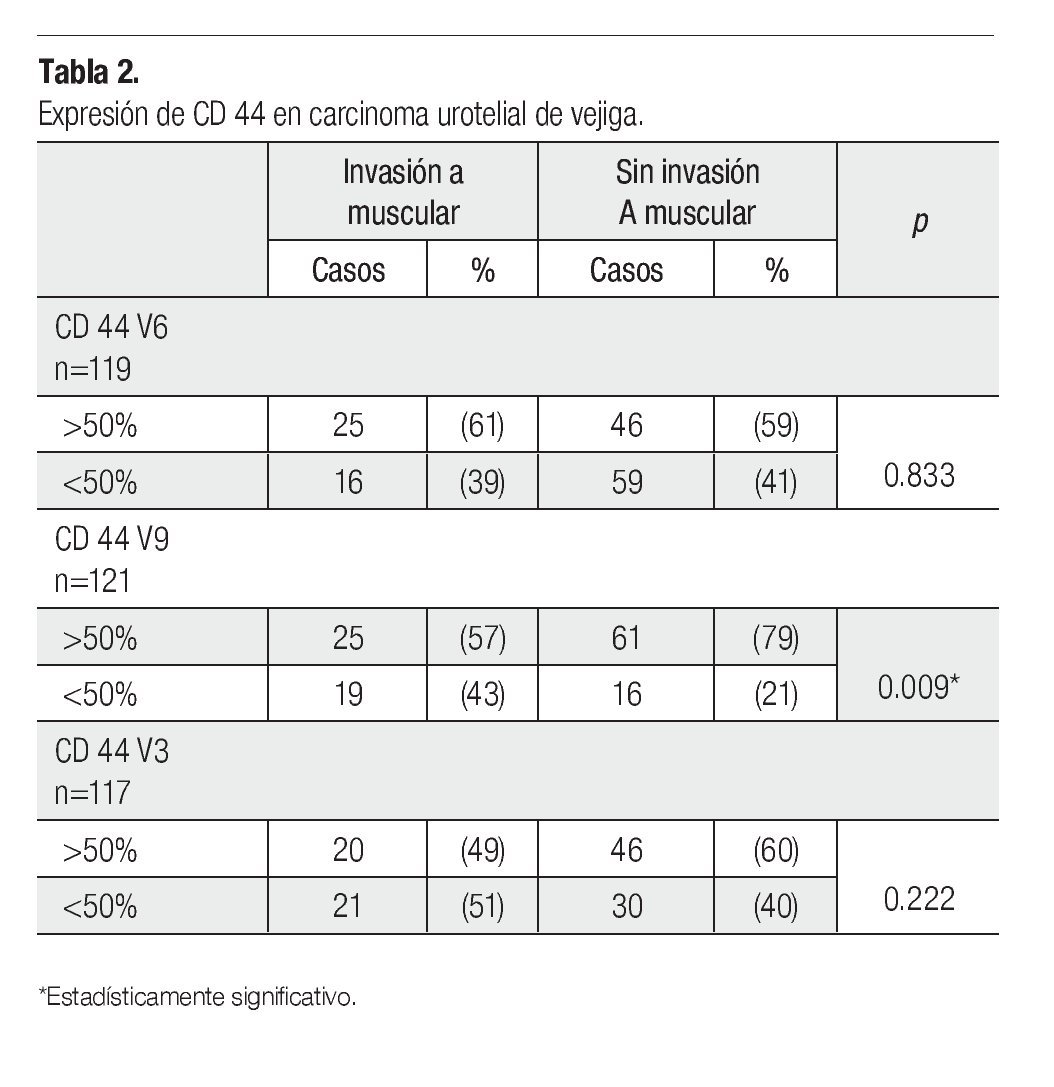
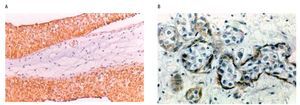
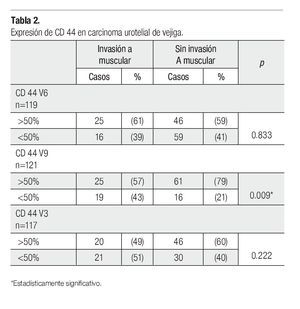
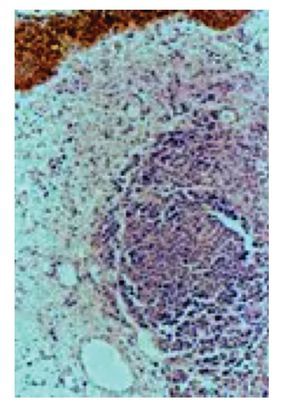
La expresión de CD44v9 fue mayor en los carcinomas sin invasión a la muscular propia (Figura 1), observándose positividad en más del 50% de las células neoplásicas en el 79% de los casos Ta-T1, y sólo en el 25% de los casos con invasión a la muscular propia (p=0.009) (Tabla 2).
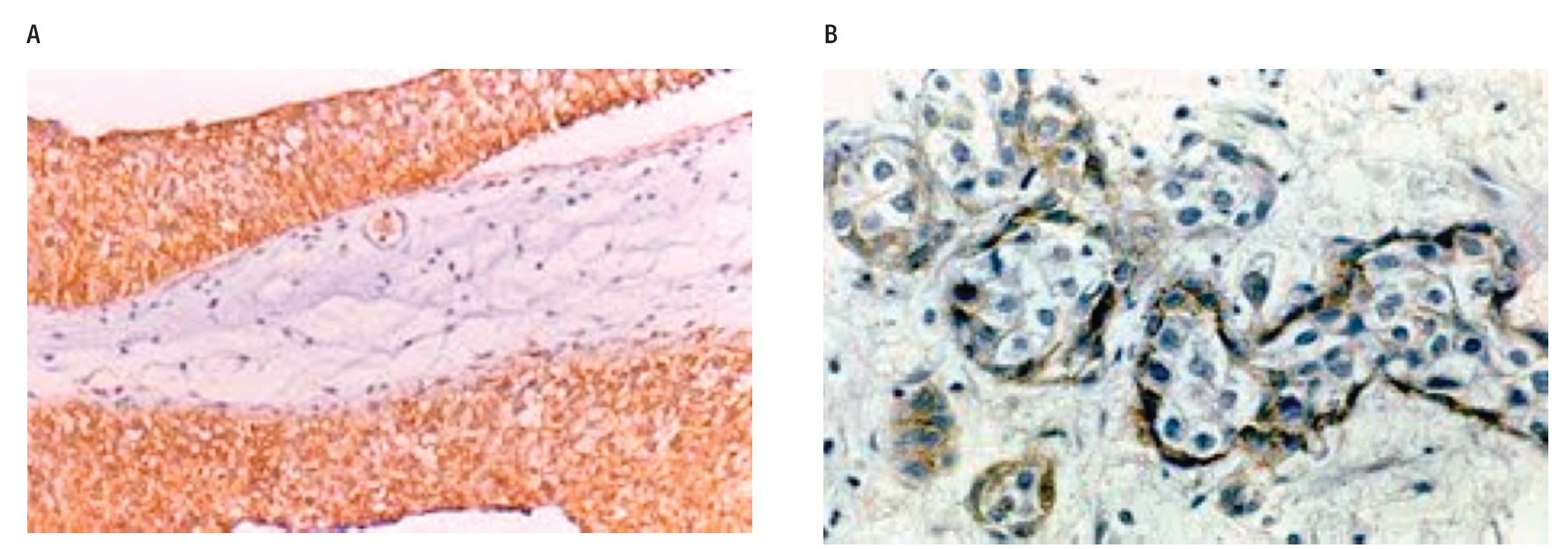
Figura 1. A) Expresión de membrana en CD44v9 en carcinoma urotelial con patrón papilar. B) Expresión de membrana en carcinoma con patrón infiltrante.
Al hacer el análisis multivariado tomando en cuenta las características histopatológicas de grado, invasión vascular, patrón de crecimiento y asociación con carcinoma in situ, la expresión de CD44v9 y el patrón de crecimiento siguen mostrando diferencias estadísticamente significativas (p=0.017).
No se demostró diferencia de expresión entre los invasores y no invasores a muscular propia, con las variantes 3 y 6.
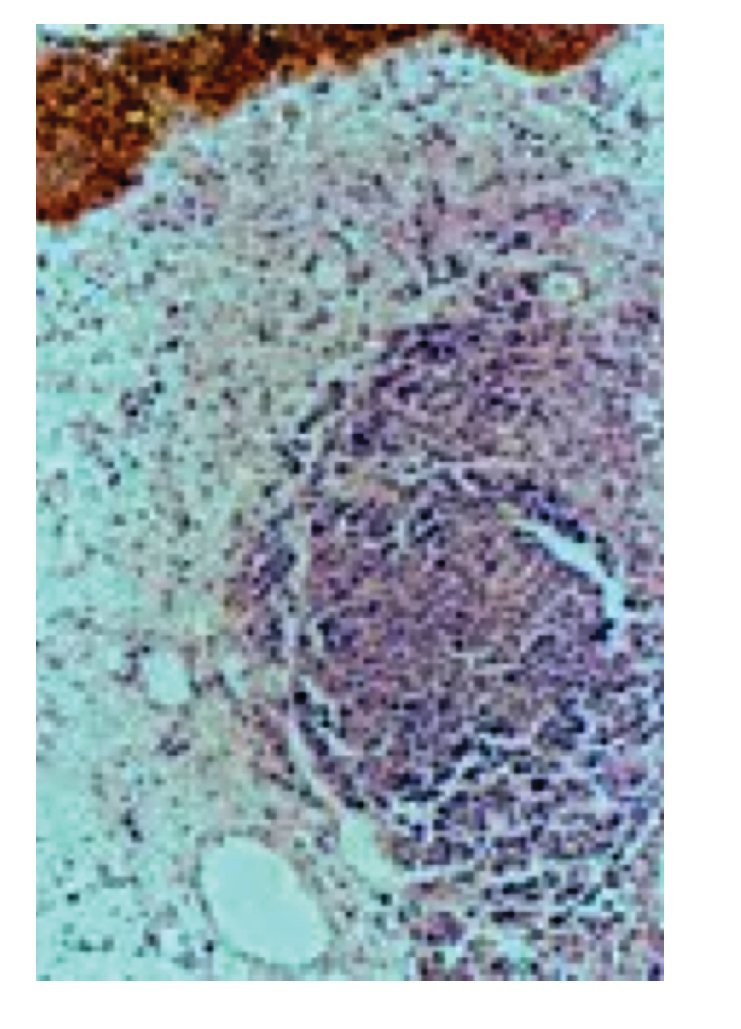
En un caso con carcinoma papilar con focos de crecimiento infiltrante observamos que el componente papilar mantuvo la expresión de CD44v9, mientras que el componente infiltrante cercano a la muscular propia perdió la expresión (Figura 2).
Figura 2. Pérdida de expresión de CD44v9 en componente infiltrante de carcinoma urotelial.
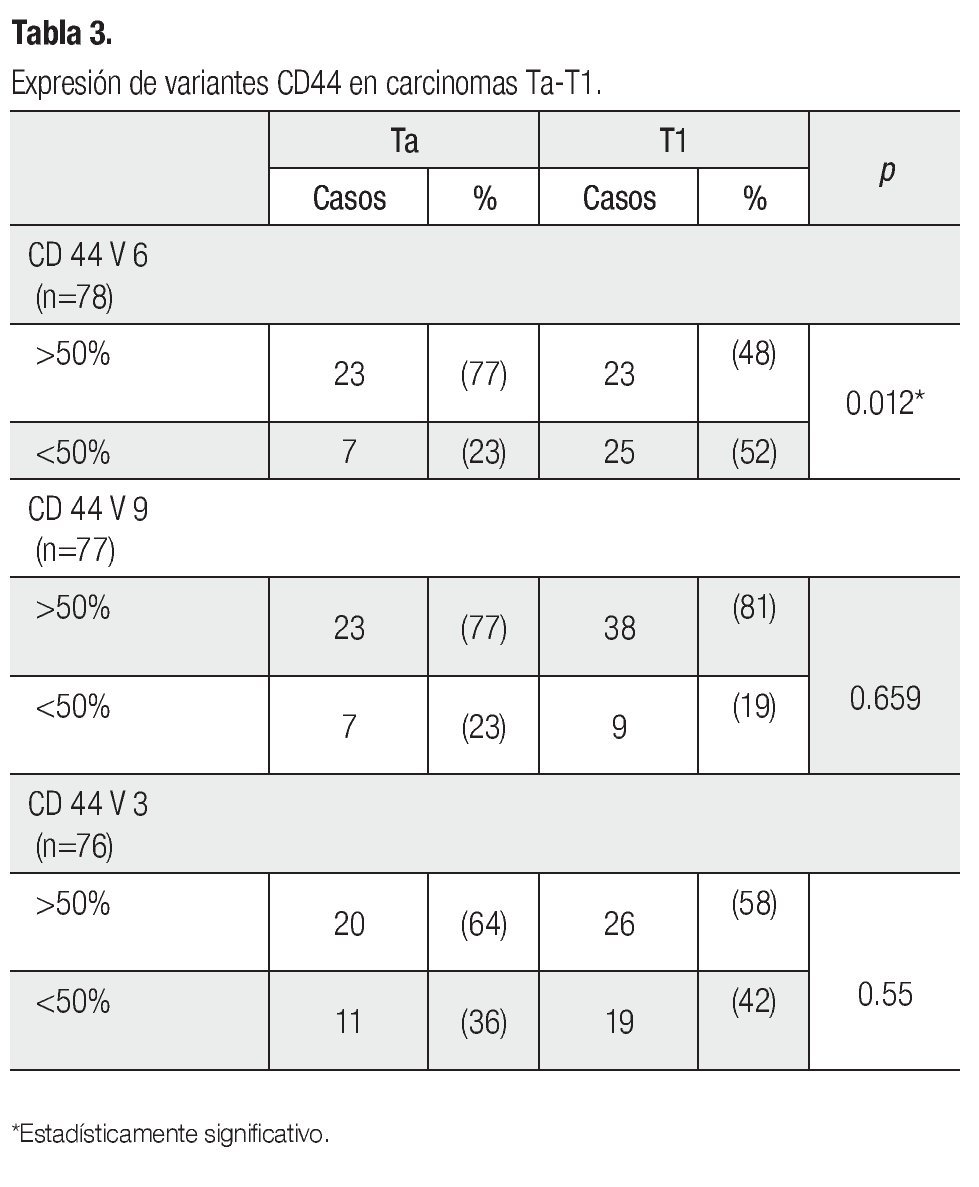
Al evaluar solamente los carcinomas Ta-T1, observamos que hubo disminución de CD44v6 en los carcinomas T1 en comparación con los Ta (Tabla 3).
DISCUSIÓN
Estudios clínicos y experimentales han demostrado que la función alterada de las moléculas de adhesión, tiene un papel importante en el proceso de invasión y metástasis en neoplasias malignas.16 La relación de C44 y estadio varía entre cada órgano estudiado. No hay una relación sistemática entre las alteraciones en la expresión de CD44 y comportamiento maligno, sin embargo, si se puede establecer que la actividad inapropiada de esta molécula es una característica de neoplasia en muchos órganos y tejidos.
En epitelio transicional normal CD44 y sus variantes se expresan en la capa basal. En líneas celulares de cáncer de vejiga y en neoplasias de pacientes con carcinoma urotelial de vejiga, la expresión de CD44 y sus variantes se ve alterada.17 En estos tumores hay un defecto en el procesamiento postranscripcional, que incluye el corte y empalme alternativo de los transcritos de CD44. Esto pudiera deberse a una alteración en el mecanismo de corte y empalme o a la sobresaturación del proceso, por un transcrito muy abundante debido a defectos en la regulación del gen.18
En este estudio, las neoplasias con invasión a la muscular propia tuvieron menor expresión de CD44v9 en relación a los carcinomas uroteliales sin invasión muscular, y no se observaron diferencias en la expresión de las variantes 3 y 6. Este resultado contrasta con el realizado por Sugino, que demostró disminución en la expresión de CD44v6 en los carcinomas infiltrantes a muscular propia. En su estudio describe, que en las neoplasias con patrón mixto papilar e infiltrante, en el componente papilar hay expresión de la CD44v6 y en el infiltrante, hay disminución heterogénea en la expresión de este.13 Su observación coincide con la realizada en uno de nuestros casos en la evaluación de CD44v9.
Este fenómeno nos lleva a cuestionarnos si el cambio en la expresión de las variantes de CD44 es un factor pronóstico, o un epifenómeno asociado a las características del microambiente.
Se sabe que el ácido hialurónico, una glicoproteína presente en la matriz extracelular puede modificar la expresión celular de CD44s y sus variantes, influyendo en la transcripción del gen y en el proceso de corte y empalme alternativo, dando lugar a diferentes isoformas de CD44.19,20 Además, Ooms observó en forma indirecta que entre la mucosa vesical no neoplásica y neoplásica hay diferencias en la concentración de ácido hialurónico.21
Hay evidencia de que el contacto con enzimas presentes en la matriz extracelular como las metaloproteinasas y la catepsina D, modifican la expresión de CD44 por las células neoplásicas.22,23 Todas estas observaciones apoyan que la disminución en la expresión de las variantes 6 y 9 de CD44 en carcinomas uroteliales, más que un factor pronóstico podría ser un epifenómeno asociado a invasión a lámina propia y muscular propia, respectivamente.
El conocimiento de que en la neoplasia urotelial invasora hay cambio en la expresión de las variantes de CD44 en relación al carcinoma urotelial no invasor, pudiera ayudar a apoyar el diagnóstico de invasión en productos de RTUV, en los que la neoplasia muestre extensa necrosis o desmoplasia intensa, y no sea posible evaluar en forma adecuada la infiltración a la muscular propia. La pérdida de la expresión de la variante 9 de CD44 pudiera ser un elemento, que indique al patólogo en la probabilidad de invasión y que se sugiera al médico tratante esta posibilidad, para que este a su vez norme su conducta de manejo en los pacientes.
Correspondencia:
Dra. Alejandra Mantilla Morales,
Unidad Médica de Alta Especialidad, Hospital de Oncología, CMN SXXI, IMSS.
Av. Cuauhtémoc 330, Colonia Doctores.
C.P. 06720. México D.F., México.
Fax: (+52) (55) 5761 0952.
Correo electrónico: alemantimora@yahoo.com.mx