Introducción: En la leucemia aguda linfoblástica (LAL) se describen lesiones orales, siendo la mucositis la más frecuente posquimioterapia, debido a la falta de selectividad hacia células con elevada replicación como las de mucosa bucal, implicando un riesgo para infecciones locales y sistémicas en el estado neutropénico del paciente.
Objetivo: Determinar los factores de riesgo para lesiones orales (mucositis e infecciones) en niños con LAL bajo quimioterapia en el periodo 2012-2013, y si estas lesiones se asocian al desarrollo de septicemia.
Material y métodos: Estudio longitudinal prospectivo en menores de 18 años con LAL vírgenes a tratamiento, incluidos en régimen de quimioterapia intensa. Muestra: la total disponible durante 2012-2013. Factores de riesgo analizados: edad, sexo, desnutrición, neutropenia e higiene bucal asociados a lesiones orales. Análisis: medidas de frecuencia, análisis bivariado (prueba exacta de Fisher) y riesgo relativo de lesión oral.
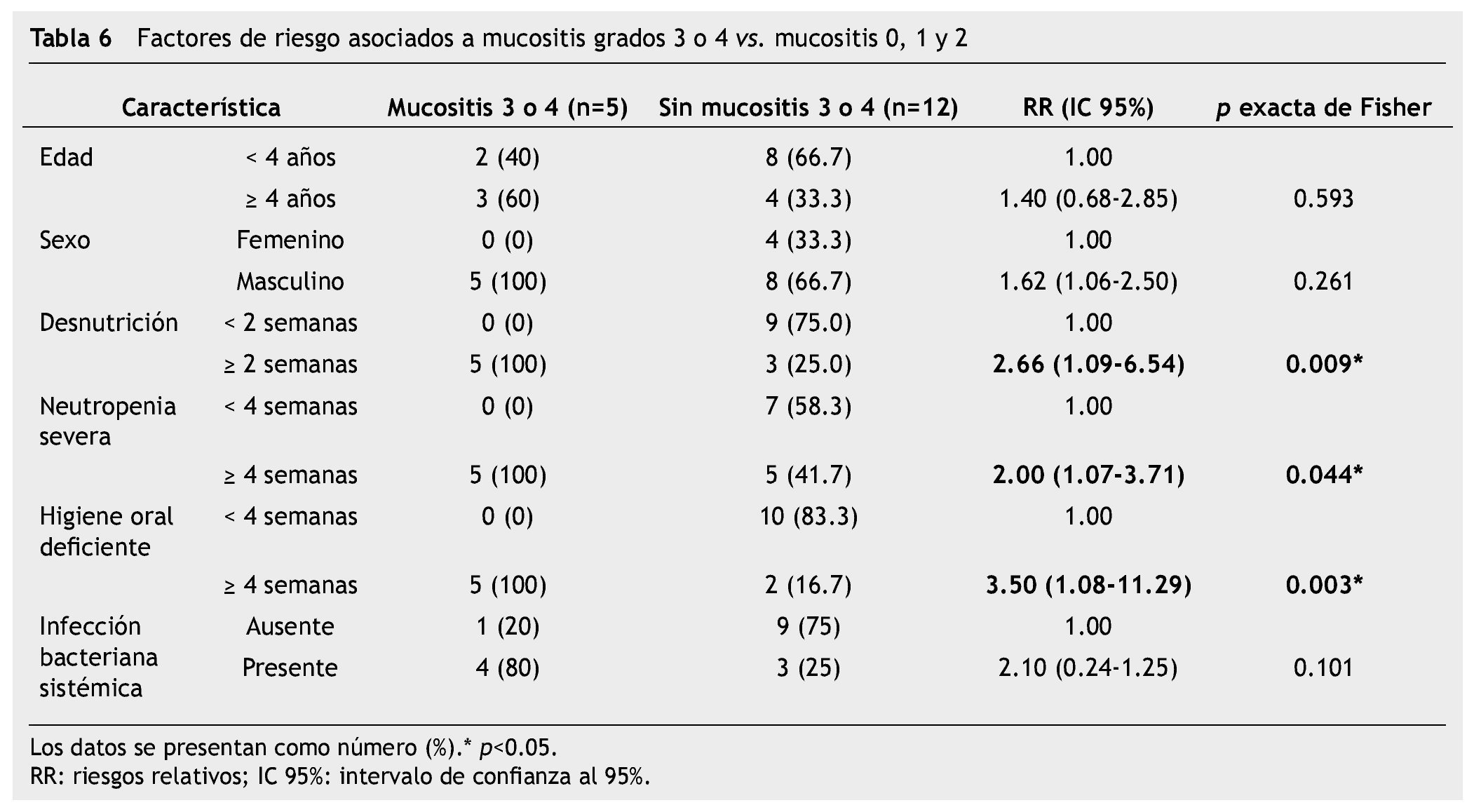
Resultados: Se incluyeron 17 niños (2-16 años), 71% desarrolló lesión oral, 65% mucositis oral, 29% infección bacteriana oral y 12% candidiasis; realizamos 24 cultivos bucales, 20 fueron positivos (19 de secreciones y un KOH). El factor de riesgo asociado a mucositis oral grado 3 y 4 fue desnutrición ≥ 2 semanas (RR=2.66; IC 95%=1.06-2.50; p=0.009), neutropenia severa ≥ 4 semanas (RR=2.00; IC 95%=1.07-3.71; p=0.044) e higiene bucal deficiente ≥ 4 semanas (RR=4.50; IC 95%=1.33-15.38; p=0.021). El riesgo para septicemia asociada a lesión oral fue RR=2.10, p=0.101, aunque no se encontró asociación estadística, representó una tendencia clínica para infecciones sistémicas ya que 4 de 5 pacientes la presentaron.
Introduction: In acute lymphoblastic leukemia (All), are described lesions in the oral cavity being the most frequent oral mucositis after chemotherapy, due to the lack of selectivity towards cells with high replication rate as the oral mucosa, implying a risk for local and systemic infections in neutropenic status of patient.
Objective: To determine the risk factors for oral lesions (mucositis and infections) in children with All in chemotherapy in 2012-2013 and whether these injuries are associated with septicemia.
Material and methods: Prospective and longitudinal study in children under 18 years old with All and no prior treatment, included in an intensive chemotherapy regimen. Sample size: The total available for 2012-2013. Risk factors analyzed: age, sex, malnutrition, neutropenia, and oral hygiene associated with oral lesions. Analysis: Measurements of frequency, bivariate analysis with Fisher´s exact test and relative risk of oral lesions.
Results: We included 17 children in chemotherapy (2-16 years), 71% developed oral lesion, 65% oral mucositis, 29% oral bacterial infection and 12% candidiasis; 24 cultures were performed mouth 20 were positive (19 secretions and KOH). The risk factor associated with oral mucositis grade 3 and 4, was malnutrition ≥ 2 weeks (RR=2.66; 95% CI=1.06-2.50; p=0.009), severe neutropenia ≥ 4 weeks (RR=2.00; 95% CI=1.07-3.71; p=0.044) and a poor oral hygiene ≥ 4 weeks (RR=4.50; 95% CI=1.33-15.38; p= 0.021). The risk for oral lesions associated septicemia had RR=2.10, p=0.101, although no association was found, represent a tendency for systemic infections clinic being that 4/5 patients presented.
Introducción
Según la Organización Mundial de la Salud (OMS), el "cáncer" es un término genérico para un grupo de más de 100 enfermedades malignas que pueden afectar a cualquier parte del organismo1; es la generación rápida de células anormales diseminándose a otros órganos dando lugar a formación de metástasis2. El factor causal es multifactorial, mutaciones somáticas en 85% de los casos, 15% transmitido por genes; existe evidencia que es resultado de mutaciones en el ácido desoxirribonucleico (ADN) de células tumorales3.
En la infancia, dentro de los padecimientos hematooncológico, las leucemias se colocan en primer lugar4, la mayoría se presentan entre los 4 a 5 años, situación de impacto en salud pública5,6. La OMS informa que existen alrededor de 10 millones casos nuevos/año, incluyendo población debajo de los 18 años de edad7. En México, la Secretaría de Salud en 1996 informó que es la segunda causa de muerte entre los 5-14 años y entre el primer y cuarto año de edad es la sexta causa de mortalidad8,9; entre los 4-15 años tiene una incidencia de 122 casos nuevos/millón/año10,11.
Las leucemias agudas son neoplasias hematológicas que se caracterizan por la proliferación y crecimiento incontrolado de células linfoides o mieloides inmaduras, dando origen a precursores poco diferenciados (blastos)3; en la edad pediátrica, los padecimientos más comunes en orden de frecuencia para la edad de 0 a 14 años, es la leucemia aguda linfoblástica (LAL) que representa el 23.6% de los padecimientos hematooncológicos10; el registro epidemiológico de neoplasias malignas reportó en el 2010 una incidencia de LAL de 1.3/100,000 habitantes/año11,12.
Las pautas de tratamiento para la LAL son a base de poliquimioterapia para buscar un efecto sinérgico de los fármacos y disminución de los efectos adversos13,14, controlar el crecimiento, replicación y destruir células cancerosas en diferentes fases del ciclo celular, pero la falta de selectividad de éstos, produce efectos tóxicos en las células normales con elevada tasa de replicación como las de la capa basal de los epitelios15, alterando su capacidad de renovación y causando efectos secundarios que varían en función de la intensidad y vías de administración16,17, los cuales afectan principalmente a los sistemas digestivo, hematológico, renal y dermatológico13,18,19. En las neoplasias hematológicas se describen con frecuencia lesiones en la cavidad oral, secundario al daño directo de la quimioterapia hacia los tejidos orales en la mitosis del epitelio20, inhabilitando la contención de enfermedades orales menores durante la mielosupresión13,21-23.
El término de "mucositis oral" es usado para describir la inflamación de la mucosa oral inducida por quimioterapia y/o radioterapia y la "estomatitis" se refiere a cualquier inflamación de los tejidos orales24,25, donde partes del tracto alimentario, desde la boca hasta el ano son afectadas19,26,27.
La mucositis se produce por la destrucción de queratinocitos basales no pudiendo realizar éstos su recambio18, forma seudomembranas por 1-2 semanas, periodo de susceptibilidad a bacteremia y sepsis10,17,28; acontece después de 7-10 días posquimioterapia, cerca del peor momento del conteo de neutrófilos; la mucosa no queratinizada bucal es la más afectada16,22,25. La mucositis es un proceso biológico de 4 fases mediadas por citoquinas17:
1. Fase inflamatoria vascular: causada por la liberación de citoquinas inflamatorias del epitelio.
2. Fase epitelial: debido a los agentes citotóxicos que actúan en la fase S del ciclo celular.
3. Fase ulcerativa/microbiológica: ruptura de barreras mucosas (alto riesgo de infección).
4. Fase curativa: depende de la renovación de las células de proliferación y diferenciación.
Debido al compromiso inmunológico y neutropenia, la cavidad oral se torna en un ambiente propicio para promover infecciones fúngicas, principalmente por Candida spp.4,29, infecciones del grupo herpes virus y bacterianas, colocando al paciente en riesgo de septicemia2. Los fármacos más frecuente que causan mucositis oral son los del grupo de anti-metabolitos como metotrexato, 5-fluorouracilo, citarabina, 6-mercaptopurina y otros como melfalán, busulfán, ciclofosfamida, etopósido, doxorrubicina, arabinósido de citosina e ifosfamida que contribuyen al daño tisular17,21,26,30. El metotrexato y etopósido se secretan por saliva, produciendo una mayor toxicidad oral32. Aunque no todos los pacientes con quimioterapia desarrollan mucositis, algunos autores han descrito la asociación con factores de riesgo que pueden incrementar su desarrollo16,17,21,31-37 (tabla 1).
Se describe a la edad como un factor de riesgo, ya que los pacientes más jóvenes tienen una tasa de mitosis epitelial más rápida y más receptores del factor de crecimiento epidérmico en el epitelio38,39. Otros factores como mucositis previa, desnutrición y neutropenia grave, son importantes ya que hay mayor riesgo de colonización microbiana y fúngica, y aumento de citoquinas proinflamatorias en la mucosa oral21,40; otros autores mencionan como un riesgo al polimorfismo genético, el cual se encuentra en estudio16,26. La etiopatogenia de las lesiones orales en el paciente pediátrico oncológico como la mucositis oral, aún no está bien definida, es una lesión frecuente posterior a la quimioterapia presentándose entre un 18%-20% en el primer ciclo20, el 50% de ellas requieren de intervención médica de acuerdo a la severidad14, por lo que nos planteamos ¿cuáles son los factores de riesgo en el desarrollo de lesiones orales en niños con LAL bajo quimioterapia?; publicaciones internacionales reportan que un 27.3% de mucositis oral grado 3 y 4, están sobreinfectadas principalmente por bacterias que originan infecciones sistémicas en aproximadamente el 15.2%33, siendo un factor de riesgo para infecciones locales y sistémicas; por lo que el segundo planteamiento fue conocer si las lesiones orales sobreinfectadas son un factor de riesgo para el desarrollo de infección sistémica en pacientes sometidos a esquemas intensos de tratamiento.
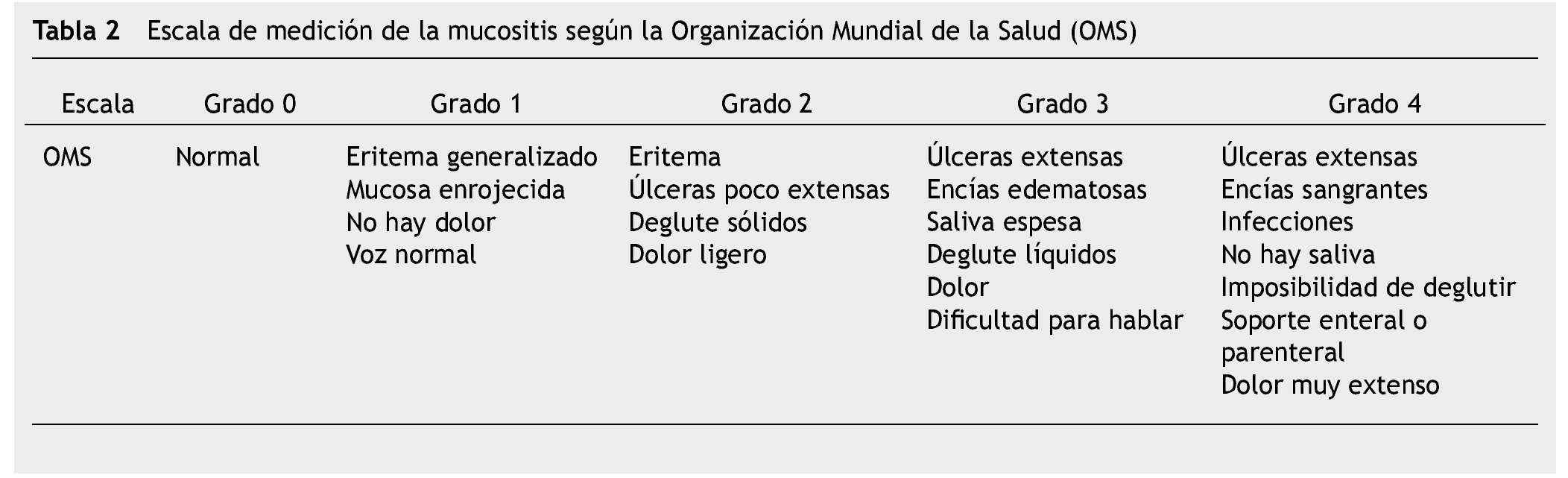
De todos los sistemas de medición de la mucositis oral que se consideran válidos, la escala de la OMS, define el estado de las lesiones de la mucositis según la severidad de las mismas, estableciendo grados del 0-420, 26 (tabla 2).
La prevalencia de lesiones orales oscila entre el 30%-85% de éstas, las candinemias representan un alto porcentaje, seguidas de infecciones virales y bacterianas, que agravan el cuadro clínico del paciente comprometiendo la respuesta inmunológica y aumentando el grado de morbilidad y mortalidad; no hay fármacos que la puedan prevenir y en algunos casos el paciente no tolera la vía oral resultando en la necesidad de nutrición enteral y/o parenteral para prevenir la desnutrición, casi siempre existe un cambio del curso o interrupción de la quimioterapia, además de asociarse con largos periodos de hospitalización significando un alto costo financiero a nivel familiar e institucional, asimismo diversos autores relacionan un buen estado bucodental durante el tratamiento con una menor incidencia y gravedad de mucositis y desarrollo de bacteremias, de ahí que nuestro objetivo primario fuera determinar los factores de riesgo para el desarrollo de lesiones orales (mucositis e infecciones bacterianas, micóticas y virales) en niños con LAL bajo quimioterapia en el periodo 2012-2013 en el Instituto Nacional de Pediatría (INP), para en un futuro desarrollar una herramienta útil de evaluación de la quimioterapia sobre la mucosa bucal, tener una perspectiva del desarrollo y evolución de este tipo de lesiones, y así sustentar un programa preventivo de atención para aminorar la incidencia y lograr una buena calidad de vida del paciente, ayudando al mismo tiempo a disminuir el riesgo de bacteriemias provenientes de un foco oral; nuestros objetivos secundarios fueron determinar si la edad y sexo del paciente pediátrico con LAL en quimioterapia se asocian con la presencia de lesiones orales, establecer si un bajo recuento absoluto de neutrófilos, la higiene oral, representada por la presencia de placa dentobacteriana y la desnutrición se asocian con el desarrollo de lesiones orales durante la quimioterapia y determinar si las lesiones orales sobreinfectadas son un factor de riesgo para el desarrollo de infecciones sistémicas.
Material y métodos
Se realizó un estudio longitudinal prospectivo en el Servicio de Oncología Médica del INP, que incluyó una muestra por conveniencia de pacientes menores de 18 años de edad con LAL, sometidos por primera vez a quimioterapia intensa durante el periodo de marzo de 2012 a marzo de 2013. Diversos estudios en base a factores de riesgo para mucositis oral han sido grandes, ya que incluyen población mixta, niños, adolescentes y adultos, y la mayoría son retrospectivos, al no haber una referencia pediátrica prospectiva, se justifica el modelo de recolección propuesto.
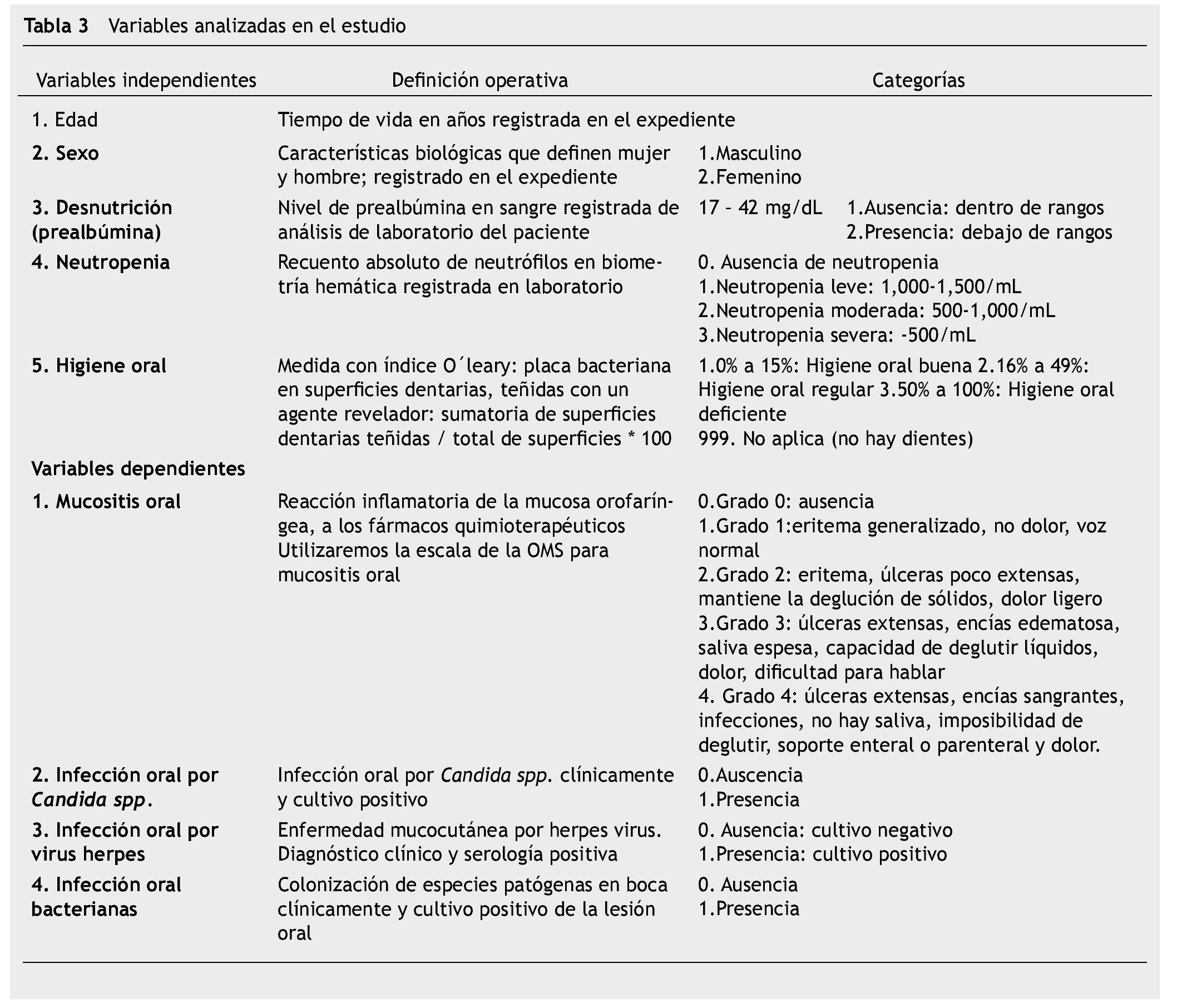
La investigación se rigió bajo el reglamento de la ley general de Salud en Materia de Investigación para la Salud41, Capítulo I, Título II y Artículo 17, Sección II, investigación con riesgo mínimo y, Artículos 21 y 22; de acuerdo al Informe Belmont42, se solicitó consentimiento informado firmado por los padres o tutores y asentimiento informado del paciente mayor de 12 años, se excluyeron a pacientes cuyos padres o tutores o ellos mismos no aceptaran participar en la investigación y pacientes previamente tratados con quimioterapia, se eliminaron a pacientes con falta de seguimiento (más de 4 revisiones), que desarrollaran una condición sistémica que modificara su tratamiento y los que quisieran abandonar la participación en la investigación. Las variables analizadas se presentan en la tabla 3.
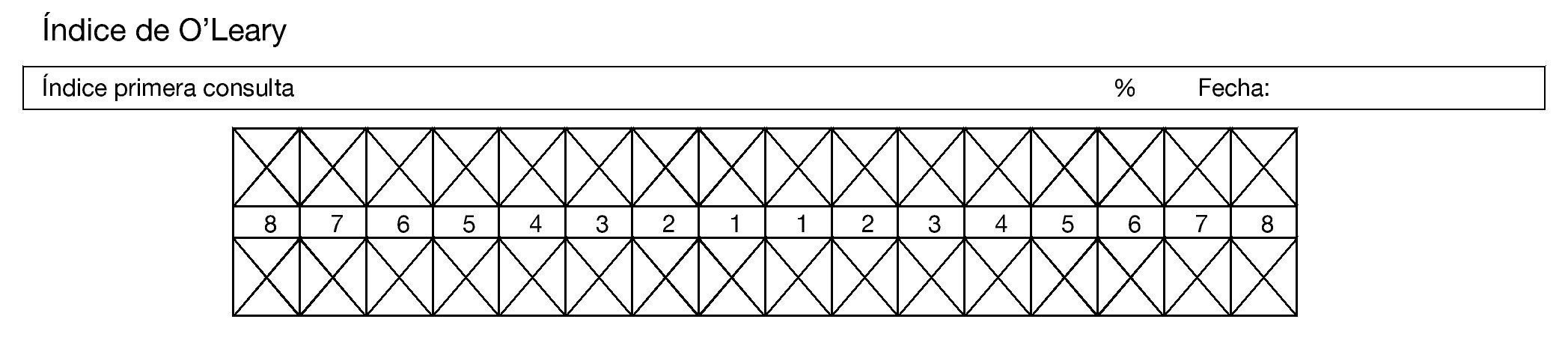
Se realizó una prueba piloto en 13 pacientes con diferentes diagnósticos oncológicos, con la finalidad de probar la logística del método de recolección de datos, estandarización de criterios y tiempos, identificando errores en el procedimiento y la reestructuración de la recolección de datos. Los investigadores se estandarizaron hasta obtener un coeficiente Kappa simple (k) y Kappa ponderado (kp) de 0.61 a 0.80, lo que representa una concordancia aceptable. Posteriormente la investigación se realizó en pacientes pediátricos con LAL, vírgenes a tratamiento quimioterapéutico que ingresaron para tratamiento oncológico, durante marzo de 2012 a marzo de 2013, iniciamos con la revisión del expediente clínico para recabar datos como: edad, sexo, tipo de leucemia, quimioterapia, biometría hemática y prealbúmina, además se realizó examen intra y extraoral en búsqueda de mucositis oral de acuerdo a la escala de la OMS (tabla 2) y presencia o ausencia de infección bucal, una vez por semana por 8 semanas; si presentaba lesión oral, se notificó al Servicio tratante para su atención y se realizó la identificación de higiene oral en base al índice O´leary43 (tabla 3) (fig. 1).
Figura 1 Odontograma para contabilizar superficies dentarias teñidas según índice O´Leary.
El examen bucal se realizó previas barreras de protección física, lámpara de luz artificial y espejo bucal (#5). Los datos se registraron en una base de datos y se analizaron en programa SPSS® versión 18, donde obtuvimos medidas de frecuencia, análisis bivariado con prueba exacta de Fisher y riesgo relativo en cada variable con asociación estadísticamente significativa.
Resultados
Prueba piloto: el 53.8% hombres, media de edad 7.92 ± 5.57 años, rango de 1-17 años. El 46.2% de la muestra tuvo lesión oral (65.05% mujeres), 15.4% presentaba mucositis oral (todas mujeres); el 7.7% presentó infección por Candida, las cuales eran mujeres; el 7.7% presentó infección por herpes virus; el 23.1% de la muestra presentaba infección bacteriana bucal; el 76.9% presentaba higiene oral deficiente. El 69.3% tenía neutropenia (leve, moderada y severa), de éstos el 66.7% tenían neutropenia severa y eran hombres, en cuanto a desnutrición tomando como base el percentil para edad, peso y talla, el 30.7% tenía desnutrición. Los resultados anteriores justificaron la importancia de continuar con la investigación para determinar si un foco infeccioso oral es predisponente para una infección sistémica que incide en la morbimortalidad de estos pacientes y establecer cómo una medida higiénica oral puede disminuir esta incidencia.
Resultados del estudio
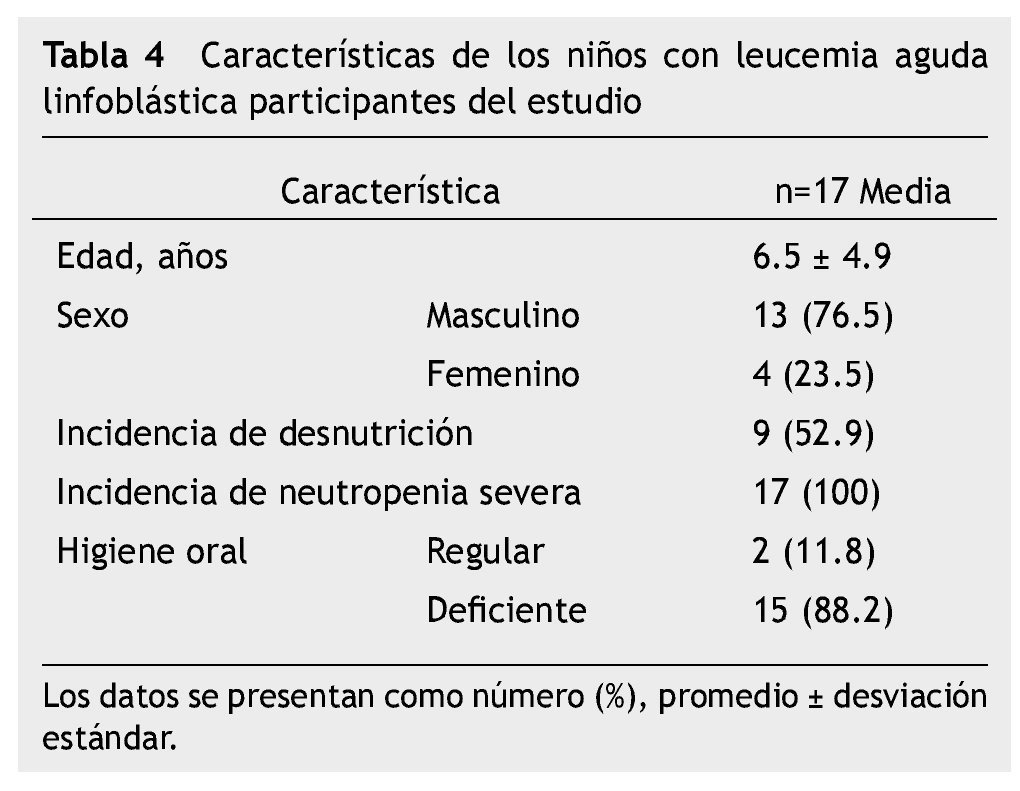
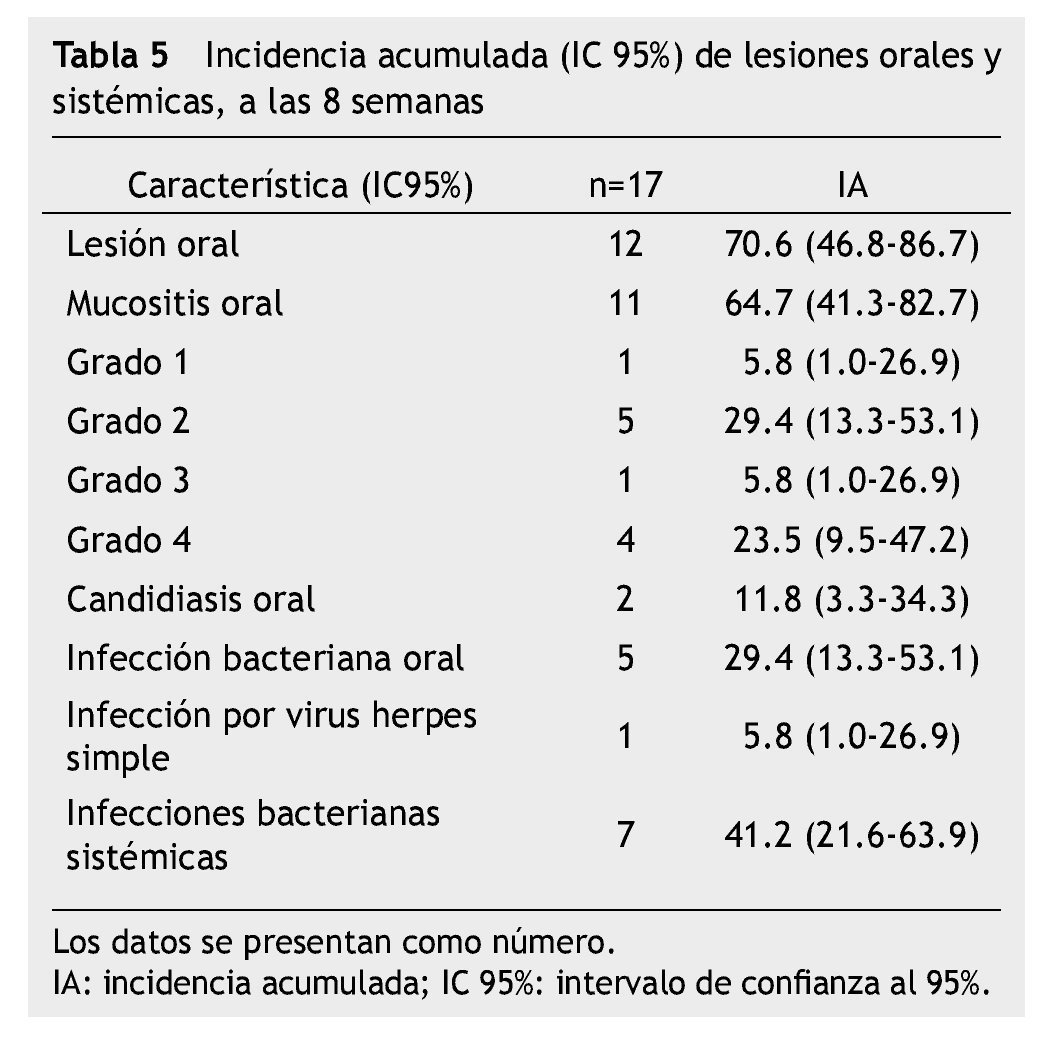
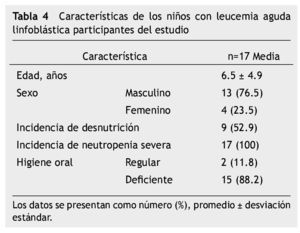
El estudio representa una muestra por conveniencia de 17 niños con LAL en quimioterapia con un periodo de seguimiento de 8 semanas; 15 (88%) en Protocolo San Judas XIIIB y 2 (12%) en BFM 90, 13 (76.5%) hombres, media de edad 6.5 ± 4.9 años (rango de 2-16 años); 12 (70.6%) de los pacientes tuvieron lesión oral, 11 (64.7%) con algún grado de mucositis oral: 5.8% mucositis grado 1, 29.4% grado 2, 5.8% grado 3 y 23.5% grado 4; 5 (29.4%) experimentaron infección bacteriana sobreagregada a mucositis, corroborada con cultivos directos de la lesión oral; se realizaron 24 cultivos, 20 fueron positivos, un KOH para Candida albicans y 19 cultivos de secreciones orales (Escherichia coli con betalactamasas de espectro extendido -BLEE-, Cocos Gram positivos, Enterococcus clocae, Staphylococcus edipermidis, Staphylococcus metalino, Staphylococcus aureus y Bacilos Gram negativos). Análisis descriptivo en la tabla 4.
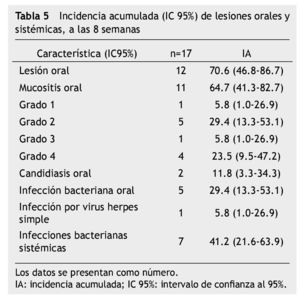
La incidencia de mucositis oral dentro de las primeras 8 semanas de tratamiento fue de 64.7% (11/17) y para mucositis oral grados 3 y 4, que representan los grados más severos fue 29.3% (5/17). Todos los pacientes (100%) tuvieron al menos una vez neutropenia severa (17/17), el 52.9% (9/17) tuvo desnutrición, 88.2% (15/17) higiene oral deficiente (tabla 5).
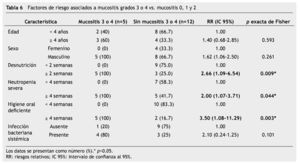
En el análisis bivariado con prueba exacta de Fisher, los factores de riesgo asociados a mucositis oral grado 3 y 4 fueron: desnutrición ≥ 2 semanas (RR=2.66; IC 95%=1.06-2.50; p=0.009), neutropenia severa ≥ 4 semanas (RR=2.00; IC 95%=1.07-3.71; p= 0.044) y una higiene oral deficiente durante ≥ 4 semanas (RR=3.50; IC 95%=1.08-11.29; p=0.003). El riesgo para desarrollar infección bacteriana sistémica asociado a mucositis grado 3 y 4 fue RR=2.10, IC 95%=0.24-1.25, p=0.101, aunque no existió una significancia estadística a través de prueba exacta de Fisher, clínicamente si observamos una tendencia del riesgo para infección sistémica en pacientes con lesiones orales sobreinfectadas, 4 de los 5 pacientes con mucositis oral grado 3 y 4, y sobreinfección oral la presentaron (tabla 6).
Como parte del tratamiento multidisciplinario, los beneficios de los pacientes durante el estudio fueron: examen intra y extraoral en busca de lesiones previas al tratamiento, educación a los padres y pacientes acerca de los cuidados bucales, cada semana durante su seguimiento se les realizó identificación de higiene bucal; a los pacientes con mucositis grado 2, se les informó a los padres acerca de la evaluación de ésta, se les recomendó higiene gentil de boca con cepillo dental de cerdas suaves y dieta blanda libre de irritantes y enjuagues con agua bicarbonatada; al paciente con mucositis grado 3 además se le implementó antibiótico para evitar su evolución y enjuagues con gelclair® y a los pacientes con mucositis grado 4 se les tomó hemocultivos y cultivo directo de cavidad bucal, se les cubrió con antibióticos y se interconsultó a gastroenterología para valorar nutrición enteral o parenteral.
Discusión
Los resultados de la prueba piloto y la muestra demuestran que existe una relación entre el sexo, la neutropenia y la higiene oral para el desarrollo de los grados más severos de mucositis oral; en la prueba piloto las mujeres presentaron mayor número de lesiones orales en comparación con los hombres, a pesar de que los hombres presentaban más neutropenia y más de la mitad tenían higiene oral deficiente. En la muestra de 17 pacientes, el riesgo relativo (RR=2.10) de infección sistémica bacteriana para los pacientes con lesiones orales sobreinfectadas (mucositis grado 3 y 4) nos indica que puede existir una tendencia clínica de riesgo para el desarrollo de infección sistémica a partir de un foco local en estas lesiones orales, aunque estadísticamente no es significativo (p=0.101), debe de ser tomado en cuenta ya que la no significancia estadística por p exacta de Fisher puede deberse al tamaño pequeño de la muestra. El cálculo de riesgos está marcando una tendencia desfavorable (RR=2.1), ya que se observó que en 5 pacientes donde se documentó infección bacteriana bucal corroborada con cultivo positivo de Escherichia coli con BLEE, Cocos Gram positivos, Enterococcus clocae, Staphylococcus edipermidis, Staphylococcus metalino, Staphylococcus aureus y Bacilos Gram negativos respectivamente, desarrollaron datos clínicos de septicemia grave, 3 de estos pacientes con positividad en el hemocultivo para las mismas bacterias y necesidad de atención en la unidad de Terapia Intensiva. Otro paciente con aislamiento de virus herpes en boca, presentó choque séptico sin hemocultivos positivos. Lo anterior sugiere que existe una asociación de riesgo para el desarrollo de bacteriemias a partir de una lesión oral mal abordada, asociación que es necesario seguir investigando para determinar cuáles son los verdaderos riesgos con un número mayor de pacientes, similar a lo reportado por Anirudhan 200833 y Cheng KK 200834, que describen que la neutropenia y el deficiente estado de salud bucodental durante el tratamiento oncológico se asocian con la presencia de mucositis oral en sus grados más severos; más de la mitad de ambas muestras presentaron higiene oral deficiente, lo que también es corroborado en asociación con mucositis oral por Pico et al. 199817; Epstein y Schubert 1999 y Sonis 200036, mencionan que un 20%-50% de las septicemias en los pacientes inmunodeprimidos se originan en boca, agravando el cuadro clínico del paciente, comprometiendo la respuesta inmunológica y aumentando el grado de morbilidad y mortalidad de los pacientes, además de afectar a la calidad de vida y a las repercusiones económicas que conllevan. La edad de los pacientes parece también estar jugando un papel muy importante para el desarrollo de complicaciones en nuestros pacientes ya que los 5 pacientes que desarrollaron un estado grave con lesión oral sobreinfectada tenían un promedio de 2.2 años de edad, con respecto a lo anterior, Figliolia et al. 200836, reportó que la mayoría de los pacientes con mucositis oral tenían edades entre los 2 y 5 años, coincidiendo con otros autores como Pico et al. 199817, donde observaron complicaciones odontológicas más frecuentes en niños menores de 12 años.
Conclusión
La mucositis oral es la lesión más frecuente posterior a la quimioterapia y no sólo representa una simple o sencilla lesión local, sino una serie de circunstancias con potencial de desarrollo para eventos infecciosos sistémicos, nutricionales, psicosociales entre otros, que pueden desencadenar una serie de factores que incluyen a la desnutrición, cambio del curso de la terapia oncológica o la interrupción de ésta, según la severidad de la misma y el riesgo de mortalidad de estos pacientes por una carga de virus, hongos o bacterias a partir de un foco infeccioso aparentemente "local" desarrollado en la cavidad oral. Aunque actualmente las investigaciones de factores de riesgos son a nivel de biología molecular y genética para determinar la evolución clínica del tratamiento en los niños con cáncer, un aspecto que en muchas ocasiones está descuidado por su aparente e inofensiva importancia, es el desarrollo de mucositis oral con focos de infección sobreagregada secundaria al efecto citotóxico de la quimioterapia, que sin una detección temprana y cuidado específico y oportuno, pueden llegar a ser verdaderos eventos catastróficos. Actualmente, la literatura internacional ha resaltado la importancia de evaluar factores de riesgo para mucositis oral en niños y adolescentes, ya que la tasa de mitosis epitelial es más rápida y con más receptores del factor de crecimiento epidérmico en el epitelio, observando que la severidad de la mucositis ha sido mayor para este grupo de edad. El impacto que puede tener este estudio puede brindar una mejor perspectiva acerca de los factores de riesgo para el desarrollo de lesiones orales y de los eventos sistémicos desarrollados a partir de éstas, en niños con LAL en quimioterapia y así posteriormente sustentar un programa preventivo y de atención a través de una guía de práctica clínica desarrollada para este tipo de pacientes a partir de los presentes hallazgos, ya que la integridad de la mucosa oral para el éxito de la quimioterapia sin lugar a dudas, constituye un pilar muy importante.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Financiamiento
Los autores no recibieron patrocinio para llevar a cabo este artículo.
Agradecimientos
Al Instituto Nacional de Pediatría y al Programa de Maestría y Doctorado en Ciencias Medicas, Odontológicas y de la Salud de la universidad Nacional Autónoma de México.
* Autor para correspondencia:
Servicio de Oncología,
Instituto Nacional de Pediatría, S.S.
Insurgentes Sur N° 3700-C, Insurgentes Cuicuilco,
Delegación Coyoacán,
C.P. 04530, México D.F., México.
Teléfono: (55) 1084 0900, ext. 1312 y 1339.
Correo electrónico: aracastol@hotmail.com (Araceli Castellanos-Toledo).