Introducción: PTP1B participa en la regulación de diversas vías de señalización y en patologías de origen metabólico y cáncer. En los últimos años, se ha demostrado que participa en la tumorogénesis del cáncer de mama. Recientemente, nuestro grupo de investigación demostró que PTP1B regula la expresión de HER2 de manera independiente de la amplificación génica. Sin embargo, se desconoce cómo la expresión de PTP1B afecta la susceptibilidad a fármacos de quimioterapia, en particular los taxanos, los cuales son ampliamente utilizados en el tratamiento del cáncer de mama. Por esta razón, evaluamos el papel de la expresión de PTP1B en la respuesta al tratamiento con paclitaxel y docetaxel.
Material y métodos: utilizamos cultivos primarios de cáncer de mama con expresión positiva y negativa para PTP1B. Se realizaron ensayos de citotoxicidad mediante la técnica de cristal violeta.
Resultados: la expresión de PTP1B correlaciona con una mayor resistencia a paclitaxel, mientras que el tratamiento con docetaxel indujo una mayor susceptibilidad.
Conclusiones: Nuestros resultados en su conjunto sugieren que la expresión de PTP1B tiene un papel predictivo en la respuesta a taxanos en cultivos primarios de cáncer de mama. Por lo tanto, determinar la expresión de PTP1B en pacientes con cáncer de mama puede ser crucial para elegir el tratamiento.
Introduction: PTP1B participates in the regulation of several signaling pathways and pathologies of metabolic origin and cancer. In the last years, it has been shown that participates in the tumorogenesis of breast cancer. Recently, our investigation group that PTP1B up regulates HER2 in an independent manner of HER2 amplification. However, it is not understood how PTP1B affect the effect of chemotherapy agents, such as taxanes. These drugs are widely used in breast cancer treatment. For this reason, we evaluated the effect of PTP1B in the response to paclitaxel and docetaxel in breast cancer cells.
Material and methods: We used primary breast cancer cells with or without expression of PTP1B. We performed citotoxicity assays by crystal violet.
Results: The expression of PTP1B correlated with resistance to paclitaxel, and sensitivity to docetaxel.
Conclusions: Overall our data suggest that the expression of PTP1B has a predictive role in the response to taxanes in breast cancer patients and might be crucial to choose taxane treatment.
Introducción
El cáncer constituye un problema de salud pública a nivel mundial, la Organización Mundial de la Salud (OMS) en 2008 estimó una incidencia de más de 12 millones, y 7.5 millones de muertes por esta causa. El cáncer de mama es el más frecuente en mujeres con 22.9% de nuevos casos (13.8 millones), y también la primera causa de muerte por cáncer en población femenina con 13.7% (458,000)1. En 2009, el cáncer de mama fue el más frecuente en mujeres estadounidenses con 29% de los casos y el segundo con mayor mortalidad (14%), superado sólo por el cáncer de pulmón. La tasa de incidencia de los 4 principales tipos de cáncer se encuentra en decremento, excepto para cáncer de mama que se muestra estable desde 20052. En mujeres mexicanas es el primer lugar en incidencia (21% de los casos) y mortalidad por cáncer (10%)1.
El tamaño tumoral y la existencia de metástasis axilares ganglionares son considerados los principales factores con valor pronóstico. El análisis de un extenso número de casos ha determinado que la sola presencia de ganglios axilares positivos disminuye la supervivencia global en 40% a 5 años (de 94% hasta 54%). De acuerdo a la clasificación histopatológica del cáncer de mama el subtipo clínico más agresivo es el ductal infiltrante y se diferencia de otros menos agresivos como el medular, mucinoso y papilar3. La expresión de receptores de estrógeno y progesterona son marcadores con un valor predictivo y pronóstico, en base a su expresión resulta factible escoger terapias hormonales como tratamientos únicos o concomitantes4. Otro marcador relevante, es la expresión del receptor HER25, su determinación permite seleccionar el 20% de los casos que se benefician de tratamiento con terapia blanco con trastuzumab, lapatinib o pertuzumab6-9. Existen otros marcadores pronósticos, como p53 y la densidad microvascular tumoral; sin embargo, su validación y uso clínico han sido limitados por costos, practicidad y poca reproducibilidad10,11.
Los fármacos antineoplásicos son diversos en su origen y mecanismo de acción, desde los agentes alquilantes como la ciclofosfamida y los derivados del platino, por otro lado los antimetabolitos como 5-fluorouracilo, pemetrexed y gemcitabina, y los que tienen como blanco componentes del citoesqueleto, como son los fármacos que actúan sobre microtúbulos. Los microtúbulos son proteínas que participan en procesos biológicos como la proliferación, la adhesión y la motilidad celular, así como transporte interno de organelos, vesículas y proteínas, todo esto mediante eventos de polimerización y despolimerización de las subunidades de tubulina12,13. Existen fármacos que actúan sobre la dinámica de los microtúbulos como colchicina, utilizada para tratar pacientes con gota14. Otros fármacos que interfieren con los microtúbulos son los alcaloides de la vinca, que se han usado para el tratamiento de diversas neoplasias, en particular cáncer de mama. Su acción sobre los microtúbulos es inhibir la polimerización de la tubulina, lo que les confiere actividad antimitótica. Por otra parte, los taxanos se unen a la tubulina polimerizada y la mantienen estabilizada, evitando la despolimerización de sus subunidades, provocando arresto celular en la fase g2/M12. En las últimas décadas, los taxanos, en particular el paclitaxel, han sido ampliamente utilizados en el tratamiento del cáncer de mama tanto localizado como avanzado, incrementando la supervivencia global y supervivencia libre de recurrencia en aproximadamente 5% de beneficio absoluto13,15. El mecanismo de resistencia mejor identificado a los agentes que unen tubulina es la expresión de la bomba de expulsión multidrogas, llamada Pgp, codificada por el gen mdr1. Otros mecanismos menos estudiados involucran formas mutantes de b-tubulina, proteínas asociadas a microtúbulos (MAP, del inglés Microtubule-Associated Proteins) y expresiones alteradas de p53, Bcl-2 y Bcl-x12-14.
En el tratamiento farmacológico del cáncer de mama, además de los fármacos citotóxicos, se han propuesto medicamentos que tienen como blanco algunas vías de señalización dependientes de la fosforilación en residuos de tirosina, como es el trastuzumab y lapatinib que inhiben al receptor HER25. La fosforilación de proteínas en residuos de tirosina es una de las modificaciones postraduccionales más importantes utilizadas por las células para regular respuestas biológicas como proliferación, diferenciación, migración y muerte celular. El nivel de fosforilación en residuos de tirosina en una célula depende de la acción equilibrada de 2 tipos de enzimas, las proteínas tirosinas cinasas (PTK, por sus siglas en inglés Protein Tyrosine Kinase) y las proteínas fosfatasas de tirosina (PTP, por sus siglas en inglés Protein Tyrosine Phosphatase). Las primeras se encargan de agregar grupos fosfato a residuos de tirosina específicos en la proteína sustrato, promoviendo cambios conformacionales que modifican la interacción con otras proteínas16. Las PTP son una familia estructuralmente diversa, altamente regulada y que puede tener efectos estimulatorios o inhibitorios17. En el genoma humano se han identificado un total de 107 PTPs18. Las PTP´s clásicas que tienen una secuencia consenso (VHCSA-GxGR(T-S)G) y se dividen en tipo receptor y no receptor19. El dominio catalítico de las PTP´s contiene 280 aminoácidos, entre ellos un residuo de cisteína conservado necesario para la actividad catalítica19. Las PTP´s remueven los residuos fosfato mediante un mecanismo de 2 pasos: primero, la formación de un enlace covalente de fosfato-PTP; y segundo, la hidrólisis de la unión fosfato-proteína sustrato17. Inicialmente, se pensó que las PTP´s tenían un papel como supresor tumoral ligado a la regulación negativa de la actividad oncogénica de las PTK. La alteración en el balance de estas enzimas provoca niveles de fosforilación aberrantes asociados a diversas enfermedades, entre ellas cáncer17.
PTP1B (PTPN1) y TC-PTP (PTPN2) fueron las primeras PTP en ser identificadas20. PTP1B pesa 50kD, está formada por un dominio catalítico de 37kD hacia su extremo N-terminal flanqueado por ambos lados por dominios ricos en prolina, y un dominio C-terminal con una secuencia de localización al retículo endoplásmico (RE)21. La especificidad de PTP1B se encuentra regulada estrechamente por su acceso a los sustratos, lo cual está en relación a la localización22. Existen otros 4 mecanismos que regulan la actividad de PTP1B: oxidación, fosforilación, sumoilación y proteólisis23. Estudios previos han demostrado que PTP1B juega un papel importante en la señalización de vías metabólicas, ya que participa en la regulación negativa de la señalización de los receptores de insulina y leptina, lo que sugiere se encuentra involucrado en patologías como diabetes mellitus y obesidad. Actualmente, se le considera como un potencial blanco terapéutico de estas enfermedades24-26. PTP1B también puede inhibir la señalización de receptores con actividad de tirosina cinasa (RTK´s) como los receptores del Factor de Crecimiento Derivado de Plaquetas (PDGF) y del Factor de Crecimiento de Hepatocitos (HGF)27. Su sobreexpresión en fibroblastos inhibe la transformación por oncogenes en los que se incluyen HER2, Src, Bcr-Acl, Crk y Ras28,29. PTP1B también es requerida para la activación de las GTPasas de Rac y Ras (enzimas asociadas con incremento de proliferación y motilidad celulares)29, también puede activar a Src mediante desfosforilación de la tirosina 527 (Y527)30. El gen que codifica PTP1B se encuentra localizado en el cromosoma 20 en la región q13.1-q13.231. Se ha demostrado que la ganancia o amplificación de esta región se asocia a un pobre pronóstico en cáncer de mama32. Estudios realizados en modelos murinos que sobreexpresan HER2 demostraron que la deleción de PTP1B retrasa el desarrollo de tumores mamarios y disminuye la posibilidad de desarrollar metástasis pulmonares33,34. Recientemente, se analizó la expresión de PTP1B en 1,402 muestras de pacientes con cáncer de mama y se encontró que el 49% de las muestras estudiadas fueron positivas para PTP1B. Se reportó una asociación positiva de la expresión de PTP1B y la expresión de receptores de Estrógeno (RE) (50.7% vs. 43.1%), así como asociación con los subtipos moleculares: luminal B con expresión HER2 (53.9%) y basaloide (37.9%). El análisis no encontró asociación con la expresión de HER2 estadísticamente significativa. Interesantemente, la expresión de PTP1B se asoció a una mejor supervivencia global de las pacientes de manera independiente (HR=0.779)35. Por otra parte, en estudios previos de nuestro laboratorio se encontró que la sobreexpresión de PTP1B en cultivos primarios de cáncer de mama induce un incremento en la expresión de HER2 de manera independiente de la transcripción del gen HER2/neu36. También se demostró que la sobreexpresión de la fosfatasa induce un fenotipo celular más agresivo con incremento en proliferación y migración celular36.
Todos estos antecedentes sugieren que PTP1B participa en la oncogénesis del cáncer de mama. Sin embargo, desconocemos si la expresión de PTP1B afecta la sensibilidad a fármacos de quimioterapia en células de cáncer de mama. El objetivo de este estudio es determinar si la expresión de PTP1B en cultivos primarios de cáncer de mama modifica la respuesta al tratamiento con taxanos (paclitaxel y docetaxel). Encontramos que la expresión de PTP1B afecta de forma inversa la sensibilidad a estos 2 taxanos. Consideramos que la expresión de PTP1B puede tener un valor predictivo de la respuesta a taxanos en células de cáncer de mama. De corroborarse esta hipótesis, los resultados podrían influir en la elección de los agentes de quimioterapia.
Material y métodos
Cultivo de células de cáncer de glándula mamaria
Los cultivos celulares primarios de cáncer de mama fueron generados previamente en el laboratorio a partir de explantes obtenidos de tejidos de pacientes tratados con mastectomía radical (protocolo aprobado por el Comité de Ética del Instituto Nacional de Ciencias Médicas y Nutrición "Salvador Zubirán", referencia 159). Los cultivos son mantenidos en RPMI-1640 (Gibco, Invitrogen, Life Technologies, Carlsbad, California, USA) suplementado con 10% de Suero Fetal Bovino (SFB) (HyClone, Thermo, Utah, USA) al 10% e incubadas a 37oC con atmósfera de 5% Co2.
Ensayos de citotoxicidad
Las células fueron sembradas a una densidad de 10,000 células/cm2 en placas de 48 pozos (Corning, NY, USA), en medio de cultivo RPMI-1640 (Gibco, Invitrogen, Life Technologies, Carlsbad, California, USA) suplementado con SFB 10% (HyClone, Thermo, Utah, USA), se dejaron adherir a la placa. Se aplicaron concentraciones crecientes de los fármacos paclitaxel (Intas Pharmaceuticals Limited, Gujarat, India), o docetaxel (Sanofi Aventis, París, Francia), se incubaron durante 48 horas más. Se fijaron las células con glutaraldehído al 1.1% en PBS, durante 20 minutos en agitación. Se retiró el glutaraldehído y se tiñó con cristal violeta (0.1%) en agitación por 20 minutos. Se lavaron las placas en agua y se dejaron secar. El cristal violeta se solubilizó en 400 ml/ pozo de ácido acético 10% en agitación por 20 minutos. Se leyó la absorbancia de la solución a 595 nm en un espectrofotómetro de microplaca (Opsys Mr, Dynex Technologies, Chantilly, VA, EUA). Los valores están expresados como el porcentaje de viabilidad celular con respecto al control no tratado, en un experimento representativo sembrado por triplicado.
Ensayo de Western Blot
Las células se lisaron en un buffer que contiene 50 mM HEPES (pH 7.4), 250 mM NaCl, 5 mM EDTA, 0.1% Nonidato P-40, 10 mM NaF, 50 mM b-glicerofosfato de sodio, 1 mM vanadato de sodio y mezcla de inhibidores de proteasa (Complete, EDTA free, Roche). La cuantificación de proteína se realizó mediante técnica de Bradford, la densidad óptica se midió a 595 nm en especofotómetro (DU-65, Beckman Coulter, Pasadena, California, EUA). Se corrieron 20 mg de proteína en gel de policramida desnaturalizante al 9%. Posteriormente, se transfirió a una membrana Inmobilon-P PVDF (Millipore Corp Bedford, MA). La membrana se bloqueó durante una hora con leche al 5% en PBS tween. Después se colocó en anticuerpo primario anti-myc, anti-HER2 y anti-tubulina (Santa Cruz Biotechnology, CA, EUA) durante la noche a 4oC, en agitación continua. Se lavó con PBS tween y después se incubó con el anticuerpo secundario marcado con HrP. La señal fue visualizada mediante reacción de quimioluminiscencia con Super Signal (Thermo Fisher Scientific Inc., EUA) y captada por autoradiografía (Kodak, rochester, NY, EUA).
Resultados
La expresión endógena de PTP1B en cultivos primarios de cáncer de mama induce resistencia a paclitaxel
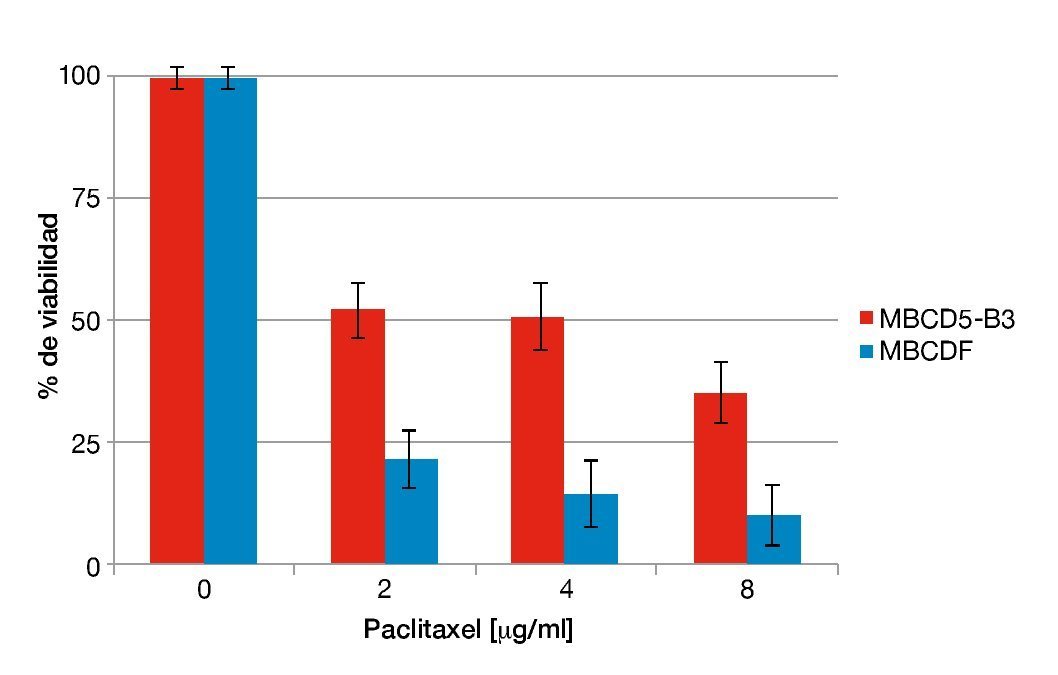
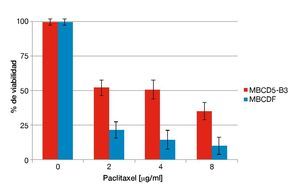
En estudios recientes en nuestro laboratorio se encontró que la sobreexpresión de PTP1B incrementa la expresión de HER2 de manera independiente a la transcripción en cultivos primarios de cáncer de mama. Además, se comprobó que dicho incremento en la expresión de HER2 confiere a las células un fenotipo más agresivo reflejado como una mayor capacidad de migración y proliferación36. Para analizar cómo este fenotipo afecta la sensibilidad a fármacos de quimioterapia (paclitaxel), se seleccionaron cultivos primarios previamente caracterizados para la expresión de PTP1B (López-Zelada KA et al., datos no publicados). Se realizaron ensayos de citotoxicidad en los cultivos MBCD5-B3 y MBCDF, positivo y negativo para PTP1B, respectivamente en los que se adicionaron concentraciones crecientes de paclitaxel y fueron incubadas por 48 horas. Los resultados mostraron que el cultivo MBCD5-B3, positivo para PTP1B, presenta una mayor resistencia a paclitaxel en las 3 concentraciones probadas: 2, 4 y 8. En contraste, el cultivo MBCDF, negativo para PTP1B muestran una mayor susceptibilidad a este fármaco (fig. 1). Estos resultados sugieren que la expresión endógena de PTP1B en cultivos primarios de cáncer de mama induce resistencia a paclitaxel.
Figura 1 Susceptibilidad a paclitaxel respecto a la expresión endógena de PTP1B.
Se sembraron 10,000 cel/cm2. Se adicionó paclitaxel a dosis de 2, 4 y 8 mg/ml. Se evaluó a viabilidad por la técnica de cristal violeta 48 horas después de adicionado el fármaco. Los resultados son expresados como el porcentaje del promedio de la OD570 de las células no tratadas contra las células tratadas.
La expresión endógena de PTP1B induce mayor susceptibilidad a docetaxel en cultivos primarios de cáncer de mama
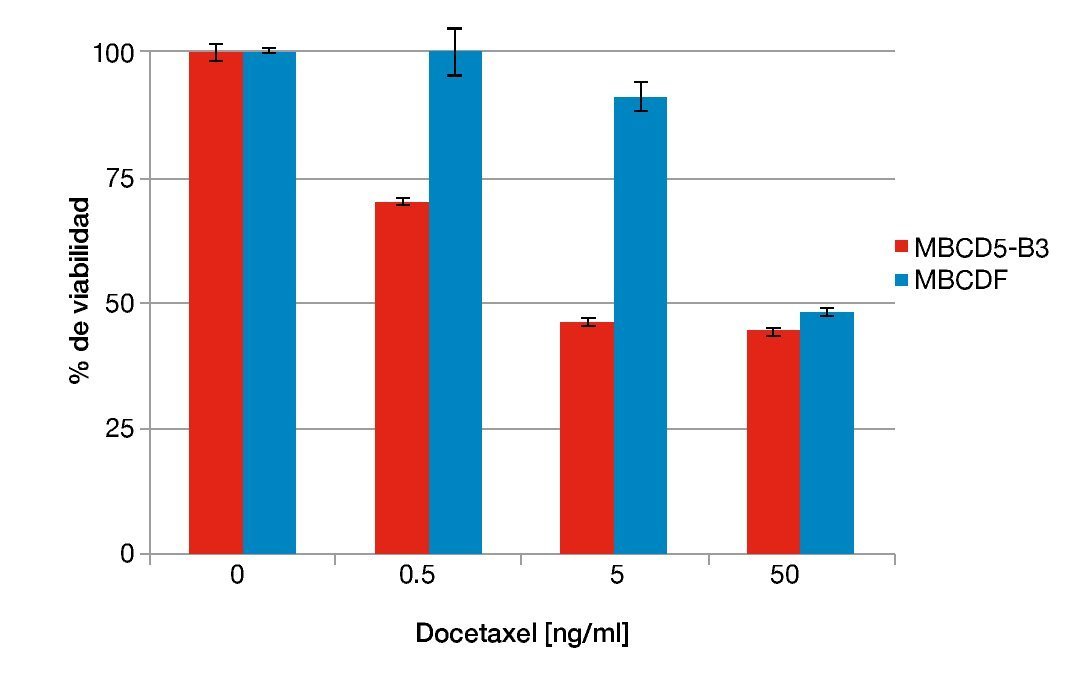
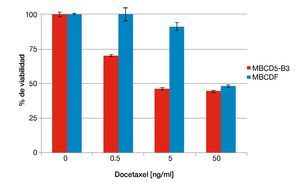
Otro de los taxanos con mayor relevancia clínica en el tratamiento de cáncer de mama además de paclitaxel, es el docetaxel. En el experimento descrito arriba, la expresión de PTP1B induce resistencia a paclitaxel. Con la finalidad de analizar el papel de PTP1B en la susceptibilidad a otros taxanos realizamos ensayos de citotoxicidad similares a los descritos anteriormente adicionando en este caso concentraciones crecientes de docetaxel. Nuevamente, utilizamos el cultivo primario con expresión endógena de PTP1B MBCD5-B3, comparado con un cultivo deficiente de ella, MBCDF. El cultivo primario con expresión endógena de PTP1B resultó ser más susceptible a docetaxel que el cultivo negativo para la fosfatasa (fig. 2). Nuestros resultados sugieren que las células de cáncer de mama positivas para PTP1B presentan una mayor susceptibilidad a docetaxel. Los cultivos primarios MBCD5-B3 y MBCDF fueron sembrados a 10,000 cél/cm2 y se adicionaron 0.5, 5 y 50 ng/ml de docetaxel. Se evaluó viabilidad a las 48 horas por técnica de cristal violeta.
Figura 2 Susceptibilidad a docetaxel respecto a la expresión endógena de PTP1B.
Discusión
En los últimos años se ha reportado que PTP1B juega un papel importante en el cáncer de mama. Estudios con modelos murinos que sobreexpresan HER2, encontraron que la deleción de PTP1B retrasa la aparición de tumores y metástasis pulmonares33,34. Por otra parte, se ha sugerido que la expresión de PTP1B es necesaria para la implantación de tumores mamarios, pero no es necesaria para su mantenimiento37. En nuestro laboratorio habíamos demostrado previamente que PTP1B juega un papel importante en la regulación de HER2 y que se asocia a un fenotipo más agresivo, con mayor capacidad de proliferación y migración celular36 (López-Zelada KA et al., datos no publicados). En el presente trabajo estudiamos el efecto de PTP1B sobre la sensibilidad a los taxanos, paclitaxel y docetaxel. Nuestros resultados muestran que la expresión de esta fosfatasa correlaciona con sensibilidad opuesta a los 2 taxanos utilizados. Es decir, células positivas para PTP1B presentan resistencia a paclitaxel; mientras que para docetaxel son sensibles. Estos resultados sugieren que la presencia de PTP1B condiciona a una respuesta antagónica a estos 2 taxanos. Es interesante hacer notar que aunque en la actualidad se usan de manera indistinta en el tratamiento del cáncer de mama, estos resultados sugieren que la presencia de PTP1B puede ser un factor predictor de respuesta a estos 2 fármacos y que su determinación al inicio del tratamiento puede ser crucial para elegir que tipo de taxano asignar a las pacientes con este tipo de cáncer.
Aunque paclitaxel y docetaxel ejercen su acción mediante la estabilización de microtúbulos38, desconocemos cuál es el mecanismo molecular por el que las células primarias de cáncer de mama positivas para PTP1B responden de manera opuesta al efecto citotóxico de estos taxanos. Sin embargo, han sido observadas diferencias entre ambos taxanos que pueden explicar este fenómeno, docetaxel ha mostrado mayor afinidad por los microtúbulos y mayor inducción de la fosforilación de Bcl-2 comparado con paclitaxel. Se sabe que docetaxel y paclitaxel son hidrolizados por distintas formas de citocromo P450 a nivel hepático; y se han observado mejores respuestas in vivo con docetaxel que con paclitaxel sobre células de cáncer de pulmón y próstata, no así en cáncer de mama39,40. Estas diferencias pueden explicar los resultados entre docetaxel y paclitaxel obtenidos en este trabajo.
La expresión alterada de bIII-tubulina, se ha relacionado a resistencia a paclitaxel38, en tanto que en estudios con líneas celulares de cáncer de próstata, docetaxel ha mostrado capacidad para disminuir los niveles de expresión de dicha isoforma39. Estudios sobre la localización intracelular de fosfatasas indican que PRL-1, y probablemente PTP1B, se encuentran en distinta localización durante las fases del ciclo celular; en la fase G0 se localizan cerca del RE, mientras que durante la mitosis se encuentran asociadas con el huso mitótico y sus tubulinas41. Esta localización podría promover la interacción directa de PTP1B y las moléculas de taxanos40. Asimismo, es muy probable que docetaxel y paclitaxel muestren una distinta afinidad por las distintas isoformas de tubulinas, mismas que podrían verse afectadas por la expresión de PTP1B. Para dilucidar estos mecanismos se requieren más estudios que evalúen la interacción entre fosfatasas y microtúbulos.
Recientemente, se ha demostrado que 49% de las pacientes con cáncer mama expresan PTP1B35. Estos datos sugieren que esta fosfatasa juega un papel importante en esta patología y que son necesarios más estudios que aborden el papel de PTP1B en diferentes aspectos del cáncer de mama, como es el efecto que puede tener sobre la sensibilidad o resistencia a fármacos de quimioterapia. Por ejemplo, los taxanos se encuentran dentro de las mejores opciones disponibles para el tratamiento adyuvante, neoadyuvante e incluso paliativo de las pacientes con cáncer de mama. Los resultados de este trabajo demuestran que la presencia de PTP1B en tumores mamarios confiere diferente sensibilidad a paclitaxel y docetaxel in vitro, lo cual nos permite proponer a PTP1B como un marcador predictivo de respuesta a taxanos. Es importante corroborar los resultados de nuestro estudio con ensayos clínicos donde se correlacione la respuesta a estos fármacos con la expresión de PTP1B, lo que permitiría seleccionar a un grupo de pacientes que se benecifie de una mejor elección de tratamiento de acuerdo a la presencia o no de PTP1B.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Financiamiento
Este trabajo fue apoyado por CONACyT 102825.
* Autor para correspondencia:
Vasco de Quiroga N° 15,
Sección XVI, Delegación Tlalpan,
C.P. 14000, México D.F., México.
Teléfono: +52 (55) 5487 0900, ext. 2606, 4481. Fax: 5485 3741.
Correo electrónico: mibarra@correo.biomedicas.unam.mx (María de Jesús Ibarra-Sánchez).