INTRODUCCIÓN
Con base en evidencias experimentales y epidemiológicas, se ha establecido la hipótesis según la cual los estrógenos incrementan el riesgo de padecer cáncer mamario. Los niveles séricos elevados de estrógeno endógeno, en particular de estradiol (E2), se vinculan con este riesgo.1-5 En las mujeres, el estradiol proviene de fuentes diferentes antes y después de la menopausia. En mujeres premenopáusicas, el ovario o membrana granulosa de folículos dominantes es la fuente principal de los estrógenos circulantes; después de la menopausia, los estrógenos se producen sobre todo por la conversión de los andrógenos de origen suprarrenal y ovárico, especialmente en la zona reticular de la corteza suprarrenal. Frecuentemente la conversión de andrógeno a estrona ocurre en tejidos periféricos, incluidos piel, músculo, grasa y hueso. El complejo de enzima aromatasa cataliza esta conversión. La aromatasa intratumoral desempeña una función importante en la conversión in situ de los andrógenos séricos a estrógenos y sirve como una fuente de estrógenos, en particular en la mujer posmenopáusica con cáncer mamario.6
POLIMORFISMO DE AROMATASA
La exposición acumulada a los estrógenos circulantes se considera de gran importancia como factor etiológico del cáncer mamario. Los estrógenos intervienen en el desarrollo y el crecimiento de los tumores de mama. Alrededor de 75% de las pacientes posmenopáusicas con cáncer de mama tiene carcinomas dependientes de estrógeno.7 Uno de los genes que participan es el de la aromatasa, el denominado CYP19, que contiene 10 exones y se localiza en el cromosoma 15q21. La enzima aromatasa tiene la capacidad de metabolizar los andrógenos precursores de estrógenos androstenediona, testosterona y dehidroepiandrostenediona para formar estrona, estradiol y estriol.
El gen CYP19 contiene un número variable de repeticiones TTTA (7 a 13) en el intrón 4 dentro de la región de codificación. Algunos estudios9-15 han revisado el posible papel del polimorfismo (TTTA)n del gen CYP19 de la aromatasa en el cáncer de mama y han registrado un incremento del riesgo cuando las pacientes presentan 10 o más repeticiones alélicas de (TTTA)n.
Sin embargo, no se ha estudiado en las mujeres mexicanas con carcinoma mamario la frecuencia de este polimorfismo; en el presente estudio se describe su distribución y se analiza a un grupo de mujeres sanas para comparar las frecuencias.
SUJETOS Y MÉTODOS
Se realizó un estudio descriptivo, comparativo y transversal en el servicio de oncológica de la Unidad Médica de Alta Especialidad No. 1 Bajío, IMSS. Se incluyó a 180 mujeres sanas que acudieron como acompañantes al servicio de oncología y 70 mujeres con diagnóstico de cáncer invasor, fuera ductal o lobulillar, de cualquier grado de malignidad de acuerdo con la escala SBR, y cualquier etapa clínica. Se excluyeron los casos en los que no se logró determinar las variantes del genotipo de la enzima aromatasa. Las pacientes recibieron una explicación acerca del estudio y con posterioridad se les solicitó un consentimiento informado. El estudio se efectuó de acuerdo con los principios éticos para las investigaciones médicas en seres humanos basados en la Declaración de Helsinki de la Asociación Médica Mundial. Obtuvo la aprobación del comité de ética de la UMAE No.1 Bajío, IMSS.
DETERMINACIÓN DEL POLIMORFISMO DEL GEN cyP19
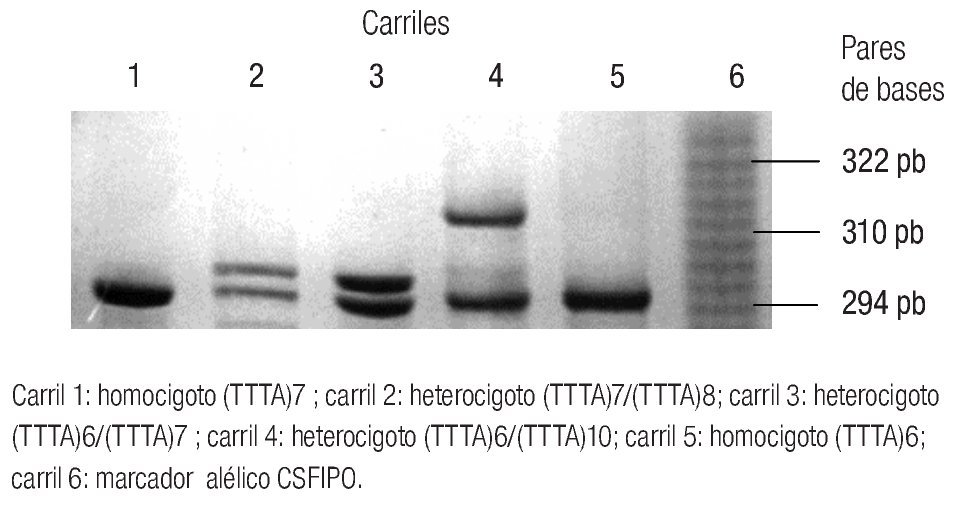
Se tomó una muestra de sangre periférica y se realizó la extracción del ADN genómico de leucocitos por procedimiento de fenol-cloroformo. La reacción en cadena de la polimerasa se llevó acabo con la adición de 80 ng de ADN genómico con 100 pmol de cada uno de los iniciadores 5'-GCAGGTACTTAGTTAGCTAC-3' y 5'-TTACAGTGAGCCAAGGTGCT-3', 200 mmol de dNTP, 2 mmol/L, MgCl2 2UdS de la enzima Taq DNA polimerasa. La amplificación del DNA se realizó de acuerdo con el siguiente programa: ciclo de desnaturalización a 94°C por 1.4 min, desnaturalización a 94°C por 1 min y alineación a 60°C por 1 min en 30 ciclos, con etapa final de extensión a 72°C por 10 min.
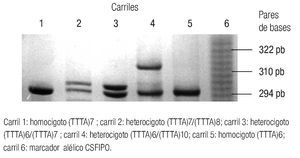
El producto de la PCR se corrió en un gel de poliacrilamida al 6% con 7.6 mol/L de urea por 3 h a 30 vatios. Se utilizó bromuro de etidio para revelar los genotipos del gel de poliacrilamida (Imagen 1).
Imagen 1. Gel de poliacrilamida al 10% con 7M de urea.
ANÁLISIS ESTADÍSTICO
Las características de las pacientes se analizaron con estadística descriptiva. Se utilizó media o mediana y desviación estándar para las variables clínicas y moleculares. También se analizaron relaciones entre el número de repeticiones y la presencia de cáncer mamario.
RESULTADOS
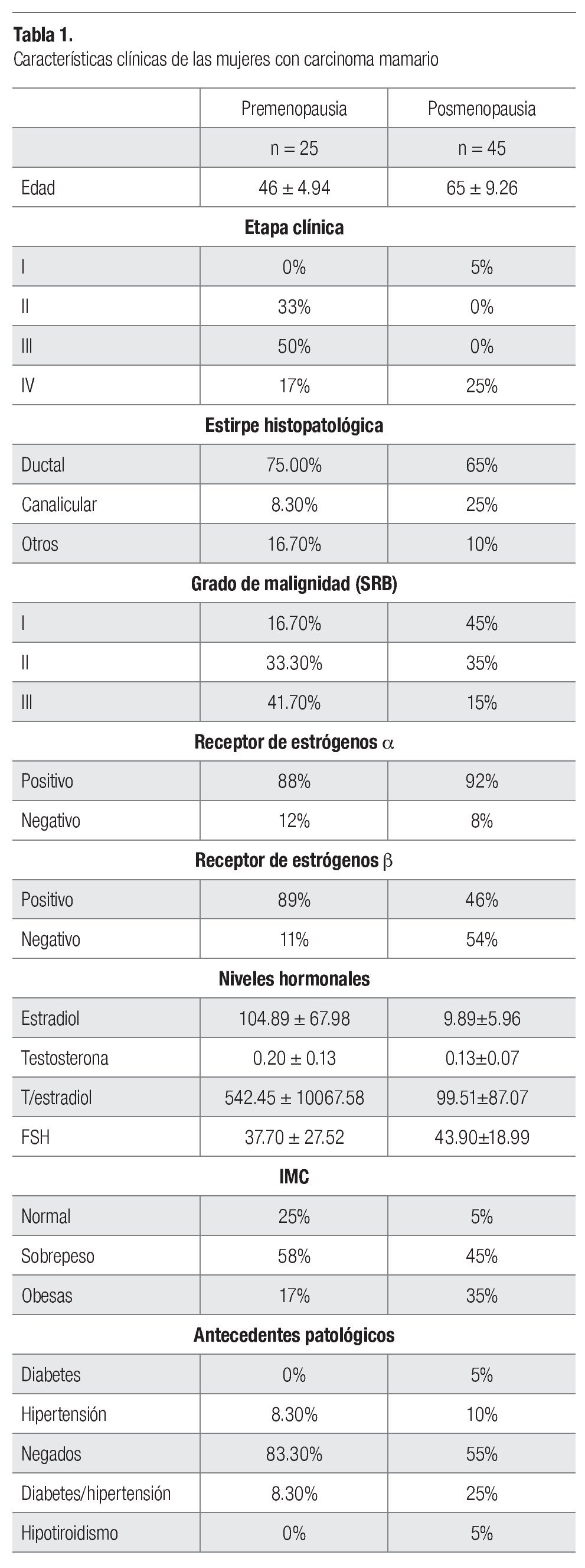
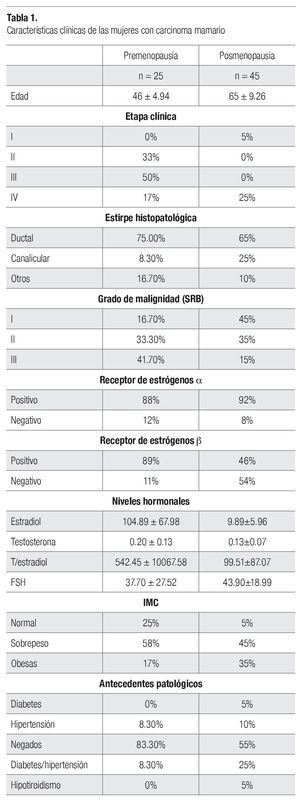
Se estudió a un total de 250 mujeres para conocer el número de repeticiones, 180 mujeres sanas y 70 con diagnóstico de carcinoma mamario; el promedio etario fue de 55 ± 12 años y el IMC fue de 30 ± 7.1 kg/m2. En la Tabla1 se observan las variables clínicas del grupo de mujeres con carcinoma mamario.
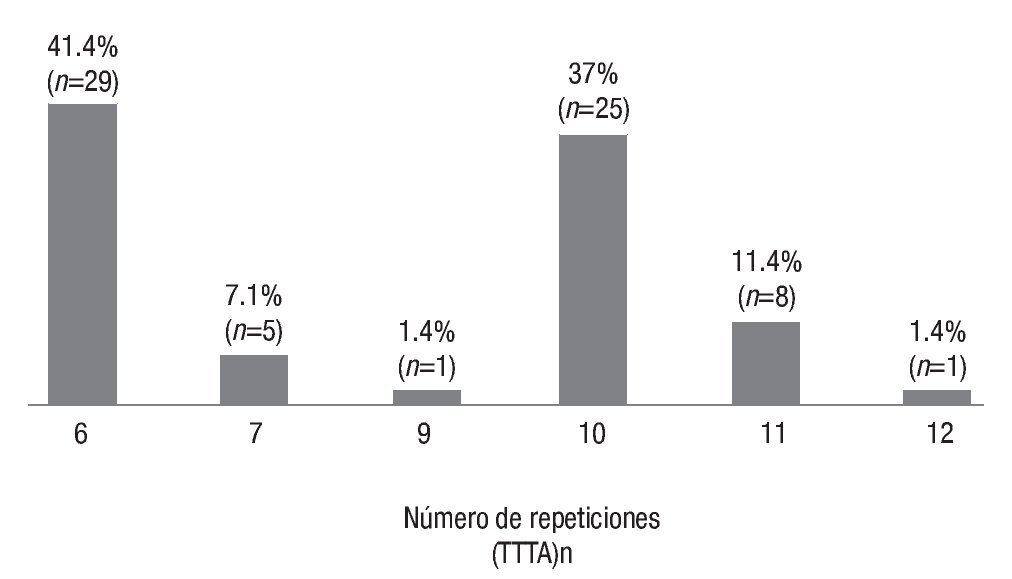
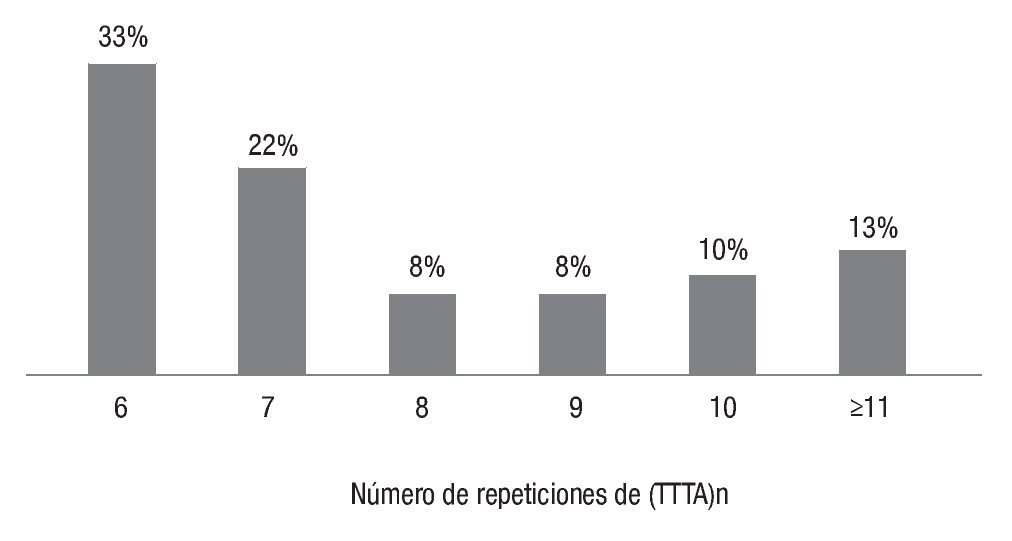
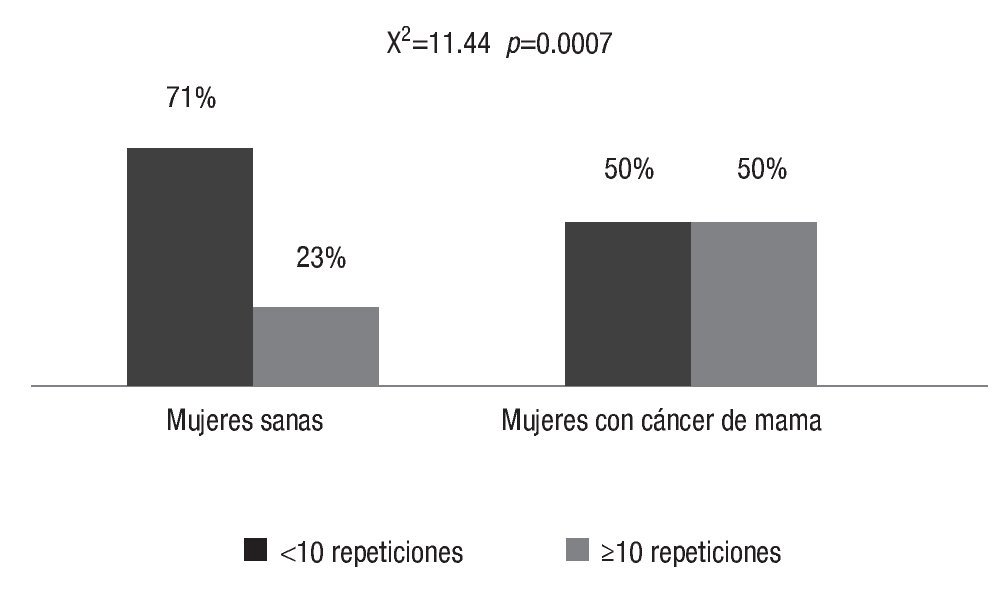
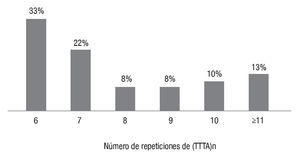
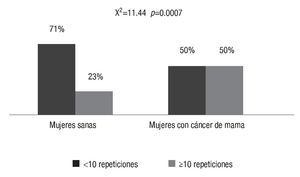
En el grupo de las mujeres con cáncer, las repeticiones más frecuentes fueron 6 (29%) y 10 (26%), como se observa en la Imagen 2, mientras que en las mujeres sanas se reconoció que las repeticiones alélicas más frecuentes eran 6 (32.7 %) y 7 (21.6 %), como se ilustra en la Imagen 3. También se advirtió que en las pacientes con cáncer de mama las repeticiones 3 10 fueron más frecuentes (35% vs 23% en mujeres sanas; c2=11.44, p=0.0007), como lo muestra la Imagen 4.
Imagen 2. Frecuencias de mujeres con cáncer de mama.
Imagen 3. Frecuencias alélicas de (TTTA)n en mujeres sanas.
Imagen 4. Frecuencia > 10 repeticiones en mujeres con carcinoma mamario en comparación con mujeres sanas.
DISCUSIÓN
La distribución de las variantes del polimorfismo del gen CYP19 (TTTA)n es diferente entre las mujeres mexicanas sanas en comparación con las que padecen carcinoma mamario. Las repeticiones ≥10 de TTTA son más frecuentes en mujeres con cáncer de mama. Éste es el primer informe realizado en mujeres mexicanas; en otras poblaciones se ha publicado que esta variante se ha relacionado con un mayor riesgo de cáncer mamario.
Kristensen y colaboradores9 comunicaron las frecuencias alélicas de este polimorfismo en 182 pacientes con cáncer de mama esporádico, 182 pacientes con cáncer familiar y 252 individuos sanos; en ese protocolo se identificaron 7, 8, 9, 11 y 12 repeticiones alélicas de TTTA. El alelo largo (TTTA) 12 fue significativamente más frecuente en las personas con cáncer respecto de los controles sanos. Esto indica que la posesión de este alelo largo (TTTA) 12 incrementa el riesgo de desarrollar cáncer de mama (OR, 2.42). Asimismo, se encontró una frecuencia mayor de este alelo largo (TTTA) 12 en el grupo de pacientes con tumores positivos para receptor de estrógenos y progesterona.
Miyoshi y colaboradores10 realizaron un estudio de casos y controles para determinar si este polimorfismo se vinculaba con el riesgo de cáncer de mama en mujeres japonesas. Las mujeres homocigotas con 10 o más repeticiones de TTTA mostraron un mayor riesgo de cáncer de mama (OR, 1.8).
Ahsan y colaboradores11 efectuaron el primer estudio familiar para examinar las vinculaciones entre el polimorfismo de repetición de (TTTA) de CYP19 y el riesgo de cáncer de mama. Se estudió a 278 familias que tenían una o más hijas con cáncer de mama (se valoró a un total de 1123 sujetos) y encontraron que las repeticiones alélicas de (TTTA) 11 se relacionaban con un mayor riesgo de cáncer de mama en estas familias.
Por su parte, Han y colaboradores12 realizaron un estudio de casos y controles para valorar la relación entre el polimorfismo de repetición (TTTA) de CYP19 y el riesgo de cáncer de mama en mujeres chinas. En esta investigación se incluyó a 213 pacientes y 430 controles y fue posible identificar que el alelo con 10 repeticiones de (TTTA) fue más frecuente en los casos que en los controles.
Más aún, Hu y colaboradores13 informaron resultados similares. Okobia y colaboradores14 sometieron a estudio el polimorfismo de repetición de (TTTA) en una población indígena subsahariana. Estos especialistas estudiaron a 250 mujeres con cáncer de mama y 250 mujeres sanas y señalaron que 10 o más repeticiones de (TTTA) se relacionaban con un incremento discreto del riesgo de cáncer de mama en mujeres nigerianas.
Ribeiro y colaboradores15 investigaron la frecuencia de las repeticiones alélicas de TTTA en una población de América del Sur y analizaron el riesgo para desarrollar cáncer de mama. Dichos investigadores comunicaron que el alelo con 10 repeticiones de (TTTA) fue tres veces más frecuente en los casos y que mostró una relación positiva (p = 0.048) con el desarrollo de cáncer de mama en una población brasileña.
El incremento del riesgo de padecer cáncer mamario por este polimorfismo de repetición debe investigarse en la población mexicana, además de conocer los factores de riesgo ambiental y genéticos, para introducir medidas que reduzcan el incremento del riesgo. La obesidad es un factor preponderante, ya que la actividad de la enzima aromatasa incrementa los niveles circulantes de estradiol a partir de la conversión del tejido adiposo. En este estudio se informó que el 75% de las mujeres premenopáusicas presentaban obesidad o sobrepeso y 80% de las posmenopáusicas. Este polimorfismo de repetición aumenta la actividad de la enzima aromatasa, por lo que su efecto metabólico en el tejido adiposo se vuelve un factor que puede modificarse mediante medidas preventivas; en consecuencia, analizar el estado nutricio y seguir las recomendaciones dietéticas reducen la obesidad en la población y, en consecuencia, en grado considerable, el riesgo de desarrollar cáncer mamario.
CONCLUSIONES
En este estudio pudo reconocerse que las repeticiones ≥10 de TTTA son más frecuentes en las mujeres con cáncer de mama (p=0.0007). En la población de mujeres sanas las repeticiones más frecuentes fueron 6 y 7.
AGRADECIMIENTOS
Los autores agradecen al Consejo Nacional de Ciencia y Tecnología del Estado de Guanajuato el apoyo otorgado a través del programa de Fondos Mixtos. Apoyo GTO-2005-CO4-18799 IMSS.
Correspondencia:
Dra. Blanca Murillo Ortiz.
Unidad de Investigación en Epidemiología Clínica,
UMAE No. 1 Bajío, IMSS. Blvd. López Mateos, Esq. Insurgentes s/n, Col. Los Paraísos. León, Guanajuato.
Teléfono y Fax: (477) 717-4800 ext. 31472.
Correo electrónico: bomo907@hotmail.com, blanca.murillo@imss.gob.mx