Introducción: La técnica del ganglio centinela (GC) puede representar una alternativa a la disección electiva para la adecuada estadificación, en pacientes con tumores tempranos de lengua móvil. El propósito del presente estudio es reportar nuestra experiencia con esta técnica.
Material y métodos: Se incluyeron pacientes con cáncer de lengua móvil T1-T2 cN0, entre enero 2010 y septiembre 2011. Todos los pacientes fueron llevados a detección de GC utilizando gamasonda y azul patente, posteriormente llevados a disección selectiva del lado que se detectó el ganglio, y resección del tumor primario en la misma cirugía. Posteriormente, se realizó el estudio histopatológico.
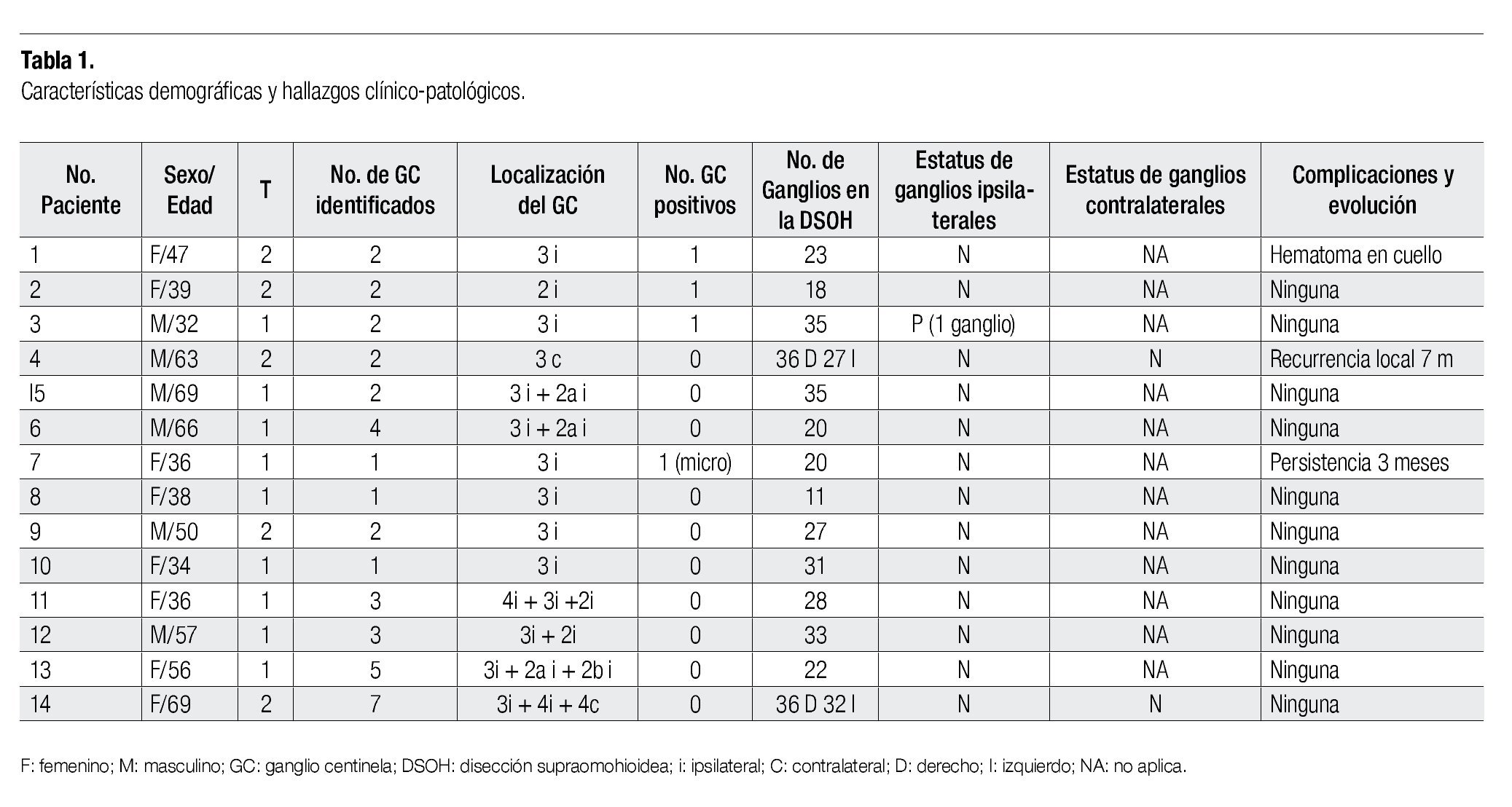
Resultados: Fueron 14 pacientes, ocho mujeres y seis hombres. Nueve pacientes fueron T1 y cinco T2. La localización fue borde lateral y la histología fue carcinoma epidermoide en todos los casos. Se identificaron 37 GC, cuatro fueron positivos a malignidad, ninguno con ruptura extracapsular. El promedio de GC por paciente fue de dos. El nivel III fue el sitio más frecuente de identificación del GC, observado en 13. Se realizaron un total de 14 disecciones de cuello ipsilaterales de los niveles I-III, y en dos casos tambien contralateral, con un promedio de 25 ganglios resecados. La técnica del GC nos permitió la identificación de metástasis en todos los casos, con un valor predictivo negativo de 92.8%.
Conclusiones: La técnica del GC nos permite estadificar de forma adecuada a nuestros pacientes con cáncer de lengua móvil (T1-T2), con cuellos cN0. Consideramos que con una mayor cantidad de casos, podría ser una herramienta útil para disminuir la cantidad y morbilidad de las disecciones electivas.
Background: The sentinel lymph node (SLN) technique may represent an alternative to the neck dissection (ND) for the adequate staging in patients with early mobile tongue cancer. The primary objective in this study was to report our experience with this technique.
Material and methods: Patients with mobile tongue cancer T1-T2, cN0 were studied from January 2010 to September 2011. All the patients were tested with SLN using the gamma probe and blue dye, followed by selective neck dissection (SND) in the SLN side, and the resection of the primary tumor in the same surgery. Pathologic analysis was performed.
Results: There were 14 patients with eight females and six males. Nine patients were T1 lesions and five T2. Lateral edge was the location and the histology was squamous cell carcinoma in all cases. The sentinel nodes removed were 37, four of them positive for cancer but non with extracapsular extension. The median number of SLN removed per patient was two. Level III was the most common site in SNL´s identified (n=13). The SND was performed in the SLN side at levels I-III, and in two patients both sides, with a median of 25 nodes removed. The SLN technique let us identify metastases in all cases, with a negative predictive value of 92.8%.
Conclusions: The SLN technique leads to an adequate staging in our patients with a mobile tongue cancer (T1-T2) with neck cN0. We believe that a bigger number of cases might be a useful response to achieve less morbidity and number of neck dissections.
¿ INTRODUCCIÓN
Un total de 263 900 nuevos casos y 128 000 muertes por cáncer de cavidad oral se reportaron a nivel mundial en el 2008, siendo éstos más frecuentes en el centro de Europa, Asia, Sur de África y Centroamérica. Los factores de riesgo mayormente relacionados a esta patología son el tabaquismo, el consumo de alcohol e infecciones por virus del papiloma humano (VPH) mayormente en tumores de la orofarínge, y con el alcohol y el tabaco teniendo efecto sinérgico.1 El 90% de los tumores de la cavidad oral son carcinomas de células escamosas, y el 10% restante son histologías poco frecuentes como tumores de glándulas salivales, melanomas o incluso, linfomas. En conjunto con los tumores de la faringe, representan la sexta causa de cáncer a nivel mundial, siendo la lengua el subsitio intraoral más comúnmente afectado, representando un 40% a 50%.2
A pesar de que ha habido un avance importante en el conocimiento de la biología en los tumores de la cavidad oral, esto se ha repercutido en poco en la sobrevida de los pacientes, pero es indudable que la calidad de vida se ha visto mejorada.3 Se sabe que la enfermedad ganglionar cervical es el factor pronóstico más importante para los pacientes con cáncer de cavidad oral y orofarínge, especialmente en aquellos con presencia de extensión extracapsular, en donde la sobrevida se puede ver afectada hasta en un 50% y la decisión de tratar a los pacientes de forma electiva, continua siendo un punto de controversia.4,5
Por otra parte, sabemos que la incidencia de metástasis ocultas en cuellos clínicamente negativos es alta, en muchas series, reportando hasta más del 30% dependiendo del sitio de tumor primario, pero si a todos los pacientes los llevamos a una disección electiva de cuello podríamos estar hablando de un sobretratamiento.6,7
Es por esto, que se ha estudiado la técnica del ganglio centinela (GC), el cual es un método poco invasivo que permite determinar el estatus ganglionar, sin la necesidad de una disección formal del cuello, por lo que en estudios recientes se concluye que es un método seguro para la estadificación del cuello con una baja morbilidad y con un valor predictivo negativo de hasta un 95%.8 El propósito del presente estudio es reportar nuestra experiencia con esta técnica, y determinar el valor predictivo negativo.
¿ MATERIAL Y MÉTODOS
Todos los pacientes con cáncer de lengua móvil T1, T2, N0, que se presentaron fueron incluidos en este estudio. Los criterios de inclusión fueron: cáncer de lengua móvil diagnosticado por biopsia y confirmación histológica, y tomografía contrastada complementaria en los casos que así lo requirieran (considerando negativos aquellos menores de 10 mm, ausencia de necrosis central, presencia de hilio graso y bordes bien definidos). Los criterios de exclusión fueron: cirugía previa y tratamiento con radioterapia en el área de cabeza y cuello. Los pacientes se llevaron a técnica de GC y disección selectiva de cuello en el mismo tiempo quirúrgico de los niveles I al III. Se realizó centellografía preoperatoria en todos los casos. El sitio primario fue tratado en la misma cirugía en todos los casos. Se inyecto 1 mCi de renio marcado con Tc99 en el Departamento de Medicina Nuclear, en todos los casos se realizó por el mismo médico radiólogo, de forma perilesional, en cuatro sitios diferentes y, utilizando una jeringa de 1 mL (Plastipak, Becton Dickinson) con una aguja de 25-gauge. Posterior a la inyección se realizó linfocentellografía y se marcó el sitio de mayor concentración en la superficie de la piel, con un marcador indeleble. El volumen del radiocoloide siempre fue el mismo, no importando el volumen tumoral. Posterior a la inyección del radiocoloide el paciente fue llevado a sala de operación, en donde bajo anestesia general, intubación orotraqueal y previa medicación con hidrocortisona 100 mg IV, se realizó la inyección de 1 mL de azul patente perilesional en cuatro cuadrantes. Se realizó una pequeña incisión sobre el sitio previamente marcado, y con ayuda de la gama sonda se localizó el ganglio más activo y se disecó, etiquetando el nivel en donde se encontraba. Se resecaron aquellos ganglios que marcaban una mayor actividad en el sitio previamente marcado, así como los ganglios adyacentes que tenían una cuenta mayor al 10% del ganglio más caliente previamente resecado. Se extrajeron los ganglios y fueron etiquetados como SN1, SN2 y SN3, y también en orden se documentaron las lecturas hechas con la gama sonda. La radioactividad fue confirmada ex vivo con la ayuda de la gamasonda. Se verificó finalmente la radioactividad residual en el cuello, para asegurar la remoción completa de los GC. Todos los ganglios extraídos se enviaron para su revisión histológica, fijados en para formaldehído y después revisados por el Servicio de Patología. Posteriormente, la incisión cutánea fue ampliada para realizar la disección selectiva del cuello. El producto de la disección fue enviada también al Servicio de Patología para su revisión. Finalmente, se realizó la resección del tumor primario, con estudio transoperatorio del lecho quirúrgico para lograr márgenes negativos. Los pacientes iniciaron seguimiento. El análisis estadístico se llevo a cabo con el programa SPSS versión 17.0.
¿ RESULTADOS
Se incluyeron un total de 14 pacientes, ocho mujeres y seis hombres, con una edad promedio de 49 años (rango de 32-69 años). Nueve pacientes fueron T1 y cinco pacientes fueron T2. La localización fue borde lateral en todos los casos. El tamaño tumoral clínico promedio fue de 2.1 cm (rango de 1-4 cm), y por patología fue de 1.5 cm (0.5-3.7 cm). En la totalidad de los pacientes la histología fue carcinoma epidermoide, dos fueron bien diferenciados, siete moderadamente y cuatro poco diferenciados (Tabla 1). De los 37 GC identificados, cuatro fueron positivos a malignidad. El promedio de GC por paciente fue de 2.6 (rango de 2-7). Al menos un GC fue identificado en cada paciente, es por esto que la tasa de identificación es del 100%. Se identificó de forma bilateral en dos pacientes, y en los 12 restantes sólo ipsilateral al sitio primario, siendo el nivel más frecuente el III ipsilateral (13 ganglios centinela). Del total de 37 GC identificados, cuatro fueron positivos a malignidad, ninguno con ruptura extracapsular, y después de la tinción con hematoxilina & eosina y el estudio inmunohistoquímico, uno se reportó con metástasis menor de 1 mm de eje mayor y los otros 33 fueron negativos. Ninguna glándula submaxilar presentó metástasis. Se llevaron a cabo un total de 14 disecciones de cuello ipsilaterales y en dos casos contralateral, con un promedio de 25 ganglios resecados. Sólo en un paciente (n=3) se encontró enfermedad metastásica en el producto de la disección, sin embargo, uno de los dos GC de este paciente fue positivo. Sólo un paciente presentó sangrado en el posoperatorio, sin embargo, evolucionó sin complicaciones. En uno de los casos se presentó recurrencia en el sitio del tumor primario a los siete meses, la cual fue tratada quirúrgicamente obteniendo márgenes negativos, y en uno de los casos se presentó persistencia en el nivel Ia, a los tres meses, se llevó a tumorectomía y se dio radioterapia adyuvante en ambos casos. Nuestros datos demuestran que la técnica del GC permite la detección de metástasis ganglionares en el 100% de los casos. No se identificaron metástasis saltonas. El valor predictivo negativo fue del 92.8%.
¿ DISCUSIÓN
La cirugía de mínima invasión es cada vez más común para el tratamiento de diversas patologías que afectan al ser humano, y en el área de cabeza y cuello, esto no es una excepción, ya que desde los estudios realizados por Morton y colaboradores9,10 sobre el uso de la técnica del GC para el melanoma cutáneo, y la posterior introducción de radiotrazadores por Alex y Krag,11 esta técnica se ha difundido de forma importante para los tumores del área de cabeza y cuello.
El manejo del cuello N0 en aquellos pacientes con tumores de la cavidad oral es controversial, y hasta la fecha específicamente en la lengua, se basa en factores del tumor primario, considerando como de bajo riesgo: un tumor pequeño (< 2 cm), mínima profundidad de invasión (< 4 mm), y una diferenciación histológica favorable; y para los pacientes con factores de alto riesgo se prefiere realizar la disección electiva, en la mayor parte de los centros.12,13 Sin embargo, aunque no es universalmente aceptado, la opinión más frecuente es que si el riesgo de metástasis oculta es de 15% a 20%, se debe llevar a cabo una disección electiva teniendo en consideración que el número de disecciones negativas podría ser tan alto como del 80%, lo que se puede observar en nuestra serie.
La introducción de la técnica del GC en tumores de la cavidad oral tiene como principales objetivos, seleccionar aquellos candidatos a una disección selectiva y evitar así, la morbilidad del procedimiento electivo. Los resultados de los estudios fase I han demostrado que la técnica es reproducible, con una adecuada sensibilidad y valores predictivos negativos mayores del 90%,14-16 como lo hallado en el presente estudio, por lo que ahora se requiere de estudios fase II y fase III. Actualmente, el estudio de Alkureishi y colaboradores17 representa la mayor experiencia reportada con el uso de esta técnica y en el cual, se concluye que es una alternativa viable a la disección electiva para la estadificación del cuello clínicamente negativo, con una tasa de identificación del GC del 93%, una sensibilidad del 91% y un valor predictivo del 95%, lo cual concuerda con estudios previos y con el presente. Por otra parte, en este mismo estudio se reporta la presencia de micrometástasis hasta en un 11%, sin embargo, hasta el momento no sabemos el significado real de este hallazgo, por lo que tendrá que ser estudiado en un futuro.
Otro punto importante es si la técnica del GC es aplicable para todos los subsitios de la cavidad oral, y hasta el momento el subsitio que parece tener mayor problemática para la reproducibilidad es el piso de la boca, y esto es por la cercanía del tumor primario al sitio de drenaje linfático, teniendo dificultades desde la linfocentellografía preoperatoria y la radiolocalización intraoperatoria por el fenómeno del resplandor (shine-through), lo cual ha sido reportado en varios estudios y es por esto, que no consideramos realizarlo de forma inicial en nuestros pacientes, quizá como lo vemos en el caso de la persistencia en el nivel Ia, en donde se debe ser cuidadoso al momento de realizar la disección sobre todo si el tumor tiene una extensión incipiente al piso de la boca.17,18 Finalmente, el manejo desde el punto de vista patológico de los GC se ha llevado a cabo con la experiencia obtenida en el cáncer de mama, reportando una adecuada sensibilidad para la detección de macrometástasis con corte congelado e incluso impronta, sin embargo, para la determinación de micrometástasis, es necesario emplear la tinción con hematoxilina & eosina e inmunohistoquímica, lo cual incrementa el estadio hasta en un 10%.19
CONCLUSIONES
Consideramos que la técnica del GC nos permitirá tener una menor morbilidad en comparación con la disección electiva. Es necesario adquirir la experiencia necesaria, para la reproducción de la técnica con al menos 10 procedimientos. Ahora será de suma importancia el seguimiento de los pacientes en los que hemos realizado la técnica de GC, para que en un futuro se pueda considerar el GC como un estándar para la adecuada estadificación de pacientes con cáncer de cavidad oral en etapas clínicas tempranas, y finalmente, con los resultados de estudios como el SENT y ACOSOG Z0360, se espera también esclarecer el papel de esta técnica.
CONFLICTO DE INTERESES
Los autores declaran no tener ningún conflicto de intereses.
FINANCIAMIENTO
Los autores no recibieron ningún patrocinio para llevar a cabo este estudio.
Correspondencia:
Dr. Antonio Gómez Pedraza.
Instituto Nacional de Cancerología de México, Servicio de Cabeza y Cuello, San Fernando 22, Colonia Sección XVI, Delegación
Tlalpan, C.P. 14080, México D.F., México.
Teléfonos: (55) 5628 0400, ext. 285. Celular: (04455) 3331 9594.
Correo electrónico: gopeantonio@hotmail.com