La quimiorradiación es el tratamiento de referencia para el cáncer orofaríngeo e hipofaríngeo localmente avanzado, aunque solo unos cuantos pacientes sobreviven a largo plazo. Los novedosos agentes terapéuticos que actúan sobre los receptores EGFR han demostrado beneficios de supervivencia en el entorno paliativo y de radiosensibilización en estudios preclínicos. Comparamos la quimiorradiación concurrente basada en cisplatino frente a la quimiorradiación basada en cisplatino y gefitinib en pacientes con cáncer oro e hipofaríngeo locorregionalmente avanzado.
MétodosPacientes de entre 18 y 70 años de edad con carcinoma epidermoide oro-hipofaríngeo localmente avanzado (estadios iii y iv, M0) fueron asignados aleatoriamente a radioterapia con cisplatino concurrente a 100mg/m2 los días 1, 23 y 43, o a radioterapia con cisplatino concurrente a la misma dosis más gefitinib 250mg al día iniciado 2 semanas antes de comenzar la radioterapia y hasta el final de la misma. Los criterios principal y secundario de valoración fueron la supervivencia libre de progresión y global, respectivamente.
ResultadosDe un total de 67 pacientes asignados aleatoriamente, a 32 se les administró cisplatino con radiación (brazo i) y a 35 cisplatino más gefitinib con radiación (brazo ii). Las tasas de respuesta global (completa y parcial) fueron del 62 y el 71.42% en los brazos i y ii, respectivamente, sin que se registraran diferencias estadísticamente significativas (p=0.605). La mediana de supervivencia libre de progresión fue de 24 meses en el brazo i, en tanto que en el brazo ii fue de 35 meses (p=0.2877), proporción de riesgo (HR)=0.688; IC del 95%: 0.3346-1.4150). La mediana de supervivencia global fue de 31 meses en el brazo i y de 37 meses en el brazo ii (p=0.4344, HR=0.7542; IC del 95%: 0.3661-1.5539). La enfermedad proliferativa mostró una tendencia hacia la significación en términos de respuesta, aunque no pudo alcanzar el nivel de significación (p=0.086). No se encontró ninguna diferencia estadísticamente significativa en el perfil de toxicidad de los 2 brazos.
ConclusiónLa combinación de gefitinib y cisplatino es bien tolerada en concurrencia con radiación, pero no presenta ningún efecto sorprendente sobre la tasa de respuesta, la supervivencia libre de progresión ni la supervivencia global, aunque se observaron resultados alentadores en la tasa de respuesta en la morfología proliferativa.
Chemoradiation is standard treatment in locally advanced oropharyngeal and hypopharyngeal cancer but only few surviving for long term. Novel therapeutic agents targeting EGFR receptors demonstrated survival benefit in palliative setting and radiosensitization in preclinical studies. We compared cisplatin based concurrent chemoradiation with cisplatin and gefitinib based chemoradiation in patients with locoregionally advanced oro-hypo pharyngeal cancer.
MethodsPatients of oro-hypo pharyngeal squamous cell carcinoma with age between 18 and 70 and with locally advanced (stage iii and iv, M0) were randomly assigned to receive either radiation with cisplatin 100mg/m2 on d1, 23 and 43 or radiation with cisplatin in same dose plus gefitinib 250mg daily started two week before commencing radiotherapy till the end of radiation treatment. Primary and secondary end points were progression free and overall survival, respectively.
ResultsOut of total 67 patients randomized, 32 received cisplatin with radiation (arm i) and 35 received cisplatin plus gefitinib with radiation (arm ii). Overall response rates (complete and partial) were 62% and 71.42% in arm i and arm ii, respectively, with no statistically significant difference (P=.605). The median progression free survival was 24 months for arm i while it was 35 months for arm ii (P=0.2877, hazard ratio [HR]=0.688, 95% CI 0.3346-1.4150). The median overall survival was 31 months for arm i and 37 months for arm ii (P=.4344, HR=0.7542, 95% CI 0.3661-1.5539). Proliferative disease showed trend towards significance in terms of response but could not reach the level of significance (P=.086). No statisticallysignificant difference was found in toxicity profile of two arms.
ConclusionGefitinib and cisplatin combination is well tolerated concurrently with radiation but does not have impressive effect on response rate, progression free survival and overall survival, but encouraging result was seen in response rate in proliferative morphology.
El cáncer de cabeza y cuello constituye el 5% de todos los cánceres a nivel mundial y es la sexta neoplasia maligna más común1. Es la neoplasia maligna más frecuente en varones de la India y da cuenta del 23% de todos los cánceres2. El cáncer de cabeza y cuello también constituye el 6% de todos los cánceres en las mujeres. La prevalencia desproporcionadamente más elevada de cáncer de cabeza y cuello en relación con otras neoplasias malignas en la India se debe al uso de tabaco en formas diversas, al consumo de alcohol y a las precarias condiciones socioeconómicas.
La quimiorradiación es el tratamiento de referencia para el cáncer orofaríngeo e hipofaríngeo localmente avanzado, con una supervivencia relativa a 5 años del 36.5 y el 26.8% (datos de SEER). Aproximadamente, entre el 50 y el 60% de los pacientes presenta recurrencia local de la enfermedad dentro de un periodo de 2 años y entre el 20 y el 30% de los sujetos afectados desarrolla enfermedad metastásica3,4. En los pacientes con enfermedad avanzada, la supervivencia no ha mejorado significativamente en los últimos 25 años a pesar de los avances en las técnicas quirúrgicas y de radiación, así como en la quimioterapia. La investigación en biología molecular y anticuerpos monoclonales, la cual ha llevado al desarrollo de novedosos agentes terapéuticos que interactúan con vías biológicas selectivas en la célula cancerosa, ha generado recientemente considerable atención tras su utilización exitosa en el tratamiento de la leucemia mieloide crónica. Los estudios clínicos se han concentrado en los antagonistas del receptor del factor de crecimiento epidérmico (epidermal growth factor receptor [EGFR]) y han revelado que la activación del EGFR promueve una multitud de vías de señalización importantes relacionadas con el desarrollo y la progresión del cáncer, y de manera importante, con la resistencia a la radiación5-7. Dado que la radioterapia (RT) desempeña un papel integral en el manejo del cáncer de cabeza y cuello de histología epidermoide, la inhibición de la vía del EGFR podría mejorar los esfuerzos en la curación del cáncer. La cuestión a entender ahora es cuándo la aplicación de dichos inhibidores del EGFR es pertinente en un paciente en lo individual y cómo y cuándo deben combinarse estos fármacos con radiación y quimioterapia. El valor pronóstico-predictivo de la expresión del EGFR en el carcinoma epidermoide de cabeza y cuello (CECC) se ha mostrado en varios estudios, entre ellos un análisis correlativo de los pacientes incorporados a un estudio fase iii llevado a cabo por el Grupo Oncológico de Radioterapia8. En teoría, el bloqueo del receptor EGFR debería derivar en una inhibición del crecimiento tumoral y sensibilización a la radiación. El trabajo consignado en el presente artículo constituye un esfuerzo para recopilar información sobre la combinación de gefitinib con cisplatino y radiación en el cáncer orofaríngeo e hipofaríngeo, y encontrar si este novedoso agente puede ser incorporado al tratamiento convencional.
MétodosPacientesEl presente estudio con asignación aleatoria se llevó a cabo en el J.K. Cancer Institute, el cual es el centro más grande en el estado de Uttarpradesh en la India. Los criterios de elegibilidad consistieron en tener una edad superior a los 18 años y hasta los 70 años y presentar carcinoma epidermoide de orofaringe e hipofaringe, confirmado mediante análisis histológico o citológico. Todos los pacientes presentaban enfermedad locorregionalmente avanzada (estadio iii o iv sin metástasis a distancia) sin tratamiento previo, un estado funcional de 1 o menos en la escala del Grupo Oncológico Cooperativo del Este (ECOG) y pruebas funcionales hematológicas, renales y hepáticas adecuadas. Los pacientes debían ser médicamente aptos para la administración de quimiorradiación concurrente. Solo se incluyó a los pacientes que otorgaron su consentimiento para participar en el estudio y para la publicación de los datos. Las evaluaciones iniciales incluyeron anamnesis, exploración física, evaluación dental, análisis hematológico y bioquímico, electrocardiografía, estudios de resonancia magnética o tomografía computarizada de la cabeza y el cuello, y radiografía de tórax. Cuando fue indicado o requerido, se llevaron a cabo otras investigaciones. El estudio fue aprobado por el comité de ética del GSVM Medical College de Kanpur.
Diseño del estudioTras la verificación de la elegibilidad, los pacientes se distribuyeron aleatoriamente en grupos de estudio en los que fueron tratados con radiación más cisplatino concurrente100mg/m2 los días 1, 22 y 43 o con radiación concurrentemente con cisplatino y gefitinib 250mg al día por vía oral iniciado 2 semanas antes de comenzar la RT y administrado diariamente hasta completar la RT. La RT se administró en dosis convencionales de 2Gy por fracción, 5 días a la semana hasta un total de 70Gy irradiando la enfermedad primaria y las linfadenopatías macroscópicas. La irradiación ganglionar programada se efectuó utilizando 50-60Gy dependiendo del riesgo. Durante la quimiorradiación, los pacientes fueron monitoreados clínicamente y con pruebas de laboratorio y estudios de imagen cuando fue necesario.
El criterio principal de valoración, la supervivencia libre de progresión (SLP), se definió como el tiempo entre la asignación aleatoria y la progresión, la recidiva o el fallecimiento, lo que ocurriera primero. En los casos en que la progresión, la recidiva o el deceso no ocurrieron antes de la fecha de corte, los datos fueron censurados al momento de la última evaluación válida antes de la fecha de corte. Los criterios de valoración secundarios fueron la supervivencia global (SG) y los efectos tóxicos. Todos los pacientes recibieron medicación antiemética y de apoyo adecuada durante la quimioterapia.
La evaluación de la respuesta se llevó a cabo tras 4-6 semanas de la conclusión de la quimiorradioterapia y de ahí en adelante se llevó un seguimiento en intervalos de 1 a 3 meses. Cualquier sospecha de lesiones residuales o recurrentes se confirmó mediante biopsia con aguja o escisional. La evaluación de la respuesta se clasificó de conformidad con los Criterios de Evaluación de Respuesta en Tumores Sólidos (Response Evaluation Criteria in Solid Tumors [RECIST]) como respuesta completa (RC), respuesta parcial, enfermedad estable y enfermedad progresiva. A los pacientes con enfermedad residual o recurrente se les ofreció quimioterapia de rescate o posible intervención quirúrgica o tratamiento paliativo. Los pacientes se evaluaron semanalmente a fin de detectar efectos de toxicidad durante la radiación y posteriormente en cada visita de seguimiento, y se calificaron de conformidad con los Criterios de Morbilidad por Radiación Aguda y Crónica del Grupo Oncológico de Radioterapia (Radiation Therapy Oncology Group [RTOG]). Las toxicidades que aparecieron después de 6 meses se consideraron toxicidades tardías, en tanto que las que se presentaron durante el tratamiento o hasta 6 meses tras el tratamiento se consideraron toxicidades agudas.
Análisis estadísticoPara las variables categóricas se utilizaron la prueba de la χ2 y la prueba exacta de Fisher, en tanto que para las variables continuas se compararon la media y la desviación estándar utilizando la prueba t para muestras independientes con un intervalo de confianza (IC) del 95%. En todas las pruebas se aplicó un nivel de significación de 0.05 bilateral. Los datos del tiempo transcurrido hasta el evento de interés se describieron mediante el uso de curvas de Kaplan-Meier. Se calcularon IC para las medianas de SLP y de SLP. Los intervalos del tiempo transcurrido hasta los eventos de interés se compararon entre grupos con la prueba del orden logarítmico.
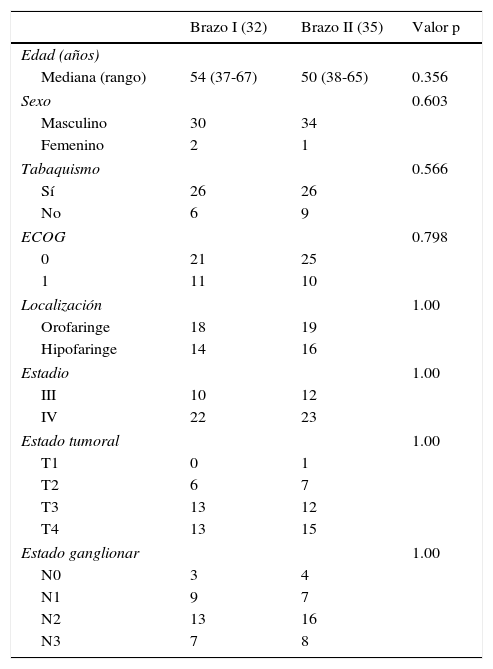
ResultadosLa mediana de edad en el brazo i fue de 54 años, en tanto que en el brazo ii fue de 50 años. La mayoría de los pacientes fueron masculinos, incluidos 30 pacientes de 32 en el brazo i y 34 de 35 en el brazo ii. Seis pacientes (18.75%) eran no fumadores en el brazo i, en tanto que en el brazo ii 9 pacientes (25.71%) eran no fumadores. Veintiún pacientes (65.62%) mostraron un estado funcional ECOG de 0 en el brazo i y 25 pacientes (71.43%) lo hicieron en el brazo ii. El cociente de orofaringe a hipofaringe en los brazos i y ii fue de 1.28 y 1.19, respectivamente. La mayoría de los pacientes en ambos grupos presentaba enfermedad en estadio iv, entre ellos 22 pacientes (68.75%) en el brazo i y 23 (65.71%) en el brazo ii. Todos los parámetros de los pacientes, incluido el estadio tumoral y ganglionar, resultaron equiparables y no presentaron diferencias estadísticamente significativas entre ambos brazos (tabla 1).
Características basales de la población de estudio
| Brazo I (32) | Brazo II (35) | Valor p | |
|---|---|---|---|
| Edad (años) | |||
| Mediana (rango) | 54 (37-67) | 50 (38-65) | 0.356 |
| Sexo | 0.603 | ||
| Masculino | 30 | 34 | |
| Femenino | 2 | 1 | |
| Tabaquismo | 0.566 | ||
| Sí | 26 | 26 | |
| No | 6 | 9 | |
| ECOG | 0.798 | ||
| 0 | 21 | 25 | |
| 1 | 11 | 10 | |
| Localización | 1.00 | ||
| Orofaringe | 18 | 19 | |
| Hipofaringe | 14 | 16 | |
| Estadio | 1.00 | ||
| III | 10 | 12 | |
| IV | 22 | 23 | |
| Estado tumoral | 1.00 | ||
| T1 | 0 | 1 | |
| T2 | 6 | 7 | |
| T3 | 13 | 12 | |
| T4 | 13 | 15 | |
| Estado ganglionar | 1.00 | ||
| N0 | 3 | 4 | |
| N1 | 9 | 7 | |
| N2 | 13 | 16 | |
| N3 | 7 | 8 | |
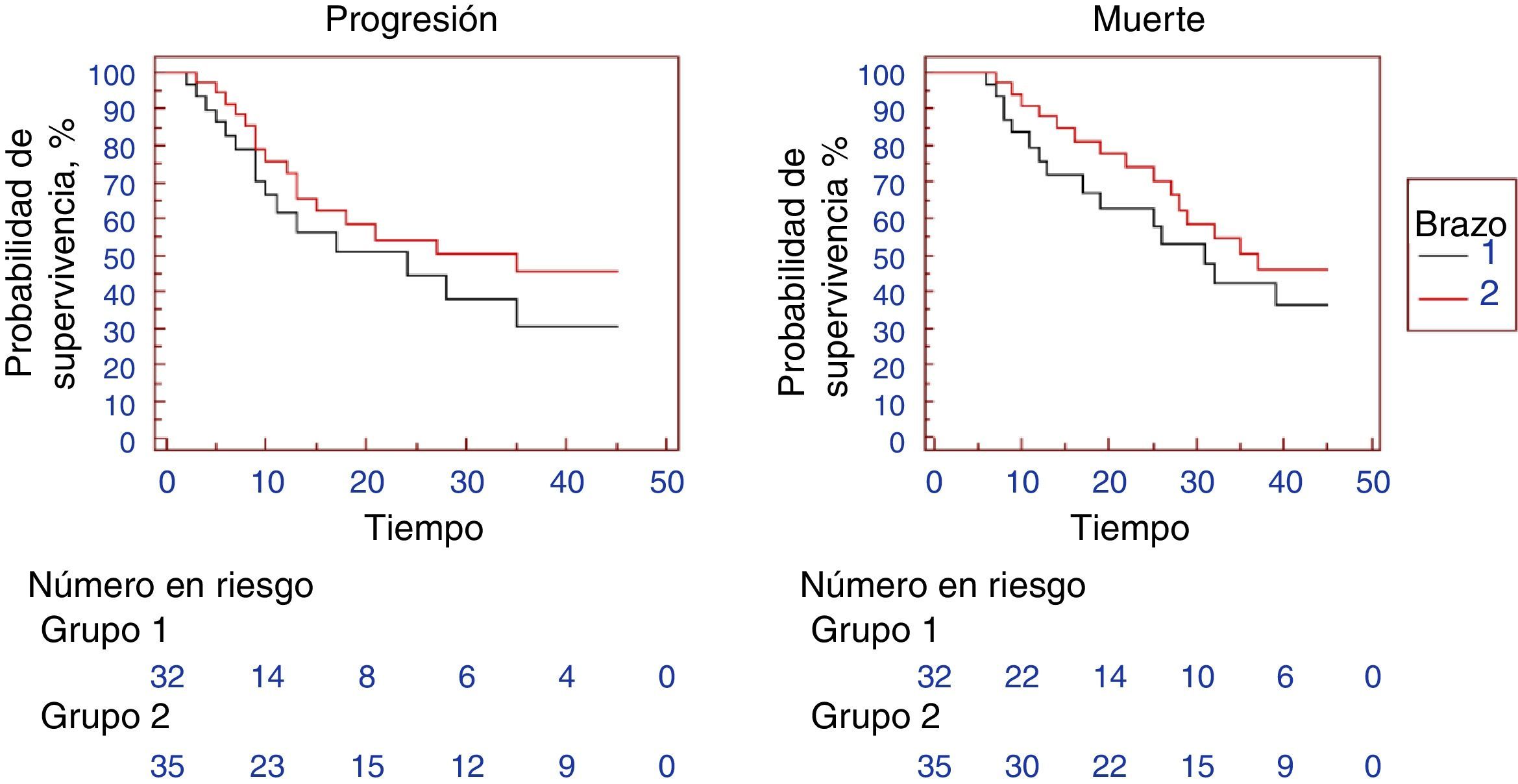
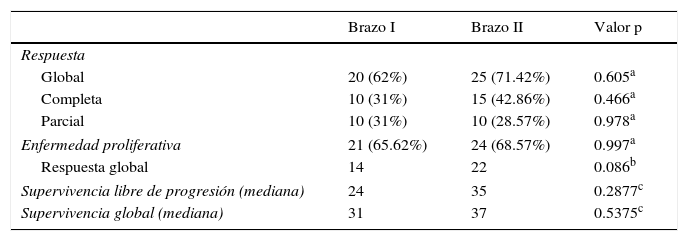
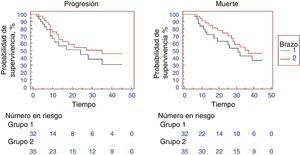
Las tasas de respuesta global (completa y parcial) fueron del 62 y el 71.42% en los brazos i y ii, respectivamente, sin que se registrara ninguna diferencia estadísticamente significativa (0.605). Lo mismo se observó con las respuestas parcial y completa al ser comparadas por separado. La enfermedad proliferativa mostró una tendencia hacia la significación, aunque no pudo alcanzar dicho nivel (tabla 2). En el caso de los pacientes que sobrevivieron en el brazo i, la mediana de duración del seguimiento fue de 22 meses (rango 13-42 meses), en tanto que en el brazo ii fue de 23 meses (rango 12-45 meses). La mediana de SLP fue de 24 meses en el brazo i, en tanto que en el brazo ii ascendió a 35 meses (p=0.2877, proporción de riesgo (hazard ratio [HR]): 0.688; IC del 95%: 0.3346-1.4150). La SLP a 1 y 2 años fue del 61.4 y el 44.3% en el brazo i, mientras que en el brazo ii fue del 72.4 y el 54.3%, respectivamente, sin que se registraran diferencias estadísticas significativas (p > 0.05) (fig. 1). La mediana de SG fue de 31 meses en el brazo i y de 37 meses en el brazo ii (p=0.3130; HR: 0.6952; IC del 95%: 0.3358-1.4390). La SG a 1 y 2 años fue del 75.6 y el 62.7% en el brazo ii y del 85.4 y el 68.8% en el grupo ii, sin que se detectaran diferencias estadísticamente significativas (p>0.05; fig. 1). Se observó una tendencia hacia la separación de las 2 curvas de SG hasta aproximadamente los 25 meses, aunque posteriormente se perdió. Es posible que esto refleje el efecto del tratamiento paliativo.
Respuesta al tratamiento y supervivencia
| Brazo I | Brazo II | Valor p | |
|---|---|---|---|
| Respuesta | |||
| Global | 20 (62%) | 25 (71.42%) | 0.605a |
| Completa | 10 (31%) | 15 (42.86%) | 0.466a |
| Parcial | 10 (31%) | 10 (28.57%) | 0.978a |
| Enfermedad proliferativa | 21 (65.62%) | 24 (68.57%) | 0.997a |
| Respuesta global | 14 | 22 | 0.086b |
| Supervivencia libre de progresión (mediana) | 24 | 35 | 0.2877c |
| Supervivencia global (mediana) | 31 | 37 | 0.5375c |
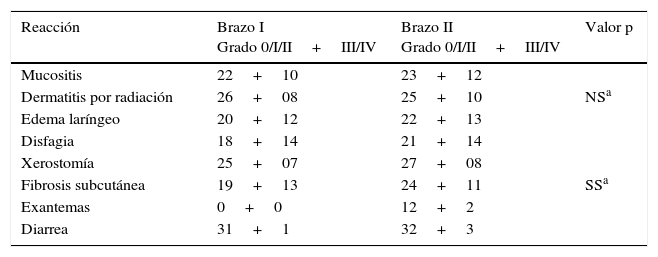
Las toxicidades agudas se consideraron tolerables en ambos grupos y, salvo las toxicidades específicas de gefitinib (diarrea y exantemas), no se encontraron diferencias significativas entre ambos grupos (tabla 3). Las reacciones adversas agudas más frecuentemente encontradas fueron mucositis, dermatitis por radiación y disfagia. La mayoría de ellas fueron de grados 1 y 2 y se atendieron en el entorno ambulatorio. Los efectos tóxicos tardíos registrados fueron xerostomía, fibrosis subcutánea y edema laríngeo.
Eventos adversos de la quimiorradioterapia (agudos y crónicos)
Las estrategias de tratamiento combinado se han convertido en el tratamiento de referencia para los pacientes con CECC localmente avanzado (CECCLA). Varios estudios fase iii con asignación aleatoria y metaanálisis documentaron un beneficio de supervivencia y/o conservación del órgano con la adición de quimioterapia a la RT como tratamiento primario. Se han investigado múltiples agentes quimioterapéuticos, de los cuales cisplatino fue el más ampliamente utilizado y fue considerado el tratamiento de referencia para los pacientes con CECCLA. La nueva terapia dirigida contra el receptor EGFR ha mostrado respuesta y beneficios en el entorno paliativo. El presente estudio se realizó con el objeto de observar cualquier ventaja en términos de respuesta y supervivencia derivada de la adición del nuevo agente gefitinib a cisplatino, un compuesto de uso más bien generalizado, como pauta de quimiorradioterapia. Las ventajas de la quimiorradiación concurrente sobre la radiación sola en los entornos tanto definitivo como posoperatorio en el cáncer de cabeza y cuello, utilizando cisplatino como la quimioterapia de sostén, se han comprobado en muchos estudios con asignación aleatoria a gran escala y metaanálisis9-11. El estudio «Metaanálisis de quimioterapia en cáncer de cabeza y cuello» (Meta-Analysis of Chemotherapy in Head and Neck Cancer [MACHNC]), el cual involucró 63 estudios con asignación aleatoria y datos de casi 11,000 pacientes individuales a fin de evaluar las repercusiones en la supervivencia derivadas de la adición de quimioterapia en la enfermedad locorregional, mostró que la adición de quimioterapia a la RT en la enfermedad localmente avanzada mejoró la SG a 5 años en un 8%12. Un análisis actualizado recientemente en el que se agregaron estudios clínicos con asignación aleatoria de entre 1994 y 2000 arrojó resultados similares13. Algunos de los agentes dirigidos más novedosos, los cuales actúan sobre objetivos moleculares específicos responsables del crecimiento maligno, fueron examinados en el entorno recurrente y paliativo con la esperanza puesta en mejorar la supervivencia. En la mayoría de los estudios se utilizaron cetuximab, gefitinib y erlotinib. El papel de estos inhibidores del EGFR en la modalidad de terapia combinada de primera línea para pacientes con cáncer de cabeza y cuello sigue siendo indefinido14. Bonner et al.15,16 demostraron que la combinación de cetuximab y radiación resultó superior a la radiación sola en pacientes con CECC orofaríngeo, hipofaríngeo o laríngeo en estadios iii/iv, con mejoras clínica y estadísticamente significativas en la duración del control locorregional y la SLP. Rao et al.17 compartieron su experiencia con gefitinib en el tratamiento del CECC recurrente con una mejoría sintomática en aproximadamente el 63% de la población de pacientes. Un par de estudios fase ii publicados en 2003 evaluaron el papel de gefitinib por vía oral como monoterapia de primera o segunda línea en pacientes con cáncer de cabeza y cuello recurrente o metastásico18,19. Estos 2 estudios efectuados por Cohen et al. mostraron una tasa de control de la enfermedad del 53 y el 36%, respectivamente. Los estudios preclínicos sugirieron enfáticamente que la combinación de gefitinib y radiación inhibía por completo la señalización del EGFR corriente abajo y ejercía un efecto fuertemente inhibitorio sobre las vías de la DNA-PKc posteriormente20. Un estudio de la Universidad de Colorado, EE. UU, realizado por Chen et al.21 reveló que gefitinib fue bien tolerado con un refuerzo concomitante de RT o quimiorradioterapia concurrente con cisplatino semanal, y la administración prologada de gefitinib por hasta 2 años a 250mg al día fue también bien tolerada. El presente estudio prospectivo se diseñó para investigar si la adición de gefitinib puede mejorar el resultado de supervivencia en el CECC localmente avanzado, considerando las alentadoras tasas de respuesta y los efectos secundarios mínimos en estudios anteriores. Los 2 grupos mostraron características equiparables en términos de distribución de edad y sexo, tabaquismo, estado funcional, estadio y localización de la lesión primaria. La respuesta global (completa y parcial) se logró en el 62% de los pacientes en el brazo i, que corresponde al grupo de control, lo cual resultó equiparable a lo observado en otros estudios. En el brazo de estudio (brazo ii), una proporción superior de pacientes logró una respuesta global (71.42%), pero la diferencia no alcanzó un nivel estadísticamente significativo (p=0.605). El 31% de los pacientes alcanzó una RC en el brazo de control, en tanto que 42.86% de los pacientes lograron una RC en el brazo de estudio. Sin embargo, este alentador resultado no pudo validarse con una significación estadística. La adición de gefitinib al régimen de quimiorradioterapia basado en cisplatino fue bien tolerada y las toxicidades en los 2 brazos de tratamiento resultaron equiparables. Las reacciones grado iii y iv relacionadas con la radiación más frecuentes fueron mucositis, dermatitis por radiación, xerostomía, edema laríngeo y disfagia, aunque no se registró ninguna diferencia estadísticamente significativa en términos de incidencia (tabla 3). Ninguno de los pacientes interrumpió el tratamiento a causa de reacciones inducidas por radiación, mismas que se manejaron conservadoramente. Asimismo, no se detectó ningún incremento significativo en el desarrollo de toxicidades tardías. Las excepciones a estos hallazgos fueron algunos casos de diarrea y exantemas, los cuales se presentaron con una frecuencia significativamente superior en el brazo que contenía gefitinib. Sin embargo, tanto la diarrea como los exantemas pudieron manejarse adecuadamente y de manera conservadora y no contribuyeron al retraso del tratamiento. Los análisis de la SLP y la SG demuestran una diferencia en la SLP y en la SLP pero esto no se pudo validar estadísticamente. Esto puede deberse a la falta de potencia y la pequeña población del estudio. Tanto la SLP como la SG son equiparables a las reportadas en otros estudios10-15,22,23. Se sabe que la mayoría de los CECC sobreexpresan el EGFR, pero el estado mutacional no es un biomarcador predictivo24, de modo que no se solicitó el estudio de la expresión del EGFR en razón del costo considerable que esto involucra.
Por el momento, podemos comentar que la adición de gefitinib a la quimiorradiación clásica basada en cisplatino es bien tolerada, con resultados alentadores en términos de RC en un subgrupo de pacientes con morfología proliferativa. El presente estudio no pudo encontrar beneficios estadísticamente significativos en la SLP ni en la SG con la adición de gefitinib. Un estudio a mayor escala con la potencia estadística podría encontrar diferencias en términos de supervivencia.
Conflicto de interesesLos autores no tienen ningún conflicto de intereses que declarar.