El objetivo primario fue evaluar la respuesta patológica completa (RPc) y del objetivo secundario, la supervivencia de las pacientes con cáncer de mama avanzado tratadas con dosis alta de epirrubicina neoadyuvante y periodos diferentes.
Pacientes y métodosLas pacientes recibieron FE100C (5-fluorouracilo 500mg/m2, epirrubicina 100mg/m2, ciclofosfamida 600mg/m2) ya sea de 4 o 6 ciclos. El análisis de regresión logística de la predicción de la RPc se ajustó con factores predictores. Las curvas de Kaplan-Meier y riesgo proporcional de Cox fueron realizados.
ResultadosSe incluyeron 60 pacientes por grupo. Tras recibir 6 FE100C se observó un incremento no significativo en la tasa de RPc (16.7%; p = 0.283). El análisis de regresión logística reveló que solo la etapa clínica IIIA (OR, 11; p = 0.023) fue factor predictivo de lograr una RPc. El análisis univariado reveló una diferencia estadísticamente significativa a favor de tumores IIIA (82%; p= 0.042) y ganglios axilares negativos (96%; p= 0.000) en la supervivencia libre de enfermedad. En el análisis multivariado, el grupo 4 ganglios positivos o más (razón de riesgos [HR], 19.6; p = 0.003) tuvo el peor pronóstico. El efecto del tratamiento no fue significativo para la RPc (HR, 3.9; p = 0.184) y número de ciclos administrados (HR, 1.3; p = 0.412) en la SLE.
ConclusiónLos datos muestran un incremento ligero en la efectividad (RPc) con 6 FE100C, sin embargo no hubo posibilidad de mejorar las tasas de SLE y de ganglios negativos posquimioterapia comparado con un periodo de tratamiento más corto.
The primary endpoint was to assess the pathological complete response (pCR) rate, and the secondary endpoint was to determine the survival of the patients with advanced breast cancer treated with high doses of neoadjuvant epirubicin, and for different treatment periods.
Patients and methodsThe patients received FE100C (5-fluorouracil 500mg/m2, epirubicin 100mg/m2, cyclophosphamide 600mg/m2) in either 4 or 6 cycles.
A logistic regression analysis was performed to identify the relationship of pCR with predictive factors. Kaplan-Meier plots and Cox proportional hazard were performed. The groups were compared using log-rank test.
ResultsThe study included 60 patients per group. A non-significant increase in the pCR rate (16.7%; p=.283) was observed after receiving 6 FE100C. The logistic regression analysis revealed that only clinical stage IIIA (OR, 11; p=.023) was more likely to achieve a pCR. The univariate analysis showed a statistically significant difference in favour of IIIA tumours (82%; p=.042), and negative axillary lymph nodes (96%; p=.000) in disease-free survival. In the multivariate analysis, the group with more than 4 positive lymph nodes (hazard ratio [HR], 19.6; p=.003) had the worst prognosis. The treatment effect was not significant for the pCR (HR, 3.9; p=.184), or the number of cycles given (HR, 1.3; p = .412) on disease free survival.
ConclusionThe results show a slight increase in the effectiveness (pCR) with 6 FE100C, however there was no chance of improving the disease-free survival and the post-chemotherapy negative lymph node rates compared with a shorter treatment period.
La eficacia de las antraciclinas (doxorrubicina y epirubicina) han sido probadas como tratamiento de primera línea en el cáncer de mama localmente avanzado (CMLA) y en el cáncer de mama operable1–3. Hoy en día, la quimioterapia neoadyuvante (QN) es parte del manejo multidisciplinario seguido de cirugía y radioterapia. La QN ha demostrado varios beneficios al permitir la erradicación de micrometástasis, la reducción de volumen del tumor primario lo que permite la resección quirúrgica total o parcial en algunas pacientes4–6 y su eficacia ha demostrado un incremento más prolongado en la supervivencia libre de enfermedad2,3.
El reporte de la respuesta clínica es común y la subetapificación clínica después de la QN no siempre proporciona evidencia definitiva de que el tamaño del tumor se ha reducido por completo2,3. La expresión de los biomarcadores del tumor deben ser incorporados a las características clínicas para establecer un mejor tratamiento7–10.
Los resultados de varios ensayos han considerado como factores predictivos o de pronóstico de la QN a los ganglios linfáticos metastásicos5,6,11,12, tamaño del tumor5,6,11, el estado del receptor de estrógeno (RE)6,11, y la expresión de varios marcadores biológicos (p537–9,13, Ki-6714,15, c-erb29,16). Los hallazgos a menudo son variables, contradictorios y no concluyentes, se puede atribuir a varios factores como al diseño de los ensayos, la población heterogénea de pacientes, y a los diferentes regímenes quimioterapéuticos6–12.
La epirrubicina neoadyuvante ha demostrado su eficacia al incrementar la dosis de 100 a 150mg/m2 para obtener mejores resultados17–19. Todas estas observaciones pueden justificar un incremento escalonado de dosis altas de epirrubicina durante los primeros meses de la QN.
El propósito de este estudio fue evaluar el impacto pronóstico de las pacientes con respuesta patológica completa (RPc) y con afección ganglionar persistente posterior al uso de epirrubicina neoadyuvante con dosis alta (100mg/m2) ya sea de 4 ciclos o 6 ciclos.
Pacientes y métodosSelección de las pacientesEste estudio retrospectivo, observacional, longitudinal y comparativo registró un total de 120 pacientes consecutivas de febrero de 2003 a diciembre de 2010. Las pacientes fueron tratadas en la Unidad Médica de Alta Especialidad del Hospital de Ginecología y Obstetricia n.°. 3, Centro Médico Nacional La Raza, Instituto Mexicano del Seguro Social, al término de la QN se programó cirugía, radioterapia y quimioterapia adyuvante para las pacientes con tumor residual.
Se eligieron pacientes con diagnóstico clínico de cáncer de mama en estadio IIIA, IIIB y IIIC sin evidencia de metástasis a distancia de acuerdo a las normas del American Joint Committee on Cancer (AJCC 2002)20.
Los criterios de inclusión, de exclusión, metodología de estudios de laboratorio y de gabinete además del tipo de cirugía, radioterapia y hormonoterapia se describen en estudio previo21.
Quimioterapia neoadyuvanteLas pacientes fueron tratadas con 5-fluorouracilo 500mg/m2, epirrubicina 100mg/m2 y ciclofosfamida 600mg/m2 (FE100C) el día 1, cada 21-28 días sin apoyo de factores de crecimiento hematopoyético, los fármacos fueron aplicados por vía intravenosa. La primera cohorte (n = 60) recibió 4 ciclos (4 FE100C) que inició de febrero de 2003 hasta diciembre de 2004 y a partir de enero de 2005 en adelante, la segunda cohorte (n = 60) recibió 6 ciclos (6 FE100C) de acuerdo con la práctica habitual de la época.
Criterios de respuestaLa respuesta clínica de acuerdo a la OMS22 y la respuesta patológica de acuerdo al criterio de Chevallier23 se describen en estudio previo21. Los resultados parciales de estos parámetros fueron tomados en cuenta para este estudio para establecer diferencias en la supervivencia en ambas cohortes.
SeguimientoAl término de la quimioterapia adyuvante, las pacientes fueron evaluadas cada 3 meses durante los primeros 2 años de seguimiento con examen físico y pruebas de función hepática, estos estudios se realizaron cada 6 meses durante los siguientes 3 años. Los siguientes estudios fueron realizados cada 12 meses durante 5 años: radiografía de tórax, radiografía ósea completa, ultrasonido abdominal y una mastografía. Si la paciente mostró pruebas elevadas de la función hepática o un ultrasonido abdominal anormal se realizó una tomografía abdominal computada.
Método estadísticoLos principales criterios de valoración fueron la tasa de efectividad (RPc, sin evidencia de células tumorales en la mama y en los ganglios linfáticos). Los criterios secundarios de valoración fueron la tasa de respuesta objetiva (RO: RC + RP), la supervivencia libre de enfermedad (SLE) y la supervivencia global (SG).
Las variables categóricas basales muestran las frecuencias de la población de estudio. La prueba de chi cuadrado de Pearson o prueba exacta de Fisher fueron usadas según tendencia para comparar variables categóricas y las tasas de respuesta clínica y patológica de ambas cohortes.
La SLE se midió a partir de la fecha de cirugía hasta la primera fecha de recaída de la enfermedad, fallecimiento o último seguimiento. La SG se midió a partir de la fecha del diagnóstico histológico hasta la fecha del fallecimiento o último seguimiento. El tiempo fue medido en meses. Los siguientes eventos fueron considerados en la SLE: recidiva (locorregional, a distancia o ambos) y muerte por cualquier causa. Las pacientes vivas y abandonos fueron censurados.
Se utilizó el modelo de regresión logística para determinar la probabilidad de lograr una RPc y los factores predictivos incluidos en el análisis fueron: edad, estadio clínico, estado menopáusico, RE, RPg, HER2, grado histológico y número de ciclos administrados. Los resultados fueron expresados como razón de momios (por sus siglas en inglés OR) con sus intervalos de confianza del 95% (IC 95%) y valores de p correspondientes.
Las curvas de supervivencia se estimaron mediante el método de Kaplan-Meier24 y se empleó la prueba de rangos logarítmicos para comparar diferencias en ambas cohortes; el modelo de riesgo proporcional de Cox25 se llevó a cabo para evaluar la influencia relativa de los factores predictivos y la prueba de rangos logarítmicos se realizó para comparar grupos. En ambos métodos se estimó la razón de riesgos (por sus siglas en inglés HR) con IC 95% y valores de p correspondientes. En el modelo de Cox las siguientes covariables fueron predefinidas: edad (< 50 años vs. > 50 años), estadio clínico (IIIB-C vs. IIIA), RE (negativo vs. positivo), HER2 (positivo vs. negativo, RPc (no vs. sí), número de ganglios positivos posquimioterapia (> 4 vs. 1-3 vs. 0) y número de ciclos (4 vs. 6). Además, se evaluó el impacto del estado del RE de acuerdo a la RPc en la SLE.
Todos los valores fueron de dos colas con un nivel de significación de 5% y un poder de 80%. Los análisis estadísticos fueron realizados en un software estadístico denominado SPSS versión 15 (SPSS Inc., Chicago, IL).
ResultadosLas características clinicopatológicas de ambas cohortes se comportaron de manera similar como se muestra en la tabla 1. Para el grupo entero, la mediana de edad fue de 51 años (límites: 28 a 74). De acuerdo con la enfermedad avanzada, 76 pacientes (63.3%) correspondieron a EC IIIA, 41 (34.1%) a EC IIIB y solo 3 (2.5%) a EC IIIC. El promedio del tamaño del tumor fue de 7.1 ± 2.3cm debido al diagnóstico del cáncer en etapa avanzada. La mayoría de los tumores independientemente del tamaño del tumor correspondieron a RE positivo (66.6%) y HER2 negativo (73.3%).
Características de las pacientes y del tumor
| Característica | 4 FE100C | 6 FE100C | P* |
|---|---|---|---|
| n = 60 (%) | n = 60 (%) | ||
| Edad, años | |||
| ≤ 50 | 32 (53.3) | 23 (38.3) | 0.099 |
| > 50 | 28 (46.7) | 37 (61.7) | |
| Tamaño del tumor ç | |||
| T2 | 4 (6.7) | 7 (11.7) | 0.381 |
| T3 | 38 (63.3) | 31 (51.6) | |
| T4 | 18 (30.0) | 22 (36.7) | |
| Estado ganglionar ç | |||
| N1 | 18 (30.0) | 19 (31.7) | 0.835 |
| N2 | 40 (66.7) | 40 (66.7) | |
| N3 | 2 (3.3) | 1 (1.6) | |
| Etapa clínica ç | |||
| IIIA | 40 (66.7) | 36 (60.0) | 0.561 |
| IIIB | 18 (30.0) | 23 (38.3) | |
| IIIC | 2 (3.3) | 1 (1.7) | |
| Grado histológico + SBR | |||
| BD | 4 (6.7) | 4 (6.7) | 0.824 |
| MD | 38 (63.3) | 41 (68.3) | |
| PD | 18 (30.0) | 15 (25.0) | |
| Tipo histológico | |||
| Ductal invasivo | 38 (63.3) | 40 (66.7) | Ref.* |
| Lobular invasivo | 18 (30.0) | 14 (23.3) | 0.472 |
| Mixto invasivo | 4 (6.7) | 6 (10.0) | 0.603 |
| Invasión linfovascular | |||
| Ausente | 46 (76.6) | 50 (83.3) | 0.361 |
| Presente | 14 (23.4) | 10 (16.7) | |
| Receptor de estrógeno | |||
| Negativo | 17 (28.3) | 23 (38.3) | 0.245 |
| Positivo | 43 (71.7) | 37 (61.7) | |
| Receptor progesterona | |||
| Negativo | 21 (35.0) | 31 (51.7) | 0.065 |
| Positivo | 39 (65.0) | 29 (48.3) | |
| Estado del HER2 | |||
| Negativo | 42 (70.0) | 47 (78.3) | 0.409 |
| Positivo | 18 (30.0) | 13 (21.7) | |
| Triple negativo | |||
| No | 49 (81.7) | 46 (76.7) | 0.500 |
| Sí | 11 (18.3) | 14 (23.3) | |
F: 5-fluorouracilo; E: epirrubicina; C: ciclofosfamida; Ç: 6.a. edición de la clasificación de TNM del AJCC; +SBR: escala Scarff-Bloom-Richardson.
La tabla 2 muestra un incremento significativo en la tasa de RO a favor de la cohorte 6 FE100C en comparación con la cohorte 4 FE100C (85 vs. 65%, respectivamente; p = 0.011), esto incluye la respuesta clínica completa (RCc) del 33.3% (IC 95%, 21.2 a 45.5) con 6 FE100C frente al 8.3% (IC 95%, 1.2 a 15.5; p = 0.005) con 4 FE100C. Para el grupo entero, se observó por evaluación clínica una reducción del tumor ≥ 50% posquimioterapia en 90 casos (75%). De este grupo se obtuvó una RCc en 26 pacientes (28.8%) con tumores T2-3 y en solo 3 casos (3.3%) con tumores T4. Ninguna paciente tuvo progresión de la enfermedad durante el tratamiento previo a la cirugía.
Tasa de la respuesta clínica y respuesta patológica posquimioterapia en pacientes con cáncer de mama avanzado
| Tipo de respuesta | 4 FE100C | 6 FE100C | P* | ||
|---|---|---|---|---|---|
| n = 60 (%) | RO | n = 60 (%) | RO | ||
| Respuesta clínica | |||||
| RCc | 5 (8.3) | 65.0% | 20 (33.3) | 85.0% | 0.011 |
| RCp | 34 (56.7) | 31 (51.7) | |||
| EE | 21 (35.0) | 9 (15.0) | |||
| Respuesta patológica completa (RPc) | |||||
| Sí | 6 (10.0) | 10 (16.7) | 0.283 | ||
| No | 54 (90.0) | 50 (83.3) | |||
C: ciclofosfamida; E: epirrubicina; EEc: enfermedad estable; F: 5-fluorouracilo; RCc: respuesta clínica completa; RCp: respuesta clínica parcial; EE: enfermedad estable; RO: respuesta objetica (RCc + RCp).
Aunque los datos mostraron un ligero incremento en la tasa de RPc a favor de 6 FE100C en comparación con 4 FE100C (16.7 vs. 10%, respectivamente; p = 0.283), en la interacción del tratamiento la diferencia no alcanzó la significación estadística (tabla 2).
La ocurrencia de ganglios linfáticos axilares negativos posquimioterapia fue similar para 4 FE100C y 6 FE100C (33.3 y 35%, respectivamente; p = 0.847) (tabla 3).
Correlación entre el estado ganglionar axilar patológico y número de ciclos
| Número de ganglios axilares involucrados posquimioterapia | |||||
|---|---|---|---|---|---|
| 0 ganglios | 1-3 ganglios | 4-9 ganglios | >10 ganglios | ||
| Número de ciclos: | n (%) | n (%) | n (%) | n (%) | P* |
| 4 ciclos | 20 (33.3) | 19 (31.7) | 17 (28.3) | 4 (6.7) | .847 |
| 6 ciclos | 21 (35.0) | 17 (28.3) | 20 (33.3) | 2 (3.3) | |
Del grupo entero, 17 de las 37 pacientes (45.9%) con ganglio clínico N1 tuvieron ganglios patológicos positivos (pN+). Con enfermedad N2, 58 de 79 pacientes (73.4%) tuvieron pN+, y solo 6 pacientes (5%) tuvieron más de 10 pN+.
El grupo de pacientes con RPc tuvieron menor tasa de recidivas a distancia en comparación con aquellas que tenían una respuesta tumoral incompleta (6.2 vs. 24%, respectivamente; p = 0.107), aunque la diferencia no alcanzó la significación estadística.
Las pacientes del grupo con respuesta tumoral primaria incompleta tenían más probabilidad de presentar recidiva a distancia en los primeros 24 meses después de cirugía en comparación con las pacientes que tuvieron recidiva a distancia después de 24 meses (57.6% [n = 15] v 42.3% [n = 11], respectivamente; p = 0.530), independientemente del número de ciclos.
La aparición de las recidivas de acuerdo con la condición del tumor con RE, los datos mostraron una mayor ocurrencia de recidiva a distancia en el grupo de pacientes con tumores RE positivo en 74% (n = 20) y estas ocurrieron en los primeros 24 meses en el 50% (n = 10), independientemente del tamaño del tumor.
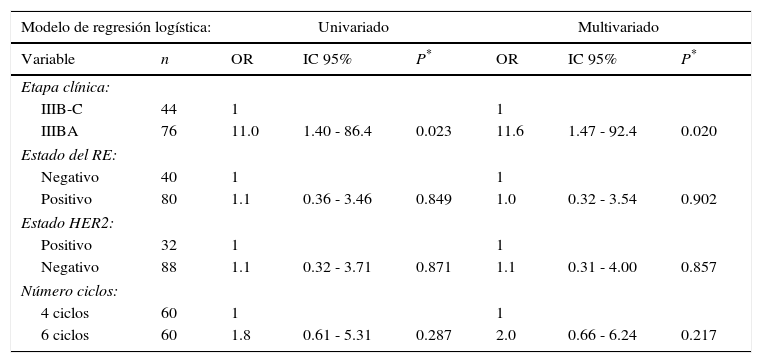
Predicción de la RPcEn el análisis univariado y multivariado del modelo de regresión logística solo un factor tuvo mayor probabilidad de lograr una RPc, el estadio clínico con OR de 11 (p = 0.023) y OR de 11.6 (p = 0.020), respectivamente. En cambio, el análisis multivariado de la regresión logística no mostró diferencias con respecto al RE positivo (OR, 1; p = 0.902) y 6 ciclos administrados (OR, 2; p = 0.217) (tabla 4).
Factores predictores para alcanzar una RPc de acuerdo con el análisis de regresión logística, (n = 120)
| Modelo de regresión logística: | Univariado | Multivariado | |||||
|---|---|---|---|---|---|---|---|
| Variable | n | OR | IC 95% | P* | OR | IC 95% | P* |
| Etapa clínica: | |||||||
| IIIB-C | 44 | 1 | 1 | ||||
| IIIBA | 76 | 11.0 | 1.40 - 86.4 | 0.023 | 11.6 | 1.47 - 92.4 | 0.020 |
| Estado del RE: | |||||||
| Negativo | 40 | 1 | 1 | ||||
| Positivo | 80 | 1.1 | 0.36 - 3.46 | 0.849 | 1.0 | 0.32 - 3.54 | 0.902 |
| Estado HER2: | |||||||
| Positivo | 32 | 1 | 1 | ||||
| Negativo | 88 | 1.1 | 0.32 - 3.71 | 0.871 | 1.1 | 0.31 - 4.00 | 0.857 |
| Número ciclos: | |||||||
| 4 ciclos | 60 | 1 | 1 | ||||
| 6 ciclos | 60 | 1.8 | 0.61 - 5.31 | 0.287 | 2.0 | 0.66 - 6.24 | 0.217 |
HER2: receptor 2 del factor de crecimiento epidérmico humano; IC: intervalo de confianza; OR: odds ratio; RE: receptor de estrógeno; RPc: respuesta patológica completa.
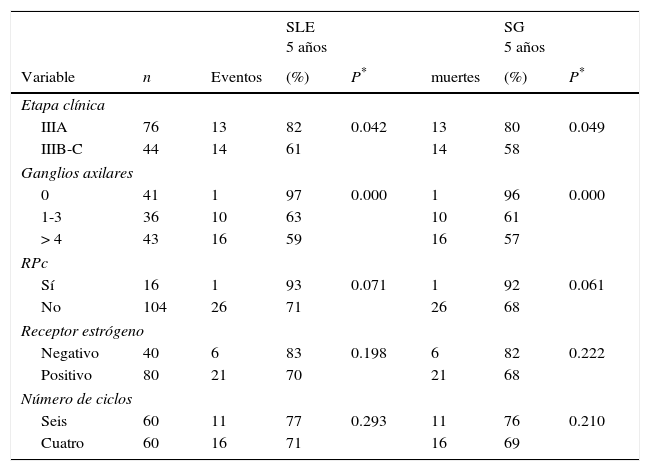
La tabla 5 muestra la supervivencia de acuerdo a los factores pronósticos posquimioterapia. El análisis univariado reveló que la etapa clínica y número de pN+ fueron los factores independientes de la SLE y de la SG.
Análisis univariado de la SLE y SG para factores predictores, (n = 120)
| SLE 5 años | SG 5 años | ||||||
|---|---|---|---|---|---|---|---|
| Variable | n | Eventos | (%) | P* | muertes | (%) | P* |
| Etapa clínica | |||||||
| IIIA | 76 | 13 | 82 | 0.042 | 13 | 80 | 0.049 |
| IIIB-C | 44 | 14 | 61 | 14 | 58 | ||
| Ganglios axilares | |||||||
| 0 | 41 | 1 | 97 | 0.000 | 1 | 96 | 0.000 |
| 1-3 | 36 | 10 | 63 | 10 | 61 | ||
| > 4 | 43 | 16 | 59 | 16 | 57 | ||
| RPc | |||||||
| Sí | 16 | 1 | 93 | 0.071 | 1 | 92 | 0.061 |
| No | 104 | 26 | 71 | 26 | 68 | ||
| Receptor estrógeno | |||||||
| Negativo | 40 | 6 | 83 | 0.198 | 6 | 82 | 0.222 |
| Positivo | 80 | 21 | 70 | 21 | 68 | ||
| Número de ciclos | |||||||
| Seis | 60 | 11 | 77 | 0.293 | 11 | 76 | 0.210 |
| Cuatro | 60 | 16 | 71 | 16 | 69 | ||
RPc: respuesta patológica completa; SG: supervivencia global; SLE: supervivencia libre de enfermedad.
Los tumores etapa IIIA en comparacion con tumores etapa IIIB-C fue un factor significativo para la SLE (82 vs. 61%, respectivamente; p = 0.042) y para la SG (80 vs. 58%, respectivamente; p = 0.049) (tabla 5 y fig. 1).
El número de pN+ también fue un factor pronóstico independiente, las pacientes con pN0 y con menor número de pN+ (1-3) comparado con aquellas que tenían más de 4 pN+ tuvieron una mejor SLE (97, 63, 59%, respectivamente; p = 0.000) y una SG (96, 61, 57%, respectivamente; p = 0.000) (tabla 5 y fig. 2). De las 79 pacientes con pN+ posquimioterapia, 25 (31.6%) desarrollaron metástasis a distancia y del grupo con pN0 solo un caso tuvo una recidiva sistémica (6.2%).
Las pacientes con una RPc (92%; p = 0.061) y aquellas que recibieron un número mayor de ciclos administrados (76%; p = 0.210) tuvieron un impacto favorable en la SG, aunque la diferencia no alcanzó la significación estadística como lo muestra la tabla 5.
Análisis multivariadoLos factores predictivos fueron previamente predefinidos. De los cuales, solo un factor parece ser independiente para la SLE y SG, el estado ganglionar.
El análisis multivariado de Cox afirmó que el número de pN+ es un factor pronóstico independiente de la SG, particularmente el subgrupo de 4 pN+ o más tuvo el peor pronóstico con HR de 19.3 (IC 95%, 2.5-147; p = 0.004). En cambio, no hubo diferencia significativa para el mayor número de ciclos administrados (HR, 1.4; p = 0.331) y para la RPc (HR, 4.1; p = 0.170) en la SG (tabla 6 y fig. 3).
Análisis multivariado de acuerdo con el modelo de Cox, (n = 120)
| SLE | SG | ||||||
|---|---|---|---|---|---|---|---|
| Variable | n | HR | IC 95% | P* | HR | IC 95% | P* |
| Ganglios: | |||||||
| 0 | 41 | 1 | 1 | ||||
| 1-3 | 36 | 19.6 | 2.5-149 | 0.003 | 19.3 | 2.5-147 | 0.004 |
| > 4 | 43 | 12.4 | 1.5-97 | 0.017 | 12.1 | 1.7-95 | 0.016 |
| Etapa clínica: | |||||||
| IIIA | 76 | 1 | 1 | ||||
| IIIB-C | 44 | 1.8 | 0.8-3.9 | 0.126 | 1.7 | 0.8-3.7 | 0.149 |
| Estado del RE: | |||||||
| Positivo | 80 | 1 | 1 | ||||
| Negativo | 40 | 0.5 | 0.2-1.4 | 0.219 | 0.5 | 0.2-1.4 | 0.259 |
| RPc: | |||||||
| Sí | 16 | 1 | 1 | ||||
| No | 104 | 3.9 | 0.5-30 | 0.184 | 4.1 | 0.5-31 | 0.170 |
| Núm. de ciclos: | |||||||
| 6 FEC | 60 | 1 | 1 | ||||
| 4 FEC | 60 | 1.3 | 0.6-2.9 | 0.412 | 1.4 | 0.6-3.1 | 0.331 |
HR: razón de riesgos; IC: intervalo de confianza; RE: receptor de estrógeno; RPc: respuesta patológica completa; SG: supervivencia global; SLE: supervivencia libre de enfermedad.
Para el grupo entero, durante el seguimiento con una mediana de 53 meses (límites, 12- 85 meses) del grupo RPc, solo un caso presentó recidiva a distancia. En cambio, el grupo de pacientes con tumor residual presentaron recidiva a distancia en 15 pacientes de la cohorte 4 FE100C y en 11 pacientes de la cohorte 6 FE100C. Además, en la cohorte 4 FE100C hubo una recidiva local asociada con enfermedad sistémica, y una muerte debido a complicaciones por insuficiencia renal avanzada sin enfermedad neoplásica. En ambas cohortes, todas las pacientes con tumor residual que tuvieron una recidiva a distancia posterior a la QN han muerto.
La mediana de seguimiento de la SLE fue de 42 meses (límites, 7 a 95) para 4 FE100C y de 46 meses (límites, 4 a 69) para 6 FE100C. La mediana de seguimiento de la SG fue de 49 meses (límites, 14 a 85) para 4 FE100C y de 56 meses (límites, 12 a 75) para 6 FE100C. La ventaja de supervivencia total observada en las pacientes tratadas con 4 FE100C se relaciona con el periodo inicial de selección de las pacientes.
DiscusiónNuestro estudio reveló un ligero incremento de la tasa de RPc de las pacientes que recibieron 6 ciclos de epirrubicina en esta población de estudio. Sin embargo, el CMLA se asocia con un mal pronóstico, y es difícil predecir el curso clínico incluso aún cuando los tumores tienen una RPc, debido a que las respuestas tienen diversos resultados a la quimioterapia. La mayoría de los casos son tratados satisfactoriamente con un tratamiento multidisciplinario, pero la tasa de mortalidad aún no ha disminuido para este grupo de pacientes2,3,6,7,26.
Actualmente, la RPc se considera como el factor pronóstico más poderoso y se asocia con un incremento de la SLE a largo plazo. Un gran número de estudios han mostrado que las pacientes que han obtenido una RPc tienen una mejor SLE a 5 años (aproximadamente del 90%) en comparación con aquellas pacientes con tumor residual (menor del 60%)2,3,8. La tasa de RPc también incluye el estado de los ganglios linfáticos patológicos6–12,27,28.
Las tasas de recidiva local y sistémica varían de acuerdo con diferentes series, pero en general, las recidivas a distancia son dominantes. Un pequeño porcentaje de pacientes con cáncer de mama avanzado con RPc, aún experimentan recidiva sistémica (13-25%)6,10,28.
El estado de los ganglios axilares posquimioterapia es otro factor pronóstico importante, varios estudios han evaluado que la QN reduce la incidencia de pN+12,29–34, y el pronóstico es inversamente proporcional al número de pN+6,12,30,31.
La ausencia de ganglios afectados puede reflejar la sensibilidad de los fármacos, al menos en algunos casos12. Pocos estudios han evaluado la razón ganglionar posquimioterapia y las pacientes con una mayor razón ganglionar (también descrito como porcentaje de ganglios afectados) tenían un pobre pronóstico en la supervivencia. Estos estudios evaluaron el porcentaje de ganglios afectados en comparación con el número absoluto de ganglios afectados, señalando que este parámetro puede ser superior como factor indicador independiente en pacientes con cáncer de mama en estadio II /III35,36.
Estudios moleculares han encontrado que las diferencias genéticas observadas en las células del tumor primario y de metástasis en los ganglios linfáticos axilares podrían explicar los diferentes resultados de quimiosensibilidad, esto repercute en la SLE12,30.
Para el grupo entero en este estudio, el número de ganglios linfáticos axilares metastásicos residuales en el análisis multivariado de Cox fue un predictor independiente de la SLE, con una mediana de seguimiento de 45 meses el subgrupo de 4 pN+ o más (p = 0.003) tuvo un impacto negativo en el pronóstico.
Hay información suficiente del uso de las antraciclinas (doxorrubicina, epirrubicina) como tratamiento de primera elección en la QN. Al emplear un mínimo de 3 a 4 ciclos se obtiene una baja tasa de RPc (3 al 16%)6,37–40. Los ciclos adicionales pueden ser considerados para maximizar la respuesta, de modo que, se han preferido 6 ciclos de antraciclinas como QN para obtener un mejor resultado en la tasa de RPc (15 al 24%)18,28,41,42. Por lo tanto, 6 ciclos son mejores que 4 ciclos de FEC.
En este estudio el uso de un mayor número de ciclos de epirrubicina tuvo un ligero incremento no significativo (p = 0.331) en la SG. Los ciclos adicionales parecen reflejar una mayor eficacia en comparación con un periodo de tratamiento más corto7,18,32–34,43. Otro beneficio de la QN es la posibilidad de cambiar a un régimen diferente si el tumor no responde32–34,43.
El análisis de varios ensayos aleatorios han informado una probabilidad de obtener una mayor tasa de RPc para las mujeres con tumores RE negativos en comparación con tumores RE positivos independientemente del régimen, del fármaco o duración de la QN3,6,11,29,33,37,44. En contraste con los estudios anteriormente mencionados, en este reporte los tumores RE positivos se correlacionaron favorablemente con una RPc. En cambio, la ausencia de expresión de los RE mostraron un favorable incremento no significativo (83%; p = 0.198) en la SLE a 5 años.
Aunque la muestra de este estudio no fue lo suficientemente grande, se pudo agrupar un número determinado de pacientes de acuerdo a la etapa avanzada. El estudio tiene ciertas limitaciones como: el análisis retrospectivo, la probabilidad de sesgo de selección en pacientes con esquema completo de QN y la baja tasa de RPc, este último, quizás debido relativamente a tumores demasiadso grandes que podrían contribuir a debilitar el valor pronóstico de la RPc.
No obstante, nuestros resultados pueden ser lo suficientemente consistentes dado que nuestra población es homogénea en términos del apego de un tratamiento homogéneo con quimioterapia y cirugía. La cirugía fue realizada por dos cirujanos oncólogos y la quimioterapia fue aplicada por un oncólogo médico en una sola institución.
A pesar de un número limitado de eventos en cada cohorte, es posible sacar conclusiones definitivas de este estudio donde no se identificó un beneficio significativo en términos de la SLE y SG para aquellas pacientes que tenían una RPc en comparación con aquellas que tenían un tumor residual invasivo. Las pacientes del grupo con tumor residual con pN+ (>4) posquimioterapia han sido capaces de tener una buena expectativa de vida en ambas cohortes, una posible explicación es el sesgo de selección de pacientes con un número diferente de ciclos sin ser aleatorizados y al tamaño limitado de la muestra. Por lo tanto, los datos deben ser interpretados con cautela.
ConclusiónLa epirrubicina es un fármaco quimioterapéutico de primera elección en el tratamiento de pacientes con cáncer de mama avanzado. Aunque este estudio proporcionó información limitada para indicar un mejor régimen de quimioterapia para tratar el CMLA.
La duración de la quimioterapia es importante, en nuestro hospital, 6 ciclos de epirrubicina neoadyuvante con dosis alta de epirrubicina tuvo un incremento ligero en la tasa de efectividad (RPc), sin embargo no hubo posibilidad de mejorar las tasas de SLE y de ganglios axilares negativos en comparación con un periodo de tratamiento más corto.
Los resultados de una baja tasa de RPc en este estudio y el mal pronóstico en las pacientes con CMLA justifican el desarrollo de nuevas estrategias con fármacos citostáticos y esquemas diferentes para obtener mejores resultados.
FinanciaciónNinguna.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este trabajo se presentó dentro del marco del XXXIII Congreso Nacional de Oncología llevado a cabo del 21 al 24 de octubre de 2015 en Cancún, Q. Roo, México. (Abstract: folio 122).