La quimiorresistencia es la principal causa de falla a la quimioterapia neoadyuvante (QTN).1,2 El estudio de los mecanismos de quimio-resistencia en la clínica como blanco primario tiene implicaciones importantes en la selección de regímenes terapéuticos.
Ante la exposición a un agente citotóxico in vitro, la sensibilidad y la resistencia se presentan en las células de manera simultánea estimulando o inhibiendo temporalmente su crecimiento; en contraste, debido a la heterogeneidad in vivo de las poblaciones celulares, la exposición a un agente citotóxico genera resultados variados en función del número de células sensibles o resistentes dentro de dicha población.3 Este fenómeno se denomina clonalidad celular. El uso de modelos in vitro implementado por Skipper y Perry se ha utilizado desde hace 30 años para explicar la biología del cáncer humano;4 sin embargo, la inmortalización y los xenotrasplantes de líneas celulares en modelos murinos desafortunadamente no reflejan la misma heterogeneidad de los cánceres humanos in vivo.
Múltiples líneas celulares neoplásicas inmortales se caracterizan por presentar diversas alteraciones genéticas,5,6 como mutaciones en genes clave en la apoptosis inducida porquimioterapia.7,8 Lo anterior explica por qué algunas neoplasias son quimiorresistentes aún sin haber recibido tratamiento previo (resistencia tumoral innata). Sin embargo, la quimiorresistencia también puede ser adquirida, lo que se demuestra durante el tratamiento con segundas o terceras líneas de quimioterapia (QT). Otra posible causa que ha sido discutida es la misma propiedad mutagénica de los fármacos que podrían inducir resistencia a otros.9 Los estudios comparativos y las observaciones clínicas sugieren varias diferencias en los mecanismos de quimio-resistencia como: sobreexpresión de proteínas de bomba de membrana (tipo MDR y Glicoproteína-P), además de ciertos oncogenes, desregulación de enzimas metabolizadoras de fármacos (Citocromo P450) y mutaciones de genes involucrados en la apoptosis (genes de la familia Bcl-2, p53 y caspasas).
Por el contrario, ahora sabemos que un factor importante de la resistencia a las antraciclinas es por vía de la glicoproteína-P, la cual es codificada por el gen de resistencia a multifármacos (MDR), también desde hace algunos años implicado en la vía apoptótica.10 Otro mecanismo común de resistencia lo representa la desregulación de la glutación.
Estudios recientes se han enfocado en la sobreexpresión del protooncogén HER-2/neu,11 en los defectos de la enzima topoisomerasa II12 y en las mutaciones del gen p53.13
Existen múltiples mecanismos de resistencia a quimioterapia, y varios de éstos se encuentran vinculados,14,15 como se observa en la asociación de la sobreexpresión del oncogén HER-2/neu, la sensibilidad a antraciclinas y la sobreexpresión de la topoisomerasa II, enzima coamplificada por HER-2/neu.
Park K y colaboradores16 analizaron 67 pacientes con CMLA tratadas con Quimioterapia Neoadyuvante (QTN) basada en doxorrubicina, y observaron mayores tasas de respuesta en quienes presentaron co-amplificación de HER-2/neu y topoisomerasa II (18/19), en comparación con pacientes que no la presentaban (17/36), con lo que se concluye el papel determinante de dichos genes en la sensibilidad de esta neoplasia.
¿ FACTORES PRONÓSTICOS Y PREDICTIVOS DE LA RESPUESTA A LA QUIMIOTERAPIA
Los factores pronósticos son aquéllos relacionados con el desarrollo de metástasis de una neoplasia17e influyen en el riesgo de recaída o muerte, independientemente de su tratamiento.18Por su parte, los factores predictivos se asocian a la sensibilidad o resistencia al tratamiento citotóxico del tumor.
El estado de receptores hormonales (RE, receptor de estrógenos y RPg, receptor de progesterona) en cáncer de mama temprano son factores pronósticos débiles; sin embargo, son adecuados predictores de respuesta a la hormonoterapia.19 Su valor en enfermedad localmente avanzada es controversial.20
La utilidad del estudio de la sensibilidad a la quimioterapia radica en: 1). La evaluación directa de la respuesta objetiva tumoral,21 así como la respuesta celular mediante la determinación del índice apoptótico,22 2).
El monitoreo de las lesiones medibles y por último, 3). La comparación, en biopsias de control, de los cambios en las características biológicas secundarias al tratamiento. Sin embargo, se desconoce si los efectos de la QTN pueden ser un parámetro de respuesta y considerarse de valor pronóstico.
Actualmente se están investigando los cambios histopatológicos y marcadores moleculares como factores pronósticos y predictivos de respuesta a quimioterapia.23
¿ APOPTOSIS Y PROLIFERACIÓN CELULAR COMO BIOMARCADORES EN EL CÁNCER DE MAMA
La apoptosis es un mecanismo regulador importante en el crecimiento y desarrollo celular, que al inhibirse conduce a la carcinogénesis. Cuando existe pérdida del equilibrio entre la proliferación y la muerte celular o apoptosis, se favorece la tasa de crecimiento o bien, la remisión tumoral.24
Debido a que varios antineoplásicos requieren una vía apoptótica para inducir muerte celular, se pueden estudiar la proliferación celular y apoptosis como predictores de respuesta a QT, considerando que sus vías principales convergen en varios puntos, igual que los procesos biológicos regulados por el gen supresor de tumor p53.24
La apoptosis y la proliferación celular se han relacionado estrechamente en diversos reportes de pacientes con cáncer de mama previamente tratadas con QT.25-27 La población celular con mayores tasas de proliferación, también muestra elevadas tasas de apoptosis.
Lo anterior se asocia con tumores de alto grado, sobreexpresión del oncogén HER-2/neu y del gen supresor de tumor p53; y de manera inversa, la expresión del oncogén Bcl-2 y de RE se asocia con un pobre pronóstico.28
No obstante, la evidencia que permita señalar a la apoptosis como marcador pronóstico independiente en cáncer, no ha sido demostrada,29-32 aun cuando se publicó en una gran serie de pacientes con cáncer de mama (más de 700) la relación entre apoptosis, sobrevida libre de enfermedad (SLE), sobrevida global (SG) y la presencia de ganglios positivos. En este estudio no se identifica a la apoptosis como un marcador pronóstico independiente,30 lo cual no descarta esta posibilidad, pues otros estudios ha señalado a la apoptosis como una variable independiente cuando se correlaciona con otros indicadores pronósticos.31
Recientemente se ha identificado a una nueva familia de genes inhibidores de la apoptosis que pueden tener un mayor potencial como marcadores predictivos o pronósticos (XIAP, cIAP1, cIAP2, NIAP y survivina en humanos).32
El producto protéico de estos genes inhibe la apoptosis por unión directa e inactivación de las caspasas. El inhibidor más potente hasta ahora, es el XIAP.
Por otra parte, otros estudios indican que los tumores con alto grado de proliferación celular (determinado por la expresión de las proteínas Ki-67 o MIB-1) están fuertemente asociados con una disminución en la SLE y SG, en gran parte debido a su quimiorresistencia.33,34 Si bien es sabido que el grado tumoral también se relaciona con la respuesta a los agentes citotóxicos, esta observación probablemente demuestra las diferencias genéticas asociadas con cada tejido tumoral. Esto se demostró en un meta-análisis que incluyó 46 ensayos (n = 12 155), en el que la positividad paraKi-67/MIB-1 se asoció con un riesgo significativamente mayor de recaída, tanto enfermedad con ganglios positivos (HR 1.59, 95% CI 1.35-1.87) como ganglios negativos (HR 2.31, 95% CI 1.83-2.92). También se encontró relación entre la positividad a Ki-67/MIB-1 y menor sobrevida, independientemente al estatus ganglionar.35 No obstante, la falta de estudios prospectivos impide llevar estos resultados a la práctica clínica.
Aun cuando se ha demostrado en el tejido residual post-QT una reducción significativa en los niveles de apoptosis en clonas quimiorresistentes, el balance entre apoptosis y proliferación celular se mantiene sin variaciones, cuestionando si la disminución en ésta es el resultado de una sub-regulación proliferativa por una vía molecular inactiva, o bien, es resultado de células residuales menos proliferantes e intrínsecamente menos sensibles a la QT.
Se ha detectado una mayor concentración de proteína Bcl-2 en la población de células residuales, aunque se considera que Bcl-2 podría ser el único factor relacionado con la disminución de la proliferación celular, gracias a sus propiedades reguladoras e inhibidoras de la apoptosis.28,29 Asimismo, un índice proliferativo elevado en el tumor residual se asocia con menor SG, lo que se refleja en los hallazgos de Vakkala y colaboradores,36 en el que se aprecia que el aumento de la proliferación celular y la disminución del índice apoptótico en tumores de mama recurrentes predicen un peor pronóstico. Aas y colaboradores, determinaron la proliferación celular tumoral como factor predictivo en CMLA tratado con doxorrubicina neoadyuvante a través de la frecuencia mitótica y los niveles de Ki-67.El análisis univariado mostró una asociación significativa entre la tasa de proliferación celular (frecuencia mitótica alta) y resistencia a la doxorrubicina (p = 0.001); sin embargo, esta relación se limitó a un subgrupo de tumores que expresaron una proteína p53silvestre (p = 0.016). El estado del gen p53 mutado fue el único factor predictivo de quimiorresistencia en el análisis multivariado. Se concluye que una frecuencia mitótica alta y una elevada expresión de la proteína Ki-67, se correlacionan con la mutación del gen p53 (p = 0.001 para ambos), lo cual es útil como predictor de la fármaco resistencia en los tumores mamarios, sin descartar que la proliferación celular podría jugar un papel adicional en los tumores que albergan un gen p53 tipo silvestre.37
¿ PERFILES DE EXPRESIÓN GÉNICA EN EL CÁNCER DE MAMA
Pese a que los predictores clínicos han demostrado utilidad, no se ha determinado su aplicación clínica concluyente. Las mediciones genómicas proporcionan información para identificar patrones de actividad de los mismos y subclasificarlos.38
Huang y colaboradores,39 observaron un patrón agrupado de expresión de genes (metagenes) con capacidad para predecir metástasis linfática ganglionar y recurrencia de la enfermedad de manera individual, con una especificidad de alrededor de 90%. Estos metagenes sugieren la participación de múltiples procesos biológicos en el cáncer de mama que incluyen a los genes inducidos por interferones, varias citocinas y sus receptores (RANTES, CXCL10, CCR2), algunos genes interferón-inducidos (IFI30, IFI35, IFI27, IFI44, IFIT1, IFIT4, IFITM3) y genes efectores de interferón (2´-5´oligo A sintetasa), además de genes codificadores de proteínas, genes mediadores de la inducción de éstos (STAT1 y IRF1), y genes involucrados en la función de células-T (TCRA, CD3D, IL2R, MHC).
¿ MARCADORES BIOMOLECULARES EN EL CÁNCER DE MAMA
En la actualidad no se cuenta con factores moleculares predictivos de respuesta o resistencia a la QT con utilidad clínica. Los marcadores a analizar incluyen: el gen MDR1 (gp170), la enzima topoisomerasa II, la fase-S del ciclo celular, el gen HER-2/neu y el gen p53, entre otros. De éstos, los más relevantes parecen ser HER-2/ neu y p53.
El HER-2/neu, localizado en el cromosoma 17q23, codifica para una glucoproteína transmembranal de 185-kD y es uno de los cinco miembros de la familia del receptor del factor de crecimiento epidérmico; se sobreexpresa en 20% a 40% de los cánceres de mama, y confiere un mal pronóstico clínico (Figura 1). En estudios retrospectivos, se ha demostrado que es un factor predictivo de respuesta a QT, específicamente para antraciclinas (doxorrubicina).40
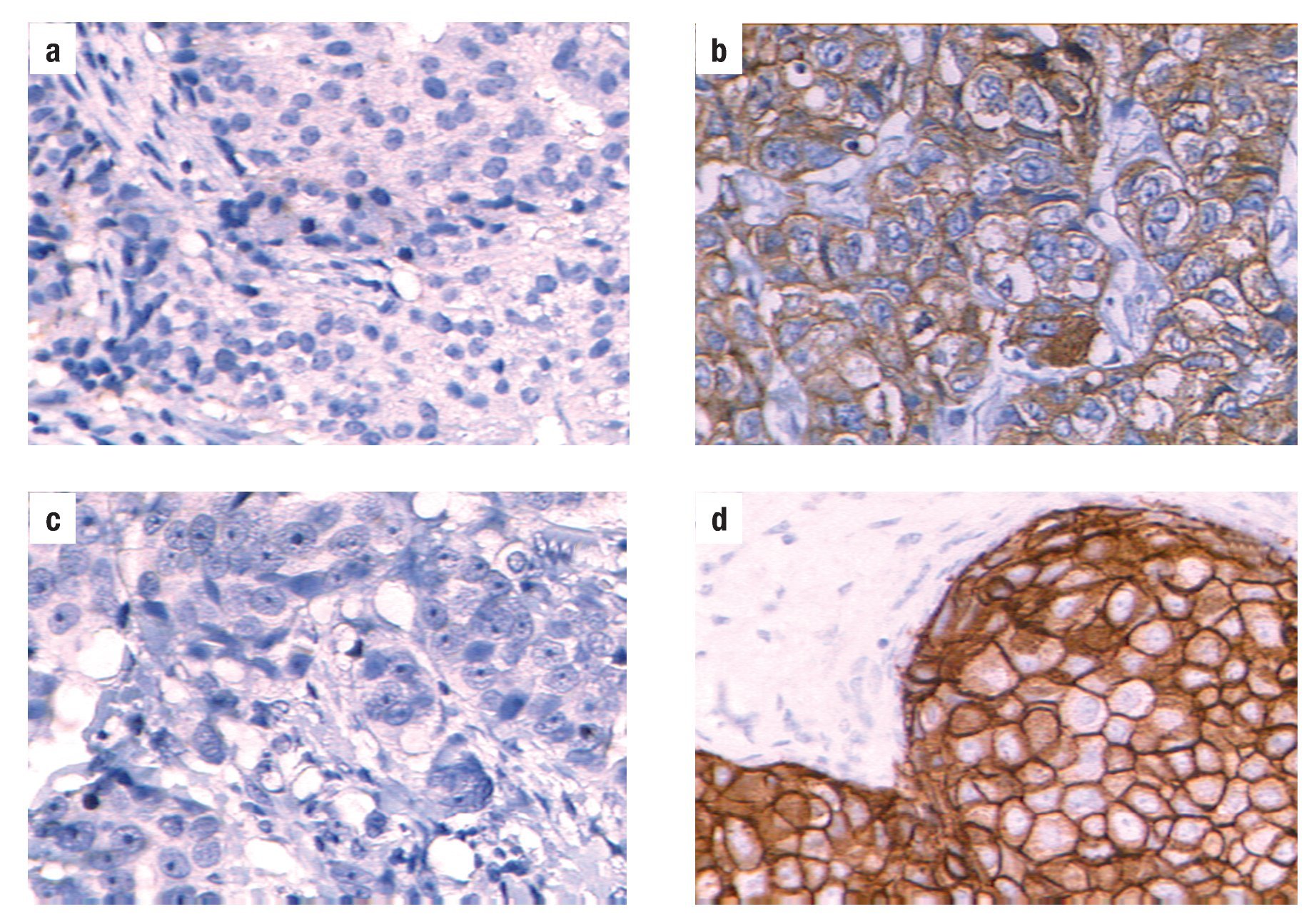
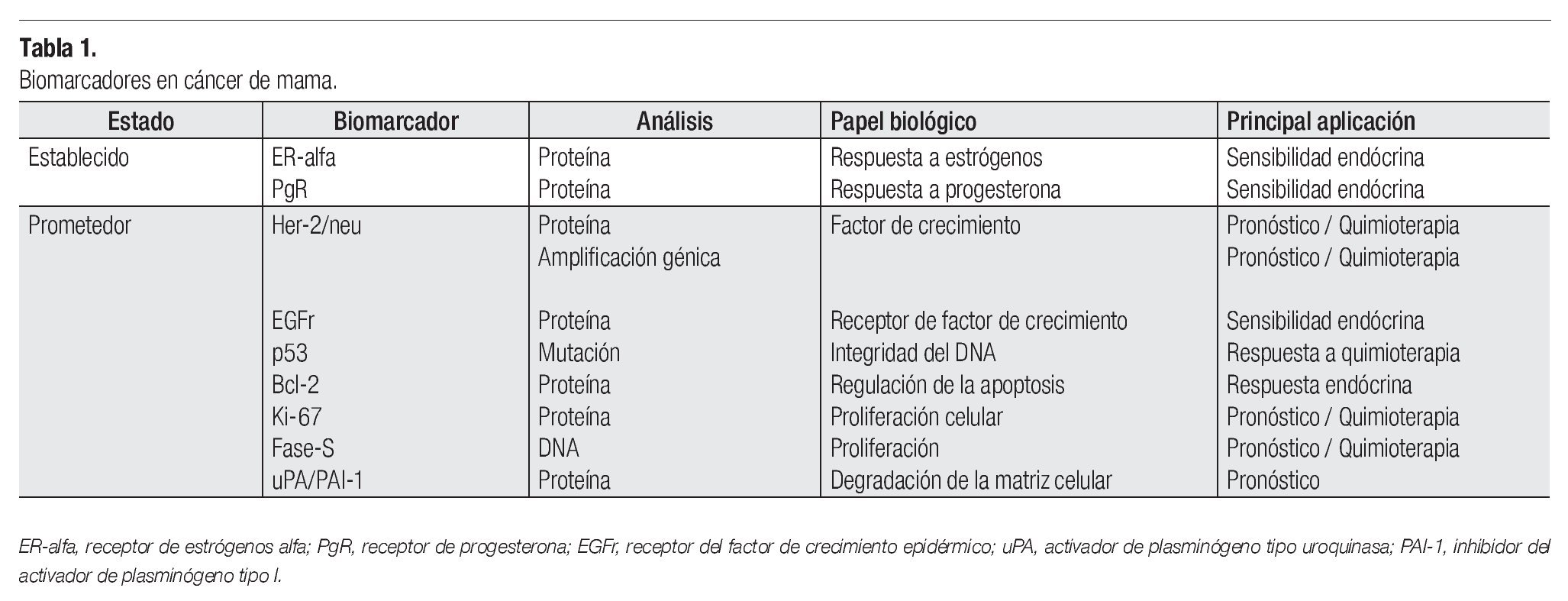
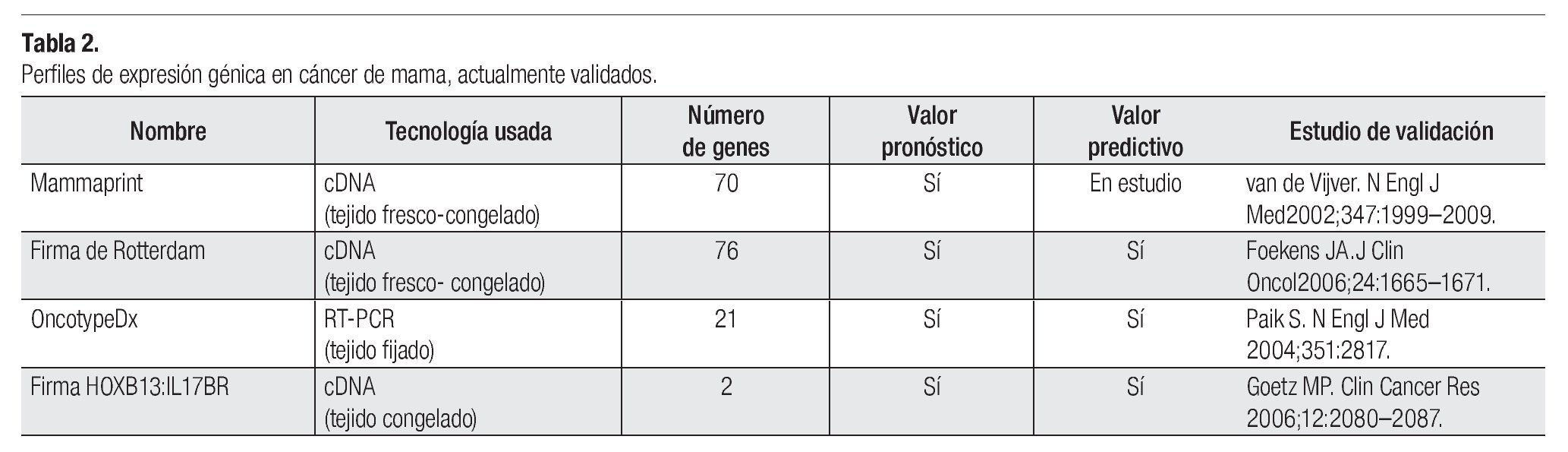
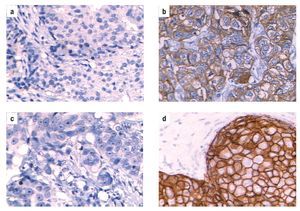
Figura 1. Análisis de expresión del biomarcador HER-2/neu en biopsias de cáncer de mama. (a). Biopsia negativa para el biomarcador HER-2/neu, (b). Biopsia positiva para el biomarcador HER-2/neu con un puntaje de (+); (c). Micrografía de un control negativo para la muestra de estudio del panel (b). En el panel (d) micrografía con un resultado de (+++) para el biomarcador HER-2/neu en una biopsia de cáncer de mama
El papel clínico de HER-2/neu como factor predictivo de sensibilidad, específicamente con antraciclinas, ha sido analizado en diversos ensayos, con resultados poco uniformes. Dos meta-análisis sugirieron un mayor beneficio del tratamiento con antraciclinas en mujeres con tumores con sobreexpresión del HER-2/neu.41,42 En contraste, en el ensayo clínico fase III BR9601, que compara CMF vs.Epirrubicina seguido de CMF, se evidenció un mayor beneficio en sobrevida libre de progresión (SLP) y SG en pacientes con tumores que tenían una expresión normal de HER-1, HER-2 y HER-3. No se observó beneficio en administrar antraciclinas a pacientes con tumor que sobreexpresaba HER-2/neu.43
La TOPO2A es el blanco de las antraciclinas y se ha sugerido que sus alteraciones están asociadas a quimiosensibilidad.44,45 Se conoce que este gen se encuentra adyacente a HER-2/neu en el cromosoma 17q12-21. El estudio TOP, es el primer ensayo prospectivo que ha intentado establecer si el gen de TOPO2A (y no la proteína) predice la sensibilidad a antraciclinas. Ciento cuarenta y nueve pacientes recibieron epirrubicina neoadyuvante seguida de docetaxel adyuvante e irradiación. Se obtuvo una respuesta completa patológica (RCp) en 14.5% de las pacientes. La amplificación del gen TOPO2A (11% de los casos) sólo se observó en quienes presentaron amplificación de HER-2/ neu (33%). Hubo correlación estadísticamente significativa entre la amplificación del gen TOPO2A y la RCp (p = 0.0002); sin embargo, ni la sobreexpresión de la proteína TOPO2A determinada por IHQ, ni la determinación del mRNA, ni la polisomía del cromosoma 17, mostraron correlación con la respuesta a epirrubicina.46
Otro estudio con antraciclinas neoadyuvante, contradice al anterior y menciona que la expresión de la proteína TOPO2A medido por IHQ, previo a la quimioterapia, tanto en al análisis multivariado como univariado, presenta correlación con la RCp (p = 0.021).47
En cuanto a los taxanos, en un estudio preliminar con paclitaxel más radioterapia neoadyuvante (RTN) se observó que la sobreexpresión de la proteína HER-2/neu identificada por IHQ se asoció con una mejor respuesta clínica, comparada con tumores HER-2/neu negativos;48 no obstante, en otro ensayo de paclitaxel más RTN en enfermedad locorregionalmente avanzada, los tumores HER-2/neu negativos mostraron una mayor tasa de respuesta.49 Hasta el momento, diversos estudios aleatorios sugieren que la sobreexpresión de HER-2/neu (detectado por IHQ) se asocia a una baja probabilidad de beneficio con un esquema adyuvante de ciclofosfamida, metotrexate y 5-fluorouracilo (CMF), comparado con tumores que no expresan la proteína en pacientes con cáncer de mama en etapa temprana.50
Por otra parte, el gen p53 ha surgido como un posible factor pronóstico y predictivo en el cáncer de mama, aunque su valor aún no está bien establecido, se ha observado que su asociación con HER-2/neu podría tener un mayor valor predictivo que utilizándolo solo.51
En un estudio realizado por Yamashita y colaboradores, la asociación de la sobreexpresión de HER-2/neu y la presencia del gen p53 en 506 muestras con carcinoma ductal infiltrante, fue un marcador molecular pronóstico. En el análisis multivariado, las pacientes con presencia de ambos genes presentaron recaída y fallecieron dentro de un periodo postquirúrgico significativamente corto (p = 0.0001 y p <0.0001, respectivamente), con una disminución considerable en la SVG (p = 0.04).52
De acuerdo a las características moleculares y bioquímicas tumorales en pacientes con carcinoma de mama inflamatorio, se está intentando establecer el tratamiento óptimo mediante el desarrollo de nuevos blancos terapéuticos, aunque éstos no han sido validados para su uso en la práctica clínica (Tabla 1).53
Diversos estudios sobre factores biológicos en cáncer locorregionalmente avanzado o inflamatorio han analizado marcadores que incluyen: RE, RPg, MIB-1, HER-2/neu, p53 y ciclina D1 (todos por IHQ), tratando de determinar su valor pronóstico y predictivo mediante la respuesta clínica a cinco años. En el estudio de Bonnefoi y colaboradores54 evidenciaron que la presencia de p53 se asoció con menor SLP y SG. Sin embargo, el RPg fue un predictor de mayor SG, sin correlacionarse de forma significativa con el grado de expresión del receptor hormonal (RH), MIB-1, HER-2/neu o p53, y con una respuesta clínica completa. En este estudio se concluyó que p53 fue un factor predictivo para la sobrevida y el análisis univariado demostró que la ciclina D1 negativa se asoció con una baja tasa de respuesta clínica completa (p = 0.051).
¿ GEN SUPRESOR POR TUMOR P53 Y CÁNCER DE MAMA
El anticuerpo específico de p53 (Ac-p53) fue descrito por primera vez en 1982;55 actualmente se encuentran disponibles diversos sistemas de pruebas comerciales para su detección. La técnica utilizada inicialmente fue mediante inmunoprecipitación, desplazada posteriormente por inmunoblot y ELISA.
El gen p53 se localiza en el cromosoma 17, codifica para una fosfoproteína nuclear de 53 kD y juega un importante papel en la regulación del ciclo celular y la apoptosis como respuesta al daño del DNA. Su inactivación representa un paso crítico en el desarrollo de neoplasias, debido a su función determinante en múltiples vías celulares como: el control del ciclo celular en el punto de restricción G1/S, la reparación del DNA, la apoptosis y la neoangiogénesis, indispensables para mantener la integridad del genoma.56
El daño al DNA causado por QT conduce a un incremento del nivel del gen supresor tumoral p53, que detiene el ciclo celular en G1 y apoptosis, mediante lo cual, los agentes antineoplásicos logran su efecto citotóxico; por esta razón, TP53 se ha propuesto como un factor determinante de sensibilidad en las células neoplásicas.57
¿LA MUTACIÓN DEL GEN P53 COMO FACTOR PREDICTIVO DE RESPUESTA A LA QTN CON ANTRACICLINAS
El gen p53 es inactivado por una mutación puntual en aproximadamente 50% de todos los cánceres humanos.58Su mutación somática (TP53) se encuentra en 20% a 40% de los cánceres de mama. Anelli y colaboradores59,60 y otros grupos, la señalaron como la alteración genética única más frecuente y se asocia a mal pronóstico.
La mutación de p53 en el tejido tumoral se presenta con mayor frecuencia en tumores primarios voluminosos, de alto grado, con ganglios positivos yRPg negativos; clínicamente, las pacientes presentan una menor SLE y SG.61-63 Esto sugiere que la mutación de p53 puede ser un factor pronóstico independiente y predictivo de resistencia a antraciclinas. Sin embargo, Bertheau y colaboradores,64 analizaron pacientes con CMLA (IIB, IIIA, y IIIB) tratadas con dosis altas de ciclofosfamida más epirrubicina como primera línea de tratamiento y no observó correlación entre el estado de TP53 (por IHQ) pre-tratamiento y la respuesta clínica, pero sí una asociación importante con el estado inicial de TP53 y la respuesta histológica del tumor (p <0.0001).
Por otra parte, estudios in vitro e in vivo han demostrado que tumores con p53 tipo silvestre responden mejor con antraciclinas que aquéllos con mutación del mismo.
Geisler S y colaboradores observaron la relación entre las mutaciones del TP53 que afectan el enlace L2/L3 (dominio obligatorio del DNA de la proteína p53) con la respuesta a las antraciclinas en pacientes con CMLA.13 Los tumores con TP53 tipo silvestre fueron resistentes a la terapia, mientras aquéllos que presentaban mutación de TP53 en el dominio L2/L3 fueron quimio-sensibles. Para explicar esto, surgieron tres posibilidades: 1). La mutación del gen TP53 no fue la causa de la resistencia, sino una covariante de otros factores; 2). Las mutaciones pudieron ser la causa de resistencia en los pacientes analizados, pero no en otros y 3). La resistencia pudo ser debido a la inhibición de una cascada particular que involucra genes adyacentes a p53, pero que TP53 también interactúa con una vía que puede compensar la pérdida de la función.
Estas hipótesis explican la razón por la cual la mutación de TP53 se encuentra tanto en pacientes que responden al tratamiento como en los que no.
En contraste, Rahko y colaboradores65 sugieren que el p53 mutado es un factor pronóstico independiente en pacientes con cáncer de mama así como predictor de quimiorresistencia a antraciclinas y su co-expresión con HER-2/neu impacta negativamente en la SG. Asimismo, la actualización del estudio de Aas, también sugiere que la mutación específica de TP53 confiere resistencia a las antraciclinas. Por el contrario, el efecto citotóxico de los taxanos no tiene relación con la mutación de p53, debido a que su mecanismo de acción es independiente.
Como se ha discutido, establecer un factor predictivo asociado a la causa de quimiorresistencia es complejo, ya que existe la posibilidad de que el factor predictivo sea una covariante de la causa de resistencia. Sin embargo, si una alteración biológica en particular es causa de quimio-resistencia, la restauración de esta función podría revertirla.
¿ NUEVAS TECNOLOGÍAS PARA LA BÚSQUEDA DE MARCADORES MOLECULARES EN EL CÁNCER: APLICACIÓN CLÍNICA DE LOS MICROARREGLOS DE CDNA
Los microarreglos de DNA representan una herramienta nueva para el estudio de los perfiles de expresión génica en tumores humanos. La tecnología de microarreglos permite investigar y determinar la expresión de miles de RNA mensajeros simultáneamente a partir de un espécimen biológico. La densidad de genes actualmente disponibles en un microarreglo, abarca un rango de cientos a más de 30 000 secuencias únicas.66
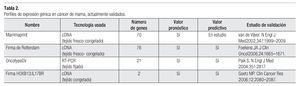
Esta herramienta ha puesto de manifiesto la existencia de varios subtipos moleculares de cáncer de mama, con sensibilidades terapéuticas y evoluciones clínicas diferentes (Tabla 2).
¿ MODELO DE 70 GENES (MAMMAPRINT O FIRMA DE ÁMSTERDAM)
Se trata de la identificación de una huella genética pronóstica de 70 genes a partir del tejido congelado de 70 pacientes menores de 55 años las cuales no habían recibido tratamiento adyuvante y por lo tanto, reflejaban la evolución natural de la enfermedad.67 Fue validado en una cohorte de 295 carcinomas de mama en estadios I o II,68 aunque recientemente se ha evaluado el papel de Mammaprint en pacientes con axila positiva. Esta plataforma comienza a dar evidencia de la capacidad predictiva de respuesta a la QT. En un meta-análisis (n = 1637) se dividieron los pacientes en: bajo riesgo génico (47%) y alto riesgo génico (53%). Los pacientes de alto riesgo génico se beneficiaban de la QT, mientras que los pacientes de bajo riesgo génico parecían no hacerlo.69-71
¿ MODELO DE 76 GENES (AFFYMETRIX O FIRMA DE ROTTERDAM)
Consiste en 76 genes con valor pronóstico, 60 para pacientes con RE positivo y 16 para pacientes con RE negativo. Esta firma se validó en un grupo de 286 pacientes con axila negativa sin haber recibido QT adyuvante. El modelo tuvo sensibilidad de 93% y especificidad de 48% para predecir metástasis a 10 años.72
¿ MODELO DE EXPRESIÓN DE DOS GENES
Razón HOXB13/IL17BR. El grupo de Massachusetts elaboró un modelo de expresión génica en mujeres con cáncer de mama RE positivas tratadas con tamoxifeno. La razón de expresión de dos genes, compuestos por el gen homebox (HOXB13) y el receptor IL17BR de la interleuquina-17b (modelo HOXB13/IL17BR) fue la base para predecir la SLP.73 Este modelo ha sido validado por tres estudios retrospectivos.
¿ MODELO DE 21 GENES (ONCOTYPE DX)
Se realiza en tejido tumoral fijado en formol o incluido en parafina. El test analiza la expresión, mediante la reacción en cadena de la polimerasa, de 21 genes implicados en la vía de los receptores hormonales, HER-2/neu, proliferación e invasión (16 genes relacionados al cáncer y cinco genes de referencia). El resultado es por medio de una puntuación, en escala continua, denominada RS (recurrence score, por sus siglas en inglés, o índice de recurrencia),74 que ha permitido un algoritmo predictivo de riesgo basado en tres grados pronósticos: alto (>30%), intermedio (>18% y <30%) y bajo (<18%), los cuales permiten estimar tanto el valor pronóstico, en el riesgo de recurrencia, validado por el ensayo clínico NSABP B-14,75 como el valor predictivo en el beneficio de la QT, validado por el ensayo NSABP-B20.76
El estudio SWOG S8814, ensayo fase III en mujeres postmenopáusicas con cáncer de mama RE positivo y axila positiva, demostró que seis ciclos de FAC (5-fluorouracilo, adriamicina, ciclofosfamida) mejoraba la SG y SLP vs. tamoxifeno solo. Se obtuvo muestra tumoral para realizar Oncotype DX en un subgrupo de 367 pacientes. EL RS fue riesgo bajo en 40%, riesgo intermedio en 28% y riesgo alto en 32%. Las mujeres con RS de riesgo alto se beneficiaron más de la QT, mientras que las pacientes con riesgo bajo no obtuvieron ningún beneficio adicional.77Este tipo de perfiles génicos han sido utilizados para predecir el beneficio de la QTN o adyuvante, con resultados hasta ahora muy prometedores, pero con limitaciones de muestra y poder predictivo, aunque se precisan validaciones prospectivas antes de integrarlas en la práctica clínica. Se están realizando dos ensayos grandes de validación de estas plataformas; el ensayo MINDACT (Microarray May Avoid Chemo Therapy) donde se evalúa el riesgo en 600 pacientes con axila negativa, utilizando el modelo de 70 genes (Mammaprint), en el cual, si el riesgo es bajo no se administra QT.78 El ensayo TAILORx está evaluando la plataforma de 21 genes (Oncotype DX). Las pacientes con cáncer de mama y axila negativa se asignan a tres brazos según el RS. Las pacientes con RS bajo recibirán hormonoterapia sin QT, las pacientes con riesgo intermedio se aleatorizarán a hormonoterapia o QT, seguido de tratamiento hormonal, y las de alto RS recibirán QT seguido de tratamiento hormonal.79
En los próximos años estará disponible información sobre el alcance clínico de estas herramientas moleculares, contribuyendo a complementar el algoritmo terapéutico individualizado.
Entre las aplicaciones clínicas actuales de los microarreglos se encuentran: como pruebas de tamizaje para identificar moléculas individuales potencialmente relevantes como blancos terapéuticos, marcadores predictivos y pronósticos; como herramienta para el análisis del complejo comportamiento celular de las neoplasias (estudio del perfil transcripción al genético bajo condiciones experimentales o durante la QT, identificación de vías moleculares involucradas en la patogénesis del cáncer); como instrumento para clasificar las neoplasias en base a la descripción de nuevas clases de moléculas o neoplasias histológicamente similares o a la identificación de resultados clínicos importantes, como la SVG o las tasas de respuesta al tratamiento.
En este contexto, actualmente puede ser posible lo enunciado por Karen Vousden (Instituto Nacional del Cáncer de Estados Unidos): 'Si pudiéramos marcar como mínimo algunas de las proteínas mutantes que se comportan como p53 tipo silvestre, podría ser posible la restauración normal del control del crecimiento en tumores que expresan un p53 mutado'.
Lo anterior retribuiría en mejores resultados con regímenes preestablecidos de quimioterapia.
¿ CONCLUSIONES
El papel del gen p53 como marcador de respuesta es controversial.80 Se ha tratado de establecer una relación significativa entre sobreexpresión del gen p53 o mutaciones del mismo, por medio de: 1). La respuesta a la terapia convencional y 2). Los regímenes de QT basada en antraciclinas vs. QT sin antraciclinas.
Si bien, algunos estudios indican que las alteraciones del gen p53 son factores predictivos de quimio-resistencia, otros trabajos sugieren que podría considerarse como un factor predictivo de quimio-sensibilidad. La controversia en cuanto a su potencial papel predictor, según su estado estructural o su patrón de expresión, aún es materia de estudio en las neoplasias humanas81. Un factor importante que influye en esta disyuntiva, es que aun cuando se ha avanzado en el desarrollo de sistemas de detección comerciales, los resultados pueden variar de acuerdo a la técnica utilizada.
A partir de esta consideración, estudios como el publicado por Volkmann y colaboradores,82 en el que se analizaron 165 biopsias de neoplasias mediante un anticuerpo anti-p53, utilizando diferentes técnicas para su detección que incluyeron: ELISA, inmunoblot e inmunofluorescencia (Huh7) para su confirmación, además de inmunohistoquímica para determinar la expresión in situ del gen en el tejido tumoral. Los resultados del estudio mostraron que la tasa global de detección de la proteína p53 fue de11%, valor muy bajo según lo señalado en la bibliografía. Asimismo, las determinaciones por inmunoprecipitación (9%), inmunofluorescencia (5%) y ELISA (12%) fueron menores. Lo anterior permite concluir que existe un nivel bajo de expresión de la proteína p53 en pacientes con carcinoma de mama. Por otra parte, otros estudios que utilizaron distintos métodos moleculares de diagnóstico, establecieron que el estado del gen p53 es un marcador independiente y de mal pronóstico en el cáncer de mama, a pesar de los resultados obtenidos por IHQ que han mostrado ser controversiales.83
Se puede inferir que la sobreexpresión de la proteína p53 detectada por IHQ se correlaciona de manera directa con mutaciones del gen p53. La falta de sensibilidad y especificidad en los métodos empleados en la detección de la proteína p53, explica los resultados contradictorios en los intentos de establecerlo como un marcador pronóstico o predictivo en cáncer de mama. Otro aspecto a considerar es que una gran cantidad de estudios de quimio-resistencia se realizan de manera retrospectiva y una limitante para estos estudios es que las muestras disponibles utilizadas son biopsias incluidas en bloques de parafina. Aun cuando estas preparaciones son útiles para realizar estudios de inmunodetección y análisis de DNA, no tienen utilidad para el estudio de las nuevas técnicas genómicas ni para el estudio de microarreglos, para los cuales necesariamente se requiere de la obtención de un-RNA mensajero de buena cantidad y calidad.
Entre los estudios genómicos, la purificación y caracterización de proteínas será útil para el estudio de los perfiles de expresión proteica en el cáncer (proteómica), y la limitante será, nuevamente, la calidad del material biológico de estudio.
Considerando que en una neoplasia se expresan múltiples genes, la simple inmunodetección resulta una técnica limitada para el análisis molecular masivo y nos obliga a utilizar técnicas que permiten el estudio de un mayor número de genes simultáneamente, para lo que requieren de la extracción de RNA mensajero de calidad.84 Lo anterior evidencia las dificultades metodológicas en los estudios retrospectivos para determinar un papel predictivo del gen p53 en las neoplasias humanas.
Es imperativo continuar con investigación de nuevos blancos moleculares que puedan contribuir a establecer mejores estrategias terapéuticas (convencional, altas dosis o experimental), y aportar un mejor conocimiento de los genes relacionados con el crecimiento y la metástasis tumoral para identificar con mayor precisión a pacientes de alto riesgo.
Por último, si bien estudios de DNA y cDNA han determinado que mutaciones del gen p53 predicen la resistencia a diferentes regímenes de QT en el tratamiento del cáncer de mama,85 más de 15 estudios no lo han demostrado. Cabe mencionar que la evaluación del estado del gen en estos estudios fue realizada por IHQ y en biopsias tumorales incluidas en parafina.
La posible explicación para la discrepancia entre la expresión de la proteína p53 y la resistencia a QT, es que las mutaciones del gen p53 asociadas con la quimio-resistencia no pueden ser detectadas por IHQ cuando se utiliza un anticuerpo anti-p53 convencional y de origen policlonal (como comercialmente se encuentran disponibles) y el uso de anticuerpos monoclonales para regiones peptídicas específicas de la proteína p53 implicaría el uso de un set de anticuerpos muy extenso para detectar de manera simultánea todas las posibles mutaciones inhibidoras de la función de la proteína p53.
El futuro inminente es analizar el papel pronóstico y predictivo de múltiples genes a través de modelos que determinen perfiles de expresión génica de los genes de funciones celulares, vías bioquímicas, proliferación celular y mecanismos de regulación del cáncer de mama.86
¿ AGRADECIMIENTOS
Este trabajo fue apoyado por la Coordinación de Investigación en Salud del Instituto Mexicano del Seguro Social (IMSS) y la Dirección del Hospital de Oncología del Centro Médico Nacional Siglo XXI, IMSS. Agradecemos a la Lic. Montserrat Guadarrama Orozco por la revisión de estilo de todo el presente trabajo.
Correspondencia: Dr. Horacio Astudillo-de la Vega.
Avenida Cuauhtémoc 330, Col. Doctores 06720. México, D. F.
Teléfono: 525 56276900, ext. 22784; fax: 525 56276900.
Correo electrónico: hastud2@aol.com.