¿ INTROCUCCIÓN
El cáncer cérvico-uterino es el segundo más común en el mundo, después del cáncer de mama en mujeres. En las dos décadas pasadas, el cambio más importante en el tratamiento de las pacientes portadoras de esta entidad ha sido para mejorar la sobrevida (SV) y el control local (CL); esta fue la utilidad de quimio-radioterapia (QT-RT) concomitante. En pacientes con alto riesgo, el platino parece ofrecer un beneficio significativo en el control local y a distancia, así como en la SV.
En etapas localmente avanzadas, los resultados sobre cáncer cérvico-uterino son pobres, la adición de quimioterapia mejora tanto la SV libre de recurrencia local como la SV libre de enfermedad. Con cisplatino semanal, se alcanzan respuestas clínicas completas hasta en 60% a 85% en cáncer localmente avanzado y el beneficio en la SV es de 30% a 50% en EC IB2-IV.1-4
En la práctica clínica, las etapas iniciales (según FIGO IA - IIA) son generalmente tratadas con cirugía o radioterapia externa (RTE) combinada con braquiterapia (BQT), mientras que el estándar de tratamiento en etapa IIB - IVA es QT-RT concomitante, seguido de BQT. La tasa de control local de RTE más BQT es de 88% a 93% para ECI, 66% a 88% ECII, 48% a 63% EC III. El tratamiento con braquiterapia es un componente esencial en el tratamiento de carcinoma cérvico-uterino.
La BQT es un componente fundamental debido a que libera una dosis alta y localizada a la lesión cervical primaria y al tejido parametrial adyacente; mientras que se minimiza la dosis al tejido sano.4 La BQT de baja tasa de dosis (LDR. Por sus siglas en inglés) ha sido utilizada por cerca de un siglo y la de alta tasa de dosis (HDR, por sus siglas en inglés) por casi 30 años; la primera se define como una dosis de 0.4 - 2 Gy/hora y la segunda mayor de 12 Gy/hora. La braquiterapia HDR ha sido ampliamente utilizada en Asia y en Europa, actualmente en el norte y sur de América.1,2
La prescripción a puntos "A" por Todd y Mederith en 1938, y luego revisada en 1953, es aceptada como puntos de referencia en el tratamiento de BQT inicialmente en baja tasa de dosis; los puntos "A" tradicionalmente cruzan el uréter y la arteria uterina en el triángulo paracervical y es considerado un punto crítico en la tolerancia de radiación. Esta definición de puntos "A" provee una planeación de dosis de BQT y de RTE, en recientes estudios publicados se siguen aún utilizando.4
En la actualidad, la BQT de alta tasa utiliza fuentes de Iridio192; así, el uso de HDR ofrece un tratamiento ambulatorio de la paciente, fácil protección de radiación, bajo costo y mejoría en la distribución dosis-tumor. Recientes recomendaciones de la American Society Brachy-therapy (ASB), también aclaró algunas controversias en la dosis óptima y los esquemas de fraccionamiento de HDR. La BQT de alta tasa es el resultado de un desarrollo tecnológico en la manufactura de fuentes radioactivas de alta intensidad, control remoto sofisticado de carga diferida y software de planeación de tratamiento. Hay casi tres décadas de experiencia comparando LDR vs. HDR, sobre cáncer cérvico-uterino; sin embargo, aún persisten las controversias en reconocer la eficacia y la seguridad de BQT, HDR vs. LDR. Desafortunadamente estudios prospectivos y aleatorios fase III bien diseñados comparando LDR vs. HDR, no han sido aún publicados.1-4
En un meta-análisis con cinco estudios aleatorizados que totalizan 2145 pacientes comparando BQT HDR vs. LDR, se señala que la SV total y el control local fueron similares en ambos grupos en etapas I, II y III. Sin embargo, varios resultados en EC III han sido informados, como el de Vahrson y Romer, que refieren una tasa de SV mayor en pacientes con ECIII tratadas con BQT HDR comparado con lo que indica Ferringo y colaboradores,5 en donde obtiene un pobre resultado con HDR comparado cuando se tratan con baja tasa; en donde la SV y sobrevida libre de enfermedad (SVLE) a cinco años fue estadísticamente superior en el grupo de baja tasa. En relación con la toxicidad para ambos grupos, fue similar y sin diferencia significativa, como lo reportado en otras publicaciones sobre toxicidad aguda grado I y II, del tipo de la cistitis o proctitis y la crónica predomina más proctitis.2,6-9
En un reciente estudio incluye a cinco instituciones que han realizado dosimetría al inicio y al término de la aplicación intracavitaria de BQT de baja tasa; se demostró que la tasa de dosis de puntos calientes en vejiga y recto se incrementa durante el tratamiento en un promedio de 7% y 19% respectivamente y con un cambio insignificante en la tasa de dosis a los puntos "A".
Teóricamente, la HDR tiene mayor probabilidad de efectos tardíos en un nivel dado para el control tumoral; sin embargo, el fraccionamiento en alta tasa parece compensar esas diferencias en el tumor y los efectos en el tejido normal por un incremento en la tasa de dosis. A pesar de las desventajas radiobiológicas mencionadas por Eifel.10 La posibilidad de optimización de la distribución de dosis y la menor oportunidad de desplazamiento de los aplicadores, sobrepasa esa desventaja. Además, la variación de los tiempos de las posiciones con una fuente única que se detiene permite una variación casi infinita de la longitud efectiva de la fuente y de las posiciones de la fuente, lo cual permite un mayor control de la distribución de dosis y potencialmente menor morbilidad.2
La dosis y esquema de la braquiterapia HDR no ha sido del todo establecida; el tamaño de la fracción y su número depende de la dosis de RTE; si se utilizan dosis bajas de tele-terapia, deben darse tamaños de fracción mayor en BQT de alta tasa o bien aumentar el número de fracciones,6,7 los rangos van de 530 cGy a 750 cGy en cuatro a seis sesiones (una a dos por semana); hay estudios que recomiendan 21 Gy en tres fracciones, aunque para pacientes con cáncer localmente avanzado se indican hasta 28 Gy; si la dosis de RTE es de 45 Gy - 50 Gy se completa con BQT para alcanzar dosis de 80 Gy a 85 Gy en lesiones iniciales, en tumores avanzados se alcanza 85 a 90 Gy.9,11,12
La braquiterapia convencional se basa en recomendaciones del ICRU 38, con puntos de referencia como "A" y "B", entendidas como las dosis a parametrio y pared pélvica, respectivamente, así como puntos de vejiga y recto, considerados como los órganos de riesgo (OR). La dosis liberada al volumen blanco, vejiga y recto no se correlaciona con los puntos de referencia del ICRU 38. La dosis máxima al tejido normal puede predecir las complicaciones tardías,13 así se demuestra que en el plan convencional se sobreestima la cobertura de dosis a puntos "A" y subestima la dirigida a los OR, por lo que la cobertura resulta insuficiente al volumen de tratamiento o una sobredosis al tejido normal. Datta y colaboradores, han demostrado que el porcentaje del tumor cubierto por la dosis prescrita a los puntos "A", está en el rango de 68% a 100% en el plan convencional; esta proporción depende del volumen tumoral así como del tiempo de BQT intracavitaria. El moderno plan de tratamiento de BQT se basa en la tomografía computarizada (TC) o por imagen de resonancia magnética (IRM) con distribución de dosis tridimensional (3D); este tratamiento permite mejor determinación de distribución de dosis en diferentes volúmenes, como grueso del volumen tumoral (GTV), volumen blanco clínico (CTV) y OR mediante histogramas que los determinan.12,14,15 Desde 2004 se publicaron las guías para BQT en cáncer cérvico-uterino basadas en imagen.11
Comparando el plan de tratamiento convencional con imagen guiada 3D, generalmente sobreestima la dosis mínima liberada al volumen blanco y subestima la dosis máxima a vejiga y recto. La planeación 3D permite la evaluación de la distribución de dosis aplicada a cierto volumen como GTV, CTV u órganos de riesgo.2 Esta ventaja es debida a que se puede delinear adecuadamente el volumen blanco así como los órganos de riesgo, mejorando considerablemente la conformidad de la dosis que con RTE convencional.15,16
En el tratamiento 3D no se eliminan los puntos de referencia ya conocidos, sino que se agregan los volúmenes de radiación y delineación de órganos de riesgo.16-18 El Grupo de Trabajo de Braquiterapia de Imagen Guiada (IGBWG) propone determinar el Grueso del Volumen Tumoral (GTV1) definido por imagen. GTV: GTV1 más tumor palpable o visualizado clínicamente, GTV + cx (cérvix entero), pCTV (CTV del tumor primario): GTV+ cx y 1 cm de margen. Este grupo si incluye rCTV: pCTV más ganglios linfáticos regionales. El grupo de trabajo del ESTRO de gineco-oncología define el pCTV: GTV + útero completo + tejido parametrial + 2 cm por lo menos de vagina normal, esta última definición del CTV se presentó la reunión de Barcelona de 2004 por Subir Nag.16-23
En relación con los OR, se delinean los contornos y en algunas instituciones también realizan los contornos de las paredes de éstos, si bien sólo tiene importancia cuando el volumen es mayor de 2cm3, en el caso de la vagina se contornea el órgano completo. La determinación de dosis-volumen se basa en un histograma, los autores describen que "V100" es la dosis prescrita a los puntos "A" que cubre el GTV y CTV; se prefiere que los puntos "A" se determinen en los aplicadores según la Sociedad Americana de BQT. El resultado de esta prescripción de dosis es que puede no ser igual a la dosis que cubre el V100. La dosis máxima en OR debe especificar la dosis en cualquier punto dentro de la pared de vejiga o recto.24-27
Yosshiok y colaboradores, comunicaron la viabilidad de una posición deseada basada en anatomía y un método de optimización inversa. La prescripción de dosis está determinada por las restricciones de dosis en el volumen blanco y OR. Actualmente se realizan algoritmos de planeación inversa, como lo que se hace en radioterapia de intensidad modulada basada en anatomía.17-20,26,27
¿ OBJETIVO
Determinar el control tumoral y la toxicidad de braquiterapia así como la homogeneidad de dosis a puntos de prescripción y tolerancia a órganos de riesgo.
¿ MÉTODOS
Se trata de un estudio retrospectivo, descriptivo y transversal de pacientes con cáncer cérvico-uterino tratadas con braquiterapia de alta tasa de dosis en la Unidad de Radio-Oncología del Hospital General de México, del periodo comprendido entre julio de 2005 a diciembre de 2008.
Todas las pacientes contaban con diagnóstico histopatológico del Hospital General, estudios de laboratorio completos y de gabinete para descartar enfermedad a distancia, así como recto y cistoscopia para determinar extensión de la enfermedad en las pacientes que estuviera indicado. Criterios de inclusión: Pacientes de cualquier edad, con etapa clínica I-IVA; pacientes que no fueran operadas y que hayan recibido quimio-radioterapia concomitante o radioterapia externa sola; seguimiento mínimo de seis meses. Criterios de exclusión: Pacientes operadas, que hayan recibido primera fase de tratamiento fuera de la unidad, etapa clínica IVB y con seguimiento menor a seis meses.
La recolección de los datos fue mediante la revisión del expediente clínico, así como del expediente de física. El análisis estadístico fue a través de t de Student, Wilcoxon, Ji cuadrada y Mann Whitney en el programa SPSS versión 15.
¿ RESULTADOS
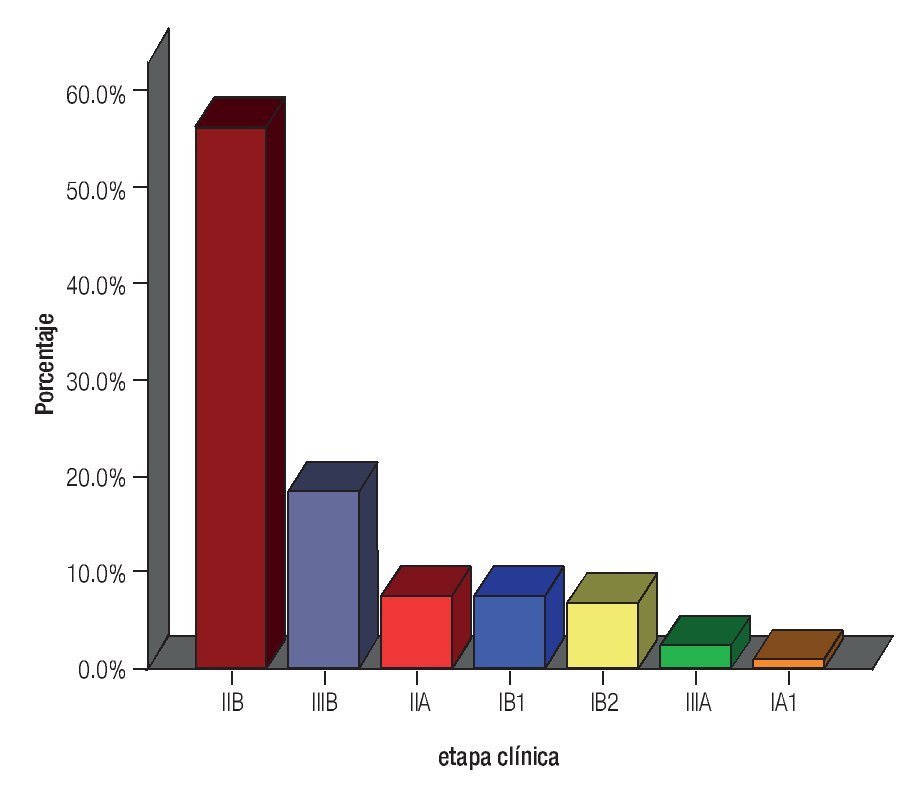
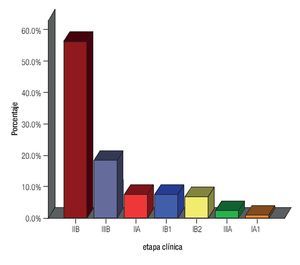
Se analizaron 158 expedientes y se excluyeron 39, por no contar con los criterios de inclusión. Se integraron 119 casos, con una media de edad de 52.3 años (rango 24 a 81), el grupo de edad más afectado fue 40 a 49 años (42 pacientes), seguido de 50 a 59 (26 pacientes) y 60 a 69 (25 pacientes), el resto distribuido en el rango ya comentado. La etapa clínica de mayor presentación fue IIB en 67 pacientes (56.3%), seguido de IIIB en 22 pacientes (18.5%), el resto se muestra en la Figura 1. El subtipo histopatológico más frecuente fue el epidermoide en 101 casos (84.9%), adenocarcinoma (11.8%) y neuroendocrino (3.4%).
Figura 1. Distribución por etapa clínica.
Recibieron tratamiento con quimio-radioterapia concomitante 67 (56.3%) y 52 (43.7%) sólo radioterapia. La media de dosis de RTE fue de 49.9 Gy (rango 45 a 50.4); así, 115 pacientes (78.8%) recibieron 50 Gy. La técnica de tratamiento fue convencional en 72 pacientes (60.5%), con energía de cobalto 60; radioterapia conformal en 41 pacientes (34.5%); 10 pacientes (18MV) y 31(10MV) y radioterapia de intensidad modulada en seis pacientes (18MV). El agente quimioterapéutico más utilizado fue cisplatino semanal (63 pacientes), tres carboplatino y una carboplatino-taxol.
La media del tiempo total de tratamiento fue 68.3 días (rango 47 - 123), la mayor proporción de pacientes (41) estuvo en el rango de 60 a 69 días, 30 pacientes (51 a 59 días); sólo cuatro pacientes en el rango 47 a 50 días y seis de 100 - 123. La media del tiempo entre RTE y braquiterapia fue 17 días (rango dos a 90), mediana de 14 días. En el rango de 11 a 19 días 44 pacientes, 23 casos (seis a 10); en los extremos 15 pacientes en el rango de dos a cinco días y una mayor a 90 días.
En 119 pacientes se realizaron 472 aplicaciones de braquiterapia, 115 recibieron cuatro fracciones y cuatro, sólo tres. La media de dosis por fracción fue 553.4 cGy (rango 303 a 562), mediana fue 562 cGy; la media de dosis total de braquiterapia administrada fue 2220 cGy (rango 1686 a 2302), mediana 2248 cGy; en 106 pacientes la dosis total de braquiterapia fue 2248 cGy. En relación con la dosis prescrita, 94% de las pacientes recibieron 562 cGy por fracción; de las 472 aplicaciones, 381 recibieron de 98% a 100% de la dosis prescrita y de éstas, 187 recibieron 100%, asimismo, la diferencia de dosis entre puntos "A" fue de 0% a 3% en 429 aplicaciones y en 157 la diferencia fue de cero.
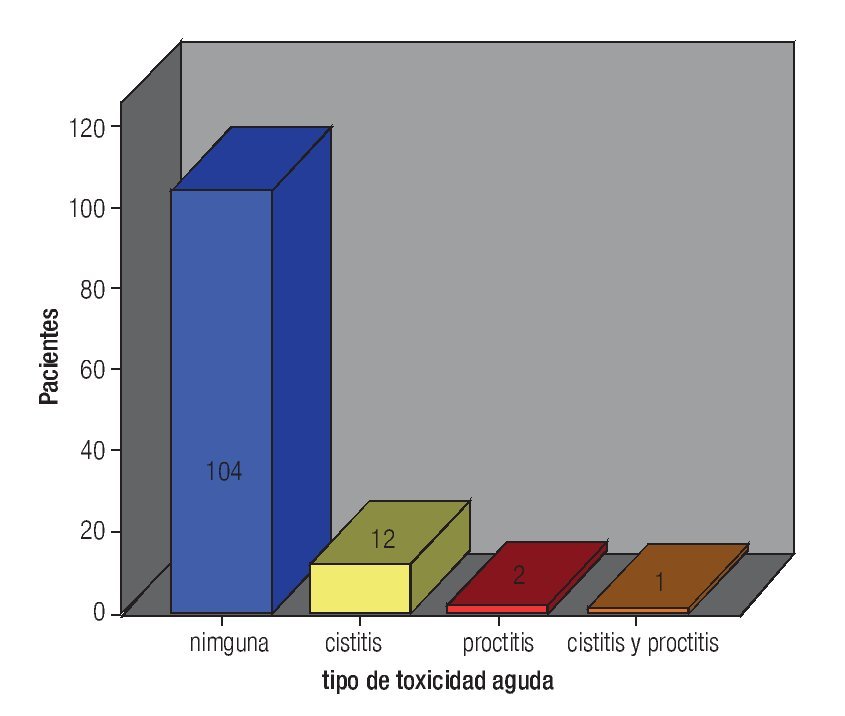
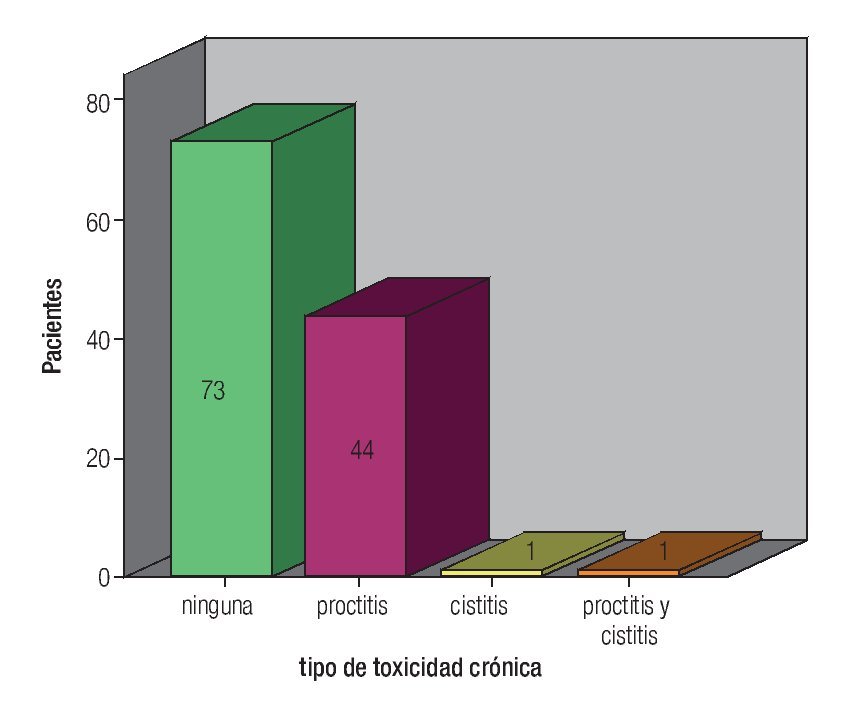
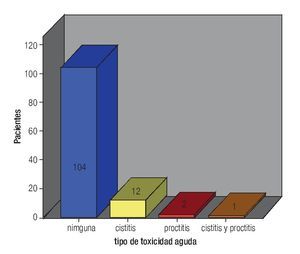
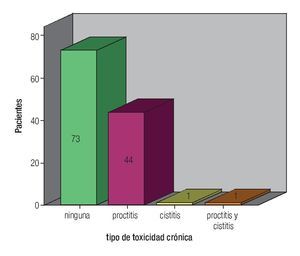
En lo que respecta a la dosis a órganos de riesgo, la media de dosis total recibida con BQT a vejiga fue 1266 cGy (rango 668 a 1943), mediana de 1249 cGy, y en recto la media fue 1140 cGy (rango 684 a 1787), mediana 1183 cGy. La media de dosis total a los puntos "A" (RTE + BQT) fue de 79.5 Gy (rango 45 a 50.4), mediana de 80 Gy, 104 pacientes recibieron 80 Gy, nueve 75 Gy a 79 Gy, cuatro de 72 Gy - 74 Gy y finalmente dos pacientes con dosis de 82 Gy. La toxicidad generada por el tratamiento fue en forma global del 51.2%, aguda en 15 pacientes (12.6%) (Figura 2) y crónica (Figura 3), en 46 (38.6%).
Figura 2. Toxicidad aguda.
Figura 3. Toxicidad crónica.
La presentación de toxicidad aguda fue con una media de dosis en vejiga de 1426 cGy y de recto 1170 cGy y la dosis media para generar toxicidad crónica fue en vejiga 1266 cGy y recto 1140 cGy, todas estas por debajo de las tolerancia aceptadas en braquiterapia de alta tasa de dosis para estos órganos de riesgo. Al realizar es análisis estadístico, no hubo significancia entre la toxicidad y la dosis a los órganos de riesgo (p = 0.05). La cistitis predominó en la toxicidad aguda y fue grado uno en 11 pacientes, sólo dos pacientes tuvieron proctitis grado uno y una paciente presentó proctitis y cistitis grado uno. La proctitis predominó como toxicidad crónica, grado uno en 42 pacientes, grado dos y tres en una paciente, respectivamente; cistitis grado uno en una paciente y finalmente cistitis y proctitis grado uno en una paciente.
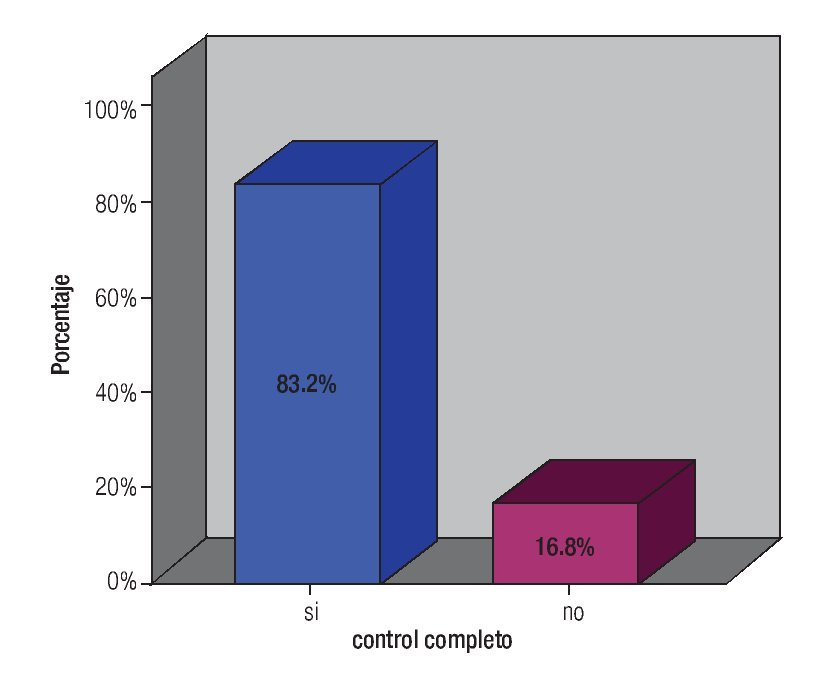
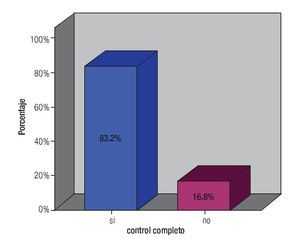
Al mes de terminado el tratamiento de radioterapia, la respuesta tumoral encontrada fue: pacientes sin actividad tumoral evidente en ningún sitio, 107 (89.9%), las 12 restantes con actividad tumoral (ocho con persistencia, dos con enfermedad a distancia y dos con ambas situaciones). La media de seguimiento fue de 21.12 meses (siete a 50); al final del estudio, 99 pacientes (83.2%), estaban libres de actividad tumoral y las 20 restantes, con actividad en diferentes sitios (Figura 4), distribuidas como sigue: ocho persistencia, tres recurrencia, dos persistencia, cuatro persistencia y enfermedad a distancia, dos recurrencia y enfermedad a distancia. Al realizar el análisis estadístico sobre la persistencia tumoral y la recurrencia, se evidenció que tuvo relación directa con el tiempo entre RTE y braquiterapia, p = 0.025, y cuando se analizó si la presencia de actividad tumoral se correlacionaba con el tiempo total de tratamiento o la dosis total a puntos "A", no hubo evidencia. De las 20 pacientes que no tuvieron control la distribución fue la siguiente: una paciente en EC IB1 y IIA, tres IIB con persistencia, tres IIB y dos IIIB con recurrencia, una paciente IB1 y IIA, ocho IIB, una IIIA y cuatro IIIB con enfermedad a distancia. El control completo de las pacientes iniciales por etapa clínica fue en IA1 (1/1), IB1 (8/9), IB2 (8/8), IIA (8/9), IIB (55/67), IIIA (2/3), IIIB (17/22).
Figura 4. Control tumoral al final de estudio.
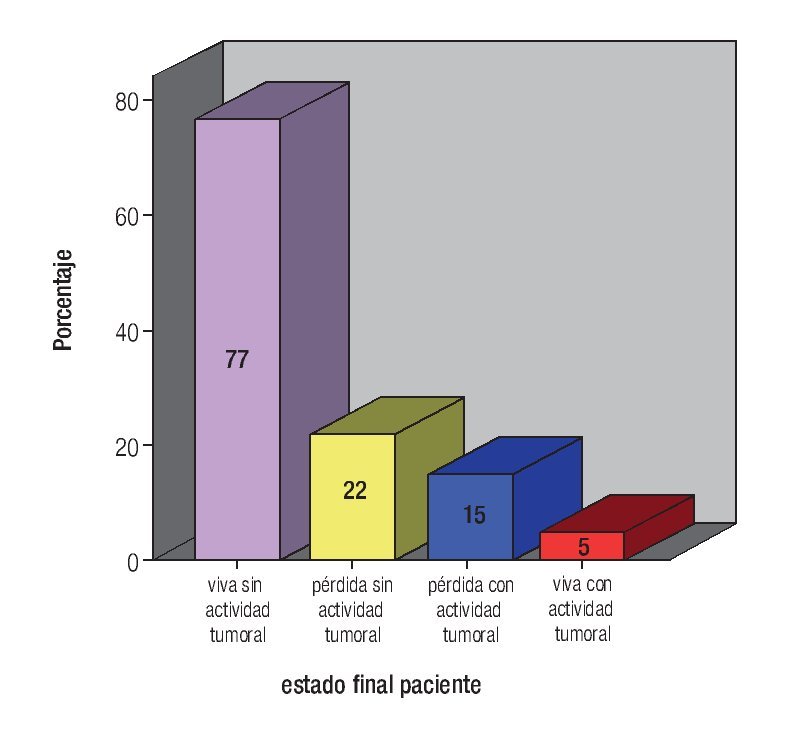
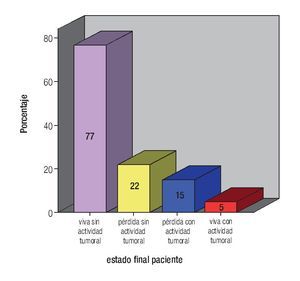
El estado final de las pacientes fue: 77 (64%) vivas sin actividad tumoral; 22 (18.5%) perdidas sin actividad; 15 (12.5%) perdidas con actividad tumoral y cinco (4.2%) vivas con actividad tumoral (Figura 5). No se presentó ningún fallecimiento. Las pacientes vivas, sin actividad tumoral, fueron seis en EC IB1, IB2 y IIA, 45 IIB y 14 IIIB, perdidas sin actividad tumoral fue una IA1, dos IB1, IB2 y IIA , 10 IIB, dos IIIA, tres IIIB; perdidas con actividad tumoral fueron: una IB1 y IIA, 10 IIB y tres IIIB. Vivas con actividad fueron dos IIB, una IIIA y dos IIIB.
Figura 5. Estado tumoral final del paciente.
¿ DISCUSIÓN
El papel que juega la radioterapia en cáncer cérvico-uterino ha sido, y sigue siendo, fundamental. Actualmente la combinación con agentes quimioterapéuticos ha incrementado el porcentaje de control local, de periodo libre de enfermedad y de sobrevida total. El tratamiento con radioterapia debe incluir la radioterapia externa y braquiterapia. Con las nuevas técnicas de tratamiento 3D, la RTE ha mejorado la cobertura del volumen tumoral; lo mismo sucede con braquiterapia, por muchas décadas el uso de baja tasa de dosis dio aceptables resultados; pero la BQT de alta tasa de dosis con Iridio192 ha ganado popularidad debido a sus ventajas, como lo es el manejo de la fuente radioactiva a control remoto con lo cual se evita la exposición del personal ocupacionalmente expuesto, evita hospitalizaciones, optimiza la dosis y logra una mejor distribución en el volumen de tratamiento y menor dosis a órganos de riesgo.1-4 Actualmente, la braquiterapia 3D es el tratamiento ideal en esta área, ya que comparado con BQT bidimensional hay una mejor cobertura del volumen a tratar porque la definición del volúmenes está dado mediante imágenes de tomografía computarizada o resonancia magnética, lo que disminuye aún más la dosis a órganos de riesgo, porque se manejan restricción de dosis y se asegura que 100% de la dosis cubra el volumen de tratamiento. Aún en muchos paciente que no cuentan con BQT guiada por imagen, el manejo convencional se realiza mediante placas ortogonales y prescripción basada en el ICRU 38 (puntos "A" de Manchester, órganos de riesgo).18-22
Las primeras publicaciones de braquiterapia de alta tasa indican que el control local y la sobrevida son similares, pero que la toxicidad sobre todo crónica es mayor con ésta cuando se compara con baja tasa, aunque otros autores han informado menor toxicidad debido a que con alta tasa es factible una adecuada optimización de la dosis. Ahora con las nuevas modalidades estas limitaciones han mejorado.
En el presente estudio se analizaron 119 pacientes con una media de edad de 52.3 años. El grupo de edad más afectado fue el de 40 a 49 años como se informa en la literatura. En lo que se refiere a la etapa clínica, la IIB fue la más afectada (63%), seguida de IIIB (18.5%). El subtipo histopatológico más frecuente fue epidermoide (84.9%), seguido de adenocarcinoma (11.4%) y neuroendocrino (3.7%), este último con mayor porcentaje que lo informado en las revisiones y con peor pronóstico.1-4
Poco más de la mitad de los casos (56.3%), recibieron tratamiento concomitante de quimio-radioterapia, aunque es el estándar de manejo, no todas las pacientes son candidatas, la mayoría que no recibió quimioterapia fue por bajos niveles de depuración de creatinina, de las cuales sólo tres recibieron carboplatino y una carbotaxol. La dosis en general de RTE fue de 50 Gy en 115, la media de dosis fue 49.9 Gy (rango de 45 a 50.4); en cuanto a la técnica y energía, la mayoría se trató en forma convencional (60.5%) con energía de cobalto 60; 34.5% en conformal, 31 pacientes con 10 MV, 10 con 18 MV y seis pacientes con radioterapia de intensidad modulada. Uno de los principales factores pronósticos en el control tumoral es el tiempo total de tratamiento; por cada día extra en el tiempo de protracción, la pérdida del control tumoral es de 0.9% a 1.2%;1-2 en este estudio no se evidenció correlación con el control tumoral, aunque la media del tiempo fue de 68.3 días y 41 pacientes estuvieron en el rango de 60 a 69 días. Con base en la bibliografía, el tiempo ideal debe ser de 52 a 56 días;1-2 es evidente que estamos fuera de este rango, ya que sólo en 30 pacientes éste estuvo entre 50 a 59 días y únicamente cuatro, de 47 a 50 días. Las causa del alargamiento del tratamiento son multifactoriales, el tiempo entre el término de RTE y el inicio de BQT es una de las causas; la bibliografía indica que no debe exceder idealmente ocho días; en este estudio, 41 pacientes estuvieron en el rango de 11 a 19 días, sólo 15 de dos a cinco días y los tiempos más largos fueron en 54 y 90 días con una paciente cada uno. Sólo Chen y colaboradores, concluyeron que el tiempo ideal entre RTE y BQT de alta tasa de dosis debe ser menor a ocho días.
En cuanto a los fraccionamientos, no hay un estándar; van desde 5 Gy, 6 Gy o 7 Gy por fracción, y de cuatro, cinco o seis fracciones; en nuestra institución indicamos 562 cGy por fracción (cuatro en total) para un total de 2248 cGy a los puntos "A" de Manchester, esta dosis es equivalente según el modelo lineal cuadrático a 30 Gy en BQT de baja tasa de dosis. Logramos prescribir 562 cGy por fracción en 94% de las pacientes y de las 472 aplicaciones realizadas, en 381 los puntos "A" recibieron 98% a 100% de la dosis prescrita; de estas 187 recibieron 100%, en BQT HDR convencional no es fácil lograr una adecuada distribución de dosis, aun cuando se tenga una optimización ideal, ya que hay variación entre cada aplicación y el personal que la realiza, aunque sea el mismo en todo el tratamiento. Con respecto a la diferencia de dosis entre los puntos "A" de Manchester, en 429 aplicaciones la diferencia fue de 0% a 3%, que es un bajo porcentaje y que indica una adecuada homogeneidad de dosis entre éstos. De las 429 aplicaciones, en 157 la diferencia fue cero; que resulta un orientador de que la dosis prescrita cubre adecuadamente los puntos de referencia según el ICRU 38 y un adecuado control tumoral es otorgado. La dosis total a puntos "A" (RTE +BQT) fue de 80 Gy en 104 pacientes, la bibliografía señala el precedente de que la dosis para lesiones más avanzadas es de 85 Gy a 90Gy. Si consideramos que la mayoría de los pacientes se encuentran en ECIIB, la dosis está en el límite para control tumoral. Nueve pacientes recibieron 75 Gy a 79 Gy y la mayor proporción fue IIB; cuatro recibieron 72 Gy a 74 Gy y se manejaron con cirugía complementaria (histerectomía extra-fascial). La dosis total a puntos "A" es otro de los factores importantes en el control tumoral.1
Las dosis que recibieron los órganos de riesgo con BQT están dentro del rango (media de dosis recto = 1149 cGy, vejiga = 1266 cGy); en cada fracción del tratamiento en la mayoría de los pacientes no se rebasa 70% de la dosis administrada en cada tratamiento de BQT. La toxicidad aguda es de 12.6% y crónica de 38.6%, similar a lo que se reporta en la información asequible; algunas series indican que la toxicidad es mayor que con BQT de baja tasa, ya que el tamaño de la fracción es mayor, otros debaten este resultado.6-9 En nuestro estudio, al realizar el análisis estadístico de la relación sobre la toxicidad y la tolerancia a órganos de riesgo, no hubo significancia. La presencia de toxicidad es independiente de la dosis recibida a órganos de riesgo, tal y como lo comenta Petereit. En términos generales, el grado de toxicidad fue uno en la mayor parte de los pacientes como se describe en las revisiones.
El control tumoral al terminar el tratamiento fue bueno en 107 casos (89.9%), 12 pacientes tenían persistencia; mismas que se enviaron a tratamiento de salvamento. Las dos que tenían enfermedad distancia y las que presentaban también persistencia se enviaron a manejo sistémico. El seguimiento máximo fue de cuatro años dos meses y el mínimo de siete meses; los resultados al final del estudio son similares a los que se comentan en la bibliografía, con un control tumoral completo en 83.2% (99 pacientes), 16.8% con actividad tumoral: la mayoría (nueve pacientes) con enfermedad a distancia, tres recurrieron y dos continuaron con persistencia que fueron las que se enviaron a terapia sistémica inicialmente, cuatro pacientes con persistencia y enfermedad a distancia y dos con recurrencia y metástasis a ganglios para-aórticos. No hubo significancia estadística entre la dosis total a puntos "A" y el tiempo total de tratamiento con la presencia de recurrencia o persistencia; pero si fue significativo (p = 0.025) el intervalo de tiempo entre RTE y el inicio de BQT. Los reportes indican que el mayor tiempo entre el inicio de la BQT y el término de la RTE son factores para la recurrencia y la pérdida del control tumoral como fue evidente en este estudio. La mayoría de los pacientes con actividad tumoral tenían EC IIB, hay que recordar que fue la etapa de mayor presentación.
Así, al final del estudio 77 pacientes (64.7%) estaban vivas y sin actividad tumoral; durante el seguimiento, 22 pacientes sin actividad tumoral se perdieron (después de un año); 15 pacientes (12.6%) se perdieron con actividad tumoral (local y a distancia), cinco pacientes en seguimiento con actividad a distancia (metástasis pulmonares), estaban en control con agentes quimioterapéuticos. Así, los resultados son muy similares a los recuperables en la bibliografía biomédica mundial.
¿ CONCLUSIONES
Los resultados encontrados en nuestro estudio sobre control local y sobrevida, son similares a lo mostrado en la bibliografía. Tuvimos un control tumoral completo en 83.2% y al final del estudio, 64.7% pacientes estaban vivas y sin actividad tumoral. La toxicidad global fue de 51.2%, con mayor proporción la crónica; sin embargo, al realizar el análisis estadístico, no hubo relación entre ésta y la dosis de tolerancia a órganos de riesgo, a diferencia de lo que se comenta en muchas series. Encontramos un impacto en el control local, cuando el tiempo entre radioterapia externa y braquiterapia se alarga, ya que un incremento de éste se correlaciona con persistencia o recurrencia tumoral, siendo significativo. En 89.5% de las pacientes se prescribieron 2248 cGy con braquiterapia de alta tasa, que es equivalente a 30 Gy en baja tasa, logrando que 80% de las aplicaciones recibieran de 98% a 100% de la dosis a los puntos "A" de Manchester y que la diferencia de dosis de entre estos puntos fuera de entre 0% a 3% en 90% de las aplicaciones; esto demuestra que la homogeneidad de dosis es adecuada y similar entre las aplicaciones. Con braquiterapia convencional se pueden realizar adecuados procedimientos, sobre todo en sitios donde no se cuente con braquiterapia 3D.
Correspondencia: Dra. Yicel Bautista Hernández. Encinos N°2. Colonia Ampliación Tlacoyaque. Delegación Álvaro Obregón. 01859. México, D. F. Teléfono: 5810 6552.
Correo electrónico: yiselbautista@prodigy.net.mx.