Los tumores del estroma gastrointestinal (GIST) son poco comunes, localizándose alrededor del 20% en el intestino delgado; la presentación clínica más común es la hemorragia gastrointestinal, produciéndose debido a la necrosis por presión y ulceración de la mucosa digestiva con laceración de los vasos subyacentes.
Caso clínicoHombre de 37 años de edad, con cuadro clínico de hemorragia de tubo digestivo de origen obscuro, con endoscopia y colonoscopia sin anormalidades, y tomografía abdominopélvica que describe asa de intestino delgado con lesión tumoral probable GIST; por persistencia de la hemorragia digestiva se realiza laparotomía exploratoria con hallazgo de tumor en yeyuno, realizándose resección intestinal y enteroentero anastomosis terminoterminal. Con una adecuada evolución postoperatoria, se egresa al quinto día, con reporte de histopatología de tumor de células fusiforme positivo para CD117, compatible con tumor estromal.
DiscusiónLos GIST son neoplasias derivadas de células de Cajal y se caracterizan por mutaciones del gen c-KIT; representan menos del 1% de todos los tumores digestivos y se localizan con mayor frecuencia en el estómago, seguido del intestino delgado. Su presentación clínica más frecuente es la hemorragia digestiva, representando el 5-10% de las causas cuando el origen es obscuro. Parte de las recomendaciones quirúrgicas en el tratamiento curativo del GIST son la resección completa con su seudocápsula y bordes quirúrgicos negativos (R0).
ConclusionesLos GIST son causa de hemorragia gastrointestinal de origen obscuro; la resección quirúrgica completa es la única opción curativa.
Gastrointestinal stromal tumours (GIST) are rare, with around 20% being located in the small intestine. The most common clinical presentation is gastrointestinal bleeding, resulting from pressure necrosis and ulceration of the gastrointestinal mucosa, with laceration of the underlying vessels.
Clinical caseA 37-year old male, with clinical symptoms of obscure gastrointestinal bleeding. The endoscopy and colonoscopy showed no abnormalities, and an abdominal-pelvic tomography demonstrated a small bowel loop with a possible GIST being likely, due to the persistent gastrointestinal bleeding. An exploratory laparotomy it is performed, finding a tumour in the jejunum. An intestinal resection and end-to-end intestinal anastomosis was performed. With normal post-operative course, the patient was discharged on the fifth day, with histopathology reporting fusiform tumour cells and positive CD117, compatible with a stromal tumour.
DiscussionGISTs are derived from Cajal cells, and are characterised by mutations of c-KIT gene. They represent less than 1% of all digestive tract tumours, and occur most often in the stomach, followed by the small intestine. Its most common clinical presentation is gastrointestinal bleeding, representing 5-10% of cases when the origin is obscure. Part of surgical recommendations in the curative treatment of GIST are complete resection with negative surgical margins and pseudo-capsule (R0).
ConclusionsGISTs are a cause of gastrointestinal bleeding of obscure origin, with complete surgical resection being the only curative option.
Los tumores del estroma gastrointestinal (GIST por sus siglas en inglés: gastrointestinal stromal tumors) son poco comunes, representando el 1% de todas las neoplasias del tracto gastrointestinal. Dos tercios de los GIST están localizados en el estómago, mientras que un cuarto se localiza en el intestino delgado; generalmente son asintomáticos, aunque la presentación clínica más común es la hemorragia gastrointestinal (aproximadamente en el 50% de los casos)1. Hasta un 5% de las hemorragias gastrointestinales son de origen obscuro, siendo el GIST una de las causas descritas2. La hemorragia digestiva se produce por la necrosis por presión y ulceración de la mucosa digestiva con laceración de los vasos subyacentes. La tomografía contrastada es el estudio diagnóstico de imagen por elección, ya que caracteriza la masa abdominal y evalúa su extensión y la presencia o no de abscesos o metástasis3.
El tratamiento es quirúrgico y consiste, idealmente, en la resección completa con márgenes negativos (R0), dependiendo esta de la localización, el tamaño y el compromiso de estructuras vecinas, no recomendándose la linfadenectomía4.
Se reporta el caso de un paciente con hemorragia de tubo digestivo de origen obscuro, con hallazgo de tumor localizado en yeyuno compatible con GIST, realizándose manejo quirúrgico con resección intestinal y enteroentero anastomosis, sin complicaciones, por parte del Servicio de Cirugía General en el Hospital General de Zona Norte, SSA Puebla.
Caso clínicoSe trata de un hombre de 37 años de edad, originario y residente de Puebla, con antecedente de hemorragia de tubo digestivo alto en junio de 2015 y reporte de endoscopia como gastritis crónica, corroborado por histopatología (gastritis crónica superficial, metaplasia intestinal incompleta sin displasia), requiriendo transfusión de paquetes globulares en dicho internamiento (2 paquetes); consumo de alcohol de manera crónica (cerveza y tequila). Inicia su padecimiento el 31 de enero de 2016, al presentar dolor en epigastrio, tipo ardoroso, intensidad 7/10 en la escala visual análoga, intermitente y sin irradiaciones, acompañándose de evacuaciones melénicas, así como disnea y sensación de palpitaciones, por lo que acude al Servicio de Urgencias, encontrándose con datos clínicos de bajo gasto cardiaco y en la exploración física con los siguientes signos vitales: tensión arterial 95/60mmHg, frecuencia cardiaca 116lpm, frecuencia respiratoria 24rpm, temperatura 36°C, Glasgow 15, palidez de tegumentos, conjuntivas hipocrómicas, mucosa oral húmeda, campos pulmonares con adecuada transmisión de murmullo vesicular, ruidos cardiacos rítmicos, taquicardia, sin presencia de soplos, abdomen plano, depresible, con dolor leve a palpación profunda de epigastrio, sin resistencia muscular involuntaria, peristalsis presente, llenado capilar 4s.
Se toman análisis de laboratorio a su ingreso, con hemoglobina 6.4g/dl, hematocrito 21.4%, VCM 82fL, HCM 24.5pg, leucocitos 9.97, neutrófilos 77.5%, plaquetas 176,000, glucosa 120mg/dl, creatinina 0.5mg/dl, urea 64mg/dl, sodio 138mEq/l, potasio 3.9mEq/l y cloro 109mEq/l.
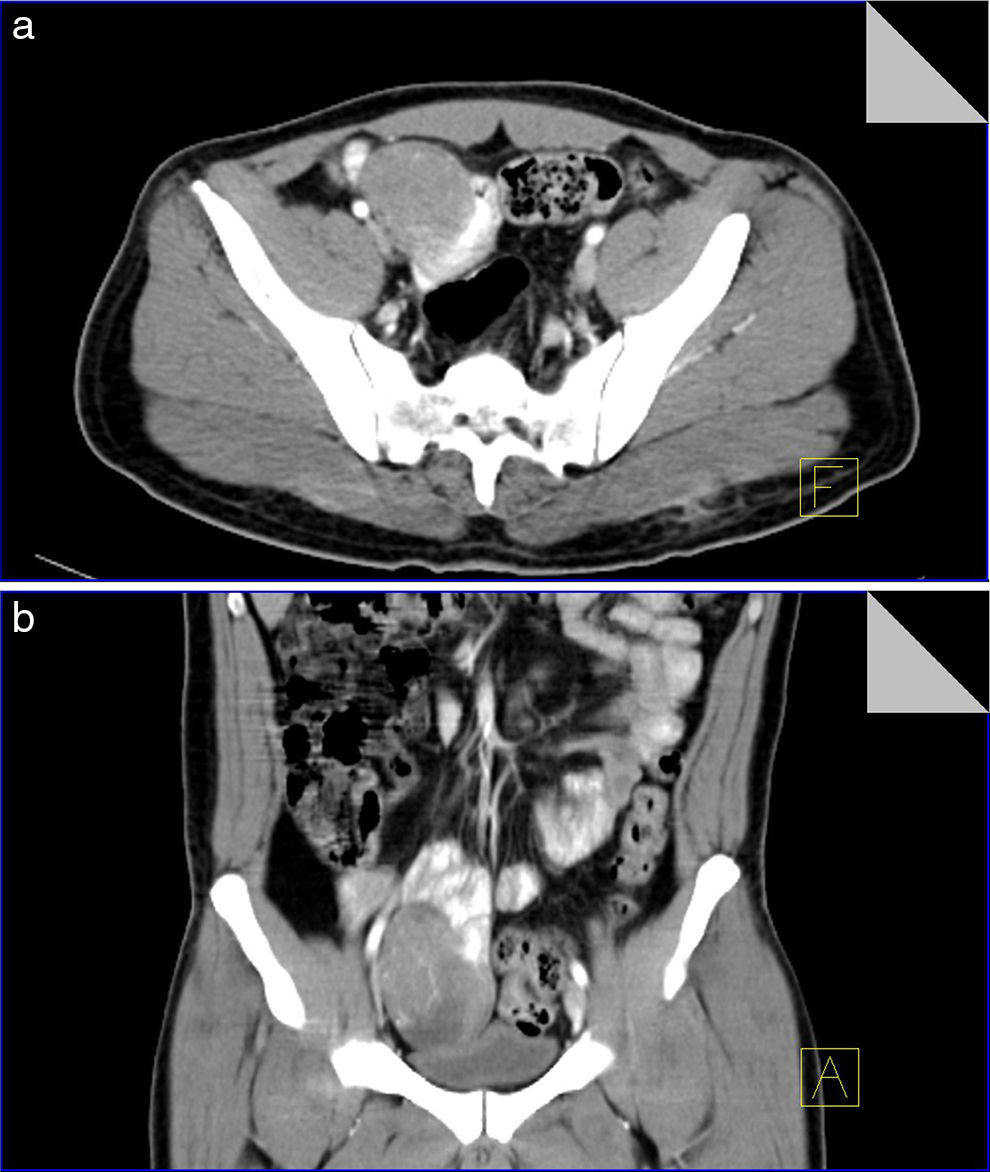
Con diagnóstico de choque hipovolémico grado ii secundario a hemorragia de tubo digestivo alto ingresa a sala de choque iniciando manejo con cristaloides y transfusión de 3 paquetes globulares, así como infusión de inhibidor de bomba de protones; a las 24h presenta mejoría clínica y sin datos de hemorragia activa, con control de hemoglobina 8.3g/dl, hematocrito 26.4% y plaquetas 125,000; se decide nueva transfusión de paquete globular y realizar panendoscopia con hallazgo de gastritis sin datos de hemorragia. Al sexto día, se presentan episodios de melena y descenso de la hemoglobina a 5.6g/dl con un hematocrito de 18.2%, por lo que se inicia transfusión de 3 paquetes globulares y preparación del colon para colonoscopia, con sospecha de probable hemorragia de tubo digestivo bajo, la cual se realiza sin evidencia de anormalidades; se solicita tomografía simple y contrastada abdominopélvica, con reporte de asa de intestino delgado con lesión tumoral de morfología ovoidea y bordes regulares adyacente a íleon que muestra realce importante durante fases contrastadas, con dimensiones de 76×48×51mm (fig. 1); el resto de las estructuras tienen características normales, concluyendo con el diagnóstico de tumor dependiente de intestino delgado.
Tomografía simple y contrastada de abdomen en corte axial y con reconstrucción coronal. a) Corte axial donde se identifica un tumor bien definido, redondo, dependiente de la pared del yeyuno, con marcada afinidad por medio de contraste, sin infiltración a tejidos adyacentes. b) Corte coronal donde se confirma dependencia del tumor a pared de asa yeyunal, condicionando moldeamiento del techo vesical sin pérdida de interfase que evidencie infiltración.
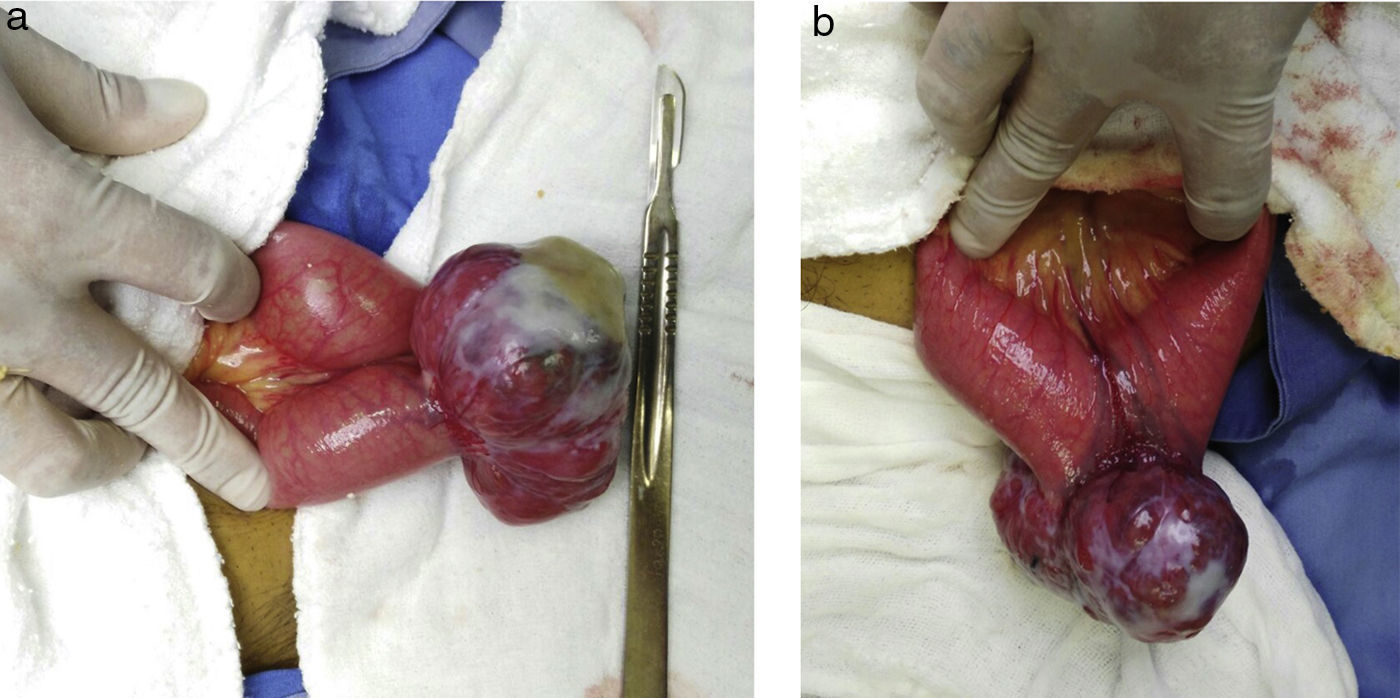
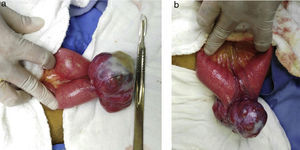
Debido a la persistencia de la hemorragia digestiva y a los hallazgos tomográficos, se decide realizar laparotomía exploratoria con diagnóstico prequirúrgico de hemorragia de tubo digestivo bajo secundaria a tumor de intestino delgado (íleon), teniendo como hallazgo: tumor dependiente de intestino delgado a 110cm del ligamento de Treitz y 220cm de la válvula ileocecal, en el borde antimesentérico, con unas dimensiones de 7×5×5cm, muy vascularizado y de bordes regulares (fig. 2), por lo que se decide realizar resección intestinal, abarcando 10cm proximal y 10cm distal al tumor, con enteroentero anastomosis terminoterminal manual en un plano, sin complicaciones.
Durante el postoperatorio se transfunden paquetes globulares, teniendo hemoglobina de control en 10.2g/dl, y permanece en ayuno durante 72h; posteriormente se inicia vía oral con líquidos y se progresa sin complicaciones o incidentes. Al quinto día de postoperatorio, hemodinámicamente estable, con herida quirúrgica sin complicaciones, tolerando vía oral y sin datos de SRIS, se decide su egreso para seguimiento por consulta externa.
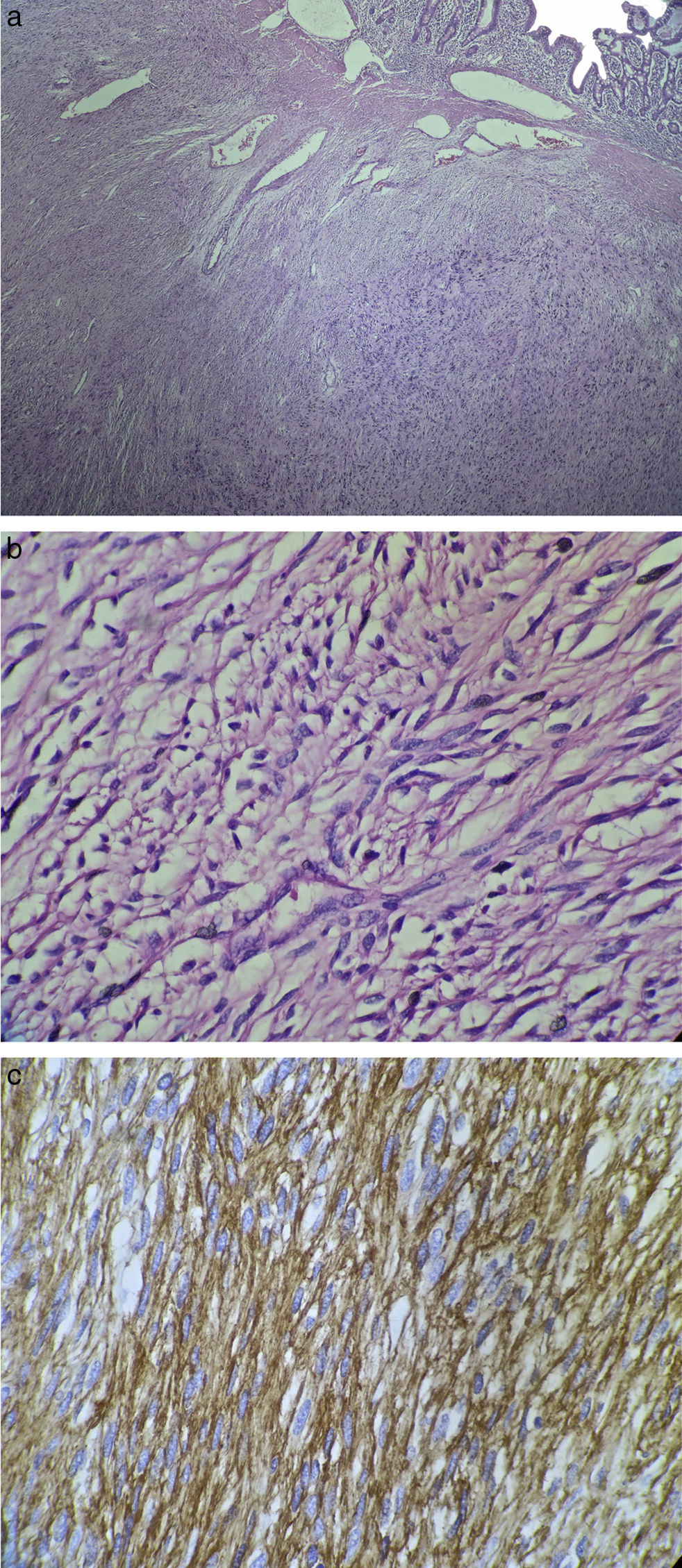
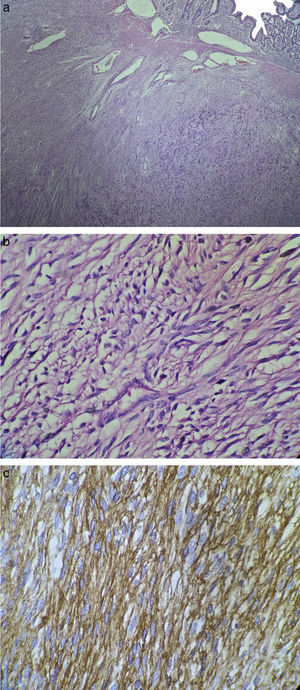
Se obtiene reporte de histopatología con hallazgo de tumor de células fusiformes, con índice mitótico escaso 2/50HPF y positivo para CD117, compatible con tumor estromal, con bordes macro y microscópicos negativos (fig. 3). Se continúa seguimiento por consulta externa de Cirugía Oncológica, sin indicación de adyuvancia con imatinib.
DiscusiónLos GIST comprenden neoplasias derivadas de las células de Cajal del tubo digestivo, encargadas de regular como marcapasos el movimiento del mismo, pudiendo encontrarse estos tumores en cualquier parte del tracto digestivo, epiplón o mesenterio; se caracterizan por mutaciones del gen c-KIT o del receptor del factor de crecimiento derivado de plaquetas5.
Hay algunos síndromes relacionados con GIST: a) síndrome de Carney, deficiencia en la subunidad B de la succinato deshidrogenasa, que se presenta con una tríada de GIST gástrico, paraganglioma y condromas pulmonares; b) síndrome de Carney-Stratakis, mutaciones en línea germinal de subunidades A, B, C, y D de la succinato deshidrogenasa, con díada de GIST y paraganglioma, y c) neurofibromatosis tipo i, relacionada con GIST multicéntrico, predominantemente localizado en el intestino delgado6.
Los GIST son las neoplasias mesenquimales más frecuentes del tracto digestivo, comprendiendo el 80% de ellas4, pero representan menos del 1% de todos los tumores digestivos; su incidencia es de 10-20/1,000,000 habitantes, sin diferencias en género o raza7, con una mediana de edad de 60-65 años, aunque con un amplio rango, siendo la aparición en pacientes pediátricos muy rara, representando un subconjunto distinto marcado por el predominio femenino, ausencia de mutaciones en c-KIT/receptor del factor de crecimiento derivado de plaquetas, localización gástrica multicéntrica y posibilidad de metástasis a nódulos linfáticos6.
La localización más frecuente de los GIST es el estómago (60-70%), seguida del intestino delgado (20-30%), particularmente duodeno, colon y recto (<5%), esófago (<2%) y, con menor frecuencia, en peritoneo, mesenterio y epiplón5,7. En nuestro paciente su localización fue en el yeyuno, donde la literatura reporta una incidencia del 0.1-3% de todos los tumores gastrointestinales y el 47% de los GIST localizados en el intestino delgado1,2.
Aunque un 10-30% de los pacientes con GIST son asintomáticos8,9, los síntomas iniciales tienden a la cronicidad y a ser inespecíficos, con dolor abdominal e incomodidad, lo que dificulta el diagnóstico precoz9,10. Su presentación clínica es muy variable dependiendo del tamaño, la localización y/o la presencia de ulceración de la mucosa11; algunas formas de presentación, aunque muy raras, pueden ser obstrucción intestinal e intususcepción (debido a la tendencia en su crecimiento extraluminal)11, hemoperitoneo por rotura del GIST8 y perforación intestinal9, ocasionando cuadros clínicos de abdomen agudo. Sin embargo, la presentación más frecuente es la hemorragia digestiva (70%)10, y existen varios factores que contribuyen con la hemorragia con los GIST de localización en yeyuno: a) la localización en intestino delgado se asocia con la mayor incidencia de hemorragia (>64%), mientras que en estómago, colon y recto es de menos del 50%; b) los GIST pueden ulcerarse a través de la mucosa adyacente causando hemorragia intraluminal, a pesar de su origen extraluminal, y c) el colágeno estromal es mínimo en la mayoría de los GIST, consecuente con prominencia en vasos de paredes delgadas y finas12. Nuestro caso se presentó con hemorragia de tubo digestivo y su localización fue en yeyuno, lo que concuerda con lo reportado en la literatura, iniciándose estudio con panendoscopia y colonoscopia, las cuales resultaron ser negativas, clasificándose como hemorragia de tubo digestivo obscuro. La hemorragia gastrointestinal obscura se define como la hemorragia recurrente en la que no se logra identificar la fuente de origen posterior a una panendoscopia y colonoscopia, siendo el lugar de origen con mayor frecuencia el intestino delgado13,14, representando un 5-10% de las causas después de las angiodisplasias15.
Debido a la ausencia de cápsula endoscópica, arteriografía y/o eritrocitos marcados, se decidió realizar una tomografía computarizada, la cual es parte del protocolo de estudio para hemorragia gastrointestinal obscura por la posibilidad de lesiones intramurales en el intestino delgado14,16, pero siendo el estudio diagnóstico de imagen por elección, ya que caracteriza el tumor abdominal, evalúa su extensión y la presencia o no de abscesos o metástasis3,6. La apariencia usual de un tumor estromal en la tomografía es la de una masa sólida de contorno suave que refuerza con el contraste intravenoso; los tumores muy grandes (>15cm) pueden parecer más complejos debido a la necrosis, la hemorragia o a los cambios degenerativos que presentan3. El tamaño de estos tumores es variable (3-35cm de diámetro mayor), suelen ser circunscritos y algunos, multinodulares; la mucosa suprayacente puede estar intacta o ulcerada5.
El diagnóstico diferencial con otras neoplasias primarias malignas puede ser hecho con base en los siguientes hallazgos específicos por tomografía: a) los linfomas tienden a causar engrosamiento mural circunferencial con refuerzo por contraste homogéneo y adenomegalias; b) los carcinoides se encuentran principalmente en íleon terminal y causan una reacción desmoplásica local sin infiltración local, y c) las metástasis intestinales son normalmente multifocales y vienen con una historia de enfermedad maligna primaria3.
El diagnóstico definitivo es por histopatología y con imnunohistoquímica3. Los GIST exhiben 3 patrones histológicos fundamentales: fusiforme (70%), epitelioide (20%) y mixto (10%)17; los GIST epitelioides se confunden con linfomas, melanomas o carcinomas (particularmente en biopsias endoscópicas), y los GIST con células fusiformes se pueden confundir con sarcomas, por lo que es necesario la inmunohistoquímica5. Los GIST son positivos para CD117 (95%), CD34 (70%), actina de músculo liso (40%), proteína S-100 (5%) y desmina (2%)5. Alrededor del 5% es negativo para CD117; de estos, el 2% carece de mutaciones del gen c-KIT, por lo se utiliza un marcador especial en estos tumores (DOG-1)5,18. El reporte de histopatología e inmunohistoquímica en nuestro caso mostró un patrón fusiforme positivo para CD117, confirmando la sospecha de GIST.
Los factores pronósticos más importantes para definir el riesgo de comportamiento maligno de un tumor estromal son el tamaño tumoral y el índice mitótico en 50 campos de gran aumento; con base en estos pueden clasificarse en 4 categorías: a) muy bajo riesgo (tamaño<2cm y menos de 5 figuras mitóticas); b) bajo riesgo (tamaño de 2-5cm y menos de 5 figuras mitóticas); c) riesgo intermedio (tamaño<5cm y 6-10 figuras mitóticas), y d) alto riesgo (tamaño>5cm y más de 5 figuras mitóticas o tamaño>10cm y cualquier número de figuras mitóticas o cualquier tamaño tumoral y más de 10 figuras mitóticas)3,17. Los tumores de riesgo alto presentan recidivas en más de un 50% de los casos, y los de riesgo bajo, una supervivencia similar a la de la población normal una vez realizada una resección completa3.
Los tumores GIST pueden presentarse clínicamente en 5 escenarios clínicos: 1) micro-GIST (tumor menor de 10mm); 2) GIST primario, localizado en un órgano (sin metástasis); 3) GIST primario, localizado, pero con invasión a órganos adyacentes; 4) GIST con metástasis a distancia, y 5) GIST recurrente5. La única modalidad terapéutica con potencial curativo para GIST primario y localizado es la resección quirúrgica completa3,5,6; en caso de que el tumor no pueda resecarse debido a que la resección quirúrgica represente una morbimortalidad elevada, la biopsia es fundamental antes de iniciar el tratamiento neoadyuvante5,6.
Algunas recomendaciones quirúrgicas en el tratamiento curativo de GIST son: resección completa, incluyendo su seudocápsula, siendo esta una característica compartida con todos los sarcomas, y se llama así porque se trata de un tumor que crece desplazando las estructuras, sin infiltrar, por lo cual parece estar encapsulado; los GIST son estructuras frágiles con riesgo de rotura, presentando hemorragia y diseminación transcelómica, con alto riesgo de recurrencia; se debe explorar hígado y superficies peritoneales, ya que son sitios donde con mayor frecuencia se presentan metástasis; en GIST primario y localizado de tamaño menor a 5cm se debe considerar el abordaje laparoscópico (aplicando los principios quirúrgicos mencionados); la linfadenectomía radical es innecesaria, la frecuencia de metástasis ganglionares regionales es menor del 5%; realizar una resección quirúrgica con bordes macroscópicos negativos (R0)5,6.
El tratamiento sistémico con imatinib es adecuado en caso de: tumor primario irresecable o borderline, tumor potencialmente resecable que requiere una disrupción orgánica extensa, recurrencia local de enfermedad localmente avanzada o cantidad limitada de lesiones metastásicas potencialmente extirpables por cirugía. El tratamiento del GIST persistente, recurrente o metastásico es fundamentalmente sistémico3,5. Valorado por Oncología Quirúrgica, con reporte histopatológico de índice mitótico bajo, con márgenes negativos, tumor localizado, sin metástasis, no se requirió el uso de imatinib.
ConclusionesEs importante reconocer a los GIST como una causa posible en la hemorragia gastrointestinal de origen obscuro; el estudio diagnóstico por imagen es la tomografía contrastada, pero el confirmatorio es por histopatología e inmunohistoquímica (CD117 positivo). La resección quirúrgica completa es la única opción curativa.
Conflicto de interesesLos autores declaran no tener conflictos de interés.