¿ INTRODUCCIÓN
La historia se ha visto transformada radicalmente por eventos que han modificado su transcurrir natural, generando en consecuencia, cambios en la perspectiva respecto de nuestro ser y entorno. Estas revoluciones han permeado todos los ámbitos posibles del quehacer humano, y por ende, la ciencia se ha beneficiado de ellas. Sin duda, la revolución informática y sus aplicaciones han sido factor primordial para los avances médicos de los últimos años, convirtiéndose junto con los conceptos de Billroth, Lister, Virchow y Morton en parteaguas paradigmáticos dentro de la práctica médica. Un claro ejemplo, lo es el arribo de la laparoscopia a la cotidianeidad quirúrgica.
A partir de su primera aplicación exitosa en una colecistectomía a mediados de la década de los ochenta, se generalizó aceleradamente en todo el mundo creando expectativas que al principio no se contemplaban. Una de ellas, hoy vigente, es la intención de aplicar la cirugía laparoscópica al tratamiento del cáncer y aunque en algunos centros quirúrgicos se cuenta con amplia experiencia e infraestructura idónea, dicho objetivo está aún lejos de cumplirse debido a las peculiares exigencias de los criterios quirúrgico-oncológicos en el tratamiento óptimo actual. Sin embargo, con el advenimiento de nuevas tecnologías y adquisición de experiencia se puede vislumbrar que en un futuro será posible. Por el momento, nos corresponde seguir los lineamientos consensuados por las instituciones avaladas al respecto, con la finalidad de ofrecer el mejor resultado a nuestro paciente.
¿ DISCUSIÓN
CRITERIO ONCOLÓGICO VERSUS CRITERIO QUIRÚRGICO LAPAROSCÓPICO
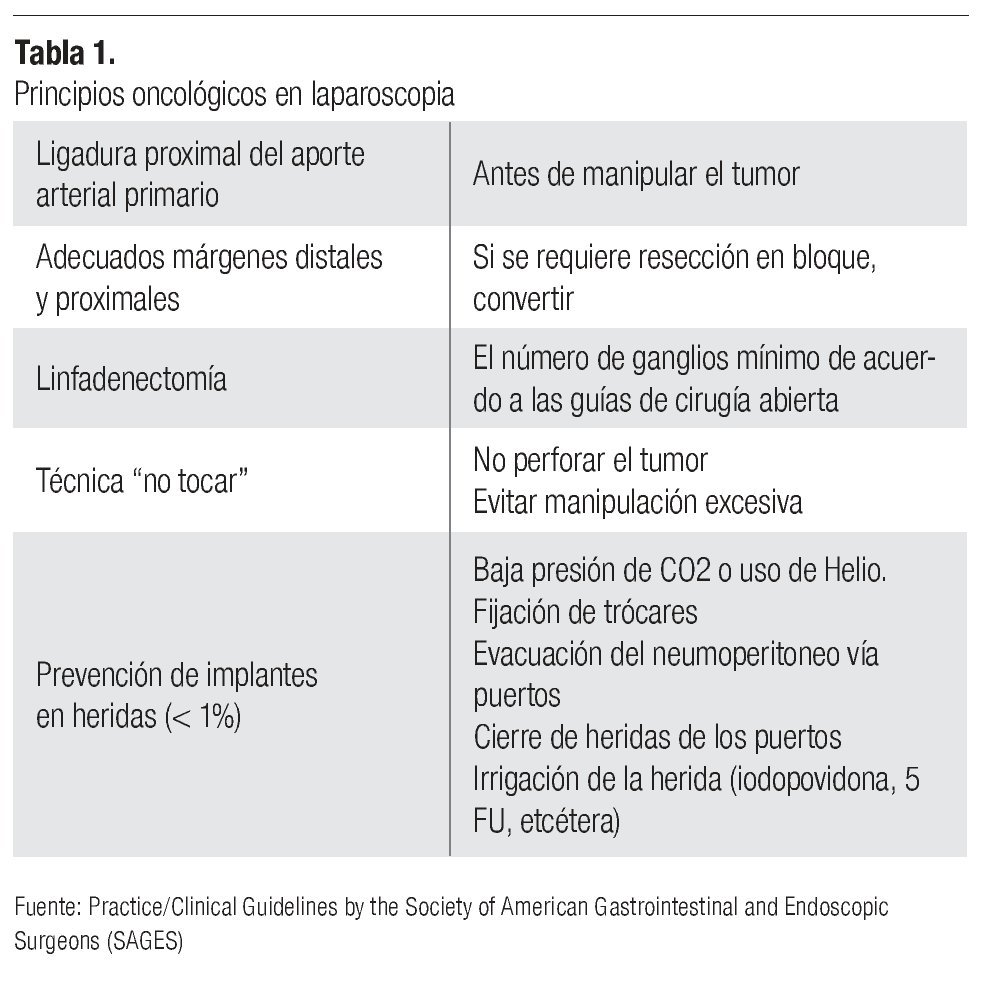
En oncología "el mejor tumor es el que se extirpa por completo". Esto hace referencia al éxito que representa el extraer en su totalidad la enfermedad neoplásica (incluso con extirpaciones o resecciones multiorgánicas en bloque), con amplitud de márgenes sanos, mínima manipulación del tumor y control de las posibles vías de diseminación durante la cirugía.
Dentro de la cirugía laparoscópica y debido a su corta historia, la búsqueda constante de superar la curva de aprendizaje hace que el cirujano considere un éxito concluir el procedimiento sin convertirlo (cirugía abierta) y posteriormente mejorar su tiempo quirúrgico, si bien estos conceptos no son contrarios a los oncológicos tampoco son coincidentes, por lo que debemos considerar en todo momento como prioritarios a los últimos.
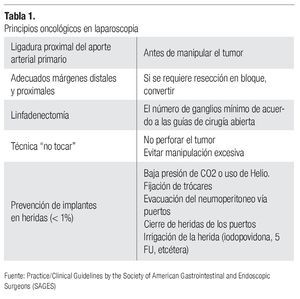
Cuando se logra la conjunción de todos los objetivos (criterio oncológico laparoscópico) (Tabla 1), podemos afirmar que se demuestra la aplicabilidad de la laparoscopia en el tratamiento del cáncer, sin embargo, actualmente son pocos los ejemplos. Probablemente con el constante adiestramiento, apoyo en técnicas y tecnologías destinadas a este propósito la cantidad aumentará, pero por el momento, el seguimiento de las recomendaciones emitidas por los consensos oncológicos debe ser estricto, ya que de ello dependerá en gran parte el pronóstico de nuestro paciente.
VENTAJAS DE LA CIRUGÍA LAPAROSCÓPICA
La mínima invasión es la piedra angular de las bondades de la cirugía laparoscópica y sobre la cual se apoyan sus recomendaciones. El hecho de disminuir enormemente la respuesta inflamatoria y preservar la inmunológica durante el trauma quirúrgico, explica la evolución pronta a la homeostasis. La menor elevación plasmática de proteína C reactiva e interleucinas proinflamatorias lo han demostrado. En contraste, la laparotomía por sí misma, provoca supresión de linfocitos T y células NK (natural killer) así como liberación de factor de necrosis tumoral alfa (FNT), factor de crecimiento plaquetario y radicales superóxido vía macrófagos1-5 que pueden ser condiciones adversas en cualquier paciente, incluso en el oncológico. Es pues, fácil demostrar la superioridad de la cirugía laparoscópica en la recuperación posoperatoria del íleo quirúrgico y disminución del dolor que se ven reflejados en un rápido inicio de la alimentación, movilización del paciente, menor estancia hospitalaria y reintegración a las actividades cotidianas.6,7
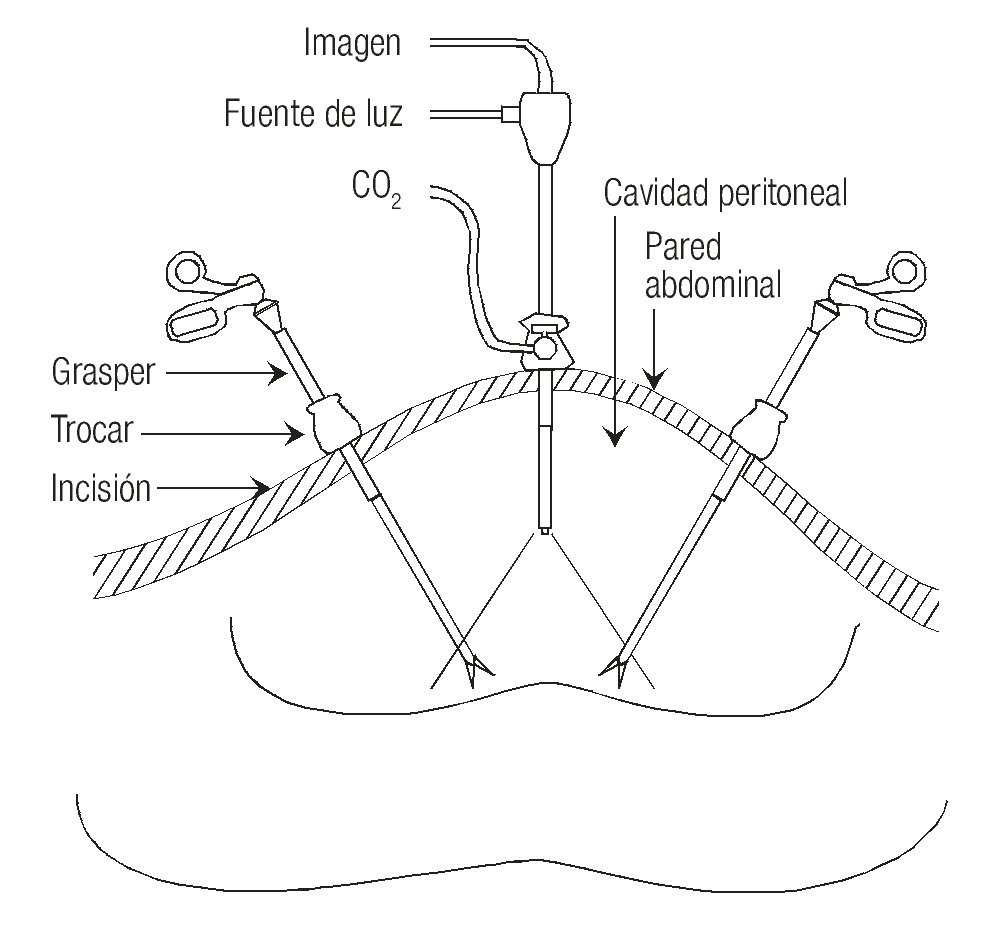
Adicionalmente, la vía laparoscópica ofrece un buen campo de visión proporcionado por el espacio generado mediante el neumoperitoneo (aunque nunca comparado con el campo visual de 150° de los ojos humanos). Esto permite una asequibilidad visual a toda la cavidad peritoneal y sus órganos comparativamente similar a la de la laparotomía. El beneficio extra de la laparoscopia en este rubro es la posibilidad de magnificar la imagen adquirida hasta 20 veces el tamaño real, con lo que se pueden observar a detalle características que a la vista pasarían desapercibidas, permitiendo aplicar una técnica minuciosa, "milimétrica" (Figura 1).
Figura 1. El espacio generado por el neumoperitoneo permite la visualización de toda la cavidad peritoneal.
LIMITACIONES DE LA CIRUGÍA LAPAROSCÓPICA
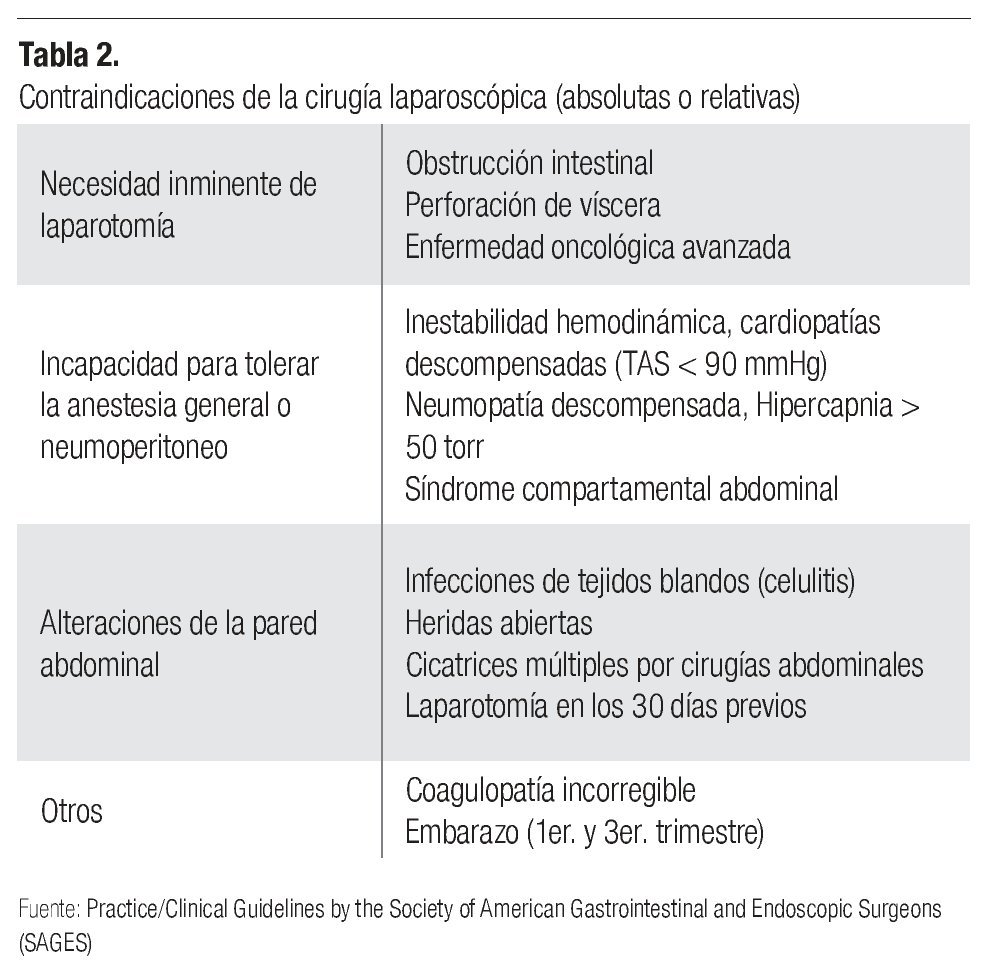
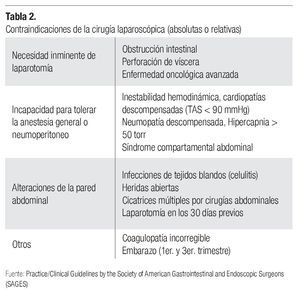
Éstas se refieren, en principio, a la imposibilidad de aplicarse a cualquier paciente. Las contraindicaciones absolutas y relativas de su uso van desde estados clínicos (embarazo) hasta patologías específicas que interfieren con la aplicación del neumoperitoneo (cardiopatías, neumopatías) o con la efectividad de éste para generar el espacio visual y de acción necesario (adherencias posquirúrgicas) (Tabla 2).
Rapidez de acción y reacción son características de la laparotomía por el acceso inmediato y múltiple que se tiene para la resolución de eventualidades, así como la oportunidad de aplicar los millones de movimientos posibles de la extremidad superior humana; en el caso laparoscópico dichos movimientos disminuyen considerablemente (menos de mil) por más habilidad que se tenga;8 el cirujano tiene además la posibilidad de echar mano del adiestrado sentido del tacto, lo que probablemente influirá en las decisiones que tome durante la cirugía. La carencia de estos elementos es otra limitante de la laparoscopia (Figura 2).
Figura 2. Las articulaciones en la extremidad superior humana la proveen de 29 grados de libertad, que se traducen más de 594 millones de posibles movimientos en tanto que en laparoscopia, sólo se pueden realizar 729 debido a sus 3 grados de libertad.
La visión bidimensional propia de observar imágenes en una pantalla modifica la perspectiva del cirujano acostumbrado a la tercera dimensión de la cirugía abierta, y en tanto éste se habitúa al cambio, será una dificultad muchas veces no muy fácil de sortear.8 Se añaden entonces a nuestra lista los factores propios del cirujano que realiza la cirugía laparoscópica. El número de cirugías necesarias para considerarse apto varía de acuerdo al procedimiento; dicha destreza influye directamente en el tiempo quirúrgico utilizado y la probabilidad de conversión.
Finalmente, se debe considerar como limitante, la falta de aplicación generalizada por factores económicos e institucionales.
No olvidemos que las antes mencionadas son desventajas generales de la laparoscopia. Comentario extra merecen las que se presentan en cirugía oncológica.
Si consideramos que en México un gran porcentaje de los casos oncológicos referidos a los centros especializados se encuentran en etapa clínica avanzada, fuera de tratamiento quirúrgico, el resto es un número reducido de pacientes en estadios tempranos de la enfermedad que pueden ser candidatos a cirugía laparoscópica.
La resección completa del tumor, con márgenes amplios libres de enfermedad hace que los especímenes extraídos sean generalmente de gran tamaño; la necesidad de manipularlos mínimamente con fines de diagnóstico histopatológico y de evitar diseminaciones impide su extracción fragmentada, lo que constituye una desventaja más para la vía laparoscópica. En la búsqueda por librar este obstáculo, se implementaron técnicas híbridas para la extracción de la pieza quirúrgica y que posteriormente fueron útiles incluso durante el proceso de separación y disección. La llamada técnica "mano asistida" (Imagen 1) que consiste en realizar adicionalmente una incisión mayor (a través de la cual se pueda introducir la mano del cirujano) y aplicar un aditamento que impide la pérdida del neumoperitoneo,9 ha sido útil; sin embargo, muchas veces el espécimen excede el tamaño de la incisión. Surgen las preguntas, si finalmente será necesario ampliar más la incisión para la extracción de la pieza ¿es justificable utilizar la vía laparoscópica?, ¿en dónde quedaron los beneficios de la mínima invasión ya comentados?, ¿es mejor elegir la vía abierta convencional desde un principio?; todo esto aún se debate, lo que impide un consenso a favor y por ende limita su aplicación.
Imagen 1. Aditamento para cirugía con la técnica "mano asistida".
Como ya se ha comentado antes, el control de la diseminación es primordial, y a este respecto la mención del neumoperitoneo como posible factor adverso, es imperativa. El traslado e implante de las células neoplásicas mediante el CO2 insuflado hacia sitios distantes del tumor dentro de la cavidad peritoneal e incluso a los puertos laparoscópicos, se ha descrito en varios estudios.10-21
¿ES CUESTIÓN DE HABILIDAD O DE CRITERIO?
El procedimiento laparoscópico de más edad es la colecistectomía con más de 20 años, y por lo tanto, el más realizado a nivel mundial. Esto debería ser suficiente (por la aparente amplia experiencia en el manejo del área biliar) para considerar al cáncer de vesícula como la patología oncológica ideal para aplicar la laparoscopia, y sin embargo, no lo es. La necesidad de lograr un tratamiento óptimo con criterio oncológico implica una resección amplia que no puede ser lograda vía laparoscópica y obliga a un abordaje convencional abierto. Cabe entonces decir que la posibilidad de acceder a un mayor campo de acción de trabajo (proporcionado por la cirugía abierta) supera al mayor campo de visibilidad y magnificación (dado por la laparoscopia). Así, en aras de la seguridad y eficacia del procedimiento, el estándar de oro en este tipo de casos es la cirugía convencional.
PAPEL ACTUAL DE LA LAPAROSCOPIA EN CÁNCER GASTROINTESTINAL
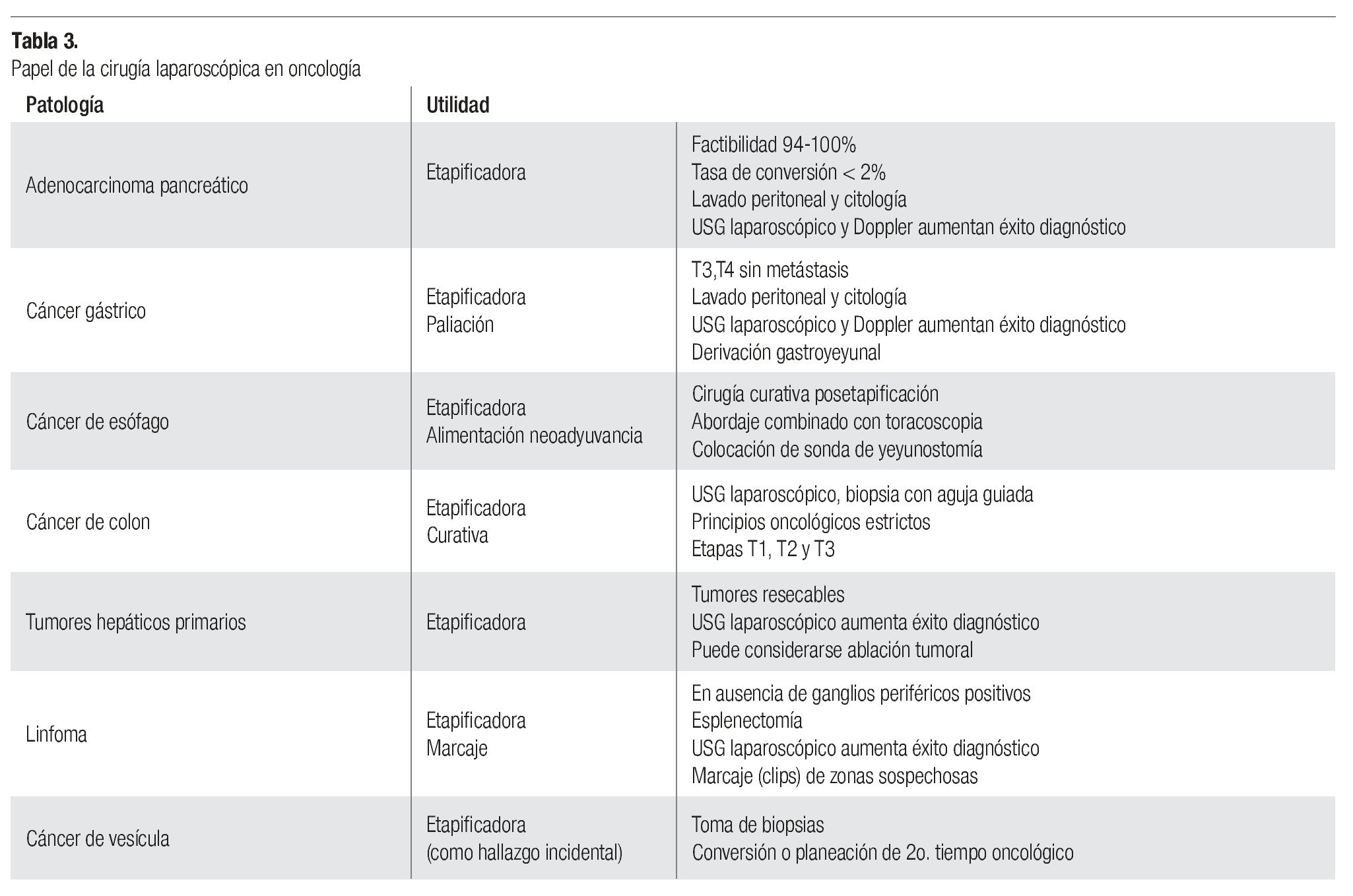
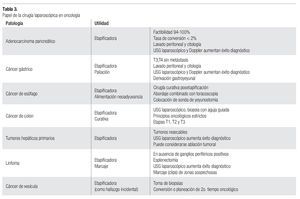
Habiendo comprendido los conceptos desarrollados en párrafos anteriores, podemos explicar por qué la cirugía laparoscópica se considera en la actualidad primordialmente diagnóstica. Su valor en la etapificación de varias patologías oncológicas es innegable, mientras su papel en el tratamiento es muy limitado. A continuación se mencionan los consensos actuales al respecto de acuerdo al sitio de origen neoplásico (Tabla 3).
Adenocarcinoma de páncreas
Se indica laparoscopia con fines de etapificación, detección de enfermedad metastásica oculta o enfermedad localmente avanzada no sospechada en pacientes con enfermedad resecable de acuerdo a los estudios de imagen. Se contraindica cuando hay metástasis conocidas.
Se pueden usar 1 o 2 puertos. La presión de neumoperitoneo recomendada es a 15 mmHg; se evalúa la superficie peritoneal, espacios supra e infrahepáticos, superficie intestinal, epiplón menor, raíz del mesenterio, ligamento de Treitz, correderas parietocólicas y pelvis, en diferentes posiciones. Si no hay ascitis se realiza lavado peritoneal para citología y biopsias de lesiones sospechosas de malignidad. Puede ser útil el USG laparoscópico o Doppler para examinar parénquima hepático, vena porta, vasos mesentéricos, tronco celíaco, arteria hepática, páncreas y ganglios periportales y paraaórticos. El procedimiento dura entre 10 y 20 minutos aproximadamente.
Tiene una sensibilidad del 94% y una especificidad del 88% aproximadamente. El paciente se beneficia de una laparotomía innecesaria y disminuye el tiempo de inicio de tratamiento con radioterapia y quimioterapia cuando el cáncer es irresecable debido al corto tiempo de convalecencia.22-30
Cáncer gástrico
Etapificadora: Indicada en etapa T3, T4 sin metástasis. En pacientes con etapa T1, T2 se realiza laparotomía curativa sin etapificación por laparosocopia. Está contraindicada en perforación, obtrucción o hemorragia tumoral. Se recomienda lente de 30° para una mejor visualización. Se realiza lavado peritoneal o citología de líquido de ascitis, con revisión general de la cavidad abdominal, si no hay metástasis evidentes se levanta el lóbulo lateral izquierdo del hígado para observar el estómago en su totalidad, se revisan y biopsian ganglios perigástricos sobre curvatura menor. El tumor se biopsia y si es necesario se abre el epiplón menor para observarlo mejor. Se revisa el ligamento gastrohepático.
Paliación: Se puede considerar la derivación gastroyeyunal laparoscópica en casos de obstrucción pilórica.30-35
Cáncer de esófago
Etapificadora: indicada en pacientes potencialmente candidatos a cirugía curativa, se contraindica si hay metástasis. Se sugiere lente de 30°. Revisión de la cavidad abdominal, visualización de unión esofagogástrica, ligamento gastrohepático y tronco celíaco, biopsia de ganglios a este nivel. Si así se planeó, se puede realizar yeyunostomía para alimentación. Se puede llevar a cabo abordaje combinado toracoscópico, con paciente en decúbito lateral izquierdo, con ventilación de un solo pulmón y colocación de 2 o 3 trócares torácicos, se incide la pleura para identificar y biopsiar ganglios. 30,36-39
Cáncer de colon
Etapificadora y curativa
Etapificadora: indicada en pacientes con metástasis hepáticas resecables sin enfermedad (neoplásica) extrahepática evidente en los estudios de imagen no invasivos. Contraindicada en enfermedad irresecable o con enfermedad extrahepática. Se realiza revisión completa de la cavidad abdominal, con rastreo hepático mediante USG laparoscópico, nódulos portales y celíacos, toma de biopsias con agujas guiadas por USG, lavado peritoneal.30,40
Curativa: se considerarán sólo pacientes clasificados como curables después de una completa realización de exámenes preoperatorios etapificadores y después de localizar el tumor lo más exactamente posible; en pacientes con etapa T4 se recomienda el abordaje abierto. Se excluyen pacientes con afección del colon transverso y recto. La preparación preoperatoria es primordial. El procedimiento debe seguir en forma estricta los criterios oncológicos. La linfadenectomía debe incluir mínimo 12 ganglios con ligadura de su vaso nutricio en su origen.
La experiencia del cirujano debe incluir al menos 20 colectomías previas y realizarse en un centro oncológico especializado con toda la infraestructura necesaria. Aún así, la tasa de conversión puede llegar hasta 30%.30, 41-49.
Tumores hepáticos primarios
Etapificadora: indicada en pacientes con tumores hepáticos primarios candidatos a resección curativa, basándose en la identificación del tamaño y localización preoperatoria de la enfermedad y con adecuada reserva hepática. Se contraindica en enfermedad avanzada. Puede ser útil para realizar ablación tumoral vía laparoscópica.30,50-52
Cáncer de vesícula
Etapificadora: como hallazgo quirúrgico incidental, con toma de biopsia. Se convertirá a vía abierta con estricto criterio oncológico (cirujano entrenado) o se programará un segundo tiempo abierto.30
Linfoma
Etapificadora: indicada en pacientes que requieren biopsias de ganglios intraabdominales en ausencia de ganglios periféricos (linfoma no Hodgkin) o biopsias no concluyentes, en enfermedad primaria o recurrencia. Con el paciente en decúbito lateral izquierdo a 45° de preferencia con técnica mano asistida si se planea esplenectomía. Se realiza exploración completa, biopsia profunda de cada lóbulo hepático y amplia del segmento lateral izquierdo; se complementa búsqueda de lesiones hepáticas con USG laparoscópico; se continúa con esplenectomía con extracción del órgano intacto; biopsias de ganglios ilíacos, celíacos, portales, mesentéricos y periaórticos; escisión de ganglios anormales identificados preoperatoriamente y colocación de clips en dichas áreas; ooforopexia posterior al útero.30,53,54
¿ CONCLUSIÓN
Cabe mencionar que en prácticamente todas las neoplasias gastrointestinales, se han reportado buenos resultados efectuando tratamiento curativo; sin embargo, los estudios en cuestión son unicéntricos, con pocos pacientes, no aleatorizados, retrospectivos o sin comparación con el estándar de oro. Es por ello que aún no se ha llegado a consensuar su aplicación generalizada, y por lo tanto, la realización de los mismos deberá sólo considerarse en protocolos de investigación bien diseñados y aprobados por comités de ética avalados.
Correspondencia: Dr. Efraín A. Medina Villaseñor.
Manuel Izaguirre No. 29, Int. 101. Ciudad Satélite, C.P. 53100, Naucalpan, Edo. de México.
Teléfono: 58 58 4039. Página
Web: www.oncologiabetania.com
Correo electrónico: efra73@hotmail.com